Триггерная роль вирусов в этиологии опухолей
В 1908—1911 гг была установлена вирусная природа лейкоза и саркомы кур. В последующие десятилетия была доказана вирусная этиология ряда лимфоидных и эпителиальных опухолей у птиц и млекопитающих. В настоящее время известно, что в естественных условиях, например, лейкоз вызывается вирусами у цыплят, кошек, крупного рогатого скота, мышей, обезьян-гиббонов.
В последние годы открыт первый вирусный возбудитель, вызывающий развитие лейкоза у человека,— это ATLV (adult T-cell leukemia virus — вирус Т-клеточного лейкоза взрослых) Т-клеточный лейкоз взрослых — эндемичное заболевание, встречающееся в двух районах земного шара иа островах Клуши и Шихоку в Японском море и у негритянского населения стран Карибского бассейна. Больные с этой лимфомой встречаются спорадически н в других регионах, но у многих из них выявлена та или иная связь с эндемическими областями.
Заболевание это встречается обычно у людей старше 50 лет, протекает с кожными поражениями, гепатомегалией, спленомегалией, лимфаденопатией и имеет неблагоприятный прогноз Вирус ATLV или HTLV является экзогенным для человека, отличается от других известных ретровирусов животных, передается Т-клеткам горизонтально от матери к ребенку, от мужа к жене (но не наоборот), при лереливании крови, не обнаруживается ни при каких других формах лейкозов или лимфом человека. Таким образом, Т-клеточный лейкоз взрослых — это типичное инфекционное заболевание (вертикальная передача вируса через половые клетки исключена специальными исследованиями). В эндемичных очагах более 20% практически здоровых людей, главным образом родственники больных, являются носителями вируса.
В других частях земного шара антитела к вирусу обнаруживают редко. Считается, что заболевает 1 из 2000 инфицированных людей. Вирус, неотличимый от ATLV, обнаружен в Африке у обезьяи. Помимо лимфомы (лейкоза), указанный вирус может вызывать СПИД, при котором нарушен Т-клеточный иммунитет.
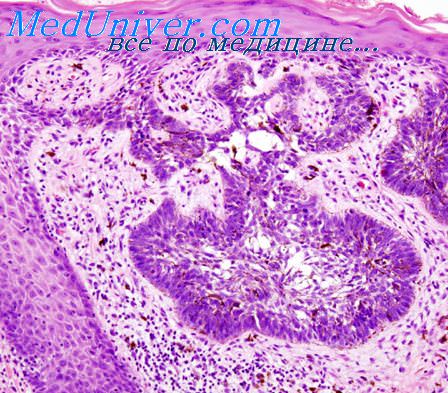
Вирусную этиологию подозревают и по отношению к некоторым другим опухолям человека Вирус Эпстайна — Барр (EBV), входящий в группу вирусов герпеса, является весьма вероятным этиологическим фактором лимфомы Беркитта. В клетках этой лимфомы в эндемических очагах в Африке постоянно обнаруживают ДНК EBV. Однако лимфома Беркитта встречается и за пределами Африки, но ДНК EBV обнаруживается лишь в меньшей части таких случаев. Общим для EBV-положительиых и EBV-отрицательных опухолей являются характерные перестройки хромосом (транслокация между хромосомами 8 и 14), что рассматривают как доказательство единой этиологии этих опухолей.
ДНК этого вируса находят в геноме клеток недифференцированной назофарингеальиой карциномы, но не в опухолях носоглотки другого гистогенеза. У больных с этими опухолями отмечают высокий титр антител к различным компонентам EBV, значительно превышающий эти показатели в популяции — EBV имеет широкое распространение, и антитела к нему обнаруживаются у 80—90% здоровых людей. Высокий титр антител обнаружен у больных лимфогранулематозом. Подавление иммунитета и активация EBV являются, по мнению ряда авторов, основной причиной развития лимфом и иммуиобластных сарком у больных с трансплантированными почками, подвергавшихся действию иммуноделрессивных средств; в пользу этого свидетельствует высокий титр антител к EBV и обнаружение ДНК EBV в геноме опухолевых клеток.
Существуют данные, позволяющие предполагать инфекционную (вирусную) этиологию рака шейки матки частота возникновения этого рака выше при раннем начале половой жизни с частой сменой партнеров, повышена она у вторых жен мужчин, первые жены которых также страдали тем же заболеванием. На основании сероэпидемиологических данных думают о роли вируса герпеса II типа как инициатора; подозревают также вирус кондилом.
В районах с высокой частотой возникновения вирусного гепатита В повышена также и заболеваемость гепатоцеллюлярным раком. С другой стороны, больные с этой опухолью чаще дают серопозитивную реакцию на вирус гепатита В, чем здоровые индивидуумы; но есть и серонегативные случаи рака. Получены линии опухолевых клеток, содержащие ДНК вируса и продуцирующие его антиген. В целом роль вируса гепатита В в индукции гепатоцеллюляриого рака остается невыясненной.
Из бородавок человека (verrucae vulgaris) выделено несколько типов вирусов папиллом, которые, как считают, вызывают лишь доброкачественные опухоли, не склонные к озлокачествлению. Лишь один из этих вирусов (5-го типа) выделен из папиллом, развивающихся при наследственной бородавчатой эпидермодисплазии и имеющих тенденцию к малигнизации.
Онкогены ныне идентифицированы, определена их химическая структура, локализация в хромосомах. Идентифицированы также белки — продукты деятельности этих генов, каждый из них синтезирует свой специфический белок.
Гипотезу о возможной роли вирусов в этиологии опухолей высказы-
вал еще И. И. Мечников. Раус (1911) установил, что куриную саркому
можно перевить от больной курицы здоровой при помощи бесклеточного
фильтрата. Это положило начало изучению так называемых вирусных
опухолей и опухолеродных вирусов. В 30-х годах XX века Шоуп описал
вирусную папиллому кроликов. Бесклеточный фильтрат этих папиллом,
нанесенный скарификационным методом на кожу лабораторных кроли-
ков, вызвал у них образование таких же папиллом. Папилломы через
несколько месяцев превращались в рак и вызывали гибель подопытных
Вирусная этиология установлена для лейкозов крыс и мышей,
папилломы кроликов, собак, коров, саркомы кур, рака почек у лягушек
и т. д. Вирусная природа вероятна в отношении некоторых опухолей
человека: кондилом, папиллом, болезни Беркитта — лимфосаркомы
нижней челюсти у детей. К опухолеродным вирусам принадлежат как
РНК-содержащие, так и ДНК-содержащие вирусы.
К РНК-содержащим опухолеродным вирусам относятся вирус
куриной саркомы Рауса, который легко преодолевает видовые и ткане-
вые барьеры и поражает не только птиц различных пород — уток, индю-
ков, цесарок, фазанов, голубей, но и представителей других классов жи-
вотных: млекопитающих — крыс, мышей, кроликов, хомячков, морских
свинок, обезьян; рептилий — черепах и степных удавчиков, а также ви-
который вызывает развитие опухоли молочных желез у самок чувстви-
тельных линий. Обычно вирус передается потомству с молоком кормя-
щей матки. В эксперименте инфицирование мышей можно вызвать пу-
тем парентерального введения материала, содержащего вирус. Рак мо-
лочных желез развивается после длительного латентного периода (бо-
лее 6—8 мес). В группу ДНК-содержащих вирусов входят: вирус папил-
ломы Шоупа, вирусы, вызывающие доброкачественные опухоли — боро-
давки (папилломы) и кондиломы у человека, собак, крупного рогатого
В и р у с н ы й б л а с т о м о г е н е з . Нуклеиновая кислота ви-
руса (или ее часть) внедряется в геном клетки и изменяет его функцию.
Способность вирусов вызывать неопластическую трансформацию
нормальной клетки не является облигатным свойством опухолеродных
вирусов. Установлено, что некоторые вирусы, относимые к «неопухоле-
ния приобретают онкогенные свойства. Типичные представители опухо-
леродных вирусов в некоторых случаях могут утрачивать свою бласто-
могенную активность и быть причиной неопухолевых заболеваний. Так,
например, вирус куриной саркомы Рауса может утрачивать свои бласто-
могенные свойства и вызывать воспаления, геморрагии, атрофии
внутренних органов, нарушать метаболизм клеток организма в
целом. Кроме того, известные в настоящее время опухолеродные для жи-
вотных вирусы (аденовирусы) могут присутствовать в организме чело-
века ничем себя не проявляя. Многие из опухолеродных вирусов легко
преодолевают тканевые и видовые барьеры, поражая очень отдаленные
виды животных, а иногда представителей других родов, семейств и даже
классов. Патогенная сила зависит как от штамма вируса, его состояния,
дозы, пути введения и т. д., так и от возраста и состояния генетических,
иммунологических, гормональных и др. факторов реципиента. Например,
один и тот же вирус эритробластоза птиц, введенный внутривенно, вызы-
вает лейкозы, введенный подкожно — саркомы. Один и тот же вирус
Рауса у молодых цыплят может вызвать быстро растущие метастазиру-
ющие саркомы, у старых кур — медленно растущие опухоли.
Скорость развития опухолей и тяжесть заболевания находятся в прямой
зависимости от количества введенного вируса и в обратной — от сте-
пени иммунологической зрелости реципиента.
Неопластическая трансформация клетки
Трансформация нормальной ткани в опухолевую осуществляется в
основном в три этапа:
П е р в ы й э т а п — с о б с т в е н н о н е о п л а с т и ч е с к о е пре-
в р а щ е н и е к л е т к и , дающей гетерогенную популяцию дочерних кле-
ток, т. е. образование зоны неопластических клеток до появления види-
мых разрастаний, обозначаемых как предопухолевое состояние.
Доказано, что большинство опухолей происходит из одной единст-
венной клетки, подвергшейся неопластическому превращению (клоновое
происхождение). Превращение совершается в относительно незрелых
элементах тканей. Основу этой стадии составляют наследственно закреп-
ленные отклонения в функционировании генетического аппарата клетки,
вызванные либо мутацией, либо эпигеномными нарушениями. Изменя-
ется ход реализации генетической информации. Имеет существенное
значение также фон — внутренняя среда организма (состояние нервной
системы, иммунологической защиты, гормонального баланса, возраста,
обмена веществ и др.), который либо способствует, либо препятствует
реализации действия онкогенных факторов.
В т о р о й э т а п — д а л ь н е й ш е е р а з м н о ж е н и е к л е т ок
п р е д о п у х о л и , п р о г р е с с и я с о б р а з о в а н и е м о п у х о л е -
в ы х у з л о в . Несколько опухолевых очагов могут появиться одновре-
менно, независимо один от другого, каждый из них результат размноже-
ния одной клетки иногда разного гистогенеза.
Вследствие естественного отбора в гетерогенной популяции опухоле-
вых клеток выживают клетки быстро растущие, наделенные большей
автономностью, независимостью от локальных ростовых факторов, луч- ше приспособленные к неблагоприятным условиям среды (гипоксия,
низкая концентрация глюкозы, некоторых ионов и т. п.), обладающие
наименьшей антигенностыо (т. е. резистентностью к иммунной защите
Т р е т и й этап — д а л ь н е й ш а я п р о г р е с с и я , приоб-
р е т е н и е с в о й с т в , о б я з а т е л ь н ы х д л я з л о к а ч е с т в е н -
В.А. Матусевич, И.В. Стукалова
Рак – бич человечества. По смертности он занимает второе место после сердечно-сосудистых заболеваний, по страху, который внушает людям – первое. Тысячи исследователей стремятся понять его причины, найти пути к его профилактике и лечению. Десятки институтов и сотни лабораторий во всем мире работают над этой проблемой, пытаясь достичь успеха в ее понимании и прогресса в профилактике и лечении этого заболевания.
Современной науке известны некоторые факторы, вызывающие развитие злокачественных опухолей и, вместе с тем, ученые вынуждены констатировать, что основная часть злокачественных опухолей возникает спонтанно, то есть без видимой связи с индуцирующими агентами. К факторам, способным вызывать развитие опухоли, относятся: различные канцерогенные вещества, наследственная предрасположенность, ионизирующее излучение и опухолеродные вирусы.
Вирусно-генетическая теория возникновения опухолей, предложенная еще в 40-х годах ХХ века Л.И. Зильбером, получила за прошедшие годы многочисленные подтверждения. В настоящее время, очевидно, что хотя вирусы и не являются единственной причиной рака, но они играют большую роль в возникновении злокачественных заболеваний как у человека, так и у животных. Характерной особенностью опухолевых заболеваний, ассоциированных с вирусами, является длительный латентный период, от момента инфекции до проявления заболевания могут пройти годы и даже десятилетия.
Согласно современным данным, этиологическими агентами около 15% опухолевых новообразований человека являются вирусы. К таким вирусам относятся: вирус Т-клеточного лейкоза/лимфомы (human T-leukemia/lymphoma virus), вирус иммунодефицита человека (ВИЧ), вирус папилломы человека (ВПЧ), вирусы гепатита В и С, вирус Эпштейна-Барр (ВЭБ) и другие. Важно отметить, что некоторые вирусы ассоциированы с опухолями только одной локализации, тогда как другие — с разными злокачественными новообразованиями, что, вероятно, обусловлено тропизмом вирусов к клеточным системам определенного типа.
Вирус Т-клеточного лейкоза/лимфомы (HTLV-1). HTLV-1 – это онкогенный вирус, способный вызывать Т-клеточный лейкоз/лимфому у взрослых, а также тропический спастический парапарез и ряд других неонкологических заболеваний.
Существуют 3 основных пути передачи инфекции от инфицированных лиц:
- с молоком матери;
- при половом контакте;
- с переливаемой кровью при гемотрансфузиях.
Вирусы гепатита В и С (Hepatitis B virus и Hepatitis C virus, HBV/HCV). В настоящее время доказано, что из общего числа зарегистрированных случаев рака печени, возникновение более половины связано с инфицированием гепатитом В, четверть – с инфицированием гепатитом С и в 22% случаев причина другая. Смертность от рака печени на планете среди всех смертностей от онкологических заболеваний занимает 3-е место после смертности от рака легкого и желудка. При этом каждая пятая диагностируемая в мире опухоль – это рак печени.
Основными методами диагностики вирусов гепатита В и С являются методы иммуноферментного анализа и полимеразной цепной реакции.
Вирус папилломы человека (ВПЧ, human papilloma virus). В середине 70-х гг. прошлого века было высказано предположение, что вирус папилломы человека является этиологическим агентом рака шейки матки, и эта область онкологии и вирусологии получила стремительное развитие. Действительно, к настоящему моменту роль ВПЧ в развитии рака шейки матки не вызывает сомнений. Многочисленные исследования доказали, что не менее 95% злокачественных опухолей шейки матки содержат разновидности ВПЧ, принадлежащие к так называемым типам "высокого онкогенного риска" (ВПЧ 16, 18, 31, 33, 35, 39, 45, 51, 52, 56, 58, 59 типов). Среди них максимальной онкогенной активностью обладают ВПЧ 16 и 18 типов. Действительно, ВПЧ достаточно часто (примерно в 30% случаев) выявляется у абсолютно здоровых женщин. Однако не у всех женщин, зараженных вирусом папилломы человека, возникает дисплазия шейки матки и рак шейки матки. Примерно у 80% женщин иммунная система организма в течение 2 лет после инфицирования сама избавляется от вируса. Таким образом, носительство этих вирусов свидетельствует не о злокачественном процессе как таковом, а о многократно повышенном риске его возникновения.
Диагностика ВПЧ-инфекции обладает очень высокой клинической значимостью. Она позволяет выявить тех пациенток, для которых жизненно необходимы активные, комплексные меры, направленные на профилактику и раннюю диагностику рака шейки матки. Самым надежным диагностическим тестом по выявлению всех 12 онкогенных типов вируса папилломы человека в настоящее время является метод полимеразной цепной реакции в режиме реального времени.
Вирус Эпштейна-Барр (ВЭБ). Известен широкий спектр патологических состояний, представленный опухолями лимфоидного и эпителиального происхождения, в возникновении которых ВЭБ принимает непосредственное участие. Доказано, что этот вирус причастен к возникновению не только лимфомы Беркитта, но и ряда других злокачественных и доброкачественных новообразований, таких, как рак носоглотки, лимфома Ходжкина, инфекционный мононуклеоз и многие другие.
Согласно некоторым исследованиям, ВЭБ широко циркулирует среди населения, о чем свидетельствует высокий процент людей, имеющих в крови антитела к ВЭБ - 50% детей и 85% взрослых. Но поскольку инфекция, как правило, протекает бессимптомно, сложилось ошибочное мнение о невысокой заболеваемости ВЭБ-инфекцией.
Вирус герпеса человека 8 типа (HHV-8). В настоящее время считается доказанной его роль в возникновении саркомы Капоши, выпотной лимфомы полостей тела и болезни Кастельмана. В геноме HHV-8 содержится ряд генов, продукты которых играют важную роль в регуляции размножения и жизнеспособности клеток; повышение их активности приводит к возникновению опухоли.
Следует понимать, что HHV-8 является всего лишь фактором риска развития вышеуказанных заболеваний. Если человек инфицирован HHV-8, то это не означает, что у него обязательно разовьётся саркома Капоши или лимфома.
Сам по себе вирус герпеса 8 типа опасности для здорового человека практически не представляет. Большинство людей с нормальным иммунитетом, инфицированных этим вирусом, не отмечают каких-либо проявлений, и он не оказывает на них никакого вредного влияния.
Свое негативное действие HHV-8 может проявить только в случае стойкого снижения иммунитета (иммунодепрессии), и то лишь у больных СПИДом (зараженных вирусом ВИЧ) или при длительном лечении, снижающем иммунитет (после пересадки органов и тканей, лучевой терапии). По данным статистики у 45% людей, имеющих HHV-8 и ВИЧ в течение 10 лет развилась саркома Капоши. У людей с нормальным иммунитетом вирус герпеса человека никак себя не проявляет. Он не влияет на состояние здоровья.
Вирус иммунодефицита человека (ВИЧ). ВИЧ может создавать необходимые условия (иммунодефицит) для возникновения рака. Этот вирус был открыт в 1983 г. и его ассоциация с синдромом приобретенного иммунодефицита (СПИД) доказана в 1984 г. Инфицированные им клетки не подвергаются усиленному делению, а разрушаются, вызывая у инфицированного лица нарастающую степень иммунодефицита, и создавая тем самым состояние, при котором организм не в силах противостоять развитию опухоли. Доказано, что у больных СПИДом примерно 50% новообразований, ассоциировано с вирусом Эпштейна-Барр или герпесвирусом человека 8-го типа. Чаще всего у таких больных диагностируют саркому Капоши либо одну из разновидностей неходжкинских лимфом.
Таким образом, несмотря на различную организацию онкогенных вирусов человека они обладают рядом общих биологических свойств, а именно:
- вирусы лишь инициируют патологический процесс, усиливая процессы деления клеток и генетическую нестабильность инфицированных ими клеток;
- у инфицированных онкогенными вирусами лиц возникновение опухоли, как правило, событие нечастое: один случай новообразования возникает среди сотен, иногда тысяч инфицированных;
- от момента инфицирования до возникновения опухоли имеет место продолжительный латентный период, длящийся годами, иногда десятилетиями;
- у большинства инфицированных лиц возникновение опухоли не является обязательным, но они могут составить группу риска, с более высокой вероятностью ее возникновения;
- для злокачественной трансформации инфицированных клеток необходимы дополнительные факторы и условия, приводящие к прогрессированию наиболее агрессивного опухолевого клона.
Такими дополнительными факторами, играющими роль сопутствующих канцерогенов, могут быть: злоупотребление алкоголем, табакокурение, коинфекция генитальным герпесом, малярия, нитрозамины в продуктах питания, пестициды.
На сегодняшний день основными методами лабораторной диагностики являются метод иммуноферментного анализа (ИФА) и метод полимеразной цепной реакции (ПЦР). Первый позволяет выявить белок вируса либо антитела к нему, которые выделяет организм в ответ на инфицирование. При помощи метода ПЦР мы можем выявить генетический материал самого вируса.
Метод иммуноферментного анализа является стандартным методом лабораторной диагностики.
Следует также отметить, что не всегда возможно определение вирусных белков в плазме крови. В таких случаях методом ИФА можно диагностировать только наличие антител в плазме крови пациента. Однако, важно помнить, что антитела могут вырабатываться в довольно длительный срок. Так, например, при инфицировании ВИЧ антитела вырабатываются в течение 6 месяцев, в случае гепатита С этот период может длиться до года, а антитела к вирусу Эпштейна-Барр (иммуноглобулины класса G) присутствуют у большого количества практически здоровых людей и их диагностика обладает низкой прогностической значимостью.
Полимеразная цепная реакция (ПЦР) — метод молекулярной биологии, позволяющий обнаружить возбудителя заболевания на основе его генетической информации.
ПЦР диагностика дает возможность существенно ускорить и облегчить диагностику различных заболеваний, в частности, вирусов гепатита В, С, D, цитомегаловирусной инфекции, вируса Эпштейна-Барр, вируса простого герпеса, а также хламидиоза, микоплазмоза, уреаплазмоза и т.п. При помощи данного метода вирусные инфекции можно обнаружить уже через 5–7 дней после заражения, за недели или месяцы до того, как появятся антитела или первые симптомы. Метод ПЦР позволяет выявить даже единичные клетки возбудителя, благодаря многократному увеличению последовательностей ДНК.
Полимеразная цепная реакция - это один из самых точных методов лабораторной диагностики. Его чувствительность составляет 95–99%, а специфичность достигает 100%.
Таким образом, достижения науки в области онкологии внесли определенную ясность в понимание механизмов возникновения некоторых злокачественных новообразований и все же большую часть из них не удается увязать с инфицированностью тем или иным вирусом, что создает большое поле деятельности современным онкологам в направлении дальнейшего изучения механизмов развития онкологических заболеваний.
Все вышеуказанные методы диагностики существуют у нас в РНПЦ онкологии и медицинской онкологии им. Н.Н.Александрова. В лаборатории клинической молекулярной генетики и иммунологических методов диагностики можно пройти обследование на вирусы герпеса,цитомегаловируса, Эпштена-Барра, вирусы гепатита В и С, а также пройти обследование на инфицирование вирусом папилломы человека, данные исследования может пройти любой человек обратившийся в центр.

Инфекция, вызванная онкогенными вирусами, является причиной 15,4% заболеваний раком по всей земле. Первый онкогенный вирус, который был идентифицирован — это куриный вирус саркомы Рауса в 1911 году. Десятилетиями позже были обнаружены серии других онкогенных вирусов, в том числе вирус папилломы Шопа (вирус папилломы кроличьего хвоста), вирус опухоли молочной железы мыши, аденовирус, вирус SV40 (обезьяний вирус sv40). Теория опосредованного вирусом онкогенеза в итоге была экспериментально продемонстрирована в 1976 году Гарольдом Вармусом и Майклом Бишопом путем превращения инфицированных клеток в опухолевые вирусом саркомы (ген v-src вызывает образование опухоли после захвата протоонкогена человеческой клетки в результате трансдукции).
Несмотря на то, что онкогенные вирусы нашли в исследованиях онкогенной активности животных клеток, они были не в состоянии преобразовать человеческие клетки. Теория вирусного онкогенеза в человеческой клетке оставалась спорной до 1965 года, когда вирус Эпштейн-Барр (EBV) был обнаружен в клетках лимфомы Беркитта. В ходе последующих исследований, в том числе выделении Т-лимфотропного вируса человека (HTLV) из клеток Т-клеточной лимфомы и выявлении роли папилломовирусов человека с высокой онкогенной активностью в развитии рака шейки матки, был определен путь для понятия человеческих онкогенных вирусов. Обнаружение связи между герпес-вирусом и саркомой Капоши (KSHV) и лимфомой и между полиомавирусом клеток Меркеля (MCV) и карциномой клеток Меркеля (MCC) подчеркнуло возможность открытия еще большего количества онкогенных вирусов с помощью современных технологий. Далее каждый вирус будет рассмотрен отдельно.
Вирус Эпштейн-Барр
Вирус Эпштейн-Барр (ВЭБ, EBV) — ДНК-содержащий вирус, который преимущественно поражает B-лимфоциты, также является митогеном для них; вызывает лимфопролиферативные болезни (лимфома Беркитта, носоглоточная карцинома, NK-клеточная лейкемия, лимфома Ходжкина и т.д.), а также инфекционный мононуклеоз. Вирионы вируса были обнаружены при электронной микроскопии биоптата лимфомы Беркитта в начале 1964 года Энтони Эпштейном и Ивонной Барр.
Строение. ВЭБ имеет вирусный капсидный антиген (VCA), ядерные антигены-EBNAs 1, 2, 3, 3a, 3b, 3c; латентные мембранные протеины (LMPs) 1, 2 и две маленькие Эпштейна-Барр-кодируемые РНК (EBER) молекулы — EBER1 и EBER2. EBNAs и LMPs являются ДНК-связывающими белками, считающимися необходимыми для развития инфекции и фиксации.
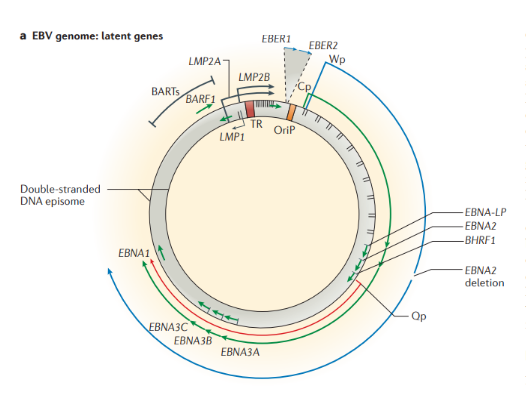
- необходим для трансформации В-лимфоцитов;
- функционирует как конститутивный активатор рецептора ФНО и имеет сходство с CD-40 рецептором;
- активирует сигнальные пути, которые делают вклад в онкогенный эффект.
В зависимости от набора экспрессируемых вирусных генов в пораженных клетках выделяют три типа латентности (I, II и III тип), характерные для различных видов лимфом: I тип подразумевает избирательную экспрессию EBNA-1 при ВЭБ-положительной лимфоме Беркитта; II тип заключается в экспрессии EBNA-1, LMP-1 и LMP-2 и является отличительным признаком ВЭБ-положительной ходжкинской лимфомы, периферических T/NK-клеточных лимфом; латентность III типа, характеризуемая экспрессией всего набора из девяти латентных белков ВЭБ, наблюдается при лимфопролиферативных поражениях, возникающих у пациентов с тяжелым иммунодефицитом (после трансплантации паренхиматозных органов или стволовых клеток, ВИЧ-инфекции). Тип латентности определяет восприимчивость инфицированных клеток к различным иммунотерапевтическим тактикам. Индуцированные ВЭБ злокачественные новообразования связаны с экспрессией латентных генов. У большинства иммунокомпетентных носителей ВЭБ вирус не индуцирует опухолевый процесс. Новообразования развиваются при комплексном взаимодействии ВЭБ, иммуногенетических факторов, факторов внешней среды (паразитарных инфекций — чаще, малярии, недоедании, потреблении пищи, содержащей канцерогены) и иммунодефицита (ВИЧ-инфекция, трансплантация).
Папилломавирусы человека
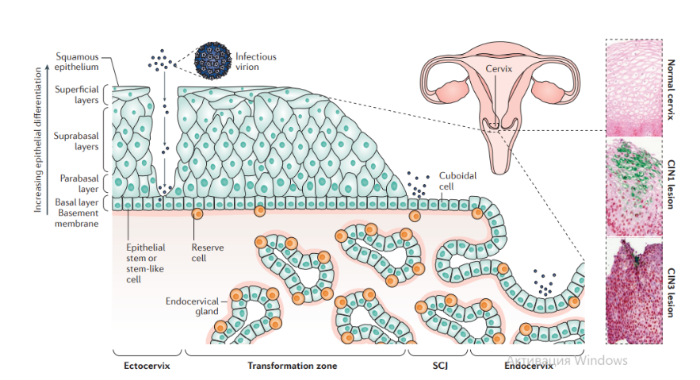
Описано около 200 папилломавирусов. Вирусы передаются при контактах через микротравмы кожи и слизистых оболочек, а также половым путем. Папилломавирусы человека вызывают доброкачественные кожные, генитальные, оральные и конъюнктивальные папилломы; индуцируют пролиферацию эпителия, обладают онкогенным потенциалом. С папилломавирусом, особенно ПВЧ-5 и ПВЧ-8, тесно связано развитие немеланомных разновидностей рака кожи. Различают низкоонкогенные папилломавирусы, вызывающие бородавки, которые не малигнизируются, и высокоонкогенные, способные вызвать рак шейки матки, — ПВЧ-16, 18, 31, 33, 35, 45, 51, 52, 58.
Строение. Капсид икосаэдрический, состоит из двух капсидных белков (L1-L2), формирующих 72 пентамера. Геном — двунитевая циркулярная ДНК; имеет в зависимости от вируса восемь ранних генов (E1-E8) и два поздних гена (L1-L2). Гены E6-E7 обладают онкогенной активностью.
Патогенез. В целом, для развития продуктивного поражения ВПЧ (высокого или низкого риска) требуется, чтобы вирус имел доступ к эпителию базального слоя как только эпителиальный барьер был подвержен риску. Папилломавирусы должны инфицировать делящуюся клетку, чтобы стать признанными как малое количество копий ядерной эписомы, и для развития стойкого поражения первичная инфицированная клетка, вероятно, должна быть похожа на долгоживующую эпителиальную стволовую клетку или похожую на нее. Кроме того, связанные с заживлением ран изменения в местном микроокружении, включая увеличение количества факторов роста, могут играть ключевую роль в создании резервуара инфекции в базальном слое. Способность ВПЧ инфицировать, и реплицироваться, и управлять прогрессированием рака зависит от функции вирусного белка, положении в эпителии, где эти белки экспрессируются. Как только инфицированные базальные клетки поделились и в конечном итоге вошли в парабазальный слой, они начинают проходить программу экспрессии генов, которая связана с дифференциацией. Амплификация вирусного генома обычно происходит в срединно-эпителиальных слоях, тогда как сбор и выход вируса происходит вблизи наружной поверхности эпителия.
Несмотря на то, что эффективная амплификация генома требует комбинированного действия множественных продуктов вирусного гена, включая E6, E7, E2 и кодированную вирусом геликазы E1, поддержание репликации в базальном слое эпителия может зависеть от факторов репликации клетки хозяина. Программа, зависящая от дифференциации, которая происходит в надбазальных слоях эпителиальной клетки, включает как временные изменения в активности промотора, так и изменения в шаблонах сплайсинга мРНК, которые облегчают производство различных продуктов вирусных генов на разных стадиях во время программы дифференциации. Функция вирусного белка далее регулируется посттрансляционной модификацией, включая фосфорилирование и протеолитическое деление клетки.
Герпесвирус, ассоциированный с саркомой Капоши
KSHV, или человеческий герпесвирус 8, был обнаружен в 1994 году как член семейства гамма-герпеса человека, присоединившись к ВЭБ. Инфекция иммунокомпрометированных индивидуумов с KSHV была связана с развитием саркомы Капоши, полученной из эндотелиальных клеток, и по меньшей мере двумя B-лимфоцит лимфопролиферативными заболеваниями: первичная выпотная лимфома и многоцентричная болезнь Кастлмана. Однако изучение патогенеза и онкогенеза KSHV затруднено отсутствием значимой модели животных и восприимчивой клеточной культуры.
Онкогенное действие. Две иммортализованные клеточные линии, KS Y-1 и SLK, когда-то использовались для исследований KS и KSHV, но в KS Y-1 были также обнаружены клетки линии рака мочевого пузыря T 24, что затруднило дальнейшую работу. Первичные эмбриональные метанефрические мезенхимальные клетки-предшественники почек крысы восприимчивы к инфекции и трансформации KSHV, но из них распространяются ограниченное количество инфекционных вирионов. Линии B-клеток, полученные из первичной выпотной лимфомы, обычно заражаются KSHV на латентной стадии и могут быть индуцированы для получения малого количества вирионов KSHV, но первичные B-лимфоциты из периферической крови или тонзиллярной ткани являются устойчивыми к инфекции KSHV, и для их инфицирования может потребоваться совместный рост с KSHV-позитивными клетками.
KSHV кодирует несколько важных белков, которые обладают некоторой онкогенной активностью для индуцирования пролиферации клеток, иммортализации, трансформации и передачи сигналов; производства цитокинов; иммунного контроля; антиапоптозной активности; и ангиогенеза. К ним относятся вирусные латентные белки, латентный ассоциированный ядерный антиген (LANA), vFLIP (FADD (Fas-ассоциированный белок с доменом смерти), подобный ферменту, ингибирующему синтез интерферона или ингибирующему белок каспазы 8 (FLICE)), vCyclin и вирусные литические белки G-белкового рецептора (vGPCR), интерферон-регуляторный фактор 1 (vIRF-1) и K1. Хотя истинную онкогенную природу каждого белка еще предстоит определить, накопление доказательств указывает на то, что каждый из них вносит свой вклад в онкогенез KSHV. Таким образом, полный спектр вызванной KSHV злокачественности может потребовать, чтобы несколько онкогенных продуктов работали вместе в присутствии клеток хозяев и экологических факторов. Например, как LANA, так и vIRF-1 нацелены на клеточный опухолевый супрессор p53. LANA также ингибирует pRB и PP2A.vCyclin, активатор CDK4 6,198, подавляет p27kip1, ингибитор CDK199 и вызывает реакцию на задержку старения G1, результаты от гиперактивации NF-κB. vFLIP и K1 активируют путь сигнала NF-κB для предотвращения апоптоза B-клеток. vGPCR и K1 влияют на сигнальные пути AKT и NF-κB и способствуют ангиопролиферативному и воспалительному поражению саркомой Капоши.
Т-лимфотропный вирус человека (HTLV)
T-лимфотропный вирус человека (HTLV) относится к семейству ретровирусов, является возбудителем T-клеточного лимфолейкоза взрослых. Вирус впервые был изолирован в 1980 году от больного Т-лимфомой.
Геном. Gag, Pol и Env являются вирусными структурными белками, другие — вирусными регуляторными/вспомогательными белками. За исключением гена hbz, который кодируется минус-цепью провирусного генома HTLV из 3'-LTR, все остальные гены кодируются плюсовой нитью по направлению 5'-LTR. Следует отметить, что 5'-LTR часто удаляется или метилируется по мере прогрессирования заболевания. Кроме того, на поздних стадиях лейкемиогенеза в гене tax часто возникают нонсенс- или миссенс-мутации. Хотя белок tax и ген HBZ индуцируют опухоли у трансгенных мышей, а p12 проявляет слабую онкогенную активность, ни один из вирусных белков/генов, кроме tax, не требуется для опосредованного HTLV-1 опухолеобразования. Продукт tax гена действует на терминальные повторы LTR, стимулируя синтез вирусной иРНК, а также образование рецепторов IL-2 на поверхности зараженной клетки.
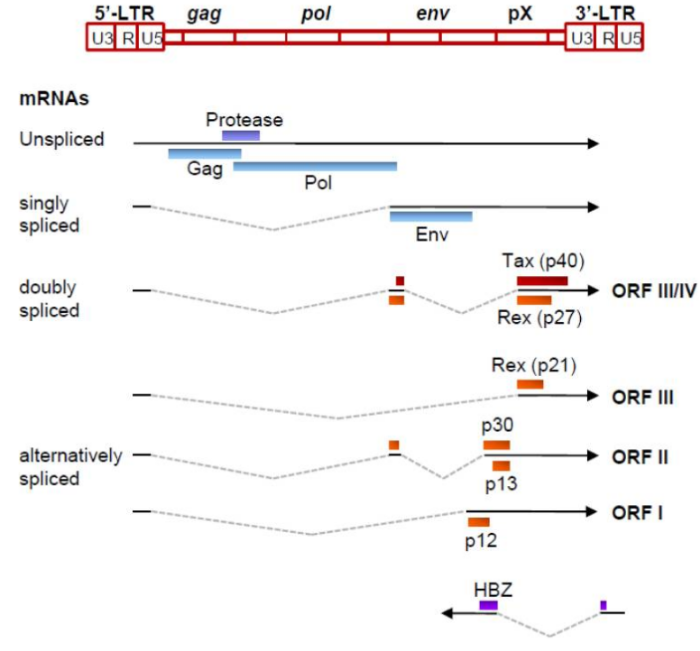
Рисунок 3. Gag, Pol и Env вирусные регуляторные/вспомогательные белки HTLV
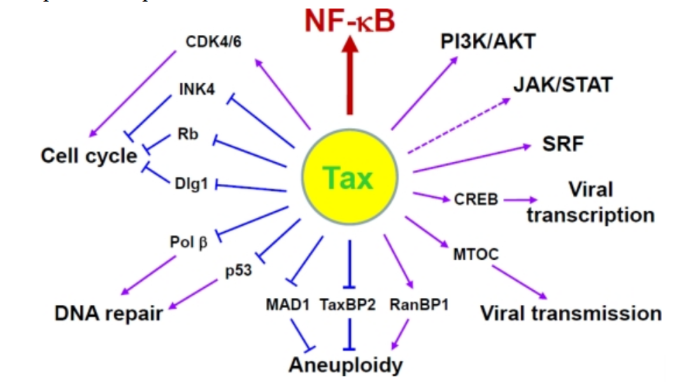
Рисунок 4. К леточные пути вирусного онкобелка tax
Патогенез. Проникновение HTLV-1 в клетку человека охарактеризовывает начало выживания и репликации вируса. HTLV-1 связывается с рецептором клеток, имеющих необходимый антиген, что инициирует процесс инвазии. Рецепторный комплекс состоит из транспортера глюкозы (GLUT1), гепаринсульфат протеогликана (HSPG) и рецептора VEGF-165 нейропилина-1 (NRP-1). HTLV-1 взаимодействует с HSPG. Процесс слияния происходит через комбинацию GLUT1 с HSPG/NRP-1, после чего ядро, содержащее вирусную РНК, доставляется в цитоплазму клеток-мишеней. После обратной транскрипции HTLV-1 встраивает свой геном в генома хозяина, чтобы сформировать провирус, окруженный двумя LTR на 5' и 3' концах. Затем провирус транскрибируется и кодирует структурные, регуляторные и вспомогательные белки. Впоследствии вирусные геномные РНК и Gag, Env и Gag-Pol белки переносятся в плазматическую мембрану, чтобы начать собираться в зрелую вирусную частицу.
Вирусы гепатита
Вирус гепатита В (HBV) и вирус гепатита С (HCV) представляют собой несвязанные вирусы, имеющие тропность к гепатоцитам и реплицирующиеся в них. Около 2 миллиардов человек инфицированы HBV, и более 350 миллионов человек становятся хроническими носителями. Только 5-10% взрослых, которые приобретают инфекцию, становятся хроническими носителями, у 30% развиваются прогрессирующие хронические заболевания печени: гепатит, фиброз, цирроз и, наконец, гепатоцеллюлярная карцинома (HCC).
Патогенез. HCC, индуцированная посредством HBV и HCV, развивается в области воспаления и регенерации, что является результатом хронического повреждения печени, а это в свою очередь указывает на то, что патогенез HCC иммунно-опосредован. Эти вирусы постоянно реплицируются в культуре клеток без явных повреждений и смерти клеток, подразумевая, что они являются не цитопатическими. Постоянная репликация вируса является фактором риска для образования HCC, потому что воспаление часто приводит к длительным хроническим заболеваниям печени CLD без выведения вируса. В этом контексте HBV и HCV генерируют белки, подавляющие иммунитет, который должен контролировать хронические инфекции. HBV- и HCV-кодированные белки изменяют экспрессию гена хозяина и клеточный фенотип, что является признаком рака. Эти изменения способствуют независимой от фактора роста пролиферации, сопротивлению к ингибированию роста, инвазии тканей и метастазированию, ангиогенезу, перепрограммированию энергетического метаболизма и устойчивости к апоптозу. Хроническое воспаление также способствует генетической нестабильности в клетках опухоли. Вклад HBV в развитие HCC включает в себя экспрессию гена гепатита Bx (HBx) и, возможно, усеченные пре-S или S-полипептиды карбоксимицина; основной белок и неструктурные (NS) белки NS3 и NS5A HCV способствуют онкогенной трансформации. Изменения в экспрессии гена хозяина, которые способствуют возникновению опухолевого генеза, также, похоже, поддерживают репликацию вируса и/или защиты вирусных гепатоцитов от иммунного опосредованного повреждения и разрушения.
Читайте также:


