Трансплантация почки при гепатите с
В мире существует огромная нехватка донорских органов, из-за чего тысячи людей погибают, так и не дождавшись спасительной операции. Среди них и пациенты с почечной недостаточностью, единственным шансом для которых является трансплантация. Но уже скоро количество доступных донорских почек может значительно увеличиться: недавнее исследование показало, что пересадка почек от носителей вируса гепатита С безопасна для неинфицированных реципиентов.
Гепатит С является одним из самых распространенных инфекционных заболеваний печени: по данным Всемирной организации здравоохранения, по всему миру насчитывается 71 миллион человек с этим диагнозом. Вызывает его одноименный вирус, который обычно передается через кровь. Инфекция провоцирует воспаление в печени, что может привести к ее серьезным повреждениям. Размножаясь в печеночных клетках, вирус гепатита провоцирует развитие хронического воспаления, фиброза, дистрофии.
Однако самыми опасными осложнениями гепатита С являются цирроз и рак печени, которые со временем развиваются у большинства инфицированных. Именно они считаются главными причинами смерти среди носителей этого вируса, который, согласно статистике, ежегодно забирает около 400 000 жизней.
Учитывая, что передается вирус гепатита С через кровь и ее продукты, зараженные им люди прежде не могли сдавать кровь и быть донорами органов. Были опасения, что инфекция передастся от ее носителей здоровым людям. Но недавно команда ученых Научного центра здоровья Университета Теннеси заявила, что пересадка почек от инфицированных вирусом гепатита С доноров здоровым реципиентам является безопасной. К такому выводу они пришли, проведя два небольших клинических и одно наблюдательное исследования, результатами которых поделились на страницах медицинского журнала American Journal of Transplantation.
Новые возможности в трансплантации почек
В настоящее время пересадка почек от инфицированных гепатитом С доноров возможна только тем пациентам, которые сами являются носителями этого типа вируса. Но таких донорских органов намного больше, чем зараженных людей, нуждающихся в трансплантации. Как следствие, почти тысяча инфицированных почек, которые могли бы стать донорскими, ежегодно попросту списываются и выбрасываются.
В недавнем исследовании американские ученые решили проверить безопасность пересадки почек от инфицированных вирусом гепатита С доноров. В рамках эксперимента, который начался в 2018 году, более 80 неинфицированных реципиентов получили донорские органы от зараженных гепатитом С людей. Специалисты смогли оценить результаты только 53 получателей, в случае с остальными делать выводы еще было рано – времени после пересадки прошло недостаточно.
Принять участие в исследовании предложили пациентам, которые минимум полтора года находились в списке ожидающих операции по трансплантации почки. Все они были осведомлены о том, что донорами органов для них станут инфицированные вирусным гепатитом люди, и знали о возможном риске заражения. Тем не менее, все согласились на вмешательство. У всех пациентов трансплантация прошла успешно, после чего они в течение 12 недель получали антивирусную терапию. В результате ни у кого из них не были обнаружены признаки инфицирования гепатитом С.
Ученые говорят, что несмотря на осложнения, они планируют дальнейшие исследования. Однако главное то, что в результате пересадки люди не заразились вирусом гепатита С. Это знаковое открытие, ведь оно позволит гораздо большему количеству людей своевременно получить донорскую почку и сохранить жизнь.
Альтернатива диализу
Во многих случаях альтернативой для людей с болезнями почек, которые находятся в ожидании донорского органа или не решаются на операцию по пересадке, остается диализ. Это сложная и болезненная процедура, требующая регулярных визитов в клинику. Пятилетняя выживаемость среди людей, находящихся на диализе, составляет всего 50%. Ежегодно около 10% пациентов, вынужденных постоянно проходить эту процедуру, умирают.
Исследователи надеются, что их открытие позволит успешно пересаживать сотни, если не тысячи почек пациентам, для которых эта операция является жизненно необходимой. А инфицированные органы больше не будут выбрасывать – вместо этого они будут спасать еще больше жизней.
Похожие темы научных работ по клинической медицине , автор научной работы — Ватазин А. В., Прокопенко Е. И., Зулькарнаев А. Б., Щербакова Е. О., Кантария Р. О.
применяют общий мазок. У женщин исследуют выделения из влагалища, у мужчин - выделения из мочеиспускательного канала и секрет предстательной железы. Результат общего мазка подтверждают более точными методами исследования - ПИФ, ПЦР или посев.
Лечение трихомониаза должно быть комплексным и индивидуальным. Очень важно довести лечение до конца, либо недолеченный трихомониаз может приобрести хроническую форму и проявить себя через несколько лет.
Лечение трихомониаза сводится к назначению противотрихомонадных препаратов для приема внутрь. Местное лечение (влагалищные таблетки и свечи) неэффективно.
В ряде случаев назначают лечение, дополняющее противотрихомонадные препараты (иммунотерапия, общеукрепляющие препараты, массаж предстательной железы, инстилляции уретры, физиотерапия и т. д.).
Контроль излеченности: излеченными считают только тех больных, у которых прекращаются выделения из уретры, нормализуется моча, рассасываются инфильтраты в воспаленных половых железах, восстанавливается нормальный состав их секрета, не выявляются патологические изменения при уретроскопии.
ВИРУСНЫЕ ГЕПАТИТЫ В И С У БОЛЬНЫХ ПОСЛЕ ТРАНСПЛАНТАЦИИ ДОНОРСКОЙ ПОЧКИ
А.В. Ватазин, Е.И. Прокопенко, А.Б. Зулькарнаев, Е.О. Щербакова, Р.О. Кантария, А.С. Пасов
Московский ОНИКИ им. М.Ф.Владимирского, Россия
E-mail авторов: 7059899@gmail.com
Вирусные гепатиты - до сих пор одна из самых часто встречаемых инфекций у больных с хронической почечной недостаточностью (ХПН) на до-отрансплантационном этапе. При этом срок пребывания на гемодиализе прямо пропорционален риску инфицирования вирусными гепатитами. Инфициро-ванность вирусными гепатитами В и С (ВГС и ВГВ) является независимым фактором риска смерти у больных на гемодиализе.
ВГС - не только самая часто встречаемая инфекция среди реципиентов почек, но и является основной причиной хронических заболеваний печени после аллотрансплантации почки (АТП). Наличие ВГС приводит к достоверному увеличению риска развития сахарного диабета у реципиентов почечного аллотрансплантата (ПАТ) и инфекций. Однако поскольку даже у серопозитивных пациентов АТП является методом выбора лечения ХПН (так как летальность у инфицированных реципиентов ПАТ ни-
же, чем у больных в листе ожидания), необходима тщательная оценка состояния до операции.
По нашим данных отсроченная выживаемость как реципиентов, так и ПАТ значимо ниже у больных, инфицированными вирусными гепатитами.
Аллотрансплантация почек у больных, инфицированных вирусными гепатитами, представляет собой серьезную проблему. На данный момент нет единого протокола лечения вирусных гепатитов после АТП, недостаточно изучено влияние различных протоколов иммуносупрессии на их активность. Применение после АТП протоколов лечения вирусных гепатитов, которые используются в общей популяции сопряжено с высоким риском утраты почечного аллотрансплантата (ПАТ) в связи с развитием резистентного криза отторжения из-за выраженного иммуномодулирующего действия противовирусных препаратов.
Известно, что достижение быстрого полного и/или устойчивого вирусологического ответа при вирусном гепатите значительно улучшает долгосрочный прогноз. Благодаря внедрению экстракорпоральных методик достигнуты некоторые успехи в лечении вирусных гепатитов. В настоящее время широко применяется плазмаферез, при помощи которого можно эффективно удалить аутоантитела и патологические метаболиты, что способствует торможению прогрессирования поражений печени. Однако недостаточная селективность этого метода часто делает применение его затруднительным: проведение плазмафереза при гипоальбуминемии затруднительно, а динамка концентрации ингибиторов кальциневрина во время курса плазмафереза трудно предсказуема.
При сравнимой эффективности указанных недостатков лишен высокоселективный метод каскадной плазмофильтрации (КПФ), который способен непосредственно удалять вирионы, тем самым, понижая вирусную нагрузку. КПФ является безопасным и высокоэфеективным методом, способным значительно улучшить результаты лечения вирусных гепатитов после АТП: сократить сроки достижения устойчивого вирусного ответа и снизить риск активизации хронического процесса, что значительно улучшает долгосрочный прогноз.
Высокая эффективность КПФ в лечении ВГС также подтверждена и у реципиентов печени. Применение КПФ приводит к быстрому снижению концентрации ИСУ-РНК, что позволяет достигнуть устойчивого вирусологического ответа в комбинации с медикаментозной терапией.
Повышение эффективности лечения вирусных гепатитов путем разработки эффективных и безопасных схем лечения с применением различных экстракорпоральных методик, является перспективным направлением и способно значительно улучшить результаты трансплантации почки.
КАСКАДНАЯ ПЛАЗМОФИЛЬТРАЦИЯ КАК СПОСОБ ПРОФИЛАКТИКИ И ЛЕЧЕНИЯ ИММУНОЛОГИЧЕСКИХ ОСЛОЖНЕНИЙ
Для редактора:
Время ожидания для пересадки почки превышает 3 - 5 лет во многих частях Соединенных Штатов1. Однако более 500 высококачественных почек от умерших доноров с вирусом гепатита С (HCV) ежегодно отбрасываются.2,3 Противовирусные препараты прямого действия , Которые связаны с высокими показателями излечения HCV и управляемыми побочными эффектами, создали потенциал для существенного увеличения числа пересадок почки, делая HCV-инфицированные почки доступными для HCV-отрицательных кандидатов в списке ожидания.4,5
В этом открытом экспериментальном исследовании, проведенном в Университете Пенсильвании (пересадка почек гепатита С в негативные почечные реципиенты [THINKER], ClinicalTrials.gov, NCT02743897), мы стремились определить безопасность и эффективность трансплантации почек из HCV генотип 1-виремических доноров в HCV-негативных пациентов, а затем лечение элбасвиром-grazoprevir (Zepatier). Внешняя комиссия по мониторингу данных и безопасности рассмотрела все аспекты испытания. Авторы ручаться за полноту и точность данных и анализа, а также за приверженность испытания к протоколу, доступный с полным текстом этого письма на NEJM.org.
Взрослые, которые проходили диализ и которые давно ожидали времени ожидания пересадки почки, были допущены к включению в исследование, и пациенты с условиями, которые существенно повысили риск заболевания печени, аллотрансплантационной недостаточности или смерти, были исключены. Был внедрен процесс трехэтапного информированного согласия с участием врачей.
Критерии умершего донора обеспечивали выбор высококачественных почек (см. Дополнительное приложение, доступное на NEJM.org). Поскольку элбасвир-гразопревир не одобрен Управлением по контролю за продуктами и лекарствами (FDA) для пациентов с генотипами 2 и 3 ВГС, а противовирусное средство прямого действия для лечения пациентов с генотипами, которые имеют почечную недостаточность, не было одобрено FDA, доноры были ограничены теми, у кого были положительные качественные результаты испытаний нуклеиновых кислот HCV и генотип HCV 1. Мы разработали новый протокол для генотипирования доноров одновременно с распределением органов (см. Дополнительное приложение).
Всем реципиентам вводили внутривенные глюкокортикоиды и кроличье антитимоцитарный глобулин с последующим пероральным такролимусом, микофенолятом мофетилом и преднизоном. Вирусная нагрузка вируса гепатита С измерялась у реципиентов на 3-й день после операции; Элбасвир-гразопревир был начат, когда результаты стали положительными, и терапию поддерживали в течение 12 недель.
Из 38 пациентов, которые потенциально имели право участвовать в исследовании, 22 посетили учебную презентацию, а 14 предоставили письменное информированное согласие и изменили свой профиль списка ожидания, чтобы указать право на получение инфицированной HCV почки. По протоколу 10 пациентов получали инфицированные HCV почки. Медианный возраст реципиентов составил 59 лет (межквартильный диапазон, 51-63); Половина получателей были мужчинами, а две были черными. Среднее время от включения в список ожидания для инфицированных вирусом гепатита С почек до трансплантации составляло 58 дней (межквартильный диапазон - от 53 до 100). Средний показатель индекса профиля донорства почки (по шкале от 0 до 100%, при более высоких значениях, указывающих на более высокий риск неудачи при трансплантации для отдельной почки) составлял 42% (межквартильный диапазон, 32-48) (см. Таблицу S4 в Дополнительной Приложение).
На третий день после трансплантации у всех реципиентов обнаруживалась РНК HCV; Вирусные нагрузки варьировались от менее 15 МЕ на миллилитр (обнаруживаемый, но не поддающийся количественному определению) до 193 000 МЕ на миллилитр (рисунок 1
Рисунок 1
Вирусная нагрузка от гепатита С у 10 реципиентов почечной трансплантологии.
). Эльбасвир-гразопревир был инициирован у всех реципиентов. Девять реципиентов заразились вирусом гепатита С 1a; Ни у кого не было идентифицируемой резистентности к NS5A. Все реципиенты были излечены от ВГС; Лечение было определено как устойчивый вирусологический ответ через 12 недель после окончания лечения.4,5
Средний уровень креатинина в сыворотке крови в течение 6 месяцев составлял 1,1 мг на децилитр (97 мкмоль на литр, интерквартильный диапазон - от 0,8 до 1,3 мг на децилитр [от 71 до 115 мкмоль / л]), а скорость клубочковой фильтрации составляла 62,8 мл / 1,73 м2 (межквартильный диапазон, от 51,8 до 83,1). У одного реципиента была замедленная функция трансплантата, временные повышенные уровни аминотрансферазы, развившиеся у двух реципиентов, и у одного пациента был разработан переходный новый уровень I специфического для донора уровня антитела (1800 единиц средней интенсивности флуоресценции). Протеинурия (при оценочном уровне 2 г в день экскреции белка с мочой) развилась у одного пациента, у которого была IgA нефропатия до трансплантации; У этого пациента фокальный сегментный гломерулосклероз был обнаружен на биопсии после того, как устойчивый вирусологический ответ был достигнут через 12 недель после окончания лечения (см. Таблицу S6 в Дополнительном приложении).
Это пилотное исследование показало, что трансплантация инфицированных HCV-генотипом 1 почек в HCV-отрицательных реципиентов, а затем использование противовирусных агентов прямого действия может обеспечить потенциально превосходную функцию аллотрансплантата при лечении инфекции HCV.
Для редактора:
Время ожидания для пересадки почки превышает 3 - 5 лет во многих частях Соединенных Штатов1. Однако более 500 высококачественных почек от умерших доноров с вирусом гепатита С (HCV) ежегодно отбрасываются.2,3 Противовирусные препараты прямого действия , Которые связаны с высокими показателями излечения HCV и управляемыми побочными эффектами, создали потенциал для существенного увеличения числа пересадок почки, делая HCV-инфицированные почки доступными для HCV-отрицательных кандидатов в списке ожидания.4,5
В этом открытом экспериментальном исследовании, проведенном в Университете Пенсильвании (пересадка почек гепатита С в негативные почечные реципиенты [THINKER], ClinicalTrials.gov, NCT02743897), мы стремились определить безопасность и эффективность трансплантации почек из HCV генотип 1-виремических доноров в HCV-негативных пациентов, а затем лечение элбасвиром-grazoprevir (Zepatier). Внешняя комиссия по мониторингу данных и безопасности рассмотрела все аспекты испытания. Авторы ручаться за полноту и точность данных и анализа, а также за приверженность испытания к протоколу, доступный с полным текстом этого письма на NEJM.org.
Взрослые, которые проходили диализ и которые давно ожидали времени ожидания пересадки почки, были допущены к включению в исследование, и пациенты с условиями, которые существенно повысили риск заболевания печени, аллотрансплантационной недостаточности или смерти, были исключены. Был внедрен процесс трехэтапного информированного согласия с участием врачей.
Критерии умершего донора обеспечивали выбор высококачественных почек (см. Дополнительное приложение, доступное на NEJM.org). Поскольку элбасвир-гразопревир не одобрен Управлением по контролю за продуктами и лекарствами (FDA) для пациентов с генотипами 2 и 3 ВГС, а противовирусное средство прямого действия для лечения пациентов с генотипами, которые имеют почечную недостаточность, не было одобрено FDA, доноры были ограничены теми, у кого были положительные качественные результаты испытаний нуклеиновых кислот HCV и генотип HCV 1. Мы разработали новый протокол для генотипирования доноров одновременно с распределением органов (см. Дополнительное приложение).
Всем реципиентам вводили внутривенные глюкокортикоиды и кроличье антитимоцитарный глобулин с последующим пероральным такролимусом, микофенолятом мофетилом и преднизоном. Вирусная нагрузка вируса гепатита С измерялась у реципиентов на 3-й день после операции; Элбасвир-гразопревир был начат, когда результаты стали положительными, и терапию поддерживали в течение 12 недель.
Из 38 пациентов, которые потенциально имели право участвовать в исследовании, 22 посетили учебную презентацию, а 14 предоставили письменное информированное согласие и изменили свой профиль списка ожидания, чтобы указать право на получение инфицированной HCV почки. По протоколу 10 пациентов получали инфицированные HCV почки. Медианный возраст реципиентов составил 59 лет (межквартильный диапазон, 51-63); Половина получателей были мужчинами, а две были черными. Среднее время от включения в список ожидания для инфицированных вирусом гепатита С почек до трансплантации составляло 58 дней (межквартильный диапазон - от 53 до 100). Средний показатель индекса профиля донорства почки (по шкале от 0 до 100%, при более высоких значениях, указывающих на более высокий риск неудачи при трансплантации для отдельной почки) составлял 42% (межквартильный диапазон, 32-48) (см. Таблицу S4 в Дополнительной Приложение).
На третий день после трансплантации у всех реципиентов обнаруживалась РНК HCV; Вирусные нагрузки варьировались от менее 15 МЕ на миллилитр (обнаруживаемый, но не поддающийся количественному определению) до 193 000 МЕ на миллилитр (рисунок 1
Рисунок 1
Вирусная нагрузка от гепатита С у 10 реципиентов почечной трансплантологии.
). Эльбасвир-гразопревир был инициирован у всех реципиентов. Девять реципиентов заразились вирусом гепатита С 1a; Ни у кого не было идентифицируемой резистентности к NS5A. Все реципиенты были излечены от ВГС; Лечение было определено как устойчивый вирусологический ответ через 12 недель после окончания лечения.4,5
Средний уровень креатинина в сыворотке крови в течение 6 месяцев составлял 1,1 мг на децилитр (97 мкмоль на литр, интерквартильный диапазон - от 0,8 до 1,3 мг на децилитр [от 71 до 115 мкмоль / л]), а скорость клубочковой фильтрации составляла 62,8 мл / 1,73 м2 (межквартильный диапазон, от 51,8 до 83,1). У одного реципиента была замедленная функция трансплантата, временные повышенные уровни аминотрансферазы, развившиеся у двух реципиентов, и у одного пациента был разработан переходный новый уровень I специфического для донора уровня антитела (1800 единиц средней интенсивности флуоресценции). Протеинурия (при оценочном уровне 2 г в день экскреции белка с мочой) развилась у одного пациента, у которого была IgA нефропатия до трансплантации; У этого пациента фокальный сегментный гломерулосклероз был обнаружен на биопсии после того, как устойчивый вирусологический ответ был достигнут через 12 недель после окончания лечения (см. Таблицу S6 в Дополнительном приложении).
Это пилотное исследование показало, что трансплантация инфицированных HCV-генотипом 1 почек в HCV-отрицательных реципиентов, а затем использование противовирусных агентов прямого действия может обеспечить потенциально превосходную функцию аллотрансплантата при лечении инфекции HCV.
Гемодиализ, пересадка почки, 14 госпитализаций за 2 года и осторожная длительная терапия вирусных гепатитов
По материалам: Sustained eradication of hepatitis C virus by low-dose long-term interferon therapy in a renal transplant recipient with dual infection with hepatitis B and C viruses: a case report
Ming-Ling Chang, Ping-Chin Lai and Chau-Ting Yeh
Journal of Medical Case Reports20115:246
51‑летнему мужчине с терминальной стадией хронической почечной недостаточности, получавшему в течение 6 лет гемодиализ 3 раза в неделю, была проведена трансплантация почки. Еще на начальном этапе гемодиализа у него были выявлены поверхностные антигены вируса гепатита В (HBV), а через три года — антитела к вирусу гепатита С (HCV). В этот момент в крови: количество ДНК HBV — 4,1×10 6 копий/мл, количество РНК HCV — 5,9×10 5 копий/мл.
После трансплантации пациенту была назначена иммуносупрессивная терапия преднизолоном, микофенолата мофетилом, циклоспорином и такролимусом. В последующие два года после операции пациент 14 раз был госпитализирован в клинику по разным причинам, в том числе с цитомегаловирусной пневмонией, грибковой инфекцией мочевыводящих путей, лабиальным герпесом, острым кризом отторжения аллотрансплантата, туберкулезом легких, туберкулезным циститом, стриктурой уретры с обструктивной уропатией. Противотуберкулезную терапию проводили через год после трансплантации почки — в течение первых трех месяцев комбинацией препаратов изониазида, рифампицина и этамбутола, в фазе продолжения терапии еще на следующие семь месяцев был назначен изониазид.
Функциональные пробы печени (аланинаминотрансфераза (АЛТ), аспартатаминотрансфераза (АСТ), билирубин) в первый год после трансплантации были в норме, однако позже появилось умеренное повышение трансаминаз (1–3‑кратное). На этом фоне преднизолон отменили. Еще через год у пациента уровень трансаминаз превышал в 7 раз нормативные показатели, билирубин был 3–4 мг/дл (норма до 1 мг/дл), отмечалась желтуха. Количество ДНК HBV в сыворотке было ниже предела обнаружения ( 6 копий/мл (высокая вирусная нагрузка). Назначена монотерапия противовирусным препаратом рибавирином в дозе 200 мг/сут в первые 9 месяцев, а затем 200 мг через день в течение двух месяцев.
По завершении схемы лечения рибавирином выполнена биопсия печени, которая выявила у пациента хронический активный гепатит умеренной активности согласно индексу гистологической активности Knodell (перипортальный некроз — 3 балла из 10, внутридольковый некроз — 1 балл из 4, портальное воспаление — 3 балла из 4, фиброз — 3 балла из 4), а также жировой гепатоз. Кроме того, иммуногистохимически в биоптате печени обнаруживался HBs-антиген.
Пациенту назначен рибавирин повторно (200 мг/сут или через сут) и интерферон альфа-2b (3×10 6 ЕД подкожно 1–2 раза в неделю). Доза корригировалась с учетом состояния пациента и биохимических показателей его крови (рисунок 1) в течение 4 лет. Для профилактики реактивации HBV был назначен ламивудин (100 мг/сут), который пациент принимал в течение двух лет.
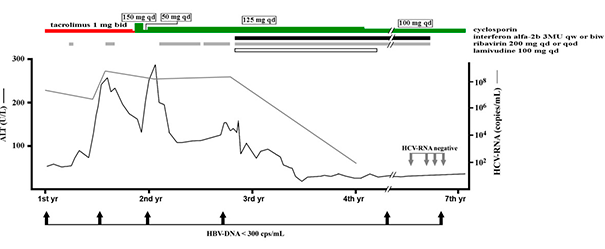
7th yr — с первого по седьмой год лечения;
серая линия и стрелки — количество РНК HCV (HCV RNA);
жирная линия и стрелки — количество ДНК HBV (HBV DNA);
красный отрезок — такролимус (tacrolimus);
зеленый отрезок — циклоспорин (tacrolimus);
черный отрезок — интерферон альфа 2b (interferon a-2b);
серый отрезок — рибавирин (ribavirin);
пустой отрезок — ламивудин (lamivudine)
В первые два года после описанного пика активности трансаминаз уровень АЛТ был в диапазоне 100–260 Ед/л, а затем постепенно стал снижаться. В конечной точке наблюдения активность АЛТ превышала норму не более чем в два раза. Состояние печени оценивалось как удовлетворительное: по данным эластометрии выявлялась только начальная стадия фиброза печени с умеренной жировой дистрофией. За год до окончания противовирусной терапии и уже после завершения курса, который в общей сложности длился почти 4 года, РНК HCV в сыворотке отсутствовала. Показатель количества ДНК HBV был ниже предела обнаружения еще на момент отмены преднизолона и в течение последующих шести лет наблюдения в крови пациента не выявлялся.
Обсуждение
Случаи коинфекции гепатита В (HBV) и гепатита С (HCV) представляют собой серьезную проблему в тех местах, где преобладает HBV. Прежде всего это касается Азиатского региона. Сочетанная инфекция HBV и HCV ускоряет прогрессирование поражения печени [3]. У пациентов, которым проводится трансплантация органов, из‑за необходимости назначения иммуносупрессивной терапии очень сложно контролировать состояние печени. При трансплантации печени пациентам с носительством HBV рекомендован длительный курс ламивудина для предупреждения реактивации инфекции [4]. Для реципиентов трансплантата почки подобная тактика в литературе не описана.
Сочетанное HBV- и HCV-инфицирование пациентов и взаимное влияние этих вирусов друг на друга наблюдалось ранее несколькими авторами [2, 3]. Так, описан случай снижения активности HBV при HCV-коинфекции у пациентов с трансплантированной почкой [3]. В приведенном клиническом случае изначально пациент был с высокой вирусной нагрузкой HBV (ДНК HBV до 4,1×10 6 копий/мл), но количество ДНК HBV стало ниже предела обнаружения на фоне активации HCV. Можно предположить, что подавление репликации HCV с помощью противовирусной терапии могло бы послужить триггером для реактивации HBV. В связи с этим было принято решение назначить пациенту ламивудин, который используется в лечении вируса гепатита В.
Несмотря на то что комбинированная терапия рибавирином и интерфероном — это стандарт лечения хронического HCV, общепринятой тактики, которая была бы эффективна в посттрансплантационном периоде до сих пор не разработано [1]. В описываемом клиническом случае биопсия печени, выполненная до начала противовирусной терапии, выявила наличие фиброза и признаки воспаления и некроза. При отсутствии должного лечения данное состояние могло трансформироваться в цирроз печени или привести к развитию гепатоцеллюлярной карциномы [5].
У пациента был диагностирован HCV генотипа 2а, который успешно лечится [6, 7]. Ранее были описаны случаи ведения HCV-больных с трансплантированной почкой. Режимы терапии были различны — монотерапия рибавирином, комбинированная терапия рибавирином и амантадином [7], интерферон в сочетании с рибавирином [2, 8], а также монотерапия препаратами интерферона [9]. Как оказалось, сочетание рибавирина и амантадина по эффективности не превосходило режим монотерапии рибавирином. Обе схемы лечения сопровождались нормализацией биохимических показателей, однако не снижали вирусную нагрузку у пациентов [2]. Ежедневные внутривенные инъекции препаратов интерферона бета в течение 6 недель приводили к снижению количества маркеров репликации HCV у реципиентов почки при условии хорошего функционального резерва трансплантированного органа [9].
Режим терапии низкими дозами интерферона альфа в комбинации с рибавирином может быть достаточно эффективным уже через полгода после начала лечения, но, к сожалению, плохо переносится большей частью пациентов и нередко приводит к дисфункциям трансплантата [2]. Схема лечения ультранизкими дозами интерферона альфа (1×10 6 ЕД подкожно 3 раза в неделю) и рибавирином (600 мг/сут) в течение 48 недель позволила добиться серонегативных результатов у 5 из 11 пациентов с HCV. Однако на фоне такой терапии у одного пациента развилось острое отторжение трансплантата и у двух пациентов — сепсис [8]. Как показывает опыт, комбинированная терапия интерфероном и рибавирином приводит к элиминации HCV-инфекции, однако дозы препаратов необходимо подбирать индивидуально для предупреждения реакции отторжения трансплантата. С другой стороны, недавно проведенные исследования свидетельствуют о том, что HCV-пациентам с устойчивой вирусной нагрузкой можно назначать длительный курс низких доз препаратов интерферона в качестве поддерживающей терапии, не забывая при этом о дополнительных мерах для поддержания почечной функции [10, 11].
За этот период не произошло реакции отторжения трансплантата, а также не было зафиксировано выраженных эпизодов присоединения каких‑либо инфекций. Важно отметить, что к концу терапии удалось подавить активность HCV, и до настоящего времени реактивации вируса не наблюдалось. Врачами был выбран препарат интерферона альфа, а не пегилированный интерферон, поскольку последний имеет более длительный период полувыведения и, следовательно, высока вероятность спровоцировать отторжение трансплантата. После окончания терапии у пациента уровень активности АЛТ оставался умеренно повышенным. Учитывая, что ДНК HBV и РНК HCV в сыворотке отсутствовали, высокий уровень трансаминаз был скорее связан с жировыми изменениями в печени пациента, а не с вирусом.
Заключение
Терапия низкими дозами препаратов интерферона может быть эффективной в лечении HCV у пациентов с коинфекцией HBV и HCV, перенесших трансплантацию почки.
Публикация клинического случая и сопутствующие иллюстрации осуществлялись с одобрения пациента. Копия подписанного информированного согласия находится у главного редактора журнала Journal of medical case reports.
- Terrault NA, Adey DB: The kidney transplant recipient with hepatitis C infection: pre- and posttransplantation treatment. Clin J Am Soc Nephrol 2007, 2:563–575.
- Sharma RK, Bansal SB, Gupta A, Gulati S, Kumar A, Prasad N: Chronic hepatitis C virus infection in renal transplant: treatment and outcome. Clin Transplant 2006, 20:677–683.
- Yen TH, Huang CC, Lin HH, Huang JY, Tian YC, Yang CW, Wu MS, Fang JT, Yu CC, Chiang YJ, Chu SH: Does hepatitis C virus affect the reactivation of hepatitis B virus following renal transplantation? Nephrol Dial Transplant 2006, 21:1046–1052.
- Freshwater DA, Dudley T, Cane P, Mutimer DJ: Viral persistence after liver transplantation for hepatitis B virus: a cross-sectional study. Transplantation 2008, 85:1105–1111.
- El-Serag HB: Hepatocellular carcinoma and hepatitis C in the United States. Hepatology 2002, 36 (5 Suppl 1):S74‑S83.
- Matthews-Greer JM, Caldito GC, Adley SD, Willis R, Mire AC, Jamison RM, McRae KL, King JW, Chang WL: Comparison of hepatitis C viral loads in patients with or without human immunodeficiency virus. Clin Diagn Lab Immunol 2001, 8:690–694.
- Bräu N: Treatment of chronic hepatitis C in human immunodeficiency virus/hepatitis C virus-coinfected patients in the era of pegylated interferon and ribavirin. Semin Liver Dis 2005, 25:33–51.
- Shu KH, Lan JL, Wu MJ, Cheng CH, Chen CH, Lee WC, Chang HR, Lian JD: Ultralow-dose α-interferon plus ribavirin for the treatment of active hepatitis C in renal transplant recipients. Transplantation 2004, 77:1894–1896.
- Konishi I, Horiike N, Michitaka K, Ochi N, Furukawa S, Minami H, Onji M: Renal transplant recipient with chronic hepatitis C who obtained sustained viral response after interferon-β therapy. Intern Med 2004, 43:931–934.
- Shiffman ML, Hofmann CM, Contos MJ, Luketic VA, Sanyal AJ, Sterling RK, Ferreira-Gonzalez A, Mills AS, Garret C: A randomized, controlled trial of maintenance interferon therapy for patients with chronic hepatitis C virus and persistent viremia. Gastroenterology 1999, 117:1164–1172.
- Alric L, Duffaut M, Selves J, Sandre K, Mularczyck M, Izopet J, Desmorat H, Bureau C, Chaouche N, Dalbergue B, Vinel JP: Maintenance therapy with gradual reduction of the interferon dose over one year improves histological response in patients with chronic hepatitis C with biochemical response: results of a randomized trial. J Hepatol 2001, 35:272–278.
Нашли ошибку? Выделите текст и нажмите Ctrl+Enter.
Читайте также:


