Титр вируса в ветеринарии
Для культивирования вирусов используют культуры клеток, куриные эмбрионы и чувствительных лабораторных животных. Эти же методы используют и для культивирования риккетсий и хламидий — облигатных внутриклеточных бактерий, которые не растут на искусственных питательных средах.
Культуры клеток.Культуры клеток готовят из тканей животных или человека. Культуры подразделяют на первичные (неперевиваемые), полуперевиваемые и перевиваемые.
Приготовление первичной культуры клеток складывается из нескольких последовательных этапов: измельчения ткани, разъединения клеток путем трипсинизации, отмывания полученной однородной суспензии изолированных клеток от трипсина с последующим суспендированием клеток в питательной среде, обеспечивающей их рост, например в среде 199 с добавлением телячьей сыворотки крови.
Перевиваемые культуры в отличие от первичных адаптированы к условиям, обеспечивающим им постоянное существование in vitro, и сохраняются на протяжении нескольких десятков пассажей.
Перевиваемые однослойные культуры клеток приготовляют из злокачественных и нормальных линий клеток, обладающих способностью длительно размножаться in vitro в определенных условиях. К ним относятся злокачественные клетки HeLa, первоначально выделенные из карциномы шейки матки, Нер-3 (из лимфоидной карциномы), а также нормальные клетки амниона человека, почек обезьяны и др.
К полуперевиваемым культурам относятся диплоидные клетки человека. Они представляют собой клеточную систему, сохраняющую в процессе 50 пассажей (до года) диплоидный набор хромосом, типичный для соматических клеток используемой ткани. Диплоидные клетки человека не претерпевают злокачественного перерождения и этим выгодно отличаются от опухолевых.
О размножении (репродукции) вирусов в культуре клеток судят по цитопатическому действию (ЦПД), которое может быть обнаружено микроскопически и характеризуется морфологическими изменениями клеток.
Характер ЦПД вирусов используют как для их обнаружения (индикации), так и для ориентировочной идентификации, т. е. определения их видовой принадлежности.
Один из методов индикации вирусов основан на способности поверхности клеток, в которых они репродуцируются, адсорбировать эритроциты — реакция гемадсорбции. Для ее постановки в культуру клеток, зараженных вирусами, добавляют взвесь эритроцитов и после некоторого времени контакта клетки промывают изотоническим раствором хлорида натрия. На поверхности пораженных вирусами клеток остаются прилипшие эритроциты.
Другой метод — реакция гемагглютинации (РГ). Применяется для обнаружения вирусов в культуральной жидкости культуры клеток либо хорионаллантоисной или амниотической жидкости куриного эмбриона.
Количество вирусных частиц определяют методом титрования по ЦПД в культуре клеток. Для этого клетки культуры заражают десятикратным разведением вируса. После 6—7-дневной инкубации их просматривают на наличие ЦПД. За титр вируса принимают наибольшее разведение, которое вызывает ЦПД в 50 % зараженных культур. Титр вируса выражают количеством цитопатических доз.
Более точным количественным методом учета отдельных вирусных частиц является метод бляшек.
Некоторые вирусы можно обнаружить и идентифицировать по включениям, которые они образуют в ядре или цитоплазме зараженных клеток.
Куриные эмбрионы.Куриные эмбрионы по сравнению с культурами клеток значительно реже бывают контаминированы вирусами и микоплазмами, а также обладают сравнительно высокой жизнеспособностью и устойчивостью к различным воздействиям.
Для получения чистых культур риккетсий, хламидий. и ряда вирусов в диагностических целях, а также для приготовления разнообразных препаратов (вакцины, диагностикумы) используют 8—12-дневные куриные эмбрионы. О размножении упомянутых микроорганизмов судят по морфологическим изменениям, выявляемым после вскрытия эмбриона на его оболочках.
О репродукции некоторых вирусов, например гриппа, оспы, можно судить по реакции гемагглютинации (РГА) с куриными или другими эритроцитами.
К недостаткам данного метода относятся невозможность обнаружения исследуемого микроорганизма без предварительного вскрытия эмбриона, а также наличие в нем большого количества белков и других соединений, затрудняющих последующую очистку риккетсий или вирусов при изготовлении различных препаратов.
Лабораторные животные.Видовая чувствительность животных к определенному вирусу и их возраст определяют репродуктивную способность вирусов. Во многих случаях только новорожденные животные чувствительны к тому или иному вирусу (например, мыши-сосунки — к вирусам Коксаки).
Преимущество данного метода перед другими состоит в возможности выделения тех вирусов, которые плохо репродуцируются в культуре или эмбрионе. К его недостаткам относятся контаминация организма подопытных животных посторонними вирусами и микоплазмами, а также необходимость последующего заражения культуры клеток для получения чистой линии данного вируса, что удлиняет сроки исследования.
Таблица 6 - Виды единиц количества вирусов при определении по 50 %-ному инфекционному действию
| Тест-объекты | Виды инфекционного действия вирусов | Единицы количества вирусов | |
| названия единиц | сокращение обозначения | ||
| Лабораторные | Гибель | 50%-ная летальная | ЛД50 |
| животные | доза | ||
| То же | Клинические симп- | 50%-ная инфекци- | ИД50 |
| томы или патоло- | онная доза | ||
| гоанатомические | |||
| изменения | |||
| Куриные эмбри- | Гибель | 50%-ная эмбриональ- | ЭЛД50 |
| оны | ная летальная | ||
| доза | |||
| То же | Патологоанатоми- | 50%-ная эмбриональ- | ЭИД50 |
| ческие изменения | ная инфекционная | ||
| доза | |||
| Культуры клеток | Цитопатический | 50%-ная цитопати- | ЦПД50 |
| эффект | ческая доза |
В качестве тест-объектов в лабораториях обычно используют белых мышей, куриные эмбрионы и культуры клеток, у которых инфекционное действие вируса может проявляться гибелью, клиническими симптомами, патологоанатомическими изменениями и цитопатическим эффектом. Для каждого вируса подбирают чувствительный к нему тест-объект и форму учета его инфекционного действия, по которой оценивают эффект заражения. В зависимости от вида тест-объекта и формы проявления инфекционного действия ЭД50 принимает один из следующих видов, приведенных в таблице 6.
1 ЛД50—это доза вируса, убивающая 50 % лабораторных животных (обычно белых мышей);
1 ИД50—доза вируса, вызывающая клинические симптомы или патологоанатомические изменения у 50 % зараженных лабораторных животных;
1 ЭЛД — доза вируса, убивающая 50 % куриных эмбрионов;
1 ЭИД50—доза вируса, вызывающая патологоанатомические изменения у 50 % зараженных куриных эмбрионов;
1 ЦПД50— доза вируса, вызывающая цитопатический эффект у 50 % зараженных культур клеток (обычно пробирок с культурами клеток).
Количество ЭД50 (ЛД50, ИД ЭЛД50, ЭИД50 или ЦПД50) вируса, содержащееся в единице объема вируссодержащего материала, и будет выражением титра (Т) вируса в этом материале. Например, Т=10 3,48 ЦПД50/0,1 мл означает, что в каждой 0,1 мл вируссодержащего материала содержится 10 3 ' 48 доз вируса (т. е. более 1000, но менее 10 000, а именно 10 3,48 =3020), каждая из которых способна вызвать цитопатический эффект в 50 % пробирок с культурой клеток.
Названные единицы 50%-ного инфекционного действия вируса (ЛД50, ИД50, ЭЛД50, ЭИД50, ЦПД50) используются в случаях оценки инфекционного действия вируса со статистически оцениваемым эффектом, имеющим место, когда учет инфекционного действия вируса ведется по летальному действию, клиническим симптомам, патологоанатомическим изменениям или цитопатическому действию.
Титрование вирусов по 50 %-ному инфекционному действию — наиболее универсальный прием, пригодный для титрования практически любого вируса, если подобрать чувствительную к нему живую систему (текст-объект). Однако этот метод титрования вирусов довольно трудоемкий, длительный и требует статистических расчетов.
Задача определения титра вируса в единицах 50 %-ного инфекционного действия (ЛД50, ИД50, ЭЛД50, ЭИД50, ЦПД50) сводится к тому, чтобы найти такое разведение испытуемого вируссодержащего материала, в объеме заражающей дозы которого содержалась бы одна ЭД50, а затем рассчитать, сколько таких единиц вируса содержится в таком же объеме вируссодержащего материала, что и будет показателем титра вируса в этом материале.
Чтобы решить эту задачу, сначала из исследуемого вируссодержащего материала готовят ряд последовательных 10-кратных разведений. 10-кратные разведения берут по двум причинам:
во-первых, как видно из графика зависимости инфекционного эффекта от дозы вируса (рис. 36), кривая этой зависимости вблизи точки, соответствующей ЭД50, на значительном отрезке приближается к прямой.
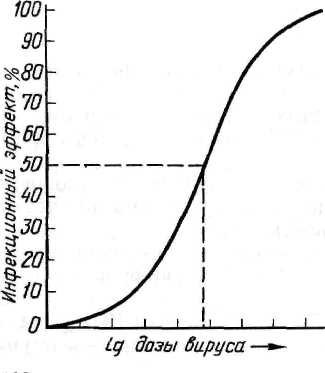
Рисунок 36 - График зависимости инфекционного эффекта от дозы вируса
Это означает, что в определенных пределах, центр которых в точке ЭД50, между логарифмом дозы (разведения) вируса и инфекционным эффектом существует прямолинейная зависимость, т. е. величина инфекционного эффекта пропорциональна логарифму дозы вируса (или его разведения), в области малых и особенно больших доз эта зависимость нарушается;
во-вторых, при 10-кратном разведении облегчаются последующие расчеты.
Одинаковыми объемами каждого из 10-кратных разведений исследуемого вируссодержащего материала заражают равные группы чувствительных к данному вирусу живых тест-объектов (мышей, куриных эмбрионов или культур клеток). При этом в каждой группе должно быть не менее 4 – 6 тест-объектов, так как при меньшем количестве статистически рассчитываемая величина титра вируса будет иметь слишком большую погрешность (статистическая величина тем точнее, чем на большем количестве исходных данных она основана).
После заражения учитывают результат действия вируса (гибель, клинические симптомы, патологоанатомические изменения или ЦПЭ) на зараженные объекты и определяют, в каком разведении вирус проявил свое действие на 50 % чувствительных объектов. Разведение, дающее 50 %-ный эффект, рассчитывают методом прямолинейной интерполяции. Когда такое разведение нашли, то считают, что в заражающем объеме вируса, разведенного в найденное (соответствующее 50 %-ному эффекту) число раз, содержится 1 ЭД50. В таком же объеме исходного (неразведенного) вируссодержащего материала таких доз (ЭД50) содержится больше во столько раз, во сколько был разведен материал, давший 1 ЭД50. Затем пересчитывают, сколько таких единиц 50 %-ного инфекционного действия вируса содержится в единице объема (мл) вируссодержащего материала, что и будет выражением титра вируса в данном материале.
Задания
1. Рассчитать титр вируса в единицах 50%-ного инфекционного действия по предложенным фактическим данным.
2. Определить титр вируса ньюкаслской болезни в аллантоисной жидкости в единицах гемагглютинирующего действия.
Самостоятельная работа студентов
а) подготовка панелей, пипеток и материала; б) получение последовательных 2-кратных разведений вируса по 0,5 мл или по 0,2 мл; в) добавление 1 %-ной суспензии эритроцитов; г) учет результатов и их интерпретация. Во время экспозиции переписывание в тетрадь (с доски или таблицы) схемы титрования антител к вирусу ньюкаслской болезни в РТГА.
Подведение итогов занятия
Задание к следующему занятию
1. Что такое титр вируса?
2. Каковы единицы измерения количества вируса?
3. Каков принцип определения титра вируса в БОЕ и ООЕ?
4. В чем принцип определения титра вируса в единицах 50 %-ного инфекционного действия?
5. Какова методика расчета титра вируса в единицах 50 %-ного инфекционного действия?
6. В чем принцип определения титра вируса в ГАЕ?
7. Каковы достоинства и недостатки разных методов титрования вирусов?
БИБЛИОГРАФИЧЕСКИЙ СПИСОК
1. Ветеринарная вирусология : учебник для вузов / Р. В. Белоусова, Э. А. Преображенская, И. В. Третьякова ; под ред. Р. В. Белоусовой. - М. : КолосС , 2007. - 424 с.
2. Ветеринарная вирусология : [учебник для вузов] / Р. Г. Госманов, Н. М. Колычев. - 2-е изд., перераб. и доп. - М. : КолосС, 2006. - 304 с.,
3. Ветеринарная вирусология / В. А Сергеев [и др.].– М., 2002. – 217 с.
4. В.Н. Сюрин, Р.В. Белоусова, Н.В. Фомина Ветеринарная вирусология.-Изд.2-е. – М.: Агропромиздат, 1991
5. Практикум по ветеринарной вирусологии : учеб. пособие для вузов / Н. И. Троценко, Р. В. Белоусова, Э. А. Преображенская . - 2-е изд., перераб. и доп. - М. : Колос, 2006. - 273 с.
7. Журнал Аграрная наука Евро-Северо-Востока. – Новосибирск, С-В НМЦ Россельхозакадемии, 2005-2015.
11. Журнал Вестник Воронежского государственного аграрного университета. – Воронеж, Изд-во Воронежского ГАУ. 2009-2016.
15. Журнал Вестник ОрелГАУ. – Изд-во ФГОУ ВПО Орёл ГАУ. 2007-2016.
16. Журнал Вестник Саратовского госагроуниверситета им. Н.И. Вавилова. – Изд-во ФГОУ ВПО СГАУ им. Н.И. Вавилова. 2002-2016.
18. Журнал Ветеринарная практика. – СПб. 2008-2016.
19. Журнал Вопросы нормативно-правового регулирования в ветеринарии. – СПб. Изд-во . – СПбГАВМ. 2008-2016.
Содержание
Тема 1. Правила работы с вируссодержащими материалами. Устройство вирусологической лаборатории……………………..
1.1 Техника безопасности и правила работы с вируссодержащим материалом………………………………………………………….
1.2 Требования к рабочим помещениям и обеспечение условий работы………………………………………………………………..
1.3 Хранение вирусов и других материалов, учет и этикетировка их в лаборатории……………………………………………………….
1.4 Основные методы консервации вирусов…………………………
Тема 2. Получение, транспортировка и подготовка патологического материала для вирусологических исследований………………..
1.1 Получение и обработка патологического материала…………..
1.2 Получение патологоанатомического материала………………..
1.3 Получение проб для гистологического исследования………….
1.4 Транспортировка и хранение проб……………………………….
Тема 3. Индикация вирусов в патологическом материале по обнаружению вирионов и вирусных телец-включений……….
3.1 Методы прямого обнаружения вируса в исследуемом материале………………………………………………………….
3.2 Методы окраски вирионов……………………………………….
3.3 Устройство и принципы работы электронного и люминесцентного микроскопов…………………………………..
3.4 Методы подготовки препаратов…………………………………..
Тема 4. Использование лабораторных животных в диагностических исследованиях. Цели использования животных в вирусологии..
4.1 Виды лабораторных животных……………………………………
4.2 Цели использования лабораторных животных………………….
4.3 Требования к лабораторным животным…………………………
4.4 Содержание лабораторных животных……………………………
4.5 Техника безопасности при работе с лабораторными животными………………………………………………………….
4.6 Метка лабораторных животных…………………………………..
Тема 5. Использование лабораторных животных в диагностических исследованиях. Биопроба………………………………………….
5.1 Методы экспериментального заражения лабораторных животных………………………………………………………….
5.2 Способы фиксации и техника заражения лабораторных животных………………………………………………………….
5.3 Содержание лабораторных животных после заражения……….
Тема 6. Использование лабораторных животных в диагностических исследованиях. Вскрытие лабораторных животных……………
6.1 Признаки размножения вируса в организме лабораторного животного………………………………………………………….
6.2 Взятие материала от лабораторных животных…………………..
6.3 Вскрытие лабораторных животных………………………………
Тема 7. Использование в вирусологии куриных эмбрионов. Культивирование вирусов на куриных эмбрионах………………
7.1 Достоинства и недостатки куриных эмбрионов как биологических объектах…………………………………………..
7.2 Цели использования куриных эмбрионов………………………..
7.3 Требования к куриным эмбрионам……………………………….
7.4 Строение куриного эмбриона……………………………………..
7.5 Подготовка куриных эмбрионов к заражению…………………..
Тема 8. Использование в вирусологии куриных эмбрионов. Заражение куриных эмбрионов………………………………………………..
8.1 Методы экспериментального заражения куриных эмбрионов.
8.1.1 Заражение в аллантоисную полость……………………….
8.1.2 Заражение на хорион-аллантоисную оболочку…………….
8.1.3 Заражение в желточный мешок…………………………….
8.1.4 Заражение в амниотическую полость………………………
8.1.5 Заражение в кровеносные сосуды ХАО……………………
8.1.6 Заражение в тело зародыша……………………………….
8.2 Накопление вируса в курином эмбрионе………………………..
8.3 Деэмбринированные яйца…………………………………………
Тема 9. Использование в вирусологии куриных эмбрионов. Вскрытие куриного эмбриона и получение вируссодержащего материала. Индикация вирусов……………………………………………….
9.1 Признаки размножения вируса в куриных эмбрионах………….
9.2 Определение гемагглютинирующих свойств вирусов…………..
9.3 Вскрытие куриных эмбрионов…………………………………….
Тема 10. Использование в вирусологии культур клеток. Типы культур клеток……………………………………………………………….
10.1 Типы культур клеток………………………………………………
10.2 Хранение культур клеток………………………………………….
10.3 Контаминация культур клеток…………………………………….
Тема 11. Использование в вирусологии культур клеток. Культивирование вирусов в культуре клеток……………………
11.2 Номенклатура культур тканей и клеток………………………….
Тема 12. Использование в вирусологии культур клеток. Заражение культур клеток. Индикация вируса……………………………….
12.1 Подбор культур клеток…………………………………………….
12.3 Культивирование вируса………………………………………….
12.4 Индикация (обнаружение) вируса в культуре клеток………….
Тема 13. Титрование антител к вирусам в реакции торможения (задержки) гемагглютинации (РТГА, РЗГА)……………………
13.1 Принципы серологических реакций……………………………..
Тема 14. Использование в вирусологии реакции непрямой гемагглютинации…………………………………………………
14.1 Методика постановки РНГА…………………………………….
Тема 15. Использование в вирусологии реакции диффузной преципитации в агаровом геле………………………………….
15.1 Принцип реакции преципитации……………………………….
15.2 Основные задачи РДП……………………………………………
Тема16. Титрование вирусов………………………………………………
ВИРУСОЛОГИЯ
В авторской редакции
Подписано в печать . Формат 60х84 1/16 .
Усл. печ. л.7,44. Тираж 100. Заказ .
400002, Волгоград, пр. Университетский, 26.

Общие условия выбора системы дренажа: Система дренажа выбирается в зависимости от характера защищаемого.

Поперечные профили набережных и береговой полосы: На городских территориях берегоукрепление проектируют с учетом технических и экономических требований, но особое значение придают эстетическим.
Коллектив авторов: Березина Л. К., Косякова Н. П., Веткова Л. Г., Степанова Т. Н., Савойская С. Л., Зубашев И. К., Клицунова Н. В., Ольшанская А. А., Рахманина М. М., Элизбарашвили Э. И., Мезенцева М. В., Куриц Т., Пронин А. В., Санин А. В., Наровлянский А. Н.; ГУ НИИЭМ им. Н. Ф. Гамалеи РАМН, НИИ вирусологии им. Д. И. Ивановского РАМН, ВГНКИ ветеринарных препаратов, г. Москва, РФ; Окриджская национальная лаборатория, Окридж, США.

Вирусы группы герпеса вызывают у домашних животных целый ряд заболеваний — болезнь Ауески, респираторные и глазные заболевания, герпесвирусный энцефалит, инфекционный ринотрахеит кошек и др. Возбудители относятся к семейству герпесвирусов — эти вирусы характеризуются наличием липопротеиновой оболочки и содержат 2-цепочечную ДНК. На основании фенотипических и генетических данных семейство герпесвирусов подразделяют на 3 подсемейства: α-, β-, и γ-герпесвирусов. Ранее, при лечении кошек, больных инфекционным ринотрахеитом (возбудитель — FHV-1, герпесвирус кошек типа 1, относящийся к подсемейству α-герпесвирусов), была установлена высокая терапевтическая эффективность таких противовирусных средств как фоспренил и максидин (1). При лечении других вирусных инфекций фоспренилом было показано, что в ряде случаев противовирусный эффект препарата может быть результатом активации некоторых звеньев врожденного иммунитета (синтез интерферона и ряда других цитокинов, активация макрофагов и естественных киллерных клеток), обеспечивающих повышение неспецифической резистентности организма (2). В настоящей работе изучали противовирусную эффективность аналога фоспренила — МПФ, фосфорилированного полипренола, выделенного из древесной листвы и отличающегося от фоспренила не только происхождением (полипренолы для фоспренила выделяют из хвои), но и длиной полипренольной цепи. Оценку эффективности МПФ проводили при экспериментальной герпетической инфекции у мышей, при экспериментальном генитальном герпесе у морских свинок, при летальной инфекции кроликов, вызванных вирусом болезни Ауески, а также при инфекционном ринотрахеите кошек.
1. Экспериментальная герпетическая инфекция у мышей
Модель экспериментальной герпетической инфекции у мышей воспроизводили на белых беспородных мышах массой 10 – 12 г . Для заражения использовали вирус простого герпеса 1 типа (ВПГ-1) штамм Л2 (коллекция вирусов НИИ вирусологии им. Д. И. Ивановского) в титре 7 lg ЛД50/0,03 мл. Мышей заражали внутрибрюшинно (в/б) вируссодержащей 10%-ной суспензией мозга мышей (доза — 100 ЛД50). МПФ вводили в дозе 400 мкг/мышь/0,2 мл в/б по 2-м схемам: профилактической (за 24 часа до заражения ВПГ-1) и лечебно-профилактической (одновременно с ВПГ-1). В качестве референс-препарата использовали коммерческий препарат ридостин, который вводили в дозе 100 мкг/мышь за 24 часа до заражения ВПГ-1. В каждой группе было по 10 мышей, срок наблюдения составил 15 дней. Противовирусную активность определяли по увеличению процента выживаемости животных, увеличению средней продолжительности жизни (СПЖ). Наибольший эффект был обнаружен у МПФ при лечебно-профилактической схеме введения (0 час) — выживаемость составила 90%, защита — 50%, а СПЖ — 14,1±0,85. Аналогичным эффектом обладал и эталонный противовирусный препарат ридостин (защита составила 50%, а СПЖ — 14,3±0,66. В контроле выживаемость была 40%, а СПЖ — 10,0±1,31.
Для доказательства противовирусной активности препаратов были проведены опыты биологического титрования вируса из мозга мышей на клетках VERO. Титр ВПГ-1 в ткани мозга опытных и контрольных мышей, взятой на 6-й день после заражения, определяли в результате обработки культуры клеток 10-кратными разведениями суспензии мозга мышей. Наблюдение и учет ЦПД осуществляли на 3 – 4 день после контакта клеток с инфекционным материалом. Титр ВПГ-1, полученного из мозга контрольных мышей составил 5 lg ТЦД50/мл. Титры ВПГ-1 из мозга мышей, которым вводили МПФ, составляли 2,0 (-24 ч) и 1,5 (0 ч) lg ТЦД50/мл, соответственно. Таким образом, МПФ существенно снижал титр вируса (на 3,5 – 2,0 lg), что было сопоставимо с противовирусным действием ридостина, который снижал титр вируса на 3,5 (-24 ч) lg ТЦД50/мл.
2. Генитальный герпес морских свинок
При воспроизведении модели экспериментального генитального герпеса у самцов морских свинок использовали ВПГ 2 типа (штамм ЕС, титр 6 lg ТЦД50/мл). Степень выраженности инфекционного процесса оценивали по 4-балльной шкале, учитывая 4 основных признака: гиперемию, отечность, специфические элементы (везикулы, пустулы, изъязвления), орхит. МПФ вводили в/б в дозе 4мг, 4-кратно: за 24 часа до инфицирования, в момент заражения, через 24 и 48 часов после инфицирования. Показано, что МПФ оказывал выраженный статистически достоверный (р
3. Болезнь Ауески кроликов
4. Инфекционный ринотрахеит кошек
Исследование влияния МПФ на течение инфекции, вызванной вирусом ринотрахеита (ВРТ), проводили на 9 беспородных разнополых котятах в возрасте от 1,5 до 3,5 месяцев. До заражения смывы носоглоточные и конъюнктивы глаз, а также кал исследовали на наличие герпес-, парво- и калицивирусов методом ПЦР. После заражения ВРТ кал котят также исследовали методом электронной микроскопии. Сыворотку крови котят, полученную до заражения, исследовали на наличие вируснейтрализующих антител к ВРТ в реакции нейтрализации на культуре клеток.
В опытную группу были взяты 5 котят, а в контрольную — 4 котенка. Заражение каждого котенка проводили внутримышечно (в/м) по 1,0 мл, перорально (п/о) и интраназально по 0,5мл вируса (активность вируса равна 6,0 ТЦД50/мл). При обнаружении клинических признаков заболевания проводили лечение 0,4% раствором МПФ перорально в дозе 0,3 – 0,7мл. Наблюдение за состоянием котят вели с момента заражения до выздоровления в опыте в течение 3 – 5 недель.
Обследование котят до заражения, проведенное с помощью ПЦР, показало, что у двоих котят был обнаружен калицивирус, а у одного из них также и ВРТ. Титр нейтрализующих антител к вирусу герпеса у всех обследованных котят варьировал от 4,0 до 9,0 lоg.
По результатам электронной микроскопии были обнаружены единичные вирионы герпеса и калицивирусов у двух котят, а единичные вирионы калицивируса и парвовируса — у четырех.
Таким образом, заражение животных ВРТ в некоторых случаях производилось на фоне смешанной инфекции.

Лечение с помощью МПФ начинали с момента появления клинических признаков заболевания (депрессия, тусклая шерсть, обезвоживание, понос, рвота, отказ от еды, язвы в ротовой полости). МПФ вводили п/о в дозе 0,3 мл первые 2 дня, а затем по 0,5мл, а также орошали слизистую ротовой полости дважды в день. В качестве вспомогательной терапии использовали кламоксил, гамавит и пиобактериофаг, а для снятия обезвоживания — физиологический раствор и глюкозу 5%.
По предварительным результатам, клиническое выздоровление наступило у двух котят на 6 – 8-е сутки (исчезновение язв, снижение обезвоживания, повышение активности, улучшение состояния шерсти), а у трех котят лечение МПФ в дозе 0,7 мл дважды в день в сочетании с орошением ротовой полости привело к выздоровлению на 3 – 4-е сутки. Исчезновение признаков заболевания в контрольной группе животных наступало на 22 – 30-е сутки.
Таким образом, МПФ — препарат, во многом аналогичный фоспренилу, обладает высокой эффективностью при лечении инфекций, вызванных вирусами группы герпеса у различных животных. Возможные механизмы терапевтической активности МПФ служат предметом дальнейшего изучения.
Библиография
2. Pronin A. V., Grigorieva E. A., Sanin A. V., Narovlyansky A. N., Ozherelkov S. V., Deyeva A. V., Danilov L. L., Maltsev S. D., Najid A. Polyprenols as possible factors that determine the instructive role of innate immunity in the acquired immune response. Russian J. Immunol. 2002, v. 7, № 2, p. 135 – 142.
Summary
NOVEL APPROACH TO TREATMENT OF ANIMAL HERPES VIRUS INFECTIONS
Berezina L. K., Kosyakova N. P., Vetkova L. G., Stepanova T. N., Savoyskaya S. L., Zubashev I. K., Klitsunova N. V., Olshanskaya A. A., Rakhmanina M. M., Elizbarashvilli E. I., Mezentseva M. V., Kuritz T., Pronin A. V., Sanin A. V., Narovliansky A. N. N. F.Gamaleya Research Inst. for Epidemiology and Microbiology, Moscow, D. I. Ivanovsky Research Inst. for Virology, Moscow, All-Russian State Research Institute for Control, Standardization and Certification of Veterinary Preparations, Moscow, National Oak Ridge Lab., Oak Ridge, USA.
A novel approach has been attempted to treat herpes virus infections in animals using MPP, a new medicine derived from plant polyprenols. MPP was shown to possess a very high therapeutic efficiency during treatment of some herpes virus infections: experimental mouse herpes virus infection, guinea pig genital herpes infection, Aueski disease of rabbits and feline viral rhinotracheitis.
По материалам Ветеринарного Конгресса, 2005 г .
Ознакомление с методикой титрования вирусов.
Оборудование и материалы
Задачи на определение титра вируса в ЭД50 по фактическим данным, выписанным на карточки (на каждого студента по одной карточке, всего не менее 10 вариантов задач); аллантоисная жидкость куриных эмбрионов, зараженных вирусом ньюкаслской болезни; 1- процентная суспензия отмытых эритроцитов кур; физиологический раствор (изотонический раствор NaCl); плексигласовые панели с лунками; градуированные пипетки на 1 мл; резиновые груши; сосуды с дезраствором; карандаши для записи по стеклу, калькуляторы, логарифмические таблицы, мультимедийное оборудование, презентации MS Office Power Point по теме занятия.
Методика проведения занятия и методические указания по теме.
В лабораторных работах с вирусами, биофабричном производстве и в ветеринарной практике постоянно возникает необходимость определения количества вирусов в том или ином материале. Без такого определения невозможны экспериментальное заражение вирусами живых лабораторных систем, производство живых и инактивированных противовирусных вакцин и диагностических препаратов, оценка активности живых противовирусных вакцин, получение иммунных сывороток и многие другие работы.
Количество вируса в каком-либо материале определяют по титру вируса в этом материале. Под титром вируса понимают выражение его концентрации в материале.
Титр вируса - это количество вируса, содержащееся в единице объема материала
Поскольку количество вируса невозможно выразить в обычно применяемых (объем, масса и т. и.) единицах, прибегают к измерению в единицах действия или единицах активности. Вирусы обладают инфекционным и гемагглютинирующим действием. Отсюда и единицы количества вирусов инфекционные и гемагглютинирующие.
Размерность этих единиц зивисит от соотношения полноценных и неполноценных вирионов в используемой суспензии, объекта, способа титрования и других факторов. В практике нашли применение три типа единиц количества вируса: 1-й - инфекционные единицы локальных повреждений, вызываемых вирусами и оцениваемых по единичному эффекту; 2-й - инфекционные единицы 50-процентного действия вирусов на чувствительные живые объекты, оцениваемые статистически; 3-й - гемагглютинирующие единицы.
Из локальных повреждений, вызываемых вирусами, наиболее известны бляшки в зараженных культурах клеток (островки мертвых клеток в слое живых) и оспины (некротические узелки) на ХАО куриных эмбрионов, зараженных оспенными и некоторыми другими вирусами. В случаях такого проявления инфекционной активности вирусов количество вируса может быть измерено в бляшкообразующих единицах (БОЕ) или оспообразующих единицах (ООЕ). Одна БОЕ равна дозе вируса, способной вызвать образование одной бляшки, а одна ООЕ - одной оспины.
Наиболее универсален метод определения титра вируса в единицах 50-процентного инфекционного действия. По этому методу за единицу количества вируса принимается такая его доза, которая способна вызывать инфекционный эффект у 50 % зараженных тест-объектов. Она обозначается как ЭД50 - эффективная 50-процентная доза.
Число таких доз вируса в единице объема материала и будет выражать титр вируса в этом материале.
Таблица 6 - Виды единиц количества вирусов при определении _ по 50-процентному инфекционному действию_
Виды инфекционного действия вирусов
Единицы количества вирусов
50-процентная летальная доза
Клинические симптомы или патологоанатомические изменения
50-процентная эмбриональная летальная доза
В качестве тест-объектов в лабораториях обычно используют белых мышей, куриные эмбрионы и культуры клеток, у которых инфекционное действие вируса может проявляться гибелью, клиническими симптомами, патологоанатомическими изменениями и цитопа- тическим эффектом. Для каждого вируса подбирают чувствительный к нему тест-объект и форму учета его инфекционного действия, по которой оценивают эффект заражения. В зависимости от вида тест- объекта и формы проявления инфекционного действия ЭД50 принимает один из следующих видов, приведенных в таблице 6.
- 1 ЛД50 - это доза вируса, убивающая 50 % лабораторных животных (обычно белых мышей);
- 1 ИД50 — доза вируса, вызывающая клинические симптомы или патологоанатомические изменения у 50 % зараженных лабораторных животных;
- 1 ЭЛД — доза вируса, убивающая 50 % куриных эмбрионов;
- 1 ЭИД5о — доза вируса, вызывающая патологоанатомические изменения у 50 % зараженных куриных эмбрионов;
- 1 ЦПД50 — доза вируса, вызывающая цитопатический эффект у 50 % зараженных культур клеток (обычно пробирок с культурами клеток).
Количество ЭД50 (ЛД50, ИД ЭЛД50, ЭИД50 или ЦПД50) вируса, содержащееся в единице объема вируссодержащего материала, и будет выражением титра (Т) вируса в этом материале. Например, Т=10 3,4 ЦПД5о/0,1 мл означает, что в каждой 0,1 мл вируссодержащего материала содержится 10 3 ’ 48 доз вируса (т. е. более 1000, но менее 10 000, а именно 10 3 ’ 48 = 3020), каждая из которых способна вызвать цитопатический эффект в 50 % пробирок с культурой клеток.
Названные единицы 50-процентного инфекционного действия вируса (ЛД50, ИД50, ЭЛД50, ЭИД50, ЦПД50) используются в случаях оценки инфекционного действия вируса со статистически оцениваемым эффектом, имеющим место, когда учет инфекционного действия вируса ведется по летальному действию, клиническим симптомам, патологоанатомическим изменениям или цитопатическому действию.
Титрование вирусов по 50-процентному инфекционному действию - наиболее универсальный прием, пригодный для титрования практически любого вируса, если подобрать чувствительную к нему живую систему (текст-объект). Однако этот метод титрования вирусов довольно трудоемкий, длительный и требует статистических расчетов.
Задача определения титра вируса в единицах 50-процентного инфекционного действия (ЛД50, ИД50, ЭЛД50, ЭИД50, ЦПД50) сводится к тому, чтобы найти такое разведение испытуемого вируссодержащего материала, в объеме заражающей дозы которого содержалась бы одна ЭД50, а затем рассчитать, сколько таких единиц вируса содержится в таком же объеме вируссодержащего материала, что и будет показателем титра вируса в этом материале.
Чтобы решить эту задачу, сначала из исследуемого вируссодержащего материала готовят ряд последовательных 10-кратных разведений. 10-кратные разведения берут по двум причинам:
во-первых, как видно из графика зависимости инфекционного эффекта от дозы вируса (рис. 36), кривая этой зависимости вблизи точки, соответствующей ЭД5о, на значительном отрезке приближается к прямой.

Рисунок 36 - График зависимости инфекционного эффекта от дозы вируса
Это означает, что в определенных пределах, центр которых в точке ЭД50, между логарифмом дозы (разведения) вируса и инфекционным эффектом существует прямолинейная зависимость, т. е. величина инфекционного эффекта пропорциональна логарифму дозы вируса (или его разведения), в области малых и особенно больших доз эта зависимость нарушается;
во-вторых, при 10-кратном разведении облегчаются последующие расчеты.
Одинаковыми объемами каждого из 10-кратных разведений исследуемого вируссодержащего материала заражают равные группы чувствительных к данному вирусу живых тест-объектов (мышей, куриных эмбрионов или культур клеток). При этом в каждой группе должно быть не менее 4-6 тест-объектов, так как при меньшем количестве статистически рассчитываемая величина титра вируса будет иметь слишком большую погрешность (статистическая величина тем точнее, чем на большем количестве исходных данных она основана).
После заражения учитывают результат действия вируса (гибель, клинические симптомы, патологоанатомические изменения или ЦПЭ) на зараженные объекты и определяют, в каком разведении вирус проявил свое действие на 50 % чувствительных объектов. Разведение, дающее 50-процентный эффект, рассчитывают методом прямолинейной интерполяции. Когда такое разведение нашли, то считают, что в заражающем объеме вируса, разведенного в найденное (соответствующее 50-процентному эффекту) число раз, содержится 1 ЭД50. В таком же объеме исходного (неразведенного) вируссодержащего материала таких доз (ЭД5о) содержится больше во столько раз, во сколько был разведен материал, давший 1 ЭД50. Затем пересчитывают, сколько таких единиц 50-процентного инфекционного действия вируса содержится в единице объема (мл) вируссодержащего материала, что и будет выражением титра вируса в данном материале.
- 1 Рассчитать титр вируса в единицах 50-процентного инфекционного действия по предложенным фактическим данным.
- 20пределить титр вируса ньюкаслской болезни в аллантоисной жидкости в единицах гемагглютинирующего действия.
Самостоятельная работа студентов
- а) подготовка панелей, пипеток и материала;
- б) получение последовательных 2-кратных разведений вируса по 0,5 мл или по 0,2 мл;
- в) добавление 1-процентной суспензии эритроцитов;
- г) учет результатов и их интерпретация. Во время экспозиции переписывание в тетрадь (с доски или таблицы) схемы титрования антител к вирусу ньюкаслской болезни в РТГА.
Подведение итогов занятия Задание к следующему занятию Контрольные вопросы
- 1 Что такое титр вируса?
- 2 Каковы единицы измерения количества вируса?
- 3 Каков принцип определения титра вируса в БОЕ и ООЕ?
- 4 В чем принцип определения титра вируса в единицах 50- процентного инфекционного действия?
- 5 Какова методика расчета титра вируса в единицах 50- процентного инфекционного действия?
- 6 В чем принцип определения титра вируса в ГАЕ?
- 7 Каковы достоинства и недостатки разных методов титрования вирусов?
Читайте также:


