Т киллеры и вирус
Новые знания, полученные в ходе работы группы ученых из Института Рагона (США), могут послужить основой для создания эффективной вакцины против СПИДа. Специалисты вычислили ген, ответственный за формирование в организме иммунных Т-клеток, которые "распознают" большее число фрагментов белка ВИЧ. Это позволяет уничтожать вирус гораздо эффективнее.
Для человека, зараженного ВИЧ, при отсутствии медикаментозного лечения развитие СПИДа, как правило, — лишь вопрос времени. Тем не менее, у небольшого числа людей, подвергшихся воздействию вируса иммунодефицита, СПИД развивается очень медленно или не развивается вообще. Почему?
Еще в конце 1990-х годов исследования показали, что очень высокий процент людей, имеющих естественный иммунитет против ВИЧ (а их число составляет примерно 1 на 200 зараженных), является носителями гена HLA B57.
В настоящее время группа ученых из Института Рагона в Чарльстоне (США) продолжила исследования в этом направлении. В результате была выявлена способность данного гена активизировать защитные силы организма и противостоять ВИЧ-инфекции.
Тем временем исследовательская группа под руководством профессора Массачусетского технологического института (MIT) Арупа Чакраборти и профессора Гарвардского университета Брюса Уолкера продвинулась в своей работе еще дальше. Внимание ученых было сосредоточено на одном из видов иммунных клеток, а именно — Т-киллерах, отвечающих за уничтожение клеток организма, пораженных заболеванием.
Т-киллеры распознают фрагменты чужеродных белков, расположенные на поверхности клетки, и в случае, если этот фрагмент определен как "вражеский", уничтожают клетку и продуцируют гамма-интерферон, который ограничивает проникновение вируса в соседние клетки. Каждая Т-клетка "настроена" только на один специфический антиген и убивает только клетки с этим антигеном.
Однако новое исследование показало, что организм носителей гена HLA B57 вырабатывает большее число Т-киллеров, которые к тому же являются кросс-реактивными, то есть могут распознавать более чем один "вражеский" белок и благодаря этому уничтожать и мутировавшие вирусы иммунодефицита.
Профессор Чакраборти пояснил: "У людей, лишенных гена HLA B57, кросс-реактивные Т-киллеры также присутствуют, но в гораздо меньших количествах. Результаты исследования позволяют надеяться на создание вакцины, способной увеличить их число".
Чакраборти и его коллеги ранее разработали расчетную модель развития Т-киллеров в вилочковой железе (тимусе), где они проходят отбор, направленный на отсеивание как слишком "слабых" клеток, плохо распознающих угрозу, так и слишком "агрессивных", набрасывающихся на здоровые клетки организма.
Этот эффект позволяет контролировать ВИЧ-инфекцию (а также любой другой активно развивающийся вирус), но, с другой стороны, делает носителей гена более восприимчивыми к аутоиммунным заболеваниям (ревматизм, системная красная волчанка, подагра).
В тимусе (лимфоидном органе человека, в котором происходит созревание, дифференцировка и иммунологическое "обучение" T-клеток) Т-киллеры взаимодействуют с собственными пептидами человеческого организма и, в зависимости от реакции на эти пептиды, либо успешно проходят "проверку на агрессивность", либо погибают.
Тип и количество собственных пептидов, с которыми сталкиваются Т-киллеры, определяется генами HLA. Ученые показали, что HLA B57, наряду с HLA B27 (носители которого также демонстрируют наличие иммунитета против ВИЧ), обеспечивает минимальное количество собственных пептидов, в результате чего Т-киллерам проще выдержать "испытание".
В итоге тимус покидают Т-клетки, обладающие более высокой кросс-реактивностью и способностью к уничтожению большего числа форм ВИЧ, но в то же время более опасные для здоровых клеток организма. Эта модель также объясняет причину повышенного риска возникновения аутоиммунных заболеваний у носителей гена HLA B57.
Новые знания, полученные в ходе исследования, могут помочь ученым в разработке вакцин, которые вызывают такую же реакцию на ВИЧ, какую носители гена HLA B57 вырабатывают самостоятельно.
Читайте также в "Правде.Ру"

Т-клетки это фактически приобретенный иммунитет, способный защитить от цитотоксического повреждающего воздействия на организм. Чужеродные клетки-агрессоры, попадая в организм вносят “хаос”, который внешне проявляется в симптомах заболеваний.
Клетки-агрессоры повреждают по ходу своей деятельности в организме все, что могут, действуя в своих интересах. А задача иммунной системы найти и уничтожить все чуждые элементы.
Специфическая защита организма от биологической агрессии (чужеродных молекул, клеток, токсинов, бактерий, вирусов, грибов и т.д.) осуществляется при помощи двух механизмов:
- продуцирования специфических антител в ответ на чужеродные антигены (потенциально опасных для организма веществ);
- выработки клеточных факторов приобретённого иммунитета (Т-клетки).
Как осуществляются иммунные реакции
Процесс запоминания (презентация) происходит благодаря антиген-распознающим рецепторам клеток и работе антиген представляющих молекул (МНС молекул- комплексов гистосовместимости).
Что такое Т-клетки иммунной системы, и какие функции они выполняют
Функционирование иммунной системы обуславливается работой лимфоцитов . Это клетки иммунной системы, являющиеся 
разновидностью лейкоцитов и способствующие формированию приобретённого иммунитета. Среди них выделяют:
Однако, помимо регуляции иммунного ответа, Т-лимфоциты способны выполнять эффекторную функцию, разрушая опухолевые, мутировавшие и чужеродные клетки, участвовать в формировании иммунологической памяти, распознавать антигены и индуцировать иммунные реакции.
Разнообразие функций Т-лимфоцитов обусловлено наличием в них субпопуляций, представленных Т-хелперами, Т-киллерами и Т-супрессорами.
Субпопуляция клеток, их стадия дифференцирования (развития), степень зрелости и т.д. определяется при помощи специальных кластеров дифференцировки, обозначаемых как СD. Наиболее значимыми являются СD3, СD4 и СD8:
- СD3 находится на всех зрелых T-лимфоцитах, он способствует передаче сигнала от рецептора к цитоплазме. Это важный маркер функционирования лимфоцитов.
- СD8 – это маркер цитотоксических T-клеток.
- СD4 является маркером T-хелперов и рецептором к ВИЧ (вирус иммунодефицита человека)
Т-хелперы
В зависимости от продуцируемого цитокина, их разделяют на:
- T-хелперные клетки 1-го класса (продуцируют интерлейкин-2 и гамма-интерферон, обеспечивая гуморальный иммунный ответ на вирусы, бактерии, опухоли и трансплантанты).
- T-хелперные клетки 2-го класса (секретируют интерлейкины-4,-5,-10,-13 и отвечают за образование IgЕ, а также иммунного ответа, направленного на внеклеточные бактерии).
Т-хелперы 1-го и 2-го типа всегда взаимодействуют антагонистически, то есть повышенная активность первого типа угнетает функцию второго типа и наоборот.
Работа хелперов обеспечивает взаимодействие между всеми клетками иммунитета, определяя какой тип иммунного ответа будет преобладать (клеточный либо гуморальный).
Т-киллеры

Это так называемые T-эффекторы (цитотоксические клетки) или клетки убийцы. Такое название обусловлено их способностью уничтожать клетки-мишени. Осуществляя лизирование (ли́зис (от греч. λύσις — разделение) — растворение клеток и их систем) мишеней, переносящих чужеродный антиген или мутировавший аутоантиген (трансплантанты, опухолевые клетки), они обеспечивают реакции противоопухолевой защиты, трансплантационного и противовирусного иммунитета, а также аутоиммунные реакции.
Т-киллеры при помощи собственных МНС-молекул распознают чужеродный антиген. Связываясь с ним на поверхности клетки, они продуцируют перфорин (цитотоксический белок).
Т-киллеры составляют до 25-ти процентов от всех Т-лимфоциотов.
Это может проявляться лекарственными аллергиями и различными аутоиммунными заболеваниями (системные заболевания соединительной ткани, гемолитическая анемия аутоиммунного характера, злокачественная миастения, аутоиммунные тиреоидиты, и т.д.).
Подобным механизмом действия обладают некоторые лекарственные средства, способные запускать процессы некроза опухолевых клеток.
Например, к таким медикаментам относится Хлорбутин. Это средство применяют для лечения хронического лимфолейкоза, лимфогранулематоза и рака яичников.
Механизм действия цитотоксических Т-клеток
В случае проникновения внутрь организма соответствующего антигена под влиянием Т-хелперов активизируются Т-киллеры и начинается деление клеток клона. Т-клетки способны выявить антиген лишь при условии его экспрессии на поверхности пораженной клетки. Т-киллеры выявляют антиген вместе с маркером клетки — молекулами МНС (главный комплекс гистосовместимости) класса I. Во время распознавания чужеродного агента цитотоксическая клетка взаимодействует с клеткой-мишенью и разрушает ее до редупликации. Помимо этого, Т-лимфоцит вырабатывает гамма-интерферон, благодаря этому веществу болезнетворный вирус не способен проникнуть в соседние клетки.
Мишенями Т-киллеров являются клетки, пораженные вирусами, бактериями, а также раковые клетки.
Цитотоксические антитела, способные вызывать необратимые нарушения цитоплазматической оболочки клетки-мишени, являются главным элементом антивирусного иммунитета.
Большинство Т-киллеров являются частью субпопуляции CD8+ и выявляют антиген в комплексе с молекулами МНС класса I. Примерно 10% цитотоксических клеток относятся к субпопуляции CD4+ и различают антиген в комплексе с молекулами МНС класса II. Раковые клетки, лишенные молекул МНС, Т-киллеры не распознают.
Лизис клеток с чужеродным антигеном осуществляется Т-лимфоцитами посредством внедрения в их оболочки специальных белков перфоринов и впрыскивания внутрь токсических веществ.
Формирование Т-киллеров
Развитие цитотоксических клеток осуществляется в вилочковой железе. Предшественники Т-киллеров активируются комплексом антиген-молекула МНС класса I, их размножение и созревание происходит при участии интерлейкина-2 и плохо идентифицированных факторов дифференцировки, вырабатываемых Т-хелперами.
Сформированные цитотоксические клетки свободно циркулируют по организму, периодически они могут возвращаться в лимфоузлы, селезенку и другие лимфоидные органы. После получения активирующего сигнала от Т-хелперов начинается размножение определенных Т-лимфоцитов.
По цитотоксическому типу развиваются такие патологии как аутоиммунный тиреоидит, анемия, лекарственная аллергия. Также вследствие внутриклеточных метаболических поражений возможен цитотоксический отек мозга.
Цитотоксические медикаментозные средства
Цитотоксический эффект способны оказывать определенные медицинские препараты. Цитотоксики повреждают или разрушают клетки организма. При этом наиболее чувствительны к воздействию таких препаратов быстро размножающиеся клетки. Поэтому данные лекарства применяются, как правило, для терапии раковых заболеваний. Также подобные средства могут использоваться в качестве иммунодепрессантов. Производители выпускают данные лекарства в таблетированной и инъекционной формах. Возможно комбинированное применение некоторых препаратов с различным типом воздействия на организм.
Цитотоксическому воздействию подвержены и здоровые клетки организма, особенно клетки костного мозга.
Цитотоксики оказывают негативное влияние на выработку кровяных клеток, вследствие чего развивается повышенная восприимчивость к инфекционным заболеваниям, анемия, кровотечения.
К цитотоксикам относятся:
- алкилирующие средства (Хлорбутин, Допан, Миелосан, Оксалиплатин, Ломустин);
- антиметаболиты (Цитабарин, Фторурацил);
- антибиотики, оказывающие противоопухолевое действие (Карминомицин, Митомицин, Дактиномицин, Идарубицин);
- препараты природного происхождения (Винбластин, Таксол, Этопозид, Кохамин, Таксотер);
- гормоны и их антагонисты (Тетрастерон, Тамоксифен, Трипторелин, Летрозол, Преднизолон);
- моноклональные антитела (Герцептин);
- цитокины (Интерферон);
- ферменты (L-аспарагиназа);
- антитубулины;
- интеркаланты;
- ингибиторы топоизомеразы I (Иринотекан), топоизомеразы II (Этопозид), тирозинкиназ (Тайверб).

Что происходит и чего ждать? Нет, более важный вопрос – как выжить?
А выжить будет не легко. Но не из-за короновируса.
Для начала легкий экскурс в вирусологию. Краткий монтаж выглядит так:
· Наука достоверно не понимает что такое вирус.
· Наука не умеет предсказывать последствия пандемий.
Достаточно вспомнить истерию 80-х со СПИДом. Если помните, тогда предсказывалось вымирание человечества к 2015 году. Практически начало Апокалипсиса объявили (уверена что сейчас обязательно проведут подобные параллели). Вы наблюдаете опустение планеты?
Но что более странно, если даже опираться на официальное видение медициной вируса и иммунной системы, то совсем не такие действия должна предпринимать официальная медицина.
Все. Конец вирусу. Система срабатывает на его уничтожение. Главное – иммунитет.
Таким образом, не противореча себе, медицина должна броситься в защиту иммунитета от ослабления (иммунитет нельзя поднять – это еще одно мощное заблуждение). Можно устранить факторы, его понижающие или отключающие.
Какие же факторы являются мощными разрушителями иммунитета (врожденный и приобретенный иммунодефицит в данной статье не обсуждаем)?
Согласно официальной медицине – это стресс. Именно его гормональные последствия отключают иммунитет и противовоспалительные факторы.
Чем порождается стресс? Страх и паника. Напряжение и неизвестность. Переживания и конфликты.
И тут уж совсем тупик просто грандиозного масштаба. Если страх и паника – это то, что делает нас абсолютно открытыми к заболеванию, то почему именно их и раздувает общество всеми силами?
Где логика? В чем задача системы? Даже не хочу тратить время и силы на объяснение этого долбизма.
Скрывает ли кто-то эпидемию гепатита? По оценкам ВОЗ, в 2016 г. от гепатита С умерли приблизительно 399 000 человек.
Объявил ли кто-то карантин? Предпринял ли грандиозные изменения?
Но более важный вопрос: заболели ли Вы или члены Вашей семьи в этой реально жуткой пандемии, которая длится уже десятилетия?
А способ заражения что туберкулезом, что вирусным гепатитом прост. Очень прост и повсеместно доступен.
Чувствуете разницу между реальной эпидемией и спровоцированной паникой?
Итак, будет ли всплеск заболеваемости короновирусом?
ОБЯЗАТЕЛЬНО и гарантированно. Но вот учитывается ли, какие группы "сделают" статистику? Подумал ли кто-то об этих людях? давайте посмотрим на срез возможных госпитализированных:
• люди предрасположенные к ипохондрии и с тревожными расстройством (10-15% взрослого населения). Это люди, в силу текущего состояния очень резко отреагируют на пропаганду и вентилирование симптомов всеми инфоканалами. Это та часть заболевших, симптомы у которых будут соматоформные. Т.е. очень похожи и реальны (это расстройство не включает симулянтов). При полной совпадающей клинической картине их, скорее всего, будут госпитализировать под эгидой короновируса.
• люди остро переживающие страх именно благодаря противокароновирусной кампании. Люди впечатлительные. Их переживание будет реально стрессовым и реально подавит иммунитет. Соответственно, и заражение будет реальным (если вирус вообще появится в стране). Но у нас и так масса вирусов гуляют. Разных.
• люди с фобиями и особенно невротическим страхом смерти (от 8 до 16 % взрослого населения).. Тут нелишне опять вспомнить новую германскую медицину, которая относит психогенное возникновение очага поражения в легких, именно к страху смерти.
В пересчете на общее население, которое внимательно внемлет информационной диарее, цифра заболеваемости уже может быть очень внушительной только благодаря пропаганде и истерии в соцсетях.
И тут уж реальное заражение реальным короновирусом даже не потребуется. Больных и госпитализированных будет предостаточно.
И развернутая информационная кампания и наши с вами перепосты непроверенной глупости бьют именно по этим людям.
Итак, как же выстоять в этой панике короновируса?
НЕ ДАТЬ ШАНСА НИКОМУ пошатнуть ваш иммунитет. Для этого:
Чувствую разочарование людей, ожидавших рецепт волшебной смеси из странных ингредиентов, или чудо маску, или афирмацию-заговор против вируса.
Но наша вера в волшебство без напряга - это чисто славянская реальность. Жить черти как, а потом – бах… и волшебно избежать последствий.
И возможно именно потому нашему брату славянину такие встряски и карантины и нужны.
Руки научиться мыть, в баню ходить, перестать жрать немытые овощи прямо на рынке; прекратить мочиться в бассейн в развлекательном центре; устраиваться на работу официально, чтобы заболев спокойно сидеть дома на оплачиваемом больничном; сидеть с болеющими детками дома, а не всовывать их бегом воспитателю или учителю и бежать к машине, прикидываясь глухим.
Опять таки, объявление карантина - в нашей стране имеет и политический подтекст: действующая власть и "на воду дуть" вынуждена, чтобы защитить себя от нападок оппонентов и главное, лишить их возможности использовать панику в своих целях. Как это возможно в нашей стране, мы уже видели на примере встречи соотечественников соотечественниками…
И для системы, которая живет в режиме "гром не грянет - мужик не перекрестится" тоже полезна встряска: и шприцы посчитать, и врачей поучить и денег из бюджета выделить.
И это важно учитывать, определяя реальную угрозу жизни и соответсвенно предпринимая ответные действия.
И напоследок, хочу напомнить, что еще 2000 лет назад Евангелие повествует о том, что не так войны и болезни, как страх перед ними будут уничтожать людей.
Что собственно мы и видим. И к сожалению, помощь тут только самим себе.
Т-лимфоциты – это вырабатываемые лейкоциты в костном мозге, направляемые в тимус (вилочковую железу), которые позже изменяются под воздействием гормонов и клеток. Погибают данные субстанции в селезёнке.
В процессе этого изменения делятся на t и b-лимфоциты, причем В-лимфоциты малочисленные, их, как правило, до 20%. Но благодаря им организм приобретает иммунитет к заболеваниям, которыми уже переболел, вырабатывая антитела на вирусы или бактерии, и вакцинация происходит успешно. На Т-лимфоциты приходится 80% клеток, они заселяют особые Т-зоны, находящиеся в лимфатических узлах, селезёнке, в мелких отростках разных органов.
Лимфоциты – клетки звеньев крови, выполняющие иммунные функции организма. Снижение или повышение уровня в крови говорит, что в организме происходит развитие патологического процесса. Анализ крови на лейкоциты измеряют общим анализом крови, который популярен в государственных учреждениях здравоохранения и недорогим в частных клиниках. Так врач получает сведения о состоянии организма, в том числе через уровень данных веществ.
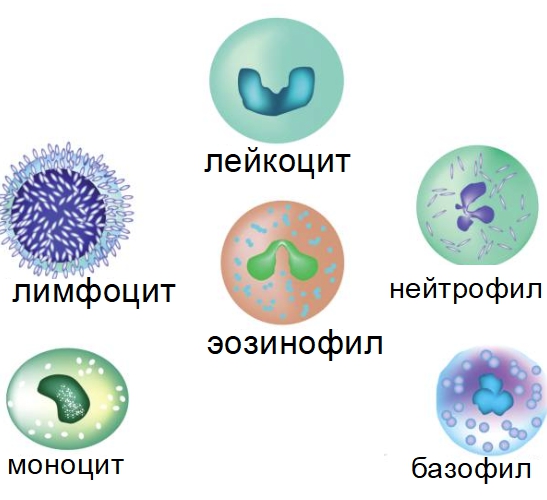
Виды и значение Т-лимфоцитов
Они уничтожают чужеродные антигены и под влиянием их подразделяются на виды:
- Т-киллеры (СD 8) – расщепляют и ликвидируют ткани, поражённые вирусом, бактерией или опухолью, тем самым уничтожая поврежденные клетки собственного организма.
- Т-хелперы (CD 4) – усиливают ответ иммунитета на вторжение чужеродных веществ и активируют Т-киллеров.
- Т-супрессоры – контролируют интенсивность ответа иммунной системы и не дают уничтожать здоровые клетки организма.
- Амплификаторы или эффекторы – клетки, способные предоставлять поддержку в размножении Т-лимфоцитов, поддерживая связь.
- Клетки памяти – они возникают, уничтожив очередную угрозу, образуя дубликаты, которые запоминают информацию об угрозе. Этот клон может быстро размножаться для повторного отражения атаки.
Антигены – это вещества, являющиеся переносчиками чужой генетической информации. Так организм распознает ткани, даже органы, и стремится ликвидировать. Иммунный ответ на потенциально опасные угрозы происходит безостановочно. Сила зависит от качества иммунитета и предыдущего контакта с данным антигеном, насколько успешно на него выработалась ответная реакция.
Количество Т-лимфоцитов узнаётся сдачей общего анализа крови, в результате лабораторного исследования будет сделана иммунограмма, где отражено в процентах количество также и b-лимфоцитов. Норма показателей взрослого человека:
- Т-лимфоцитов 50-70% (0,7-2,6 тыс.).
- В-лимфоцитов 7-22% (0,1-0,8 тыс.).
- Пропорция супрессоров и хелперов 1,4-2,1.
Когда показатель вне границ нормы, значит, происходит чрезмерная работа иммунитета или недостаточная защитная функция. Стоит помнить, что при небольшом воспалении их уровень снижается, и по размеру этого снижения определяется интенсивность и сила воспалительного процесса. Пример заболеваний при понижении уровня: гнойный клеточный процесс внутренних органов, почечная недостаточность, может быть следствием химиотерапии или приёма некоторых препаратов. Превышение нормы является свидетельством наличия хронического заболевания.

Функции
- Обнаружение антигенов (вирусов, бактерий вредоносных микроорганизмов), анализ клеток собственного организма на повреждения, мутации, заражения.
- Информирование иммунной системы о сбое или вторжении.
- Уничтожение их, выработка антител предотвращая последующее заражение.
- Помощь в выводе мёртвых клеток.
- Сохранение информации о побежденном микробе, гене с целью последующего распознавания и ликвидации ещё быстрее при последующем заражении.
Дифференцировка (превращение, созревание)
Как сказано выше, часть стволовых клеток мигрирует в тимус и созревает до Т-лимфоцитов. Клетки созревают в органах иммунитета, за 3 недели их становится до 100 раз больше количественно. Стволовая клетка в процессе миграции в тимус (вилочковую железу) дифференцируется под влиянием окружения этой железы в Т-лимфоцит. Организму необходим этот процесс, чтобы осуществить распознавание, разрушить чужеродный антиген; создать особый набор рецепторов, при последующем контакте с данным вирусом, бактерией распознает их и разрушит.
На начальном этапе дифференцировки данные распознающие рецепторы уже полностью работоспособны, существуют альфа и бета цепи, CD3 структура, но молекулы CD4 и CD8 ещё отсутствуют, строение клетки ещё неполное, в целом состав остаётся сложный. При продолжительном воздействии гормонов и тимуса Т-лимфоцит развивается все больше, и из предшественника клетки образуются незрелыми предшественниками обычного лимфоцита. Наступает этап, когда окончательно дозревает из-за контакта с мозговым веществом тимуса, при этом происходит максимальное усиление защитной функции иммунитета. Покидая вилочковую железу, прошедшие развитие зрелые Т-лимфоциты расселяются в вышеупомянутые Т-зоны органов. Подведя итог, выделим этапы дифференцировки:
- Миграция из такой поверхности, как костный мозг в поверхность тимуса.
- Формируются незрелые предшественники, происходит перераспределение генов TCR с последующим формированием рецепторов.
- Положительная и отрицательная селекция.
- Формирование Т-киллеров и Т-хелперов.
- Миграция зрелых клеток из тимуса.
Т-хелперы преобразуются (дифференцируются) в клетки, необходимые организму для особой популяции под названием цитокины. Разделены на два типа:
- th1 – отвечают за хронические воспаления, обеспечивая защиту Т-лимфоцитов от патогенных микроорганизмов, находящихся внутри клеток;
- th2 – выполняют функцию защиты от внешних клеточных угроз.
Здоровое и гармоничное развитие иммунитета и поддержание необходимого баланса в организме постоянно поддерживается балансом Т1- и Т2-хелперов, они сдерживают рост друг друга. Так, к примеру, при рождении содержание значений показателя Т2-хелпера повышено, позже количество приходит в норму, но, допустим, при заболеваниях желудка или кишечника количество Т1-хелперов уменьшается.
Размер Т-лимфоцитов меньше других, с помощью микроскопа на одну единицу исследуемого материала их размер исчисляется 6-9 мкм. Отличительной особенностью является овальное или круглое ядро, в содержимом зернистость отсутствует.
Подведя итог, важно помнить, что как высокий, так и низкий показатель Т-лимфоцитов должен насторожить и дать повод для других исследований для выявления причины этого скачка. Сдача общего анализа крови согласно общему регламенту происходит довольно просто, для точности измерений нельзя употреблять пищу за 4 часа и заниматься физическими упражнениями. Количество Т-лимфоцитов в лабораторных исследованиях записывается как CD3. Достаточно помнить, что в каждом организме незримо и ежедневно Т-лимфоциты ведут свой невидимый невооруженным глазом бой за крепость иммунной системы, уничтожение чужеродных антигенов и профилактику новых заболеваний.
Значение составляющих крови для такой науки, как иммунология, настолько важно, что существование человечества как популяции без них невозможно.
В противовирусном иммунитете разрушение содержащих вирусы клеток осуществляется как Т-лимфоцитами, так и, параллельно, активированными макрофагами.
Необходимо отметить, что возбудители, размножающиеся прямо в месте внедрения (грипп), имеют короткий инкубационный период, что может быть опасно из-за определенной инерционности развития иммунных реакций, особенно у людей с Т-клеточным иммунодефицитом, что приводит к тяжелому течению заболевания.
Специфический противовирусный иммунный ответ осуществляется при инфицировании организма вирусами и некоторыми простейшими (токсоплазма, листерия), когда антиген локализуется в цитоплазме инфицированных клеток. Преимущественно презентацией антигена в таком случае занимаются дендритные антиген-презентирующие клетки. Дендритные клетки содержатся в строме лимфатических узлов и селезенки, а также в некоторых нелимфоидных тканях: в эпидермисе кожи и слизистых оболочках воздухоносных путей, где они называются клетками Лангерганса, в слизистых желудочно-кишечного и урогенитального трактов, в интерстисиальных тканях сердца, почек и других органов.
Белковый антиген (например, вирусный капсид) в ходе процессинга расщепляется в протеосомах цитоплазмы дендритной клетки, транспортируется с помощью белков-трансмитеров к молекулам MHC I класса, где образуется его комплекс с пресинтезированной молекулой MHC I. Этот комплекс переносится через аппарат Гольджи на поверхность клетки для презентации CD8 Т-лимфоцитам. TcR CD8 цитотоксических Т-лимфоцитов (ЦТЛ или Т-киллеры) распознают антиген в комплексе с MHC I при помощи молекулы CD8+ и адгезионных молекул B7 и CD28. Вторым сигналом активации ЦТЛ является секреция антиген-представляющей клеткой IL-1 в подтверждение того, что MHC I класса ассоциирована с вирусным пептидом. После активации ЦТЛ начинает секретировать IL-2, который является главным фактором роста Т-лимфоцитов, и экспрессирует рецепторы для IL-2. В результате образуется клон цитотоксических лимфоцитов с T-клеточными рецепторами (TcR), специфичными для антигена (вируса), вызвавшего данный иммунный ответ. ЦТЛ, после контакта с клеткой-мишенью, быстро убивают ее и отделяются от нее, чтобы атаковать следующую мишень. Однако в период, пока ЦТЛ связан с клеткой-мишенью при участии TcR, создаются условия фокусирования эффекторных молекул, секретируемых лимфоцитом (IL-2), точно в месте контакта клеток. Цитотоксические функции CD8 Т-лимфоцитов обусловлены секрецией пресинтезированных цитотоксинов: фрагментинов, индуцирующих апоптоз в клетке-мишени, и перфоринов, поры-образующих белков.
ЦТЛ продуцируют и выделяют:
- IFNg, активирующий макрофаги (фагоцитируют последствия работы лимфоцитов) и пролиферацию Т-х1;
- IL-2, фактор роста Т-лимфоцитов (Т-киллеров, Т-х1 и Т-клеток памяти), а также ускоряющий синтез MHC I и II классов антигенов и представление в комплексе с ними чужеродных антигенов;
- TNFa, увеличивающий проницаемость сосудов, но при избыточной концентрации приводящий к сосудистому шоку;
- TNFb (лимфотоксин), имеющий собственный цитотоксический эффект (приводит к механизму апоптоза).
Основные механизмы T –клеточный противовирусный иммунитета:
- CD4+T-клетки определяют развитие гуморального ответа - переключение классов антител и зрелость их аффинности;
- CD4+T-клетки осуществляют помощь в индукции цитотоксичеких CD8+ T-лимфоцитов;
- CD4+ T–клетки рекрутируют и активируют макрофаги;
- CD4+ цитотоксические T-лимфоциты распознают и убивают MHС II класса- позитивные клетки, инфицированные вирусами;
- CD8+ цитотоксические-T-клетки – главная оперативная система против вирусов - высоко эффективная и селективная; CD8+клетки распознают молекулы MHC I класса и фокусируются в местах вирусной репликации, разрушая инфицированные вирусом клетки; все клетки организма экспрессируют молекулы МНС I класса;
При Т-зависимом иммунном ответе В-лимфоциты также выступают в качестве антигенпрезентирующих клеток. В-лимфоциты своими антигенраспознающими рецепторами связываются с антигеном, поглощая (интернализируя) его. В фагосоме В-лимфоцитов антиген подвергается перевариванию. Пептиды, полученные из такого антигена, возвращаются на поверхность В-лимфоцитов в ассоциации с молекулами гистосовместимосги класса II (MHC II класса). Здесь они распознаются Т-клеточным распознающим рецептором, который имеется на поверхности CD4+ клетки. Это приводит к стимуляции CD4+ лимфоцита (хелпера) и продукции ИЛ-2, ИЛ-4 и ИЛ-5. Образовавшиеся интерлейкины стимулируют В-клеточную пролиферацию и дифференцировку с превращением, в конце концов, в антителопродуцирующую плазматические клетки.
В первые 4 – 5 суток после антигенной стимуляции (инфецирование вирусом) В-клетки продуцируют и секретируют только IgM. На 14 – 16 сутки В-лимфоциты переключают синтез с IgM на IgG и далее 21 – 24 день (максимум продукции IgA) - на IgA и IgE. Таким образом, при Т-зависимом иммунном ответе индуцируется продукция иммуноглобулинов всех классов.
Aнтивирусные эффекты антител представлены в таблице .
Таблица . Aнтивирусные эффекты антител при инфецировании организма
| Мишень | Агент | Механизм |
| свободный вирус | Антитела | Блокируют связывание с клеткой; Блокируют проникновение в клетку; Блокируют раздевание вируса; |
| свободный вирус | Антитела+ комплемент | Повреждают вирусы; Блокируют вирусные рецепторы; |
| Инфицирован-ные вирусом клетки | Антитела+ комплемент | Лизируют инфицирован ные клетки; Опсонизирует вирусы или инфицированн ые клетки для фагоцитоза; |
| Инфицирован-ные вирусом клетки | Антитела свя- зываются с инфицирован-ными клетками | Антителозависимая клеточная цитотоксичность, опосредованная NK-клетками, макрофагами и нейтрофилами; |
Нейтрализация вируса, препятствующая его прикреплению к клетке-мишени; осуществляется антителами IgG во внеклеточной жидкости, IgM в крови и секреторными IgA-антителами на поверхности слизистых оболочек. Иммунные комплексы, содержащие вирус, могут связывать комплемент, что способствует нейтрализации вируса.
Вирусные инфекции, распространяющиеся гематогенно (полиомиелит, корь, эпидемический паротит, ветряная оспа), могут элиминироваться гуморальными механизмами, причем данные заболевания, как правило, характеризуется длительным инкубационным периодом.
Тем не менее, наличие у конкретного индивидуума нормально функционирующего клеточного звена иммунитета будет способствовать ограничению вирусного заболевания (в конечном итоге — выздоровлению) за счет лизиса инфицированных вирусом клеток и, как следствие, прекращения производства инфицированного потомства.
Выздоровление от острой вирусной инфекции обычно сопровождается формированием клеток памяти и выработкой длительного иммунитета и повторные атаки того же самого вируса становятся неэффективными.
Читайте также:


