Современные вирусы и вакцины
Современной науке известны сотни видов патогенных вирусов, относящихся к 26 семействам, избирательно поражающим различные системы организма человека и животных. Природное многообразие вирусных болезней вызывало необходимость наряду с санитарно-гигиеническими мерами прибегнуть к специфической профилактике с использованием широкого круга вакцинных препаратов.
Вакцинопрофилактика занимает ведущее место в борьбе со многими вирусными заболеваниями человека и животных. Несмотря на большое разнообразие вирусов и вызываемых ими заболеваний, имеются общие принципы приготовления и применения вирусных вакцин. Однако в настоящее время не все вирусные болезни в одинаковой степени удается контролировать с помощью вакцинации.
Вакцинация должна сопровождаться развитием иммунологической памяти. В идеале, это поддержание специфических антител в высокой концентрации в сыворотке крови и на месте внедрения вируса. В тоже время Т-клетки, ответственные за специфический клеточный иммунитет, должны находиться в состоянии готовности быстро синтезировать свои летальные продукты (т.е. гранзимы и перфорины), когда происходит инфицирование. Все существующие на сегодня вакцины можно разделить на три общие группы: инактивированные (убитые), живые (аттенуированные) и компонентные (субъединичные) вакцины. Каждая из этих категорий вакцин имеет свои преимущества и недостатки.
В зависимости от технологии изготовления различают несколько типов вирусных вакцин:
1. Живые реплицирующиеся вакцины:
— вакцины из природно ослабленных или гетерологичных вирусов;
— вакцины из вирусов, аттенуированных пассажами в гетерологичных организмах или в культурах клеток при обычной или пониженной температуре, или реассортацией вирусных генов.

2. Нереплицирующиеся вакцины, содержащие природные вирусные антигены:
- вакцины из инактивированных целых вирионов и неструктурных вирусных белков;
- вакцины из нативных вирусных субъединиц.
3. Вакцины, полученные с помощью рекомбинантной ДНК или других новых технологий:
- вакцины, полученные путем делеции гена (генов) или точечного мутагенеза;
- вакцины на основе вирусных белков, экспрессированных in vitro в клетках эукариотов или прокатиотов;
- вакцины из вирусных белков, собранных в вирусоподобные частицы;
- вакцины, экспрессирующие вирусные антигены с помощью вирусных векторов;
- вакцины на основе вирусных химер;
- ДНК-вакцины.
4. Синтетические полипептидные вакцины.
Живые вакцины содержат авирулентные штаммы вирусов, аттенуированные разными способами, и отличаются способностью размножаться в привитом организме (реплицирующиеся антигены). Остальные типы вакцин готовят из инактивированных вирусов или их антигенных и иммуногенных компонентов (нереплицирующиеся антигены).
Используя другие принципы классификации, вакцинные препараты можно разделить на две большие группы: цельновирионные и компонентные (субъединичные). Причем к первой группе относятся как традиционные живые, так и инактивированные вакцины. Живые гомологичные вакцины, в свою очередь, могут различаться способом получения и быть представленными природно аттенуированными или искусственно ослабленными штаммами, включая рекомбинантные и реассортантные, а также штаммы, аттенуированные цельнонаправленными изменениями генома биотехнологическими методами.
К компонентным (субъединичным) вакцинам можно отнести все, которые не входят в рубрику цельновирионных вакцин. Прежде всего, сюда относятся вакцины, полученные из компонентов вирионов или вирус-инфицированных клеток после их разрушения. Кроме них к этой категории относятся субъединичные вакцины, приготовленные из вирусных белков, экспрессируемых клонированными вирусными генами в эукариотических или прокариотических системах. Сюда же можно отнести живые рекомбинантные вакцины, которые по своей сути являются реплицирующимися субъединичными вакцинами. Клонированные гены, реплицируясь в составе вирусного вектора, обеспечивают экспрессию белков, ответственных за индукцию специфического иммунитета.
Вакцины на основе вирусспецифических пептидов, получаемых синтетическим путем, в известном смысле, тоже можно отнести к разряду субъединичных (эпитопных) вакцин.
Анализ имеющихся данных свидетельствует о достаточно высокой эффективности многих вирусных вакцин, применяемых в медицинской и ветеринарной практике. Это, прежде всего, относится к живым вакцинам, применяемым для контроля таких массовых и опасных заболеваний человека, как полиомиелит, желтая лихорадка, корь, эпидемический паротит, краснуха и др. Аналогичным примером из практики ветеринарной медицины могут служить живые вакцины против чумы свиней, крупного рогатого скота и плотоядных, против ньюкаслской болезни и другие. Примером инактивированных вакцин могут служить вакцины против полиомиелита, гриппа, ящура и многих других болезней.
Некоторые из живых вакцин (оспа человека, полиомиелит, желтая лихорадка, корь, чума крупного рогатого скота, классическая чума свиней и др.) отвечают требованиям безопасности (генетическая стабильность, отсутствие реверсии, слабая реактогенность), обеспечивают длительный напряженный иммунитет и могут служить образцом для вновь создаваемых вакцинных препаратов.
Возбудители многих вирусных заболеваний (полиомиелит, грипп, ящур, катаральная лихорадка овец, чума лошадей и др.) существуют в виде нескольких антигенных типов. Поскольку иммунизация против одного из этих типов не защищает от заражения другими, эффективная профилактика возможна только при вакцинации поливалентной вакциной, содержащей антигены нескольких антигенных типов данного вируса. Вакцины, содержащие антигены более чем одного вида возбудителя, называют комбинированными (ассоциированными).
Большинство применяемых в настоящее время вакцин содержит антигены, идентичные или подобные антигенам вирулентного вируса, против которого предполагается создать иммунитет. Такие вакцины называют гомологичными. В некоторых случаях для приготовления вакцин используют гетерологичные вирусы, содержащие перекрестно-реагирующие антигены и создающие достаточный иммунитет. Такие вакцины называются гетерологичными.

В условиях пандемии многие государства приступили к созданию лекарств и вакцин от нового коронавируса. Сообщается, что в России разработка прошла первую фазу — так ли это? Значит ли, что скоро можно ждать появления препарата? Чтобы разработать новое лекарство от неизвестного заболевания по всем правилам научного поиска нужно от 5 до 15 лет. Разобрали весь процесс на примере COVID-19 вместе с Равилем Ниязовым, специалистом по регуляторным вопросам и разработке лекарств Центра научного консультирования.
COVID-19 — инфекционное заболевание, вызываемое коронавирусом SARS-CoV-2. В тяжелых формах оно поражает легкие, иногда — сердце и другие органы. Особенно тяжело заболевание протекает, если у больного есть другие нарушения со стороны дыхательной или сердечно-сосудистой систем. Молниеносно возникшая пандемия COVID-19 поставила вопрос разработки лекарств и вакцин от новой инфекции. Это долгий процесс с множеством стадий, на каждой из которых исключают вещества-кандидатов. Только одно или небольшая группа таких веществ в итоге сможет стать безопасным и эффективным лекарством.
Шаг 1: понять, как развивается новое заболевание
Любая болезнь нарушает естественные физиологические и биохимические процессы в организме. Причины заболеваний могут быть разными, в том числе — инфекционными. Инфекционный агент (в случае COVID-19 это коронавирус SARS-CoV-2) заимствует и эксплуатирует биохимический аппарат клеток, перехватывая управление им, в результате чего клетки перестают выполнять свою физиологическую функцию. Для вируса SARS-CoV-2 основной мишенью являются клетки дыхательного эпителия, отвечающие за газообмен, то есть за дыхание.
Лекарством для лечения COVID-19 будет считаться любое вещество или комбинация веществ, которое будет способно (1) инактивировать вирус еще до того, как он успеет поразить клетку, или (2) нарушать жизненный цикл вируса внутри зараженной клетки, или (3) защищать новые непораженные здоровые клетки от инфицирования.
Чтобы создать лекарство от SARS-CoV-2, нужно хорошо знать, каков жизненный цикл вируса в организме человека:
- с какими клетками человека и через какие рецепторы на поверхности клеток он связывается, какой собственный вирусный аппарат для этого он использует;
- как вирус проникает в клетку;
- как вирус эксплуатирует биохимический аппарат клетки, чтобы воспроизводить собственный генетический материал и белки, нужные для сборки новых вирусных частиц;
- как вирус покидает инфицированную клетку, чтобы инфицировать новые клетки;
- как формируется иммунитет против вируса и какой вклад иммунитет вносит в тяжесть заболевания (чрезмерная иммунная реакция может вызывать тяжелое поражение внутренних органов).

Всё перечисленное — это совокупность фундаментальных знаний, необходимых для перехода к следующему этапу разработки лекарства — синтезу или биосинтезу веществ, которые могут нарушать свойства вирусных частиц, убивая вирус и при этом не вредя человеку. Например, так работают лекарства от ВИЧ-инфекции или гепатита C. Но при этих заболеваниях важно применять сразу несколько веществ из разных классов, чтобы вирус не становился устойчивым к терапии. Об этом нужно будет помнить и при разработке лекарств против SARS-CoV-2.
Для лечения вирусных заболеваний также могут использоваться иммуносыворотки, содержащие антитела, способные инактивировать вирус. Такие сыворотки можно получать от животных, например, лошадей или кроликов, но также и от человека, уже переболевшего заболеванием.
Однако самый эффективный подход — профилактика заболевания. Для этого используют вакцины — естественные или генетически модифицированные белки вируса, а иногда и живой, но ослабленный вирус. Вакцина имитирует инфекционное заболевание и стимулирует организм к формированию иммунитета. В последнее время также разрабатываются РНК- и ДНК-вакцины, но пока одобренных препаратов нет.
В отличие от традиционных вакцин, РНК-/ДНК-вакцины содержат не вирусные белки, а гены, кодирующие основные вирусные белки. Введение такой вакцины приводит к синтезу клетками белков вируса, на которые должна реагировать иммунная система и вырабатывать иммунитет против этих белков вируса. Гипотетически это должно препятствовать началу инфекционного процесса при заражении настоящим патогенным вирусом. Важно отметить, такие РНК- и ДНК-вакцины не должны кодировать те белки вируса, которые способны были бы привести к настоящей вирусной инфекции.
Шаг 2: поиск хитов
На ранней стадии разработки синтезируют и тестируют множество веществ — библиотеку. Основная цель этого этапа — найти группу хитов (hit — попадание в цель), которые бы связывались с нужной вирусной мишенью. Обычно это один из белков вируса. Иногда отбор идет из библиотек, состоящих из миллиардов низкомолекулярных веществ. Сейчас активно используют компьютерные алгоритмы — машинное и глубокое обучение — чтобы искать новые потенциально активные молекулы. Одна из компаний, успешно работающая в этом направлении, — InSilico Medicine, создана российскими математиками.
Другой источник потенциальных лекарств — выздоровевшие люди: в их крови содержатся антитела, часть из которых способны связываться с вирусом и, возможно, нейтрализовать его.
Шаг 3: поиск и тестирование лидов
Когда находят группу хитов, способную связываться с вирусным белком, переходят к следующему этапу скрининга. На этом шаге исключаются вещества, которые:
- нестабильны и быстро разлагаются;
- тяжелы/затратны в синтезе;
- токсичны для различных клеток человека в условиях лабораторных экспериментов на культуре клеток. Вещества не должны быть токсичны сами, токсичностью также не должны обладать продукты их метаболизма в организме, продукты их разложения и примеси, возникающие в процессе производства; вместе с тем если процесс производства способен с помощью очистки удалять продукты разложения или примеси, то такой хит может и не будет выведен из разработки;
- плохо растворимы в воде — лекарство должно в достаточном количестве растворяться в биологических жидкостях, чтобы распределиться по организму;
- быстро разлагаются в живом организме;
- плохо проникают через слизистые оболочки, клеточные мембраны или внутрь клетки, в зависимости от пути введения лекарства и расположения вирусной мишени.
Хиты, которые выдерживают эти испытания и проходят все фильтры, переводят в категорию лидов (lead — ведущий).
Лиды тестируют в еще более широкой серии экспериментов для принятия так называемых решений Go/No-Go о продолжении или остановке разработки. На этой стадии инициируются испытания на животных. Такая схема отбора нужна чтобы как можно раньше вывести из разработки бесперспективные молекулы, потратив на них минимальные время и ресурсы, поскольку каждый последующий этап является еще более затратным.
Те несколько лидов, которые успешно проходят очередные испытания, становятся кандидатами. К этому моменту разработка может длиться уже от трех до семи лет.
Шаг 4: испытания кандидатов и клинические исследования

Прежде чем перейти к испытаниям на людях, нужно выполнить исследования на животных и подтвердить отсутствие неприемлемой для человека токсичности, подобрать первоначальную безопасную дозу. На этом этапе кандидаты тоже могут отсеиваться — например, из-за генотоксичности (токсичности для генетического аппарата клетки) или канцерогенности (способности вызывать рак). Еще они могут оказаться небезопасными для беременных женщин или женщин детородного возраста, вызывать поражение головного мозга, печени, почек, сердца или легких. В зависимости от природы молекулы исследования проводят на грызунах, собаках, обезьянах, минипигах, кроликах и т.д.
В зависимости от природы заболевания, особенностей его терапии и свойств лекарства, какие-то исследования могут не проводиться или быть не значимы. Например, оценка канцерогенности лекарства не потребуется, если оно будет применяться в лечении краткосрочных заболеваний, как в случае COVID-19. Генотоксичность не оценивают для биопрепаратов или если лекарство предназначено для лечения метастатического рака и т. д. Суммарно доклинические исследования могут занимать 3–5 лет. Часть из них проводится параллельно с клиническими исследованиями.
Если доклинические исследования успешны, начинается клиническая разработка, которая условно делится на фазы. Это нужно, чтобы постепенно и контролируемо тестировать лекарство на все большем количестве людей. И снова стадийность процесса позволяет прекратить разработку на любом этапе, не подвергая риску многих людей.
- Первая фаза: здесь подтверждают первичную безопасность для людей в принципе, изучают поведение лекарства в организме человека, его биодоступность (способность достигать места действия в достаточных концентрациях), его взаимодействие с другими лекарствами, влияние пищи, половых и возрастных различий на свойства лекарства, а также безопасность для людей с сопутствующими заболеваниями (особенно важны заболевания печени и почек — эти органы отвечают за метаболизм и выведение лекарств), проверяют, не вызывает ли лекарство нарушение ритма сердца. Кроме того, на I фазе оценивают безопасный диапазон доз: эффективные дозы не должны быть неприемлемо токсичными.
- Вторая фаза: здесь начинают проверять эффективность лекарства на пациентах с заболеванием. На ранней II фазе оценивают, работает ли кандидатная молекула на людях с изучаемым заболеванием в принципе, а на поздней II фазе подбирают режим дозирования, если кандидатное лекарство было эффективным. При этом вещество, эффективное в лабораторных экспериментах, на животных моделях заболевания и даже в ранних клинических исследованиях на людях, вполне может не быть таким же рабочим в реальной медицинской практике. Поэтому и нужен длительный процесс поэтапной исключающей разработки, чтобы на выходе получить эффективное и безопасное лекарство.
- Третья фаза: здесь подтверждают эффективность и безопасность лекарства, а также доказывают, что его польза компенсирует те нежелательные реакции, которые неминуемо будет вызывать лекарство. Иными словами, в исследованиях третьей фазы надо понять, что баланс пользы и рисков положителен. Это всегда индивидуально. Например, у людей с ВИЧ в целом допустимо, если противовирусные лекарства вызывают некоторые нежелательные реакции, а в случае онкологических заболеваний приемлемы и более выраженные токсические реакции.
В случае вакцин, которые рассчитаны на здоровых людей, и особенно детей, приемлемы лишь легкие нежелательные реакции. Поэтому найти баланс трудно: вакцина должна быть высоко эффективной, и при этом вызывать минимальное число тяжелых реакций, например реже, чем 1 случай на 1000, 10 000 или даже 100 000 вакцинированных людей. Клиническая разработка может длиться до 5–7 лет, однако низкомолекулярные противовирусные лекарства для краткосрочного применения, как в случае COVID-19, можно протестировать быстрее — за 1–2 года.
Разработка многих отечественных противовирусных и иммуномодулирующих препаратов не соответствует такому научно выверенному процессу разработки.
Шаг 5: производство
Важный этап — наладить производство лекарства. Разработка процессов синтеза начинается в самом начале отбора лидов и постепенно дорабатывается, оптимизируется и доводится до промышленного масштаба.
В настоящее время против SARS-CoV-2 разрабатывается много разных методов лечения:
- низкомолекулярные соединения, которые нарушают жизненный цикл вируса. Трудность в том, что может быть нужно применять сразу несколько противовирусных лекарств. Сейчас надежды возлагают на ремдесивир. Есть данные, что может быть эффективен давно известный гидроксихлорохин, действующий не на сам вирус, а влияющий на иммунитет. Информацию, что комбинация лопинавира и ритонавира оказалась неэффективной у тяжелобольных пациентов, стоит интерпретировать с осторожностью: она может быть эффективна при более легких формах, или для профилактики, или у каких-то определенных подгрупп;
- противовирусные, в том числе моноклональные, антитела, которые связываются с ним на поверхности и блокируют его проникновение в клетку, а также помечают вирус для клеток иммунной системы. Антитела можно получать как биотехнологически, так и выделять из крови переболевших людей. Сейчас тестируются препараты, получаемые с помощью обоих методов;
- вакцины. Они могут представлять собой естественные или модифицированные белки вируса (модификации вводят для усиления выработки иммунитета), живой ослабленный вирус, вирусоподобные наночастицы, синтетический генетический материал вируса (РНК-вакцины) для того, чтобы сам организм человека синтезировал некоторые белки вируса и смог выработать антитела к нему. Одна из проблем в случае вакцин — простое введение белков вируса, пусть и модифицированных, не всегда позволяет сформировать иммунитет, способный защитить от реального заболевания — так называемый стерильный иммунитет. Даже образование антител в ответ на введение вакцины не гарантирует защиты: хорошим примером являются те же ВИЧ и гепатит C, хотя вакцина против гепатита B достаточно проста и при этом высокоэффективна. Хочется надеяться, что отечественные разработчики следуют рекомендациям Всемирной организации здравоохранения по проведению доклинических и клинических исследований вакцин, включая исследования провокации и изучение адъювантов;
- препараты для РНК-интерференции. Так называемые малые интерферирующие рибонуклеиновые кислоты (РНК) — это небольшие отрезки синтетически получаемой РНК, которые способны связываться с генетическим аппаратом вируса и блокировать его считывание, мешая синтезу вирусных белков или воспроизведению генетического материала вируса.
Процесс разработки лекарства — это научный поиск с неизвестным исходом. Он занимает много времени и требует участия большой команды профессионалов разных специальностей. Однако только реальный клинический опыт позволит оценить, удалось ли получить не только эффективное, но и безопасное лекарство, поэтому любое точное определение сроков получения лекарства — спекуляция. Получить эффективную и безопасную вакцину к концу года, если следовать всем правилам научного поиска, вряд ли удастся.
Детальные обсуждения процессов разработки новых лекарств и возникающих в связи с этим проблем — на YouTube-канале PhED.
По данным Минздрава Демократической Республики Конго, на начало декабря этого года в стране зарегистрировано 3201 подтвержденных случаев заболевания лихорадкой Эбола, 2209 заболевших умерли.
Сергей Нетёсов, доктор биологических наук, профессор, заведующий лабораторией биотехнологии и вирусологии факультета естественных наук Новосибирского государственного университета, член-корреспондент РАН
Африканский вирус оказался более актуальным, чем российские
Возбудитель лихорадки — вирус Эбола — впервые был обнаружен в 1976 году во время вспышки болезни в районе реки Эбола, протекающей между тогдашним Заиром (ныне Демократическая Республика Конго) и Суданом.
Если рассмотреть хронику создания вакцины против вируса Эбола и современное состояние дел в этой области в мире и в России, то становится понятным, как это поможет всем нам.
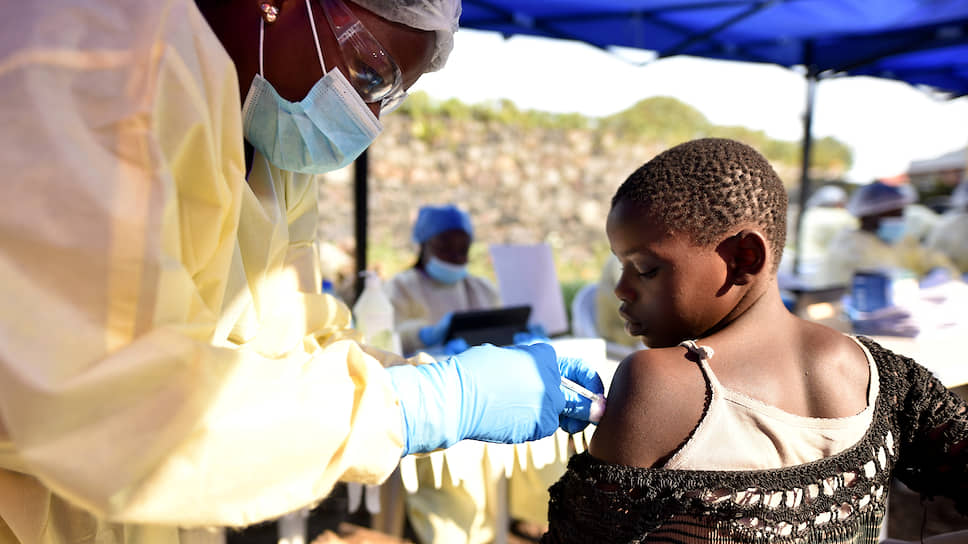
Вирус Эбола был впервые идентифицирован в 1976 году во время крупной вспышки вызванного им заболевания в Судане и тогдашнем Заире (теперь Демократическая Республика Конго; ДРК). Поскольку такие вспышки позднее случались не каждый год и их охват в несколько последующих лет был намного меньше, то ученые ограничились в те времена лишь разработкой иммуноферментных диагностикумов на ее маркеры.
Правда, основные фундаментальные исследования были проведены, в том числе секвенирование генома этого возбудителя, причем российские ученые здесь были одними из первых, включая вашего покорного слугу.
В 1990-е, а особенно в 2000-е годы масштаб и число вспышек заметно увеличились, и некоторые лаборатории в США и Канаде начали разработки и вакцинных препаратов, и средств лечения, а также диагностикумов нового типа на основе полимеразной цепной реакции. Однако для проведения полного цикла доклинических испытаний вакцинных препаратов необходимы весьма значительные средства, а с учетом особой опасности этой инфекции значительную часть таких работ необходимо проводить в лабораториях высшего, четвертого уровня биобезопасности. Ввиду этих причин полного цикла доклинических исследований перспективных, кандидатных, как говорят специалисты, вакцин против Эбола-вирусной инфекции до 2014 года так и не было завершено ни в одной из лабораторий мира.
По самым последним данным, природным резервуаром вируса Эбола вернее всего являются фруктоядные летучие мыши. Три вида таких мышей (Hypsignathus monstrosus, Epomops franqueti и Myonycteris torquata) могут быть носителями вируса без признаков заболевания. Из 24 видов растений и 19 видов позвоночных, экспериментально зараженных вирусом Эбола, удалось заразить только летучих мышей. Причем они не заболели, а просто несли в себе вирус в течение долгого времени. В обследовании в 2002–2003 годах 1030 животных, включая 679 летучих мышей из Габона и Республики Конго, только 13 фруктоядных мышей несли этот вирус. Кроме того, фрагменты вируса Эбола выделяли из тканей некоторых умерших западноафриканских равнинных горилл и центральноафриканских шимпанзе, которые иногда питаются фруктоядными летучими мышами. Что еще более важно, фрагменты РНК вируса Эбола были выявлены у клинически здоровых летучих мышей разных видов. Это означало, что летучие мыши могут быть носителями вируса без признаков заболевания, то есть хроническими носителями. А это и есть главное условие поддержания циркуляции вируса Эбола в природе.
Неожиданная по размаху, месту возникновения и продолжительности вспышка этого заболевания 2014 года в Гвинее, Сьерра-Леоне и Либерии сдвинула ситуацию с места. И уже в конце 2015 года несколько лабораторий и научно-исследовательских институтов в США, Канаде и некоторых других странах объявили о завершении доклинических испытаний нескольких кандидатных, вакцинных препаратов.
О создании прототипной вакцины объявили и у нас в России. Первыми были публикации группы ученых из НИИ эпидемиологии и микробиологии им. Н. Ф. Гамалеи Министерства здравоохранения России о разработке живой вакцины на основе рекомбинантного аденовируса. Однако к этому времени и сама вспышка закончилась, так что испытывать эти вакцины в полевых условиях реальной эпидемии стало негде.
В том же 2018 году, и опять неожиданно, началась вспышка Эбола-вирусной инфекции в ДРК. Как оказалось, один из вакцинных препаратов, разработанный на основе рекомбинантного живого вируса везикулярного стоматита, прошел к этому времени ограниченные клинические испытания в США.
От человека к человеку вирус передается при попадании вируссодержащих жидкостей от больных людей или инфицированных животных на слизистые оболочки или на микротравмы на коже. У больных и умерших концентрация этого вируса в крови и на слизистых оболочках необычайно велика и достигает 10 млн вирусных частиц на 1 мл. Поэтому близкое общение с больным с большой вероятностью приводит к заражению. Наконец, уже выздоровевший человек может нести в себе вирус (в семени мужчин, в грудном молоке женщин) до одного года после выздоровления.
Фото: Артем Геодакян / ТАСС
Производит сейчас этот препарат под названием Ervebo всемирно известный фармгигант MSD (Merck, Sharp and Dohme). Вследствие этого Всемирная организация здравоохранения совместно с правительством ДРК приняли решение о начале клинических испытаний данной вакцины прямо в очаге инфекции.
В настоящее время выявлено пять таксономических видов вируса Эбола, которые отличаются друг от друга процентом летальности. Штаммы вида Заир, которые и циркулируют сейчас в Демократической Республике Конго, самые опасные — со смертностью до 80%.
К настоящему времени, по данным сайта promedmail.org, этой вакциной привито уже более 250 тыс. человек из числа контактных лиц. По имеющимся данным, ни один из вакцинированных не заболел. Однако вспышку пока остановить не удалось, поскольку она развивается в зоне военного межплеменного конфликта, и даже просто находиться там опасно: были случаи убийств местных и иностранных врачей, да и противодействие вакцинации части населения тоже имеет место.
Между тем американская же компания Johnson & Johnson довела до клинических испытаний другую, двухкомпонентную вакцину на основе рекомбинантных аденовируса и вируса осповакцины, производящих при инъекции в организм антигенно значимые белки вируса Эбола. И в середине ноября эта вакцина также была разрешена ВОЗ для проведения полевых испытаний в ДРК, которые в ноябре же и начались.
В России за последнее десятилетие не было ни одного больного эболавирусной инфекцией. В то же время за эти же годы у нас в стране были десятки тысяч больных другими, домашними вирусными инфекциями (ветряная оспа, ротавирус, респираторно-синцитиальный вирус, метапневмовирус, вирусы парагриппа и другие) и сотни умерших от них.
Может, пора вспомнить про эти патогены и начать, наконец, разработки и производство вакцин против них, гораздо более актуальных для России инфекций?
Неожиданно, но ускорять работу над вакциной не стоит.

Научно‑популярное издание о том, что происходит в науке, технике и технологиях прямо сейчас.
Десятки биотехнологических компаний и научных институтов наперегонки с пандемией создают разные варианты вакцин от нового коронавируса SARS‑CoV‑2. Разбираемся, какие технологии используют для их разработки, сколько времени пройдёт до момента, когда от COVID‑19 можно будет делать прививки, и сможет ли будущая вакцина остановить пандемию.
Каждый раз, когда человечество сталкивается с новой инфекцией, одновременно стартуют три гонки: за лекарством, тест‑системой и вакциной. На предыдущей неделе в России начались Научный центр Роспотребнадзора начал испытания вакцины против нового коронавируса испытания антикоронавирусной вакцины на животных, а в США — уже на людях NIH clinical trial of investigational vaccine for COVID‑19 begins . Значит ли это, что победа над эпидемией близка?
По данным ВОЗ, около 40 лабораторий в мире заявили DRAFT landscape of COVID‑19 candidate vaccines – 20 March 2020 о том, что ведут разработку вакцин против коронавируса. И несмотря на то, что среди них есть явные лидеры — например, китайская компания CanSino Biologics, которая получила RECOMBINANT NOVEL CORONAVIRUS VACCINE (ADENOVIRUS TYPE 5 VECTOR) APPROVED FOR CLINICAL TRIAL разрешение на испытания на людях, и американская Moderna, которая их уже начала, — сейчас сложно предсказать, какая из компаний победит в этой гонке, а главное — обгонит ли разработка вакцин распространение коронавируса. Успех в этом забеге зависит не в последнюю очередь от выбора оружия, то есть от принципа, на котором построена вакцина.
Мёртвый вирус — плохой вирус
Разделяй и вакцинируй

Вирус табачной мозаики
Голые гены
Этот метод довольно новый, в мире ещё нет вакцин, которые работали бы по такому принципу.
Превратности и хитрости
Как только вакцины из теоретических разработок превращаются в объект исследований, препятствия и ограничения начинают расти, как грибы. И финансирование — только одна из проблем. По словам Карповой, в МГУ уже есть образец вакцины, но для дальнейших испытаний понадобится сотрудничество с другими организациями. На следующем этапе они планируют проверять безопасность и иммуногенность, и это можно сделать в стенах университета. Но как только потребуется оценить эффективность вакцины, то придётся работать с патогеном, а это в учебном заведении запрещено.

Существование вируса гриппа было доказано именно в экспериментах на хорьках, они же до сих пор служат моделью для многих вирусных болезней / NIMR London / Flickr
Есть несколько этапов, на которых процесс можно ускорить. Самый очевидный — разработка. Американская компания Moderna вырвалась вперёд, потому что давно занимается созданием мРНК‑вакцин. И чтобы сделать ещё одну, им оказалось достаточно расшифрованного генома нового вируса. Российские коллективы из Москвы и Казани тоже не первый год работают над своей технологией и опираются на результаты испытаний своих предыдущих вакцин от других болезней.
Идеальным вариантом была бы платформа, которая позволяет быстро создавать новую вакцину по шаблону. Подобные планы вынашивают, в том числе, исследователи из МГУ.
Следующий этап — доклинические испытания, то есть работа с лабораторными животными. Это не самый долгий процесс, но за его счёт можно выиграть, если совместить с клиническими испытаниями на людях. Именно это сделала Moderna — компания ограничилась быстрой проверкой на безопасность и сразу перешла к исследованиям на людях. Однако стоит помнить, что препарат, который она пробует, относится к самым безопасным. Поскольку Moderna не использует ни вирусы, ни рекомбинантные белки, то очень невелик шанс, что у добровольцев возникнут побочные эффекты — иммунной системе просто не на что агрессивно реагировать. Худшее, что может произойти, — вакцина окажется неэффективной. Но это ещё предстоит проверить.
А нужна ли вакцина?
Стоит ли сокращать клинические испытания — вопрос спорный. Во‑первых, это сам по себе процесс небыстрый. Во многих случаях вакцину нужно вводить в несколько этапов: если вирус не размножается сам по себе внутри организма, то он быстро выводится, и его концентрация оказывается недостаточной Avian Influenza A Virus Pandemic Preparedness and Vaccine Development , чтобы вызвать серьёзный иммунный ответ. Поэтому даже простая проверка эффективности займёт не меньше нескольких месяцев, а за безопасностью вакцины для здоровья добровольцев врачи собираются следить целый год.
Во‑вторых, COVID‑19 — тот самый случай, когда ускорять испытания на людях многим кажется нецелесообразным.
Таким образом, разработчики вакцин всегда находятся в неудобной ситуации. Пока вируса нет, вакцину создать практически невозможно. Как только вирус появился, оказывается, что это необходимо было сделать позавчера. А когда он отступает, то производители теряют своих клиентов.
Тем не менее вакцину необходимо сделать. Этого не произошло во время предыдущих вспышек коронавирусных инфекций — и MERS, и SARS слишком быстро закончились, и исследования лишились финансирования. Но если случаев SARS в мире не наблюдалось с 2004 года, то последний случай MERS датируют 2019 годом, и никто не может гарантировать, что вспышка не повторится. Кроме того, вакцина от предыдущих инфекций может стать стратегической платформой для разработки будущих вакцин.
Читайте также:


