Рга для идентификации вирусов
Для выявления (индикации) вирусов применяются следующие методы.
Индикация вирусов в культуре клеток осуществляется, прежде всего, по цитопатическому действию (ЦПД) вирусов, сроки и характер которого зависят от свойств вируса, проявляясь дегенеративными изменениями клеток с последующей их гибелью и отслаиванием от стекла (рис. 29).
Полная дегенерация клеток сопровождается значительными изменениями в виде пикноза ядра и цитоплазмы, отслаиванием клеточного монослоя от стекла.
Частичная дегенерация культур клеток может протекать по следующим типам:
- гроздеобразования (округление, увеличение и слияние клеток с образованием гроздевидных скоплений, типично для аденовирусов),
- очаговой деструкции (очаги пораженных клеток на фоне в целом сохранившегося монослоя), характерной для вирусов гриппа;
- симпластообразования (слияние клеток с образованием гигантских многоядерных клеток в виде симпластов или синцитиев, характерных для вирусов кори, паротита, парагриппа, респираторно-синцитиального, герпеса, иммунодефицита человека).
Пролиферативный тип ЦПД с трансформацией клеток в злокачественные, обладающие неограниченными потенциями к росту, способны вызывать онкогенные вирусы.
Сроки, в течение которых наступает ЦПД, вариабельны (например, 1-2 дня у полиовирусов, 7-14 суток у аденовирусов).


А б
Рис. 29. Культура клеток почек обезьян (а – незараженная, б – цитопатическое действие вируса) х 200
Индикация вирусов с помощью реакции гемадсорбции (РГад).
Сущность этой реакции заключается в способности эритроцитов человека или животных адсорбироваться на поверхности клеток, инфицированных рядом вирусов (например, орто и парамиксовирусов и др.) в ранние сроки их репродукции (до развития ЦПД) в результате действия гемагглютининов – гликопротеидов, входящих в состав суперкапсида вируса. Для постановки РГад в культуру клеток добавляют 0,2 мл 0,5%-й взвеси эритроцитов, выдерживают 15-20 мин при температуре 4 0 , 20 0 или 37 0 С в зависимости от свойств вируса, после чего взвесь эритроцитов удаляют и производят учет реакции под малым увеличением микроскопа по скоплению эритроцитов на отдельных клетках или на всем монослое.
Индикация вирусов по цветной пробе.
Принцип метода основан на определении кислых продуктов метаболизма, накаливающихся в клетке в процессе ее жизнедеятельности с помощью индикатора фенолового красного, меняющего свой цвет с красного в щелочной среде на оранжево-желтый в кислой среде. При заражении культуры клеток вирусами, вызывающими ЦПД (например, аденовирусы, энтеровирусы и др.), метаболизм клеток подавляется, рН среды не меняется и она остается окрашенной в красный цвет.
Индикация вирусов по внутриклеточным включениям.
Репродукция некоторых вирусов (оспы, герпеса, бешенства) приводит к образованию внутриклеточных включений, локализующихся в цитоплазме или в ядре клеток и представляющих собой скопления вируса (или его антигенов). Включения выявляют путем световой микроскопии культур клеток, окрашенных по Романовскому - Гимзе или другими методами, а также с помощью прямого флюорохромирования (например акридиновым оранжевым) с последующей микроскопией препаратов в люминесцентном микроскопе.
Индикация вирусов с помощью прямой РИФ – выявлениевирусных антигенов, находящихся в инфицированной клетке культуры ткани, с помощью антител диагностической иммунной сыворотки, специфических иммуноглобулинов или моноклональных антител, меченых флюорохромом, обычно флюоресцеином (рис. 30).
Индикация вирусов с помощью электронно-микроскопического метода (ЭММ) применяется, в основном, в научных исследованиях. Материал для ЭММ концентрируют различными методами (ультрацентрифугирование, хроматография на колонках, адсорбцией с помощью специальных сорбентов или антител – для метода иммунной электронной микроскопии). ЭММ позволяет обнаружить в ядре или цитоплазме клеток отдельные вирионы, а также их скопления. В практических целях ЭММ может быть полезен для индикации и идентификации вирусов с типичной морфологией (оспенные вирусы, ротавирусы, коронавирусы, ВИЧ и т.д.).
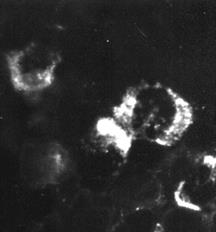
Рис. 30. Реакция иммунофлюоресценции (РИФ) – выявление вирус-специфических антигенов. х 900
Индикация вирусов по образованию бляшек - очагов разрушенных вирусом монослоя культуры клеток под агаровым покрытием. Количество бляшек отражает инфекционную активность вируса.
Для постановки этой пробы вирусную суспензию в разных разведениях вносят в культуры ткани, находящиеся в плоских сосудах, после чего монослой клеток заливают гелем (слой агара или бентонита с индикатором нейтральным красным). Время бляшкообразования для большинства вирусов, обладающих ЦПД, варьирует от 36 до 48 ч. Бляшки выглядят в виде неокрашенных светлых пятен на розово-красном фоне окрашенного монослоя. В бентонитовом методе монослой клеток молочного цвета, бляшки прозрачные.
Зараженные РКЭ инкубируют в термостате при 35- 37 0 С в течение 48 -72 ч., после чего производят их вскрытие, амниотическую и аллантоисную жидкость отсасывают шприцем, а оболочки и эмбрион извлекают и помещают в стерильные чашки Петри. При репродукции некоторых вирусов (натуральной оспы, осповакцины, простого герпеса) на ХАО куриных эмбрионах появляются характерные бляшки - беловатые пятна диаметром 1-2 мм, количество которых соответствует числу инфекционных частиц.
В аллантоисной и амниотической жидкости зараженных эмбрионов ряд вирусов (например, ортомиксовирусы, парамиксовирусы, аденовирусы и т.д.) может быть выявлен с помощью реакция гемагглютинации (РГА). Принцип реакции состоит в способности гемагглютининов - поверхностных вирусных структур гликопротеидной природы этих вирусов склеивать (агглютинировать) эритроциты определенных видов животных, птиц или человека. РГА не относится к иммунологическим реакциям, поскольку в ее основе отсутствует взаимодействие АГ и AT.
Гемагглютинационный титр (максимальное разведение вирусосодержащей жидкости, вызывающее агглютинацию эритроцитов - одна гемагглютинирующая единица вируса,1 ГЕ) соответствует концентрации вируса. Агглютинацию эритроцитов могут вызывать также некоторые бактерии (стафилококки, эшерихии, сальмонеллы, шигеллы, холерный вибрион Эль-Тор), что необходимо учитывать при трактовке результатов РГА при исследовании вирус-содержащего материала, загрязненного бактериальной микрофлорой.
Определение титра вирусов можно проводить также на хорионаллантоисной оболочке.Для этого в лунки стерильных полистироловых пластин помещают кусочки скорлупы 11-12-дневного куриного эмбриона с неповрежденной ХАО, добавляют вирусосодержащую жидкость в десятикратных разведениях на буфере, накрывают пластины фольгой и инкубируют при 35-37 0 С в течение 24-72 часов. После этого скорлупу удаляют, добавляют 0,5% взвесь куриных эритроцитов и производят учет реакции по эффекту гемагглютинации, который свидетельствует о репродукции вируса.
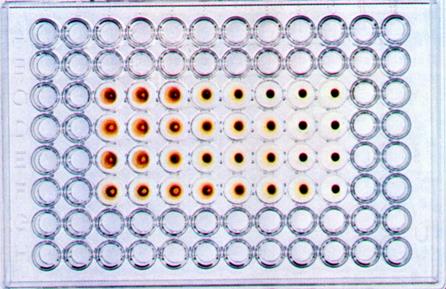
Рис. 31. Реакция гемагглютинации для выявления вируса гриппа в хорион-аллантоисной жидкости куриного эмбриона.
Индикация вирусов в организме лабораторных животных находится в зависимости от вируса и вида чувствительного лабораторного животного, будет описана в лабораторной диагностике конкретных вирусных инфекций.
Идентификация вирусов проводится с помощью следующих методов .
Учет вирусиндуцированных патологических изменений в чувствительных живых системах.
Изучение антигенных свойств вирусов в серологических реакциях с противовирусными сыворотками является основным методом идентификации вирусов. Для этого используют ряд иммунологических реакций.
Реакция нейтрализации основана на способности антител нейтрализовать инфекционную активность вирусов в культурах ткани, РКЭ, чувствительных лабораторных животных. Из вирус-содержащего материала готовят десятикратные разведения и добавляют к ним специфическую сыворотку в разведении в соответствии с титром, указанным на этикетке ампулы. Смеси вирус-сыворотка инкубируют 30 — 60 мин при 37 °С для обеспечения связывания антигенов с антителами, после чего смесью заражают культуру ткани, куриные эмбрионы или лабораторных животных. Контролем является чувствительная биосистема, зараженная вирусом без сыворотки.
Реакция считается положительной в случае нейтрализации ЦПД в культуре клеток, а также при отсутствии патологических изменений в куриных эмбрионах или в организме животных. По результатам РН высчитывается индекс нейтрализации (ИН - отношение титра вируса в контроле к титру вируса в опыте). При ИН менее 10 реакция расценивается как отрицательная, от 11 до 49 — сомнительная, от 50 и выше — положительная.
РН может быть поставлена в наиболее чувствительном варианте - подавления вирусного бляшкообразования под действием вирусспецифической антисыворотки. Для этого к вирус-содержащему материалу добавляют соответствующую искомому вирусу антисыворотку и после инкубации в термостате при 37 0 С течение 30-60 мин смесь вносят в культуру чувствительных клеток. Бляшкообразование выявляют в слое агара или бентонита. Идентичность вируса антителам сыворотки проявляется подавлением бляшкообразования.
Другим вариантом РН является цветная проба. Положительный результат пробы в случае соответствия вируса противовирусным антителам проявляется блокадой репродукции вируса, клетка при этом остается жизнеспособной, вырабатывая кислые продукты метаболизма, под влиянием которых цвет индикатора (фенолового красного) меняется с красного на желтый. Для постановки пробы в пробирки вносят по 0,25 мл рабочего разведения вируса и соответствующую антисыворотку.
Смесь выдерживают при комнатной температуре 30-60 мин, добавляют в каждую пробирку по 0,25 мл клеточной суспензии и закрывают их резиновыми пробками. Пробирки инкубируют в термостате при 37 0 С 6-8 дней, результаты реакции учитывают по изменению цвета индикатора (красный цвет индикатора соответствует щелочному характеру рН - 7,4 указывая на репродукцию вируса и подавление метаболизма клеток; желтый цвет свидетельствует о кислом рН - ниже 7,2 в результате нейтрализации вируса антителами и активном метаболизме клеток с выработкой кислых продуктов обмена).
Перед постановкой РТГА сыворотки обрабатывают периодатом калия, каолином, бентонитом, ацетоном или другими веществами для удаления неспецифических ингибиторов гемагглютинации. После этого к двукратным разведениям сыворотки добавляют равное количество вируссодержащей жидкости с активностью 4 ГЕ, смесь инкубируют 30-60 мин при оптимальной для данного вируса температуре (4 0 , 20 0 , 37 0 С), а затем добавляют равный объем 0,5-1,0% взвеси эритроцитов. Смесь снова инкубируют 30-45 мин и производят учет результатов реакции. Титром сыворотки считают ее наибольшее разведение, которое вызывает торможение гемагглютинации.
Реакция торможения гемадсорбции (РТГадс) основана на нейтрализации эффекта адсорбции эритроцитов на поверхности клеток, инфицированных вирусами, способными вызывать гемадсорбцию. Для постановки реакции по 0,2 мл специфической сыворотки, разведенной 1:5, вносят в пробирки, инкубируют 30-60 мин в термостате при оптимальной для данного вируса температуре, затем добавляют по 0,2 мл 0,5% взвеси эритроцитов. Контрольные пробы содержат неиммунную сыворотку и эритроциты. Пробирки снова инкубируют 20-30 мин, после чего производят учет реакции. Идентификация вируса основывается на признаке отсутствия адсорбции эритроцитов на клетках в присутствии иммунной сыворотки при наличии гемадсорбции в контрольных пробирках.
Для антигенной идентификации вирусов в клетках культур тканей используются также РПГ, РСК, РИФ, РОПГА ИФА, РИА со специфическими иммунными противовирусными сыворотками или моноклональными AT.
- выявление вирусной НК методами генодиагностики с помощью метода молекулярной гибридизации и ПЦР;
- электронно-микроскопическое изучение вирусов (см. выше).
Работа добавлена на сайт samzan.ru: 2016-03-30
;color:#000000">метод обнаружения и идентификации вирусов, основанный на наличии у некоторых вирусов способности избирательно агглютинировать эритроциты определенных видов животных.
">В основе РГА лежит феномен склеивания эритроцитов, происходящий под влиянием различных факторов. Различают прямую и непрямую гемагглютинацию.
При реакции прямой гемагглютинации происходит склеивание эритроцитов при адсорбции на них определенных антигенов, например вирусов.
">
В серологических исследованиях применяют реакцию торможения прямой гемагглютинации, когда выделенный у больного вирус нейтрализуют специфической иммунной сывороткой, а затем соединяют с эритроцитами. Отсутствие гемагглютинации говорит о соответствии вируса и используемой иммунной сыворотки.
">
Реакция непрямой гемагглютинации (пассивная гемагглютинация) наблюдается в тех случаях, когда к эритроцитам, заранее обработанным (сенсибилизированным) различными антигенами, прибавляют иммунную сыворотку или сыворотку больного, имеющую соответствующие антитела. Происходит специфическое Склеивание эритроцитов, их пассивная гемагглютинация.
">
Реакция непрямой, или пассивной, гемагглютинации по чувствительности и специфичности превосходит другие серологические методы, и ее используют при диагностике инфекций, вызванных бактериями, риккетсиями, простейшими.
;color:#323232">РГА используется для индикации (обнаружения) вирусов при проведении ориентировочной диагностики, для титрования вирусов по гемагглютинирующим свойствам (установление гемагглютинирующих единиц - АЕ).
;color:#323232">Основу феномена агглютинации, вызываемого вирусами, составляет адсорбция вирусов на поверхности эритроцитов, сопровождающаяся склеиванием (агглютинацией) последних и выпадением в осадок.
;color:#000000">Антиген для РГА
;color:#323232">В качестве антигена для РГА берут любой материал (патматериал в виде суспензии из органов, материал из зараженных КЭ, культур ткани и др.), в котором предполагается наличие вируса. Материал должен быть жидким, без крупных частичек.
;color:#000000">Постановка ориентировочной РГА
;color:#323232">Для постановки ориентировочной РГА на чистое и хорошо обезжиренное предметное стекло наносят одну каплю вирусосодержащего материала, к ней добавляют одну каплю 5% взвеси эритроцитов и перемешивают стеклянной палочкой.
;color:#000000">Оценка реакции РГА
;color:#323232">Оценивают реакцию в крестах (плюсах).
При оценке реакции в крестах обращают внимание на характер осадка. Если эритроциты осели тонким слоем равномерно по дну пробирки (в виде зонтика), реакцию оценивают в четыре креста
;color:#000000">2. Реакция торможения гемагглютинации серологическая реакция, основанная на способности антител предотвращать агглютинацию эритроцитов гемагглютинирующими видами вирусов (аденовирусами, арбовирусами, некоторыми энтеровирусами, вирусами гриппа и парагриппа, кори, реовирусами). Специфические антивирусные антитела взаимодействуют с поверхностными молекулами гемагглютининов вирионов этих вирусов и блокируют их связывание с комплементарными им молекулами мембраны эритроцитов.
;color:#000000">В последнее время реакция широко используется в лабораториях клинической вирусологии для определения титров специфических антител к тем или иным вирусам, а также для серологической идентификации и типирования изолятов вирусов из клинического материала от больных. Используют несколько ограничено в силу наличия в сыворотке крови людей неспецифических ингибиторов вирусов, а также естественных антител агглютининов.
;color:#8b4513">Реакция торможения гемагглютинации
;color:#000000">метод идентификации вируса или выявления противовирусных антител в сыворотке крови больного, основанный на феномене отсутствия агглютинации эритроцитов препаратом, содержащим вирус, в присутствии иммунной к нему сыворотки крови.
;color:#000000">Реакция торможения гемагглютинации. Механизм и практическое использование.
;color:#000000">Многие вирусы обладают способностью агглютинировать эритроциты строго определенных видов млекопитающих и птиц. Так, вирусы гриппа и эпидемического паротита агглютинируют эритроциты кур, морских свинок, человека, а аденовирусы эритроциты крыс, мышей. В связи с этим для их обнаружения в материале больных или культурах клеток, эмбрионов и животных ставят реакцию гемагглютинации (РГА). Для этого в лунках планшетов готовят двукратно возрастающие разведения вируссодержащих материалов и жидкостей, добавляя к ним отмытые изотоническим раствором взвеси NaCl эритроцитов. Для контроля спонтанной агглютинации эритроциты смешивают ещё с равным объемом изотонического раствора NaCl. Смеси инкубируют в термостате при температуре 37°С или при комнатной температуре.
;color:#000000">Являясь группоспецифической, РГА не дает возможности определить видовую принадлежность вирусов. Их идентифицируют с помощью реакции торможения гемагглютинации (РТГА). Для ее постановки используют заведомо известные иммунные противовирусные сыворотки, которые в двукратно снижающихся концентрациях разводят в изотоническом растворе натрия хлорида и разливают по лункам. К каждому их разведению добавляют равное количество вируссодержащей жидкости. Контролем является взвесь вируса в изотоническом растворе натрия хлорида. Планшеты со смесью сывороток и вируса выдерживают в термостате 30 мин или при комнатной температуре 2 ч, затем в каждую из них добавляют взвесь эритроцитов. Спустя 30 мин определяют титр вируснейтрализующей сыворотки (т.е. максимальное ее разведение), вызвавшей задержку агглютинации эритроцитов.
;color:#000000">Используют РТГА в серологической диагностике вирусных болезней, в частности гриппа и аденовирусных инфекций. Ставить ее лучше так же, как и РН, с парными сыворотками. Четырехкратное нарастание титра антител во второй сыворотке подтверждает предполагаемый диагноз
;color:#000000">3. Серологическое исследование позволяет поставить диагноз в случае обнаружения специфических антител в сыворотке больных. Для серологических реакций используют парные сыворотки, которые берут в первые дни от начала заболевания и спустя 1 - 3 недели, но изучают одновременно. Диагностическое значение имеет нарастание титра антител в 4 раза и более. РТГА, РН, РСК, РТГадс, РИФ, РИА, ИФА ставят с антигенами ( диагностикума-ми), приготовленными из эталонных штаммов соответствующих вирусов.
;color:#000000">4. ;color:#000000;background:#ecffe1">Парные - это значит, что кровь дважды берут с каким-то интервалом времени. По нарастанию титра антител определяют, что заражение произошло. Если титр антител не меняется, значит, эти антитела в организме уже давно, свежего заражения нет.
">
Наибольшую диагностическую ценность представляет исследование парных сывороток, взятых от животных в начале и в конце заболевания (с промежутком в 14-21 день). Сыворотку отбирают в стерильные пробирки и хранят для исследования.
">Набор для диагностики парвовирусной болезни свиней предназначен для обнаружения парвовирусного антигена в суспензии внутренних органов абортированных плодов в реакции гемагглютинации (РГА) и специфических антител в сыворотке крови свиней, а также новорожденных поросят (до приема молозива) в реакции торможения гемагглютинации (РТГА).
">Реакцию ставят микрометодом в лунках полистироловых пластин.
- ">полистироловые 96-луночные планшеты для иммунологических реакций;
- ">антиген специфический инактивированный, обладающий гемагглютинирующей активностью не ниже 1:128;
- ">сыворотка специфическая, обладающая активностью в РТГА не ниже 1:256;
- ">сыворотка нормальная (отрицательный контроль).
">Время проведения анализа:
">РГА 2,5-3,5 часа, РТГА 3,5-4,5 часа (не учитывая время подготовки материалов для исследования).
">Реакция гемагглютинации (РГА) основана на склеивании взвешенных в жидкости эритроцитов под воздействием гемагглютинирующих свойств вируса и образования рыхлого осадка в виде зонтика. Сущность РТГА заключается в нейтрализации гемагглютинирующих свойств вируса специфическими антителами, содержащимися в сыворотке крови, в результате чего не происходит склеивания эритроцитов и они оседают на дно, образуя плотный осадок в виде пуговки.
">Набор хранят в сухом, защищенном от света месте при температуре от 2 до 8°С.
">После растворения компоненты набора можно хранить в замороженном состоянии в течение 1 месяца, повторное замораживание не допускается.
;color:#333333;background:#cccccc">Эритроциты (или частицы латекса) с адсорбированными на них антигенами взаимодействуют с соответствующими антителами сыворотки крови, что вызывает склеивание и выпадение эритроцитов на дно пробирки или ячейки в виде фестончатого осадка. При отрицательной реакции эритроциты оседают в виде пуговки.
;color:#0000ff">Реакцию агглютинации ;color:#000000"> можно проводить в микроварианте в ячейках 96-луночного планшета для иммунологических исследований с коническим дном. В лунки планшета вносят по 0,05 мл ФСБ (рН 7,2-7,4) и готовят двукратные разведения испытуемых сывороток крови от 1:2 и выше. Затем в каждую ячейку вносят по 0,005 мл суспензии грибных клеток в концентрации 100 тыс. грибных клеток в 1 мл. Планшет осторожно встряхивают и выдерживают 2 часа в термостате при 37°С, а затем 16-18 часов - при 4°С. В качестве отрицательного контроля используют нормальную (негативную) сыворотку крови и ФСБ.
;color:#000000">Результаты реакции учитывают с помощью микроскопа и визуально и определяют в крестах по следующей схеме:
;color:#000000">(++++) - полное просветление жидкости и образование агглютината на дне лунки в виде перевернутого "зонтика", при встряхивании "зонтик" разбивается на хлопья;
;color:#000000">(+++) - неполное просветление жидкости и хорошо выраженный "зонтик";
;color:#000000">(++) - заметное просветление жидкости, "зонтик" выражен умеренно;
;color:#000000">(+) - едва заметное просветление жидкости, "зонтик" выражен слабо;
;color:#000000">(-) - отрицательный результат, просветление жидкости не наступило, на дне лунки осадок в виде пуговки, при легком встряхивании образуется равномерная взвесь.
;color:#000000">За титр антител принимали последнее разведение испытуемой сыворотки, в котором произошла агглютинация не менее чем в два креста (++).

Узнать стоимость написания работы -->
Материалы собраны группой SamZan и находятся в свободном доступе
| Культивирование вирусов в организме чувствительных животных | Культивирование вирусов на куриных эмбрионах | Культивирование вирусов в культурах клеток |
| Животные: взрослые или новорожденные (белые мыши, хомяки, кролики, обезьяны и др); Способы заражения: подкожно, внутримышечно, интраназально, интрацеребрально и т.д.) | Куриные эмбрионы 5-12 дневные; Заражают в: · Амниотическую полость · Аллантоисную полость · Желточный мешок · Эмбрион · На хорион-аллантоисную мембрану | Для приготовления культур клеток используют: 1.Эмбриональные ткани человека и животного; 2. Клетки злокачественных образований; 3. Нормальные ткани человека, обезьян и др. животных. |
| Методы индикации: u Клиническая картина u Патоморфологические изменения в органах и тканях, u Реакция гемагглютинации (РГА) с суспензией органов. Недостатки: видовая невосприимчивость животных ко многим вирусам человека, контаминация животных посторонними микробами, экономические и этические. | Методы индикации: u Гибель эмбриона u Специфические поражения оболочек и тела эмбриона (бляшки, оспины, кровоизлияния) u Реакция гемагглютинации (РГА). Недостатки: многие вирусы не размножаются в эмбрионах птиц. | Методы индикации: u Цитопатогенного действия (ЦПД), u Образование внутриклеточных включений, u Реакция гемадсорбции, u Реакция гемагглютинации, u Цветная реакция, u Бляшкообразование. |
| Методы идентификации (типирования) РН, РГА | Методы идентификации (типирования) РН (в т.ч. РТГА), РСК | Методы идентификации (типирования) РН (в т.ч. РТГА), РСК, РИФ |
*Индикациявирусовлабораторный процессустановления присутствия неидентифицированныхвирусовв иссл.материале или в системе культивированиявирусов.
Условия выращивания клеточных культур:
u Соблюдение правил асептики;
u Использование лабораторной посуды из нейтрального стекла или специальных реакторов;
u Использование сложных питательных сред (среда 199, Игла), содержащих минеральные соли, аминокислоиты, витамины, глюкозу, сыворотку крови животных и человека, буферные растворы для поддержания рН;
u Добавление антибиотиков к питательной среде;
u Соблюдение оптимальной температуры (36 – 38,5 С) роста клеток
Типы клеточных культур
n Однослойныекультуры клеток – клетки прикрепляются и размножаются в виде монослоя на поверхности химически
нейтрального стекла;
n Суспензионныекультуры клеток – клетки размножаются во всем объеме питательной среде;
n Органныекультуры – цельные кусочки органов и тканей.
Однослойные клеточные культуры: по числу генераций различают:
n Первичные культуры– способны размножаться только в первых генерациях, т.е. выдерживают не более 5-10 пассажей после выделения из тканей.
n Перевиваемыеили стабильные культуры – способны размножаться в лабораторных условиях десятки лет.
n Полуперевиваемые культуры– выдерживают 40-50 пассажей.
Вироиды и прионы. Пролиферация прионов. Прионные болезни.
Близкие к вирусам инфекционные агенты если:
1. только НК = вироид,
2. только белок = прион.
Терминология
Вироиды это - инфекционные агенты, состоящие только из кольцевой РНК. Вироиды это лишенные оболочки небольшие молекулы кольцевой, обычно одноцепочечной РНК. Вироиды способны автономно инфицировать клетки хозяина.
Прионы - особый класс инфекционных агентов, представленных белками с аномальной третичной структурой и не содержащих нуклеиновых кислот.
Пролиферация патологических прионов: превращение прионов в измененные формы происходит при нарушении кинетически контролируемого равновесия между ними. Процесс усиливается при возрастании количества патологического (РгР) или экзогенного приона. РгР является нормальным белком, заякоренным в мембрану клетки. РгР' - глобулярный гидрофобный белок, образующий агрегаты с собой и с РгР'' на поверхности клетки: в результате РгР' преобразуется в РгР'' и далее цикл продолжается. Патологическая форма РгР''' накапливается в нейронах, придавая клетке губкообразный вид.
Нозологические формы прионных болезней человека:
n болезнь Крейтцфельдта-Якоба (БКЯ)
n Куру
n синдром Герстманна-ШтреусслераШейнкера (СГШШ)
n фатальная семейная инсомния (ФСИ)
7. Общая характеристика и строение бактериофагов. Этапы взаимодействия вирулентного фага с бактерией-хозяином.
8. Умеренные бактериофаги: особенности, репродукция. Лизогения и лизогенная конверсия.
9. Применение бактериофагов в медицине.


Папиллярные узоры пальцев рук - маркер спортивных способностей: дерматоглифические признаки формируются на 3-5 месяце беременности, не изменяются в течение жизни.
Поперечные профили набережных и береговой полосы: На городских территориях берегоукрепление проектируют с учетом технических и экономических требований, но особое значение придают эстетическим.
ИДЕНТИФИКАЦИЯ ВИРУСОВ (позднелат. identificare отождествлять; вирусы) — определение родовой и видовой принадлежности вирусов, установление их тождественности или отличия при сопоставлении с уже известными вирусами.
И. в. является заключительным этапом при лабораторной диагностике вирусных заболеваний; широко проводится также при эпидемиол, исследованиях и при работе в области теоретической вирусологии.
И. в. осуществляется путем изучения их морфологии, физ.-хим. свойств, биол, особенностей и антигенной структуры; ее проводят на основе существующей классификации вирусов. При И. в. сначала определяют их принадлежность к определенной классификационной группе. Если группа представляет собой семейство, дополнительно определяют род вируса (напр., принадлежность изучаемого пикорнавируса к энтеро- или риновирусам). Далее устанавливают вид вируса, а для видов, подразделяющихся на типы (напр., вирусы полиомиелита, гриппа), также их тип.
Групповая принадлежность вируса обусловливается видом входящей в его состав нуклеиновой к-ты и ее мол. весом, местом формирования (сборки) капсида в клетке, числом капсомеров, видом симметрии нуклеокапсида, наличием или отсутствием оболочки, липидов, размерами вириона. Практически для И. в. обычно достаточно определения лишь нескольких, наиболее важных из перечисленных показателей.
После установления рода определяют вид вируса (а для определенных вирусов также тип) путем изучения его антигенной структуры с помощью иммунных сывороток к типичным представителям различных видов (и типов) вирусов данного рода. Реже с той же целью используют другие методы.
Наиболее сложной является И. в., которые по своим характеристикам не могут быть отнесены ни к одной из существующих классификационных групп. Очень ответственным является заключение, что изучаемый вирус отличен от всех известных; оно может быть сделано лишь после изучения всего комплекса его свойств.
И. в., как правило, проводится после их размножения в лаборатории, поэтому для исследования берутся органы зараженных животных, ткани и жидкости эмбрионов птиц, питательная среда или клетки инфицированных клеточных и тканевых культур. Если вирус не удается культивировать в лабораторных условиях, то для И. в. используют материал, взятый непосредственно от больного или погибшего организма.
Размеры вируса наиболее точно определяют при помощи электронной микроскопии (см.), к-рая одновременно дает возможность получить сведения о структуре вириона. Для электронномикроскопического исследования необходимо иметь высокоочищенный и конц. материал. Для этой цели предпочтительно использовать скоростное центрифугирование в градиенте плотности сахарозы (см. Ультрацентрифугирование), что позволяет не только очистить вирус от балластных веществ, но при наличии в материале нескольких вирусов и разделить их, если они отличаются по величине.
При некоторых вирусных инфекциях с целью быстрой диагностики электронноскопически исследуют материал, взятый без предварительной обработки непосредственно от больного (напр., содержимое пустул для дифференциации оспы и ветрянки). Метод этот находит все более широкое применение при диагностике вирусных инфекций.
Определение размеров вирусов с помощью фильтрации через целлюлозные мембранные фильтры (см. Ультрафильтрация, в вирусологии) является менее точным. Необходимо иметь набор фильтров с различным диаметром пор. Далее для каждого фильтра должен быть определен поправочный коэффициент адсорбции, показывающий соотношение между диаметром пор и максимальным размером вирионов, которые могут через них проходить. С этой целью фильтр калибруют, используя частицы известной величины. Исследуемый материал должен быть освобожден от грубых частиц путем пропускания через стерилизующий фильтр или центрифугирования в течение 10—15 мин. при скорости 2000— 3000 об/мин. Для уменьшения адсорбции вируса предварительно фильтруют какое-либо капиллярноактивное вещество (бульон, р-р пептона и т. п.) или его прибавляют к вирусной взвеси. Фильтрацию материала выполняют последовательно, начиная с наиболее крупнопористого фильтра. Размер вируса получают путем умножения величины пор мембраны, частично его задерживающей, на коэффициент адсорбции для фильтра данной пористости.
Для определения типа входящей в состав вируса нуклеиновой к-ты ее выделяют путем обработки вирусной взвеси водонасыщенным фенолом, анионными детергентами, напр, додецилсульфатом натрия и другими, с последующим хим. анализом. Если вирус размножается в культурах клеток, тип нуклеиновой к-ты часто определяют косвенным методом, который основан на способности галоидопроизводных дезоксиуридина, в частности 5-бром-2-дезоксиуридина, избирательно подавлять размножение ДНК-содержащих вирусов и не влиять на репродукцию большинства РНК-содержащих. Препарат вносят в питательную среду в дозе от 40 до 100 мкг/мл при заражении клеточной культуры вирусом.
Ориентировочные данные о типе нуклеиновой к-ты вирусов можно получить по окраске инфицированных клеток флюорохромами, напр, акридином оранжевым (его используют в разведении 1:10000 — 1:20000 в изотоническом р-ре хлорида натрия с фосфатным буфером pH 7,2—7,4). При соединении с РНК акридин оранжевый флюоресцирует красным, а после реакции с ДНК — зеленым. Этот метод позволяет определить тип нуклеиновой к-ты вирусных компонентов в местах их скоплений внутри клеток. На нем основан метод дифференциальной диагностики ряда респираторных инфекций: делают мазок-отпечаток с нижней носовой раковины больного; после окраски акридином оранжевым внутриклеточные включения вирусов гриппа и парагриппа начинают светиться красным, а при аденовирусной инфекции и герпесе — зеленым.
Наличие или отсутствие в оболочке вирусов липидов устанавливают по чувствительности к действию растворителей липидов, напр, эфира. Вирусную взвесь соединяют с равным объемом эфира, встряхивают в течение 20 мин. при комнатной температуре, затем выдерживают 18—20 час. при t° 4° в плотно закрытой посуде. Далее пробу наливают в чашку Петри и выдерживают для испарения эфира 30 мин. при t° 36—37°, после чего ее титруют параллельно с необработанным материалом для определения количества вируса. При наличии в оболочке вируса липидов он при воздействии эфира инактивируется.
Проведение этих исследований обычно позволяет отнести изучаемый штамм к определенной классификационной группе или к числу неклассифицированных вирусов. Дальнейшую И. в. проводят внутри группы путем их сопоставления с типичными представителями отдельных видов. В ряде случаев исследования внутри группы могут быть ограничены. Так, вирусы семейства пикорна испытывают на устойчивость в кислой среде. Риновирусы при pH 3,0—5,3 в течение 1 — 3 час. инактивируются, в то время как энтеровирусы сохраняют свою инфекционность.
И. в. с помощью серол, реакций проводят путем их испытания с сыворотками к известным вирусам или, наоборот, приготовленные к изучаемым штаммам иммунные сыворотки испытывают с известными вирусами.
Серол, идентификацию нередко осуществляют в два этапа. Сначала вирус изучают в реакции связывания комплемента (см.), или, если он обладает гемагглютинирующей активностью, в реакции торможения гемагглютинации (см.), а затем с помощью реакции нейтрализации. РСК в отношении многих вирусов не является строго специфичной. Так, аденовирусы человека и большинства животных имеют общий комплементсвязывающий антиген. Общий антиген имеют все известные реовирусы. В отношении других вирусов, напр, вирусов гриппа, РСК более специфична и позволяет определить их типовую принадлежность. То же самое относится к РТГА: она позволяет определить тип реовируса и очень специфична в отношении вирусов гриппа, но в то же время дает групповые реакции при идентификации тогавирусов.
Наиболее специфичной является реакция нейтрализации: в большинстве случаев она позволяет установить как видовую, так и типовую принадлежность вируса (для видов, подразделяющихся на типы). Ее осуществляют различными способами. Чаще всего готовят смесь вируса с сывороткой, к-рую затем испытывают тем или иным способом на наличие ненейтрализованного вируса.
Значительно реже И. в. проводят путем перекрестного испытания иммунитета: животных иммунизируют неизвестным вирусом, а затем заражают известным или наоборот.
Весьма широко для И. в. используют иммунофлюоресценцию (см.). Чаще всего инфицированные неизвестным вирусом клеточные культуры исследуют с флюоресцирующим иммуноглобулином к известному вирусу. Реже исследуют т. о. материал от больных (мазки из глотки при гриппе, мозг больных подострым склерозирующим панэнцефалитом на коревой антиген, мозг погибших от бешенства).
Преципитацию в агаре используют для И. в. довольно редко. В материале из кожных поражений больных оспой этим методом можно обнаружить вирусный антиген.
Некоторые виды вирусов пе удается достаточно четко дифференцировать путем изучения их антигенной структуры. В таких случаях прибегают к дополнительным тестам — определяют патогенность для животных, размножение в различных клеточных культурах и др. Т. о., напр., идентифицируют вирусы оспенной группы. Возбудитель натуральной оспы не вызывает поражений на скарифицированной коже кролика и не размножается в культурах клеток при t° выше 38,5°. В то же время вирусы осповакцины и оспы коров вызывают изменения на коже кролика и размножаются при t° до 40°. Отличаются вирусы также по морфологии поражений на хорионаллантоисной оболочке куриного эмбриона.
Библиография: Гайдамович С. Я. Классификация и идентификация арбовирусов, Вестн. АМН СССР, № б, с. 25, 1972; Лабораторная диагностика вирусных и риккетсиозных заболеваний, под ред. Э. Леннета и Н. Шмидт, пер. с англ., М., 1974; Лурия С. и Дарнелл Дж. Общая вирусология, пер. с англ., М., 1970; Соколов М. И., С и н и ц к и й А. А. и P е-м e з о в П. И. Вирусологические и серологические исследования при вирусных инфекциях, Л., 1972.
Читайте также:
- Сделали прививку от бешенства что будет если не делать следующие прививки
- Про вирус от светланы малиновской
- Противовирусные капли для глаз при ветрянке
- Вирусы сем flaviridae вызывают
- Гепатит а помидоры нельзя
 Пожалуйста, не занимайтесь самолечением!При симпотмах заболевания - обратитесь к врачу.
Пожалуйста, не занимайтесь самолечением!При симпотмах заболевания - обратитесь к врачу.

