Рабочая доза вируса это
Титр – это количество вируса, содержащегося в единице объема материала. Из локальных повреждений, вызываемых вирусами, наиболее известны бляшки и оспины на ХАО КЭ. Если имеются данные обратные то инфекционная активность вируса может быть измерена в бляшкообразующих единицах (БОЕ) или оспообразующих единицах (ООЕ) 1БОЕ = дозе вируса, способной вызвать образование одной бляшки, а одна ООЕ – одной оспины. Методы: заражают несколько КК или КЭ на ХАО. Высчитывают среднеарифметическое количество оспин или бляшек. Оно = БОЕ или ООЕ вируса. Рассчитывают сколько БОЕ или ООЕ приходится на единицу объема вируссодержащего материала. Это и есть титр. Т=n/Va, где n-сред арифметическое бляшек или оспин, а –разведение материала, V – введенная доза. Метод 50%-ного инфекционного действия. За единицу количества вируса принимается доза, которая способна вызвать инфекционный эффект у 50% зараженных. Число таких доз в единице материала и будет выражать титр вируса в этом материале. Готовят 10 кратное разведение исследуемого материала, затем одинаковыми дозами заражают равные группы живых тест объектов. Учитывают результат действия и находят в каком разведение вирус проявил свое действие на 50%. Если сразу такое разведение не найдено то оно рассчитывается по формуле Т=lgB – (b-50)/(b-a) *lgd, где В – разведение дающие инфекционный эффект более 50%, b – процент дающий инфекционный эффект более 50%, а – менее 50% d – кратность разведения. За 1ГАЕ принимается такая доза вируса, которая способна агглютинировать примерно 50% эритроцитов содержащихся в том же, что и вирус объеме 1% суспензии отмытых эритроцитов. Готовят ряд последовательных кратных разведений материала и к каждому разведению добавляют 1% суспензию. Реакция оценивается в крестах. Реакция с 2 крестами содержит 1ГАЕ, которая умножается на кратность разведения.
Титр вируса — это количество вируса, содержащееся в единице объема материала. Поскольку количество вируса невозможно выразить в обычно применяемых (объем, масса и т. п.) единицах, прибегают к измерению в единицах действия или единицах активности. Вирусы обладают инфекционным и гемагглютинирующим действием. Отсюда и единицы количества вирусов инфекционные и гемагглютинирующие.
Размерность этих единиц зивисит от соотношения полноценных и неполноценных вирионов в используемой суспензии, объекта, способа титрования и других факторов. В практике нашли применение три типа единиц количества вируса: 1-й — инфекционные единицы локальных повреждений, вызываемых вирусами и оцениваемых по единичному эффекту; 2-й — инфекционные единицы 50%-ного действия вирусов на чувствительные живые объекты, оцениваемые статистически; 3-й — гемагглютинирующие единицы.
Из локальных повреждений, вызываемых вирусами, наиболее известны бляшки в зараженных культурах клеток (островки мертвых клеток в слое живых) и оспины (некротические узелки) на ХАО куриных эмбрионов, зараженных оспенными и некоторыми другими вирусами. В случаях такого проявления инфекционной активности вирусов количество вируса может быть измерено в бляшкообразующих единицах (БОЕ) или оспообразующих единицах (ООЕ). Одна БОЕ равна дозе вируса, способной вызвать образование одной бляшки, а одна ООЕ — одной оспины.
Наиболее универсален метод определения титра вируса в единицах 50%-ного инфекционного действия. По этому методу за единицу количества вируса принимается такая его доза, которая способна вызывать инфекционный эффект у 50 % зараженных тест-объектов. Она обозначается как ЭД50— эффективная 50%-ная доза. Число таких доз вируса в единице объема материала и будет выражать титр вируса в этом материале.
Виды единиц количества вирусов при определении по 50%-ному инфекционному действию
| Тест-объекты | Виды инфекционного действия вирусов | Единицы количества вирусов | |
| названия единиц | сокращение обозначения | ||
| Лабораторные | Гибель | 50%-ная летальная | ЛД50 |
| животные | доза | ||
| То же | Клинические симп- | 50%-ная инфекци- | ИД50 |
| томы или патоло- | онная доза | ||
| гоанатомические | |||
| изменения | |||
| Куриные эмбри- | Гибель | 50%-ная эмбриональ- | элд50 |
| оны | ная летальная | ||
| доза | |||
| То же | Патологоанатоми- | 50%-ная эмбриональ- | эид50 |
| ческие изменения | ная инфекционная | ||
| доза | |||
| Культуры клеток | Цитопатический | 50%-ная цитопати- | ЦПД50 |
| эффект | ческая доза |
В качестве тест-объектов в лабораториях обычно используют белых мышей, куриные эмбрионы и культуры клеток, у которых инфекционное действие вируса может проявляться гибелью, клиническими симптомами, патологоанатомическими изменениями и цитопатическим эффектом. Для каждого вируса подбирают чувствительный к нему тест-объект и форму учета его инфекционного действия, по которой оценивают эффект заражения. В зависимости от вида тест-объекта и формы проявления инфекционного действия ЭД50 принимает один из следующих видов, приведенных в таблице 6.
1 ЛД50—это доза вируса, убивающая 50 % лабораторных животных (обычно белых мышей);
1 ИД50—доза вируса, вызывающая клинические симптомы или патологоанатомические изменения у 50 % зараженных лабораторных животных;
1 ЭЛД — доза вируса, убивающая 50 % куриных эмбрионов;
1 ЭИД50—доза вируса, вызывающая патологоанатомические изменения у 50 % зараженных куриных эмбрионов;
1 ЦПД50— доза вируса, вызывающая цитопатический эффект у 50 % зараженных культур клеток (обычно пробирок с культурами клеток).
Количество ЭД50 (ЛД50, ИД ЭЛД50, ЭИД50 или ЦПД50) вируса, содержащееся в единице объема вируссодержащего материала, и будет выражением титра (Т) вируса в этом материале. Например, Т=10 3,48 ЦПД50/0,1 мл означает, что в каждой 0,1 мл вируссодержащего материала содержится 10 3 ' 48 доз вируса (т. е. более 1000, но менее 10 000, а именно 10 3,48 =3020), каждая из которых способна вызвать цитопатический эффект в 50 % пробирок с культурой клеток.
Названные единицы 50%-ного инфекционного действия вируса (ЛД50, ИД50, ЭЛД50, ЭИД50, ЦПД50) используются в случаях оценки инфекционного действия вируса со статистически оцениваемым эффектом, имеющим место, когда учет инфекционного действия вируса ведется по летальному действию, клиническим симптомам, патологоанатомическим изменениям или цитопатическому действию.
Титрование вирусов по 50%-ному инфекционному действию — наиболее универсальный прием, пригодный для титрования практически любого вируса, если подобрать чувствительную к нему живую систему (текст-объект). Однако этот метод титрования вирусов довольно трудоемкий, длительный и требует статистических расчетов.
Задача определения титра вируса в единицах 50%-ного инфекционного действия (ЛД50, ИД50, ЭЛД50, ЭИД50, ЦПД50) сводится к тому, чтобы найти такое разведение испытуемого вируссодержащего материала, в объеме заражающей дозы которого содержалась бы одна ЭД50, а затем рассчитать, сколько таких единиц вируса содержится в таком же объеме вируссодержащего материала, что и будет показателем титра вируса в этом материале.
Чтобы решить эту задачу, сначала из исследуемого вируссодержащего материала готовят ряд последовательных 10-кратных разведений. 10-кратные разведения берут по двум причинам:
во-первых, как видно из графика зависимости инфекционного эффекта от дозы вируса (рис. 35), кривая этой зависимости вблизи точки, соответствующей ЭД50, на значительном отрезке приближается к прямой.
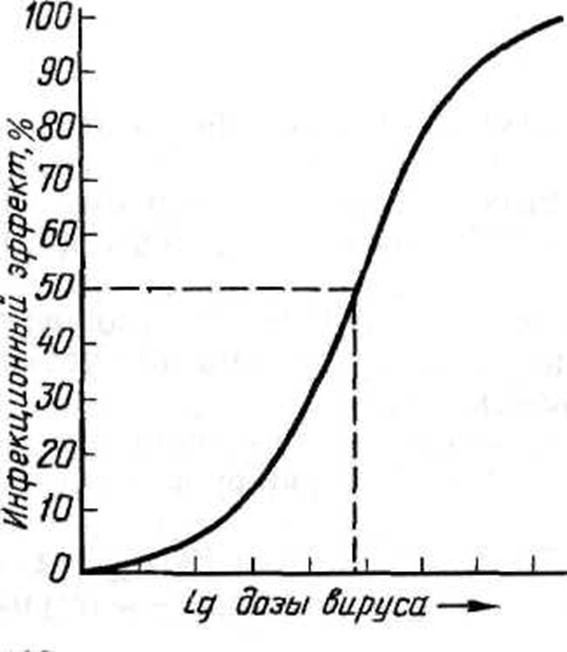
Рисунок 35. График зависимости инфекционного эффекта от дозы вируса
Это означает, что в определенных пределах, центр которых в точке ЭД50, между логарифмом дозы (разведения) вируса и инфекционным эффектом существует прямолинейная зависимость, т. е. величина инфекционного эффекта пропорциональна логарифму дозы вируса (или его разведения), в области малых и особенно больших доз эта зависимость нарушается;
во-вторых, при 10-кратном разведении облегчаются последующие расчеты.
Одинаковыми объемами каждого из 10-кратных разведений исследуемого вируссодержащего материала заражают равные группы чувствительных к данному вирусу живых тест-объектов (мышей, куриных эмбрионов или культур клеток). При этом в каждой группе должно быть не менее 4—6 тест-объектов, так как при меньшем количестве статистически рассчитываемая величина титра вируса будет иметь слишком большую погрешность (статистическая величина тем точнее, чем на большем количестве исходных данных она основана).
После заражения учитывают результат действия вируса (гибель, клинические симптомы, патологоанатомические изменения или ЦПЭ) на зараженные объекты и определяют, в каком разведении вирус проявил свое действие на 50 % чувствительных объектов. Разведение, дающее 50%-ный эффект, рассчитывают методом прямолинейной интерполяции. Когда такое разведение нашли, то считают, что в заражающем объеме вируса, разведенного в найденное (соответствующее 50%-ному эффекту) число раз, содержится 1 ЭД50. В таком же объеме исходного (неразведенного) вируссодержащего материала таких доз (ЭД50) содержится больше во столько раз, во сколько был разведен материал, давший 1 ЭД50. Затем пересчитывают, сколько таких единиц 50%-ного инфекционного действия вируса содержится в единице объема (мл) вируссодержащего материала, что и будет выражением титра вируса в данном материале.
Механическое удерживание земляных масс: Механическое удерживание земляных масс на склоне обеспечивают контрфорсными сооружениями различных конструкций.

Общие условия выбора системы дренажа: Система дренажа выбирается в зависимости от характера защищаемого.


Организация стока поверхностных вод: Наибольшее количество влаги на земном шаре испаряется с поверхности морей и океанов (88‰).
УТВЕРЖДАЮ
Министр здравоохранения Российской Федерации
УТВЕРЖДАЮ
Руководитель Федеральной службы по надзору в сфере защиты прав потребителей и благополучия человека
М.А. Мурашко
А.Ю. Попова
Временные методические рекомендации
ПРОФИЛАКТИКА, ДИАГНОСТИКА И ЛЕЧЕНИЕ НОВОЙ КОРОНАВИРУСНОЙ ИНФЕКЦИИ (2019-nCoV)
Версия 1 (29.01.2020)
Введение
1. Этиология и патогенез…. . 2
2. Эпидемиологическая характеристика…. 4
3. Диагностика коронавирусной инфекции . 6
3.1. Алгоритм обследования пациента с подозрением на новую
коронавирусную инфекцию, вызванную 2019-nCoV…. 6
3.2. Клинические особенности коронавирусной инфекции . 9
3.3. Лабораторная диагностика коронавирусной инфекции . 10
4. Лечение коронавирусной инфекции . 12
4.1. Этиотропная терапия…. 12
4.2. Патогенетическая терапия…. 14
4.3. Симптоматическая терапия . 17
4.4. Особенности клинических проявлений и лечения заболевания у
детей…. 17
4.4.1. Особенности клинических проявлений…. 17
4.4.2. Особенности лечения…. 20
4.5. Терапия неотложных состояний при коронавирусной инфекции…. 24
4.5.1. Интенсивная терапия острой дыхательной недостаточности….
4.5.1.1 Проведение неинвазивной и искусственной вентиляции легких….
4.5.1.2 Проведение экстракорпоральной мембранной оксигенации….
4.5.2. Лечение пациентов с септическим шоком…. 26
5. Профилактика коронавирусной инфекции…. 27
5.1. Специфическая профилактика коронавирусной инфекции…. 27
5.2. Неспецифическая профилактика коронавирусной инфекции…. 28
5.3. Медикаментозная профилактика коронавирусной инфекции…. 30
6. Маршрутизация пациентов и особенности эвакуационных мероприятий больных или лиц с подозрением на новую коронавирусную инфекцию, вызванную 2019-nCoV…. 30
6.1. Маршрутизация пациентов и лиц с подозрением на новую коронавирусную инфекцию, вызванную 2019-nCoV…. 30
6.2. Особенности эвакуационных мероприятий больных или лиц с подозрением на новой коронавирусную инфекцию, вызванную 2019— nCoV, и общие принципы госпитализации больного, подозрительного на заболевание коронавирусной инфекцией . 34
Приложение 1-4. 44
1
ВВЕДЕНИЕ
Появление в декабре 2019 г. заболеваний, вызванных новым коронавирусом (2019-nCoV), поставило перед специалистами в области охраны здравоохранения и врачами трудные задачи, связанные с быстрой диагностикой и клиническим ведением больных c этой инфекцией. В настоящее время сведения об эпидемиологии, клинических особенностях, профилактике и лечении этого заболевания ограничены. Известно, что наиболее распространенным клиническим проявлением нового варианта коронавирусной инфекции является пневмония, у значительного числа пациентов зарегистрировано развитие острого респираторного дистресс— синдрома (ОРДС).
Рекомендации, представленные в документе, в значительной степени базируются на фактических данных, опубликованных специалистами ВОЗ, китайского и американского центра по контролю за заболеваемостью, а также Европейского Центра по контролю за заболеваемостью в материалах по лечению и профилактике этой инфекции.
Методические рекомендации предназначены для врачей лечебно— профилактических учреждений инфекционного профиля, а также врачей— реаниматологов отделений интенсивной терапии инфекционного стационара.
1. ЭТИОЛОГИЯ И ПАТОГЕНЕЗ
Коронавирусы (Coronaviridae) – это большое семейство РНК— содержащих вирусов, способных инфицировать человека и некоторых животных. У людей коронавирусы могут вызвать целый ряд заболеваний – от легких форм острой респираторной инфекции до тяжелого острого респираторного синдрома (ТОРС). В настоящее время известно о циркуляции среди населения четырех коронавирусов (HCoV-229E, -OC43, -NL63 и —
HKU1), которые круглогодично присутствуют в структуре ОРВИ, и, как правило, вызывают поражение верхних дыхательных путей легкой и средней тяжести.
По результатам серологического и филогенетического анализа коронавирусы разделяются на три рода: Alphacoronavirus, Betacoronavirus и Gammacoronavirus. Естественными хозяевами большинства из известных в настоящее время коронавирусов являются млекопитающие.
До 2002 года коронавирусы рассматривались в качестве агентов, вызывающих нетяжелые заболевания верхних дыхательных путей (с крайне редкими летальными исходами). В конце 2002 года появился коронавирус (SARS-CoV), возбудитель атипичной пневмонии, который вызывал ТОРС у людей. Данный вирус относится к роду Betacoronavirus. Природным резервуаром SARS-CoV служат летучие мыши, промежуточные хозяева – верблюды и гималайские циветты. Всего за период эпидемии в 37 странах по миру зарегистрировано более 8000 случаев, из них 774 со смертельным исходом. С 2004 года новых случаев атипичной пневмонии, вызванной SARS-CoV, не зарегистрировано.
В 2012 году мир столкнулся с новым коронавирусом MERS (MERS— CoV), возбудителем ближневосточного респираторного синдрома, также принадлежащему к роду Betacoronavirus. Основным природным резервуаром коронавирусов MERS-CoV являются верблюды. С 2012 года зарегистрировано 2494 случая коронавирусной инфекции, вызванной вирусом MERS-CoV, из которых 858 закончились летальным исходом. Все случаи заболевания географически ассоциированы с Аравийским полуостровом (82% случаев зарегистрированы в Саудовской Аравии). В настоящий момент MERS-CoV продолжает циркулировать и вызывать новые случаи заболевания.
Новый коронавирус 2019-nCoV (временное название, присвоенное Всемирной организацией здравоохранения 12 января 2020 года) представляет собой одноцепочечный РНК-содержащий вирус, относится к семейству Coronaviridae, относится к линии Beta-CoV B. Вирус отнесен ко II группе патогенности, как и некоторые другие представители этого семейства (вирус SARS-CoV, MERS-CoV).
Коронавирус 2019-nCoV предположительно является рекомбинантным вирусом между коронавирусом летучих мышей и неизвестным по происхождению коронавирусом. Генетическая последовательность 2019— nCoV сходна с последовательностью SARS-CoV по меньшей мере на 70%.
Патогенез новой коронавирусной инфекции изучен недостаточно. Данные о длительности и напряженности иммунитета в отношении 2019— nCoV в настоящее время отсутствуют. Иммунитет при инфекциях, вызванных другими представителями семейства коронавирусов, не стойкий и возможно повторное заражение.
2. ЭПИДЕМИОЛОГИЧЕСКАЯ ХАРАКТЕРИСТИКА
Пути передачи инфекции: воздушно-капельный (при кашле, чихании, разговоре), воздушно-пылевой и контактный. Факторы передачи: воздух, пищевые продукты и предметы обихода, контаминированные 2019-nCoV.
Установлена роль инфекции, вызванной2019-nCoV, как инфекции, связанной с оказанием медицинской помощи. По состоянию на 23.01.2020 в одной из больниц г. Ухань выявлено 15 подтвержденных случаев заболевания среди врачей, контактировавших с больными 2019-nCoV.
Стандартное определение случая заболевания новой коронавирусной инфекции 2019-nCoV
Подозрительный на инфекцию, вызванную 2019-nCoV, случай:
— наличие клинических проявлений острой респираторной инфекции, бронхита, пневмонии в сочетании со следующими данными эпидемиологического анамнеза:
— посещение за последние 14 дней до появления симптомов эпидемиологически неблагополучных по 2019-nCoV стран и регионов (главным образом г. Ухань, Китай);
— наличие тесных контактов за последние 14 дней с лицами, находящимися под наблюдением по инфекции, вызванной новым коронавирусом2019-nCoV, которые в последующем заболели;
— наличие тесных контактов за последние 14 дней с лицами, у которых лабораторно подтвержден диагноз 2019-nCoV.
Вероятный случай инфекции, вызванной 2019-nCoV:
— наличие клинических проявлений тяжелой пневмонии, ОРДС, сепсиса в сочетании с данными эпидемиологического анамнеза (см. выше).
Подтвержденный случай инфекции, вызванной 2019-nCoV:
1.Наличие клинических проявлений острой респираторной инфекции, бронхита, пневмонии в сочетании с данными эпидемиологического анамнеза (см. выше).
2. Положительные результаты лабораторных тестов на наличие РНК 2019-nCoV методом ПЦР.
3. ДИАГНОСТИКА КОРОНАВИРУСНОЙ ИНФЕКЦИИ
3.1. АЛГОРИТМ ОБСЛЕДОВАНИЯ ПАЦИЕНТА С ПОДОЗРЕНИЕМ НА НОВУЮ КОРОНАВИРУСНУЮ ИНФЕКЦИЮ, ВЫЗВАННУЮ 2019-NCOV
Диагноз устанавливается на основании клинического обследования,
данных эпидемиологических анамнеза и результатов лабораторных исследований.
1. Подробная оценка всех жалоб, анамнеза заболевания,
эпидемиологического анамнеза. При сборе эпидемиологического анамнеза обращается внимание на посещение в течение 14 дней до первых симптомов, эпидемически неблагополучных по 2019-nCoV стран и регионов (в первую очередь г. Ухань, Китай), наличие тесных контактов за последние 14 дней с лицами, подозрительными на инфицирование2019-nCoV, или лицами, у которых диагноз подтвержден лабораторно.
2. Физикальное обследование, обязательно включающее:
— оценку видимых слизистых оболочек верхних дыхательных путей,
— аускультацию и перкуссию легких,
— пальпацию лимфатических узлов,
— исследование органов брюшной полости с определением размеров печени и селезенки,
— термометрию,
с установлением степени тяжести состояния больного.
3. Лабораторная диагностика общая:
-выполнение общего (клинического) анализа крови с определением уровня эритроцитов, гематокрита, лейкоцитов, тромбоцитов, лейкоцитарной формулы;
-биохимический анализ крови (мочевина, креатинин, электролиты, печеночные ферменты, билирубин, глюкоза, альбумин). Биохимический анализ крови не дает какой-либо специфической информации, но обнаруживаемые отклонения могут указывать на наличие органной дисфункции, декомпенсацию сопутствующих заболеваний и развитие осложнений, имеют определенное прогностическое значение, оказывают влияние на выбор лекарственных средств и/или режим их дозирования;
-исследование уровня С-реактивного белка (СРБ) в сыворотке крови. Уровень СРБ коррелирует с тяжестью течения, распространенностью воспалительной инфильтрации и прогнозом при пневмонии;
— пульсоксиметрия с измерением SpO2 для выявления дыхательной недостаточности и оценки выраженности гипоксемии. Пульсоксиметрия является простым и надежным скрининговым методом, позволяющим выявлять пациентов с гипоксемией, нуждающихся в респираторной поддержке и оценивать ее эффективность;
— пациентам с признаками острой дыхательной недостаточности (ОДН) (SрO2 менее 90% по данным пульсоксиметрии) рекомендуется исследование газов артериальной крови с определением PaO2, PaCO2, pH, бикарбонатов, лактата;
— пациентам с признаками ОДН рекомендуется выполнение коагулограммы с определением протромбинового времени, международного нормализованного отношения и активированного частичного тромбопластинового времени.
4. Лабораторная диагностика специфическая:
4. ЛЕЧЕНИЕ КОРОНАВИРУСНОЙ ИНФЕКЦИИ
Настоящие методические указания устанавливают методы определения показателей качества иммунобиологических препаратов для профилактики и диагностики гриппа с целью установления их эффективности и безопасности.
Методические указания предназначены для специалистов органов и учреждений государственной санитарно-эпидемиологической службы и организаций, осуществляющих определение показателей качества иммунобиологических препаратов для профилактики и диагностики гриппа.
Целью введения настоящих методических указаний является регламентация методов определения показателей качества противогриппозных препаратов на их соответствие требованиям нормативных документов.
Методические указания содержат описание общих методов определения показателей качества противогриппозных препаратов. Особенности методов оценки качества противогриппозных препаратов, не охватываемые настоящим документом, описаны в документах на эти препараты.
Задачей проведения контроля является установление эффективности и безопасности противогриппозных препаратов.
3.1 . Метод постановки реакции торможения гемагглютинации (РТГА) с вирусом гриппа (макрометод)
Реакцию торможения гемагглютинации применяют для установления типа и подтипа вируса, т.е. специфичности, а также для определения нарастания титров специфических антител.
Постановка РТГА включает следующие этапы работы: приготовление взвеси эритроцитов, определение гемагглютинирующего титра антигена в РГА и рабочей дозы вируса, постановка самой реакции.
Для постановки реакции необходимы следующие ингредиенты:
• антиген (вакцина, вируссодержащая жидкость - аллантоисная или культуральная);
• иммунные сыворотки к различным вирусам гриппа;
• буферно-солевой раствор рН 7,2 ± 0,2 (Na -фосфатный буфер 0,01 М с 0,16 M NaCl );
• взвесь куриных эритроцитов, 1 %.
3.1.1 . Приготовление взвеси куриных эритроцитов
Для постановки РТГА используют эритроциты петухов. Кровь у петухов берут из сердца или подкрыльцовой вены.
Свежеполученную от 3 - 5 петухов кровь помещают во флакон со стеклянными бусами или же с одним из антикоагулянтов (раствор Альсевера, 5 %-ный раствор лимонно-кислого натрия). Дефибринирование крови проводят немедленно путем интенсивного встряхивания флакона в течение 5 - 7 мин при температуре (20 ± 2) °C до выпадения волокон фибрина.
Дефибринированную кровь фильтруют через 4 слоя марли, затем трехкратно отмывают буферно-солевым раствором (на 1 объем крови - 4 объема буферно-солевого раствора) путем центрифугирования при (800 ± 200) об/мин в течение (15 ± 5) мин. Надосадочную жидкость удаляют. Из осадка, принимаемого за 100 %, готовят 1 %-ную суспензию куриных эритроцитов с помощью фотоколориметрирования на ФЭК-56.
3.1.2 . Приготовление 1 %-ной суспензии куриных эритроцитов с помощью фотоколориметрирования
Для получения стандартных концентраций эритроцитарных суспензий рекомендуется использовать фотометрический метод, позволяющий определять их концентрацию по величине оптической плотности. Основанием для этого служит наличие линейной зависимости между оптической плотностью и концентрацией эритроцитов в определенном интервале концентраций - от 0,15 до 1,00 %.
Величину оптической плотности для 1 %-ной суспензии куриных эритроцитов определяют экспериментально, в ряду нескольких (
20) параллельных проб с последующим вычислением среднеарифметической величины, принимаемой за исходный показатель оптической плотности.
3.1.3 . Определение показателя оптической плотности 1 %-ной суспензии куриных эритроцитов
Для приготовления одной пробы отбирают градуированной пипеткой 0,2 мл осадка эритроцитов в емкость, содержащую 19,8 мл буферно-солевого раствора; содержимое тщательно перемешивают, заполняют им объем прямоугольной кюветы фотоколориметра (толщина слоя = 1 мм) и немедленно измеряют оптическую плотность суспензии при длине волны λ = 540 нм.
В качестве контрольного раствора используют дистиллированную воду, предварительно заполняя ею объем второй такой же кюветы ФЭК.
3.1.4 . Приготовление 1 %-ной суспензии куриных эритроцитов по показателю оптической плотности
Готовят требуемое количество суспензии куриных эритроцитов несколько большей, чем 1 %-ной концентрации. Добавлением буферно-солевого раствора рН 7,2 ± 0,2 к полученной суспензии и измерением оптической плотности ее на ФЭК доводят концентрацию суспензии до такой, показатель оптической плотности которой равен величине, определенной ранее (п. 3.1.2).
Примечание. Поскольку значение оптической плотности суспензии эритроцитов может изменяться в зависимости от качества эритроцитов (на что влияет сезон года, климатические условия, состояние и возраст животных и т.п.), а также зависит от технических характеристик измерительного прибора (ФЭК), величину оптической плотности 1 %-ной суспензии куриных эритроцитов следует определять периодически (1 раз в 3 - 4 месяца) и на одном и том же приборе.
3.1.5 . Определение гемагглютинирующего титра антигена
В лунках плексигласовой планшеты готовят двукратные разведения антигена в объеме 0,4 мл на буферно-солевом растворе, начиная с 1:10 до 1:1280. В каждую лунку вносят по 0,4 мл 1 %-ной суспензии эритроцитов. Содержимое лунок перемешивают встряхиванием планшеты и оставляют при температуре (20 ± 2) °C на 40 - 45 мин (до оседания эритроцитов в контроле, см. ниже).
Реакцию оценивают по четырехкрестовой системе. За титр антигена, или одну агглютинирующую единицу (1 АЕ), принимают наибольшее разведение антигена, дающее четко выраженную агглютинацию эритроцитов (3 или 4 креста).
Определение титра антигена сопровождается отрицательным контролем на отсутствие спонтанной агглютинации эритроцитов. С этой целью в контрольную лунку той же плексигласовой доски вносят 0,4 мл буферно-солевого раствора и 0,4 мл 1 %-ной суспензии эритроцитов. При отсутствии спонтанной агглютинации на дне лунки выпадает гомогенный с ровными краями осадок эритроцитов (отрицательная реакция).
В РТГА рабочей дозой является то разведение антигена, в 0,2 мл которого содержится 4 агглютинирующие единицы (4 АЕ). Для вычисления ее следует установленную величину титра антигена разделить на 8. Полученная от деления цифра указывает, во сколько раз нужно развести антиген, чтобы в 0,2 мл его содержалось 4 АЕ (рабочая доза).
Перед постановкой основного опыта проверяют точность приготовления рабочей дозы (4 АЕ). Для этого в пять лунок горизонтального ряда плексигласовой доски, начиная со второй, вносят по 0,2 мл буферно-солевого раствора. В 1-ю и 2-ю лунки добавляют по 0,2 мл приготовленной рабочей дозы антигена. После перемешивания переносят 0,2 мл смеси из 2-й лунки в 3-ю, из 3-й - в 4-ю, из 4-й - в 5-ю, из 5-й лунки 0,2 мл удаляют. Затем в каждую лунку добавляют по 0,2 мл буферно-солевого раствора и по 0,4 мл 1 %-ной суспензии куриных эритроцитов. В 6-й лунке ставят контроль на отсутствие спонтанной агглютинации эритроцитов (см. выше). После встряхивания смесь оставляют при температуре (20 ± 2) °C на 40 - 45 мин (до оседания эритроцитов в контроле).
При правильном выборе рабочей дозы полная (++++) агглютинация эритроцитов должна наблюдаться только в первых трех лунках. В 4-й и 5-й лунках агглютинация должна отсутствовать. В случае отклонения от указанного выше разведение антигена должно быть изменено путем добавления соответствующего количества антигена или буферно-солевого раствора для получения необходимой рабочей дозы. При этом необходимо повторно проверить правильность приготовления рабочей дозы.
3.1. 7 . Постановка реакции торможения гемагглютинации
Сыворотки, используемые в РТГА, могут содержать неспецифические ингибиторы гемагглютинации. Поэтому для их удаления перед постановкой РТГА сыворотки необходимо обработать нейраминидазой холерных вибрионов (см. примеч.).
После удаления неспецифических ингибиторов готовят двукратные разведения сывороток в лунках плексигласовой доски, начиная с 1:10 до 1:640 и выше в объеме 0,2 мл. К каждому разведению сыворотки добавляют по 0,2 мл рабочей дозы антигена (4 АЕ). Смесь встряхивают, оставляют при температуре (20 ± 2) °C на 30 мин, затем в каждую лунку добавляют по 0,4 мл 1 %-ной суспензии куриных эритроцитов. Смесь повторно встряхивают, оставляют при температуре (20 ± 2) ° C в течение 40 - 45 мин (до оседания эритроцитов в контроле), после чего производят учет результатов реакции (п. 4.1.6).
При наличии специфических антител в сыворотке наступает задержка агглютинации эритроцитов. За титр сыворотки принимают предельное разведение, вызывающее полную задержку гемагглютинации.
Задержка гемагглютинации указывает на соответствие типа антигена и взятой сыворотки; отсутствие задержки гемагглютинации свидетельствует о несоответствии типа взятой сыворотки.
Препарат считают специфичным, если он не реагирует в РТГА с гетерологичной сывороткой.
Удаление неспецифических ингибиторов гемагглютинации из иммунных сывороток с помощью нейраминидазы холерных вибрионов.
При наличии инструкции по применению нейраминидазы необходимо следовать требованиям, изложенным в данном документе.
Метод основан на способности нейраминидазы холерных вибрионов, не действуя на специфические антитела, разрушать ингибиторы гемагглютинации к вирусам гриппа A и B в сыворотках крови человека, кур, крыс, кролика.
Содержимое ампулы (1 мл лиофилизированного препарата нейраминидазы холерных вибрионов) растворяют в 1 мл дистиллированной воды, тщательно перемешивают.
Готовят рабочее разведение препарата в буферно-солевом растворе, равное 1:50. В разведенном виде препарат хранят в холодильнике при температуре (4 ± 20) °C не более 3 суток.
К 0,1 мл цельной сыворотки добавляют 0,5 мл нейраминидазы в рабочем разведении 1:50.
Смесь ставят на 18 ч в термостат при (36 ± 0,5) °C.
Смесь прогревают при (56 ± 10) °C в водяной бане в течение 1 ч.
К смеси (сыворотка плюс нейраминидаза) добавляют 0,4 мл буферно-солевого раствора, чтобы получить разведение сыворотки 1:10.
Сыворотка, обработанная нейраминидазой, может быть использована для РТГА в течение 2 недель при условии хранения ее при температуре (5 ± 1) °C.
Приготовление буферно-солевого раствора рН 7,2 ± 0,2 (0,01 М Na-фосфатный буфер, содержащий 0,15 M NaCl):
• 26,8 г двузамещенного натрия Na 2 HPO 4 · 7 H 2 O растворяют в дистиллированной воде и объем в мерной колбе доводят до 1 л (0,1 М Na 2 HPO 4 );
• 13,8 г однозамещенного натрия NaH 2 PO 4 · Н2О растворяют в дистиллированной воде и объем в мерной колбе доводят до 1 л (0,1 М NaH 2 PO 4 );
• к 720 мл 0,1 М раствора Na 2 HPO 4 добавляют 280 мл 0,1 М раствора NaH 2 PO 4 ; pH такого раствора должен быть равным 7,2 ± 0,05;
• 100 мл полученного 0,1 М Na-фосфатного буфера разбавляют дистиллированной водой до 1 л и добавляют 8,5 г хлористого натрия (NaCl); pH полученного раствора - 7,2 ± 0,05. Если рН выше или ниже требуемого, добавляют 1 N раствор НСl или 1 N раствор NaOH, соответственно.
Приготовление раствора Альсевера
• 0,42 % натрия хлорида;
• 0,8 % натрия цитрата;
• 100,0 мл бидистиллированной воды.
Реакцию среды раствора доводят с помощью 5 %-ной лимонной кислоты до рН от 6,15 до 5,60 (примерно 10 мл кислоты на 1 л раствора). Стерилизуют фильтрацией или автоклавированием в течение 3 последовательных дней при 100 ° C и 0,7 атм. Для консервирования добавляют на 1 мл крови 1,2 мл раствора Альсевера.
В этом виде эритроциты можно хранить при (4 ± 2) °C в течение 1 - 2 недель. Перед употреблением их необходимо трехкратно отмыть буферно-солевым раствором с помощью центрифугирования при (800 ± 200) об./мин в течение 10 мин.
Приготовление консервирующего раствора 5 %-ного натрия цитрата
Перед употреблением 5 %-ный раствор цитрата натрия на дистиллированной воде разводят в 2 раза буферно-солевым раствором и к одной части полученного раствора натрия цитрата добавляют 2 части крови. В этом консерванте эритроциты можно хранить при (4 ± 2) °C в течение 3 - 5 суток.
3.2 . Метод постановки реакции торможения гемагглютинации (РТГА) с вирусом гриппа (микрометод)
Принцип метода, его учет и ингредиенты для реакции, проводимой микрометодом, те же, что и для проведения РТГА макрометодом. Изменяются только концентрации и объемы ингредиентов.
3.2.1 . Приготовление 0,5 %-ной взвеси эритроцитов петуха
Взвесь готовят из 1 %-ной суспензии эритроцитов (см. макрометод) разведением ее в 2 раза (т.е. в соотношении 1:1) буферно-солевым раствором.
3.2.2 . Определение гемагглютинирующего титра антигена
В каждую лунку микропанели вносят буферно-солевой раствор в объеме 50 мкл. Затем в первую лунку вносят 50 мкл антигена в разведении 1:10 и далее проводят титрование по принципу двукратного разведения. Из последней лунки удаляют 50 мкл. Затем в каждую лунку вносят по 50 мкл 0,5 %-ной суспензии эритроцитов. Содержимое лунок перемешивают встряхиванием и оставляют при комнатной температуре (20 ± 2) °C на 40 - 45 мин до оседания эритроцитов в контроле (см. ниже).
Реакцию оценивают по четырехкрестовой системе. За титр антигена или одну агглютинирующую единицу (1 АЕ) принимают наибольшее разведение антигена, дающее четко выраженную агглютинацию эритроцитов на 3 или 4 креста.
Определение титра антигена сопровождается постановкой отрицательного контроля на отсутствие спонтанной агглютинации эритроцитов. В качестве отрицательного контроля служат несколько лунок панели, в которые вместо антигена внесен буферно-солевой раствор.
Рабочая доза антигена при постановке РТГА микрометодом равна 8 ГАЕ. Для ее приготовления гемагглютинирующий титр делят на 16. Полученная цифра означает, во сколько раз необходимо развести антиген.
Пример. Титр антигена равен 1:160. Разделив 160 на 16, получаем цифру 10, указывающую, что антиген необходимо развести в 10 раз.
Перед постановкой основного опыта проверяют точность приготовления рабочей дозы (8 АЕ). Для этого в шесть лунок микропанели, начиная со второй, вносят по 25 мкл буферно-солевого раствора. В 1-ю и 2-ю лунки добавляют по 25 мкл приготовленной рабочей дозы антигена. После перемешивания смеси 25 мкл ее объема переносят из 2-й лунки в 3-ю, из 3-й - в 4-ю и т.д. Из последней лунки панели 25 мкл удаляют. Затем во все лунки добавляют по 25 мкл буферно-солевого раствора и по 50 мкл 0,5 %-ной суспензии эритроцитов. После встряхивания смесь оставляют при температуре (20 ± 2) °C на 40 - 45 мин до оседания эритроцитов в контроле.
При правильном выборе рабочей дозы агглютинация эритроцитов должна наблюдаться только в четырех лунках панели. В остальных лунках агглютинация должна отсутствовать. В случае отклонения от указанного результата добавляют антиген или буферно-солевой раствор для получения необходимой рабочей дозы.
3.2.4 . Постановка реакции торможения гемагглютинации
Постановка реакции микрометодом соответствует описанному для макрометода, за исключением объемов используемых ингредиентов реакции.
Готовят двукратные разведения сыворотки в объеме 25 мкл, вносят рабочую дозу антигена (8 АЕ) в объеме 25 мкл и после контакта антигена и сыворотки (от 30 мин до 1 ч) при температуре (20 ± 2) °C в каждую лунку панели вносят по 50 мкл 0,5 %-ной взвеси эритроцитов. После оседания эритроцитов в контроле (как правило, через 40 - 45 мин) проводят учет результатов.
За титр активности принимают разведение сыворотки, при котором отсутствует агглютинация эритроцитов.
Определение проводят на развивающихся куриных эмбрионах 10 - 12-дневного возраста.
Десятикратные разведения вируса (вакцины) готовят в 4,5 мл буферно-солевого раствора рН от 7,4 до 7,0, меняя при каждом разведении пипетку.
Вводят в аллантоисную полость 0,2 мл вируссодержащей жидкости из разведений от 10 -5 до 10 -7 (разведения могут меняться в зависимости от целей исследования и предполагаемой инфекционной активности вируса), используя на каждое разведение по 4 эмбриона. Для заражения эмбрионов используют разные шприцы или проводят заражение одним шприцем, начиная с большего разведения.
Эмбрионы инкубируют при температуре 35 °C в течение 48 ч для вируса гриппа (вакцины) типа A и 72 ч для вируса гриппа (вакцины) типа В. По истечении срока инкубации отдельно из каждого эмбриона отбирают по 0,4 - 0,5 мл аллантоисной жидкости, которую помещают в 4 отдельные лунки плексигласовой доски. Затем в каждую лунку добавляют по 0,4 - 0,5 мл 1 %-ной суспензии куриных эритроцитов. Через 30 - 40 мин контакта при температуре (20 ± 2) °C, после оседания эритроцитов в контроле, проводят учет гемагглютинации.
Контроль проводят, как описано выше, но вместо аллантоисной жидкости из куриного эмбриона в свободные 4 лунки панели вносят по 0,4 - 0,5 мл буферно-солевого раствора рН 7,2 ± 0,2.
Вычисление биологического титра проводят по методу Рида и Менча.
Метод основан на логической предпосылке, что тканевая культура или животное, погибшие при заражении их каким-либо разведением вируса, погибнут и при заражении любым более низким разведением.
Пример подсчета показан ниже.
Подсчет 50 %-ной дозы (ТЦД50) по методу Рида и Менча
Читайте также:


