Прогноз эффективность терапии хронического гепатита с

Journal of Clinical and Experimental Hepatology. March 2018
Исследование проведено в Индии: Dayanand Medical College, Ludhiana, Punjab.
Внедрение противовирусных препаратов прямого действия (ПППД) быстро изменило методики лечения вируса гепатита C (ВГС) за последние несколько лет. Благодаря более высокой эффективности, безопасности и меньшим побочным эффектам, чем схемы базируемые на интерфероне, ПППД стали стандартом для терапии ВГС.
Различные клинические испытания показали высокие показатели стойкого вирусологического ответа (УВО) после лечения ПППД. В III фазе исследования (ION-1), включавшем в себя лечение 1 генотипа у пациентов с циррозом или без него, комбинированная терапия с помощью Sofosbuvir (SOF) и Ledipasvir (LDV) независимо от рибавирина (RBV) достигала УВО в диапазоне 97-99 %. Показатели УВО увеличились до 99% в обеих группах, когда продолжительность лечения была увеличена до 24 недель. У пациентов с 4 генотипом в исследовании SYNERGY было установлено, что показатель УВО составляет 95% для схемы SOF / LDV + RBV.
Было отмечено, что у пациентов с 3 генотипом относительно низкий уровень ответа. Так в III фазе исследования ALLY-3, применение SOF и Daclatasvir (DCV) без RBV пациенты ранее не проходившие терапию без цирроза получали показатели УВО 97% и 58% у пациентов с циррозом или имевшим опыт неудачного лечения. В исследовании ALLY 3+ проводилась терапия пациентов с развитым фиброзом (METAVIR F3) и циррозом независимо от предыдущего опыта лечения по схеме SOF+DCV+RBV в течение 12 и 16 недель. Показатели УВО у пациентов с развитым фиброзом составляли 100% как после 12, так и после 16 недель терапии, в тоже время пациенты с циррозом имени показатели УВО 83% и 88% при 12- и 16-недельной терапии соответственно.
Поскольку клинические испытания проводятся в контролируемых условиях, полученные результаты не могут быть прямо перенесены на реальные условия. Эффективность препаратов в реальных условиях зависит от многочисленных факторов: соблюдение режима приема лекарств, побочные эффекты приводящие к прекращению приема, характер питания и многих других. Настоящее исследование было проведено для оценки эффективности и безопасности ПППД и оценки воздействия терапии в реальных условиях штата Пенджаб (Индия).
Пациенты и терапия
Терапию проходили большая группа пациентов, в том числе с циррозом, включая тех, кто ранее имел опыт неудачного лечения на основе интерферона. Также были включены пациенты, у которых были совместные инфекции с вирусами гепатита В (ВГВ) или вирусами иммунодефицита человека (ВИЧ). Пациентам с хроническим заболеванием почек не предлагали терапию, поскольку во время проведения данного исследования отсутствовала информация о безопасности ПППД для данной группы пациентов. Другими критериями исключения были прогрессирующее заболевание печени (Child-Turcotte-Pugh CTP> 13 или MELD> 20), тромбоз воротной вены и пациенты с гепатоцеллюлярной карциномой (HCC).
Все пациенты были тщательным образом обследованы. Уровень и соотношение антитела ВГС определяли с помощью ELISA (ELISCAN HCV, RFCL Limited, India), количественную оценку РНК ВГС и определение генотипа в режиме реального времени проводили с помощью RT-PCR (COBAS TaqMan HCV Test 2.0, Roche Diagnostics Corporation, Indianapolis, IN, USA). Также был проведен полный анализ крови, биохимические анализы печени и почек, функции щитовидной железы, индекс протромбинового времени, уровень глюкозы в крови натощак, α-фетопротеин и ультразвуковое исследование органов брюшной полости. Цирроз печени был диагностирован на основании клинических, лабораторных, радиологических, эндоскопических и/или гистологических критериев. В данном исследовании показатели плотности печени более 14,6 кПа (FibroScan®, Echosens, Франция) представляют собой цирроз. Оценки CTP и MELD были рассчитаны для всех пациентов с циррозом.
В работе использовались руководство Европейской ассоциации изучения печени (EASL) от 2015 г. Нарушения режима приема препаратов не было в случае, если противовирусные препараты не пропускались в течение двух или более дней подряд. Перечень препаратов для каждого пациента был рассмотрен и согласован двумя независимыми специалистами-консультантами, которые проверили возможное фармакологическое взаимодействие терапии на основе ПППД с другими лекарственными препаратами до начала лечения. Всем пациентам рекомендовалось прекратить применение ингибиторов протонной помпы и проконсультироваться со специалистом перед началом любого другого лечения для оценки потенциального воздействия и взаимного влияния.
| Пациент | Опыт лечения | 1 и 4 генотип | 3 генотип |
| Хронический гепатит | ранее не лечился | SOFa/LDVb 12 недель | SOFa + DCVc 12 недель |
| неудачный опыт предыдущего лечения | SOFa/LDVb 12 недель | SOFa + DCVc + RBVd 12 недель | |
| SOFa + DCVc for 24 weeks if contraindications for use of RBV | |||
| Компенсированный цирроз (CTP A) | ранее не лечился | SOFa/LDVb 12 недель | SOFa + DCVc + RBVd 24 недели |
| неудачный опыт предыдущего лечения | SOFa/LDVb + RBVd for 24 weeks if negative predictors of response | ||
| Декомпенсированный цирроз (CTP B, C up to 12 points) | SOFa/LDVb + RBVd 12 недель | SOFa + DCVc + RBVd 24 недели | |
| SOFa/LDVb for 24 weeks (if contraindications to use of RBV) |
Сокращения:
SOF — Sofosbuvir 400 mg;
LDV — Ledipasvir 90 mg;
DCV — Daclatasvir 60 mg;
RBV — Ribavirin 200 mg. a + b — фиксированная дозировка раз в сутки; a + c — одна таблетка ежедневно; d — RBV согласно массе тела.
Это исследование было одобрено Советом по Медицине и проведено в Медицинском колледже Даянанда на базе государственной клиники Лудхиана (Индия).
Оценка эффективности
Эффективность лечения контролировали спустя 4 недели, в конце терапии (12 или 24 недели) и через 12 недель после окончания лечения для оценки быстрого вирусологического ответа (RVR), завершения ответа на лечение (ETR) и УВО соответственно. Негативный ответ был определен как неспособность достичь ETR, прорыв как появление РНК ВГС в любой момент во время лечения после того как РНК во время терапии была необнаруживаемой, а вирусологический рецидив в случае необнаруживаемой РНК ВГС в конце лечения, но ее обнаружение спустя 12 недель.
Пациенты регулярно наблюдались и следили за любыми неблагоприятными факторами которые могли возникнуть во время физического обследования, клинических и лабораторных исследований. Для пациентов, которым были назначены режимы на основе RBV, контролировали гемоглобин в соответствии с CTCAE, а дозировку постепенно уменьшали на 200 мг каждую неделю, если уровень Hb составлял 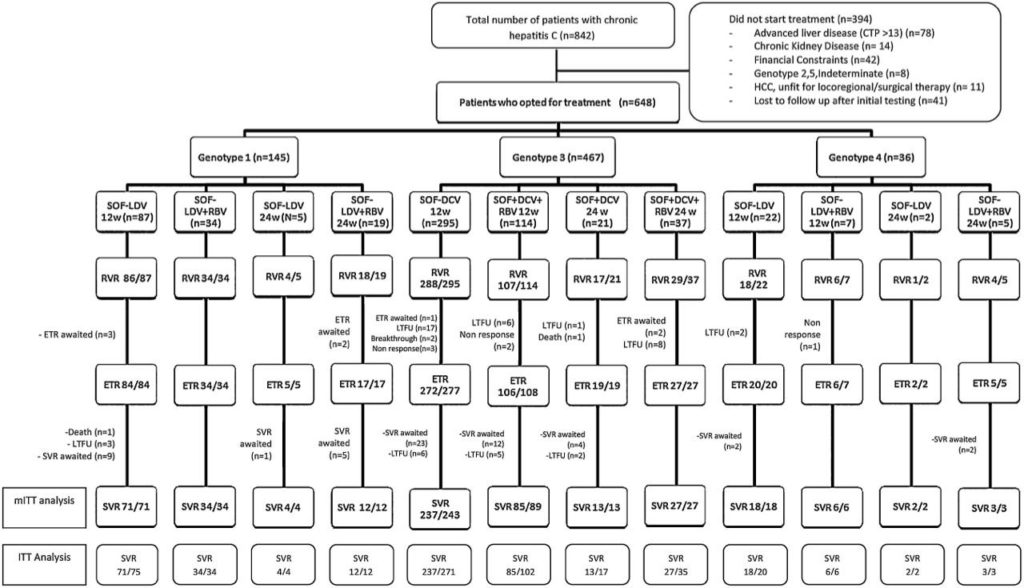
Рисунок 1. Пациенты с хроническим гепатитом С, получавшие ПППД.
mITT: все пациенты проходившие терапию, за исключением тех, кто был потерян для последующего наблюдения, либо отозвали свое информированное согласие или отказались от терапии; ITT: пациенты прошедшие терапию; ETR, окончание проводимого лечения; LTFU, потерянные для наблюдения.
Хотя у нескольких пациентов наблюдались незначительные побочные эффекты, ни один из них не прекращал терапию из-за непереносимости препаратов или побочных эффектов. Как правило, наблюдались усталость и анемия (у 53 пациентов — 8,3%), и они чаще всего встречались у пациентов в случае использования RBV.

Рисунок 2. Темпы получения устойчивого вирусологического ответа (УВО12) в соответствии с генотипами и состоянием печени.
Внедрение ПППД в течение последних нескольких лет произвело революцию в лечении хронического гепатита С. Хотя в различных исследованиях III фазы сообщалось о высокой эффективности и безопасности данных методов лечения результаты необходимо оценивать в реальных условиях, на которые могут повлиять соблюдение пациентом режима приема, сопутствующие заболевания и многие другие факторы влияющие на достижение УВО. В нашем исследовании мы мы провели анализ применения в реальных условиях при лечении 1, 3 и 4 генотипов.
В целом, показатели УВО12 были достигнуты в 98,1% (88,1% при анализе ITT). Показатель УВО12 для 1 и 4 генотипа составил 100%, а для 3 генотип — 97,3% (mITT). Полученные показатели УВО были выше, чем в исследованиях III фазы и других исследованиях в реальных условиях. Частота ответов была неизменно высокой у всех пациентов, независимо от состояния печени или используемой терапевтической схемы. Не было зафиксировано никаких серьезных побочных эффектов которые обусловили бы прекращение терапии, хотя в некоторых случаях добавление RBV у пациентов с прогрессирующим заболеванием печени вызывало анемию (53 пациентов — 8,3%) и требовало коррекцию в сторону снижения дозировки.
Полученный опыт показал высокие показатели УВО12 (91-98%) у пациентов, получавших SOF/LDV не зависимо от RBV у пациентов с 1 генотипом, включая пациентов с циррозом и у тех, кто имел опыт неудачной терапии проведенной ранее. Объективные данные о эффективности SOF/DCV у пациентов с 3 и 4 генотипами в реальных условиях недостаточны. Так, в недавно завершенном открытом многоцентровом исследовании проведенном во Франции показатель УВО12 у пациентов с 3 генотипом, получавших SOF / DCV независимо от RBV, был определен на уровне 89%. В большой европейской программе была оценена эффективность DCV на основе данных 485 пациентов из 100 медицинских центров в Германии, Австрии, Нидерландах, Швеции и Норвегии в период с апреля 2014 года по апрель 2015 года. У ста двух пациентов был 3 генотип, у 85% из них был цирроз (52% с декомпенсацией) — после проведенного лечения с помощью SOF+DCV независимо от RBV, показатель УВО12 был достигнут у 88%. В другом многоцентровом исследовании проведенный в Испании для того же генотипа и схемы лечения показатель УВО составил 94%.
Наше исследование показало более высокие показатели УВО12 в генотипах 1, 3 и 4 по сравнению с испытаниями III фазы и опытом реального применения препаратов в Европе. Возможные причины более высокого УВО могут быть связаны как с особенностью ВГС в данной местности, так и с факторами, связанными непосредственно с пациентами. Число пациентов с коинфекцией ВГВ было меньше чем в Европейских, кроме того в нашем исследовании не было ни одной коинфекции ВИЧ. Большая доля пациентов с 1b генотипом, которые, как считается, имеют лучший терапевтический ответ на ПППД. Кроме того, мы отмечали более высокую распространенность субгенотипа 3а и у этих пациентов был получен хороший ответ на терапию. Высокие показатели УВО также можно было отнести к большей доле пациентов без цирроза.
Наше исследование также представляет собой первый опыт применения в реальных условиях ПППД для лечения 4 генотипа при использовании SOF/LDV независимо от RBV в азиатском регионе. Показатель УВО12 у данной группы пациентов (включая пациентов с циррозом и пациентов с неудачным опытом предыдущего лечения) составил 100%. Хотя число пациентов с генотипом 4 было небольшим, эти результаты подтверждают эффективность данного назначения, что соотноситься с результатами клинических испытаниях.
К данному исследованию есть несколько важных замечаний: оно было центральным и проводилось в одной клинике, субтипирование для первого генотипа не проводилось у 43% пациентов, число пациентов с 4 генотипом было небольшим.
В заключении хотим отметить, что полученные нами данные показывают эфективность и безопасность терапии на основе ПППД и имеют высокий уровень успеха при лечении пациентов с генотипами 1, 3 и 4 ВГС-инфекции в реальных условиях. При этом нет явной зависимости от состояния печени пациента и негативного опыта предыдущего лечения. Наличие возможности применять двухкомпонентные схемы ПППД по заведомо низким ценам, имеющим низкие показатели основных частоты возникновения побочных эффектов, легкость приема, привело к серьезному улучшению прогнозов результативности терапии.
Более низкая стоимость терапии основе SOF, по сравнению со странами Европы и США, и меньшее количество побочных эффектов обеспечили приемлемость данной методики лечения в развивающихся странах, таких как Индия.
VarunMehta, RamitMahajan, VandanaMidha, VikramNarang, KirandeepKaur, ArshdeepSingh, AnandMalhotra, AslamParvez, AjitSood.
Предлагаемое изобретение относится к гепатологии и предназначено для прогнозирования ответа на противовирусную терапию (ПВТ) при хроническом гепатите С (ХГС) у взрослых и детей.
Прогнозирование эффективности лечения больных ХГС представляет собой важную практическую задачу в связи с высокой стоимостью противовирусных препаратов, наличием многочисленных побочных действий при их применении и связанной с этим необходимостью тщательного выбора методов лечения, оптимальных для конкретного пациента (персонализированная медицина).
Проведение ПВТ при ХГС - процесс длительный (24-48 недель и более), многокомпонентный, отягощенный большим количеством побочных явлений и высокой стоимостью препаратов.
Дозы, схемы и длительность ПВТ должны быть индивидуализированы и определяются целым рядом параметров, относящихся как к особенностям вируса (например, его генотипу), так и характеристике пациента. Совокупность этих факторов серьезно влияет на эффективность проводимого лечения.
- генотип вируса не - 1;
- вирусная нагрузка менее 600000 МЕ/мл;
- возраст моложе 40 лет;
- масса тела менее 75 кг;
- отсутствие резистентности к инсулину;
- повышенная активность трансаминаз;
- отсутствие выраженного фиброза или цирроза печени.
Каждый из этих признаков в отдельности и их сочетания в определенной степени предопределяют вероятность благоприятного ответа на терапию.
В самое последнее время предложено также учитывать генетический статус пациента в виде определения полиморфизма гена IL - 28В, кодирующего синтез интерферона лямбда 3 (Клин. Гепатология, 2010, №1, стр. 42). Однако все эти данные ориентировочны и позволяют лишь наметить общий план лечения.
Известен способ прогнозирования эффективности интерферонотерапии вирусных гепатитов у детей с помощью оценки показателей лейкоцитмодулирующей активности сыворотки крови до начала лечения (RU 2739689, 20.10.2001). Способ этот имеет ряд недостатков, ограничивающих его применение, к ним относятся:
- способ предназначен только для детей;
- определение показателя до начала лечения имеет характер группового, а не индивидуального прогнозирования;
- методы интерферонотерапии, которыми пользовались авторы (оральные препараты интерферона, интерферон в сочетании с циклофероном), не относятся к методам лечения ХГС, общепризнанным мировым гепатологическим сообществом, и поэтому не могут использоваться для прогнозирования официально рекомендуемой в настоящее время ПВТ при ХГС.
Известен также способ прогнозирования результатов лечения больных ХГС препаратами интерферона-альфа (ИФН-а), который предусматривает оценку уровня синтеза ИФН-гамма и ИЛ-4 непосредственно перед началом ПВТ и повторно через 4,5 часа после 1-й инъекции (RU 2287825, 20.11.2006). Способ обладает рядом недостатков и ограничений:
- разработан и может быть использован только у взрослых пациентов;
- характеризует избранные показатели только перед началом терапии и ответ на 1-ю инъекцию, которые могут не совпадать с таковыми в ходе многомесячной ПВТ;
- повторное взятие крови через 4,5 часа после первого ее забора на практике затруднено у амбулаторных пациентов, каковыми являются больные ХГС;
- 4,5 часа, избранные авторами как пик терапевтической активности ИФН, не могут относиться в равной мере и к стандартным ИФН-ам, и к его пегилированным формам, в то время как пациенты, у которых проводилось исследование, получали и те, и другие и не разделены по этому признаку.
Известен способ прогнозирования ответа на ПВТ с помощью определения фактора некроза опухоли (ФНО-а), исследуемого перед началом лечения и соотносящего его с показателями, определяемыми в ходе лечения (патент RU №2454666, публ. 02.02.2011). Однако этот способ относится к лечению другого гепатита - ХГВ, протекающего на фоне ХГС.
Наиболее близким способом прогнозирования эффективности ответа на ПВТ при ХГС, принятым за ближайший аналог, является способ, предложенный В.В. Макашовой с соавт.(патент RU №2461834, публ. 14.02.2011), предусматривающий определение соотношения интерлейкина - 18 и ФНО-перед началом терапии в сравнении с величиной этого соотношения в конце лечения. Недостатками этого способа являются:
- прогноз, который делается лишь по окончании терапии, является запоздалым, так как может относиться только к прогнозированию рецидивов заболевания;
- может быть использован только у взрослых пациентов.
Задачей изобретения является разработка нового подхода к индивидуализации проведения ПВТ при ХГС как у взрослых, так и у детей.
Техническим результатом предлагаемого изобретения является повышение точности прогнозирования для выбора оптимальной тактики лечения у каждого пациента.
Технический результат достигается за счет определения перед началом противовирусного лечения уровня интерферона в плазмоцитоидных дендритных клетках крови (ПДК).
С описанием в 1999 году ПДК открыта новая страница в учении об иммунитете. Эти уникальные клетки играют ключевую роль в иммунном ответе, обеспечивая взаимодействие врожденного (мощная выработка интерферона) и приобретенного (представление антигена) иммунитета (Liu YJ. IPC: professional type 1 interferon-producing cells and plasmacytoid dendritic cell precursors. Annu Rev Immunol 2005;23:275-306; Kadowaki N., YJ Liu. Natural type I interferon-producing cells as a link between innate and adaptive immunity. Hum. Immunol. 2002 Dec 12; 63: 1126-1132).
В зрелом виде ПДК циркулируют в периферической крови, а также в очень малых количествах присутствуют в костном мозге (до 1%), селезенке, тимусе, лимфоузлах (0,05-0,5%); практически отсутствуют в периферических тканях. Исключение составляют ткани печени (Cella М, Jarrossay D. Plasmacytoid monocytes migrate to inflamed lymph nodes and produce large amounts of type I interferon. Nat Med 1999; 5(8):919-23), где их количество достигает 10%.
Отличительными особенностями ПДК являются немедленная (через 2-4 часа) выработка полного спектра ИФН I и III типа (λ) и наличие специфических TLR-рецепторов (TLR7 и TLR9). С помощью регулятора экспрессии ИФН I типа (IRF7) стремительно активируется распознавание TLR рецепторами вирусных нуклеиновых кислот (Cisse В, Caton ML, Lehner М, Maeda Т, Scheu S, Reizis В. Transcription factor E2-2 is an essential and specific regulator of plasmacytoid dendritic cell development.Cell. 2008; 135(1):37-48), после чего начинается немедленная и мощная (в 1000 раз превышающая возможности других клеток) продукция ИФН I типа. Транскрипционные уровни IRF7 в ПДК выше, чем в обычных клетках (Crozat К, Guiton R, Guilliams М, Henri S, Baranek T, Schwartz-Cornil I et al. Comparative genomics as a tool to reveal functional equivalences between human and mouse dendritic cell subsets. Immunol Rev 2010; 234(1): 177-98).
При ХГС в 2010 году в этих клетках был открыт новый биологический механизм ИФН-образования. Особенности образования ИФН при HCV-инфекции с участием ПДК продемонстрировали в своем исследовании Takahashi et al. (Takahashi К, Shinichi A. Plasmacytoid dendritic cells sense hepatitis С virus-infected cells,produce interferon, and inhibit infection. Proc Natl Acad Sci U S A, Pablished on line 2010-03-15). По мнению авторов, при ХГС инфицированный гепатоцит, в котором активно реплицируется вирус, взаимодействует с ПДК, вызывая массивную выработку ИФН без заражения самой ПДК.
В наших исследованиях при изучении ПДК, их роли в патогенезе и ИФН-образовании при ХГС у взрослых и детей получен ряд доказательств того, что состояние этих клеток может лежать в основе хронического течения инфекции, а уровень ИФН-генеза в ПДК в ответ на ПВТ - определять ее эффективность.
В ходе предварительно проведенного нами исследования было показано, что у здоровых детей и взрослых ИФН в ПДК не определяется, поэтому за уровень выработки ИФН в ПДК у здоровых лиц принято 3 пг/мл - верхний уровень детекции используемого метода. При определении уровня интерфероногенеза в ПДК у больных ХГС получены следующие результаты:
-выработка ИФН в ПДК у больных ХГС, как у детей - 113,3±21,7 пг/мл, так и у взрослых - 321±141,2 достоверно выше нормальных значений (р=0,0002 и р=0,0034, соответственно);
- у взрослых интерфероногенез в ПДК интенсивнее, чем у детей (р 4 коп./мл, генотип 1в.
Фиброэластография печени - F1 балла по шкале METAVIR.
Диагноз: Хронический гепатит С, минимальной активности, репликативный, низкая вирусная нагрузка, генотип 1в, F1 балл по шкале METAVIR.
Исходный уровень выработки ИФН в ПДК, определяемый перед началом терапии - 298,7 пг/мл.
Больному проведена стандартная комплексная ПВТ (РоферонА+рибавирин) в возрастной дозировке.
На 12-ой неделе терапии отмечается нормализация уровня трансаминаз - АЛТ -35 Ед/л и ACT - 30,5 Ед/л. Маркеры ГС: HCV РНК - не определяется.
При лабораторном обследовании через 6 мес после окончания ПВТ: показатели уровня трансаминаз остались в пределах нормы, HCV РНК - не определяется, что соответствует устойчивому вирологическому ответу, под которым понимается отсутствие репликации вируса через 6 мес после окончания терапии и более. Дальнейшее наблюдение подтвердило отсутствие рецидива виремии.
Таким образом, по окончании терапии у мальчика был достигнут УВО, возможность прогнозирования которого была доступна до начала противовирусной терапии и базировалась на определении исходного уровня выработки ИФН в ПДК. У ребенка до начала проведения ПВТ зафиксирован высокий уровень интерферонообразования в ПДК - 298,7 пг/мл по сравнению с показателем у здоровых детей. Случай демонстрирует надежность позитивного прогноза перед началом проведения ПВТ и возможность на его основе строить терапию.
Больной Равшан Г., 34 года, № карты амбулаторного больного - 147.
Обратился на амбулаторный прием к гепатологу с жалобами на недомогание, снижение аппетита, ощущение тяжести в правом подреберье.
Из анамнеза заболевания было установлено наличие маркеров ВГС с 2001 года. Эпид. анамнез: парентеральные вмешательства отрицает, оперативные вмешательства не проводились, вредных привычек нет, источник инфицирования не установлен.
Противовирусная терапия не проводилась, в лечении периодически получал курсы гепатопротекторов.
Объективно: состояние средней степени тяжести по основному заболеванию. Кожа и видимые слизистые чистые. Умеренная иктеричность склер. Печень+1 см - ср/3, слегка уплотнена.
По результатам биохимического анализа крови активность трансаминаз - АЛТ -72,8 Ед/л и ACT - 31,7 Ед/л. Маркеры ГС: HCV РНК+, HCV РНК колич.-3,49×10 3 коп./мл, генотип 1в.
Фиброэластография печени - F1 по шкале METAVIR.
Диагноз: Хронический гепатит С, активный, репликативный, низкая вирусная нагрузка, генотип 1в, F1 балл по шкале METAVIR.
Исходный уровень выработки ИФН в ПДК, определяемый перед началом терапии - 851,1 пг/мл.
Больному проведена стандартная комплексная ПВТ (пегинтерферон альфа 2а+рибавирин).
На 12-ой неделе терапии отмечена нормализация уровня трансаминаз - АЛТ -30,3 Ед/л и ACT - 27,7 Ед/л. Маркеры ГС: HCV РНК колич. - не определяется.
При лабораторном обследовании через 6 мес после окончания ПВТ: показатели уровня трансаминаз остались в пределах нормы, HCV РНК - не определяется, что соответствует УВО, под которым понимается отсутствие репликации вируса через 6 мес после окончания терапии и более. Дальнейшее наблюдение подтвердило отсутствие рецидива виремии.
Таким образом, по окончании терапии у больного был достигнут УВО, возможность прогнозирования которого была доступна до начала противовирусной терапии и базировалась на определении исходного уровня выработки ИФН в ПДК.
Случай демонстрирует надежность позитивного прогноза перед началом проведения ПВТ и возможность на его основе решить вопрос о целесообразности ее проведения.
Больной Фирдавс X., 12 лет, № карты амбулаторного больного - 109.
Обратился на амбулаторный прием к гепатологу с жалобами на снижение аппетита, повышенную утомляемость, боли в правом подреберье при физической нагрузке.
Из анамнеза заболевания было установлено, что у мальчика с рождения определяются маркеры ВГС. Эпид. анамнез: вертикальный путь передачи, мать страдает ХГС.
Этиотропная противовирусная терапия не проводилась, периодически получал курсы гепатопротекторов.
Маркеры ГС: HCV РНК+, HCV РНК колич.- 7,51×10 4 МЕ/мл, генотип 3а.
Фиброэластография печени - F1 баллов по шкале METAVIR.
Диагноз: Хронический гепатит С, минимальной активности, репликативный, низкая вирусная нагрузка, генотип 3а, F1 балл по шкале METAVIR.
Исходный уровень выработки ИФН в ПДК, определяемый перед началом терапии - 3 пг/мл.
Ребенку проведена стандартная комплексная ПВТ (РоферонА+рибавирин) в возрастной дозировке.
На 12-ой неделе терапии уровень трансаминаз - АЛТ -41,2 Ед/л и ACT - 24,9 Ед/л. Маркеры ГС: HCV РНК колич. -1,86×10 3 МЕ/мл.
При лабораторном обследовании через 6 мес после окончания ПВТ: показатели уровня трансаминаз остались в пределах нормы, однако HCV РНК колич 2,8×10 4 МЕ/мл - определяется, что соответствует отсутствию эффективности проводимой ПВТ.
Таким образом, у ребенка, после проведения курса ПВТ не был достигнут вирологический ответ. Случай демонстрирует, что низкий показатель интерфероногенеза в ПДК, определяемый перед началом лечения, соответствует неудаче ПВТ, которую можно было с высокой вероятностью прогнозировать до ее проведения. Пример 4.
Больной Андрей В., 32 года, № карты амбулаторного больного - 160.
Обратился на амбулаторный прием к гепатологу с жалобами на ощущение тяжести в правом подреберье.
Из анамнеза заболевания было установлено наличие маркеров ВГС с 2003 года. Эпид. анамнез: парентеральные вмешательства отрицает, оперативные вмешательства не проводились, вредных привычек нет, источник инфицирования не установлен.
Этиотропная противовирусная терапия не проводилась.
По результатам биохимического анализа крови активность трансаминаз - АЛТ -45,3 Ед/л и ACT - 29,6 Ед/л.
Маркеры ГС: HCV РНК+, HCV РНК колич.- 2,67×10 6 МЕ/мл, генотип 1в. Фиброэластография печени - F0 баллов по шкале METAVIR. Уровень выработки ИФН в ПДК - 3 пг/мл
Диагноз: Хронический гепатит С, минимальной активности, репликативный, высокая вирусная нагрузка, генотип 1в, F0 баллов по шкале METAVIR.
Больному проведена стандартная комплексная ПВТ (пегинтерферон альфа 2а+рибавирин).
На 12-ой неделе терапии уровень трансаминаз - АЛТ -10,7 Ед/л и ACT - 19,4 Ед/л. Маркеры ГС: HCV РНК колич. -1,73×10 5 МЕ/ мл.
При лабораторном обследовании через 6 мес после окончания ПВТ: показатели уровня трансаминаз нормализовались, HCV РНК колич. - 2,3×10 5 МЕ/мл, что говорит о продолжающейся репликации вируса и соответствует отсутствию ответа на проведенную терапию.
В данном примере отсутствие достаточного уровня выработки интерферона в ПДК перед началом лечения соответствует отсутствию желаемого эффекта терапии. Подобная ситуация, так же, как у детей, может служить основой для решения вопроса о проведении ПВТ.
Таким образом, предложенный способ определения уровня ИФН в ПДК перед началом ПВТ позволяет предсказать ее конечный результат с прогностической точностью (эффективность) 75% при высокой чувствительности (83%) и специфичности (67%), что принципиально важно для решения вопроса о назначении, характере и длительности ПВТ.
Учитывая предложенный нами предиктор эффективности проводимой ПВТ, практикующий врач может иметь объективную информацию, необходимую для решения вопроса о начале терапии и выборе соответствующей схемы ее проведения.
При наличии отрицательного предиктора (выработка ИФН в pDC ниже 136,7 пг/мл) дорогостоящая и обладающая большим количеством негативных побочных эффектов ПВТ может быть мотивированно отложена до момента появления более эффективных противовирусных препаратов.
Способ прогнозирования эффективности противовирусной терапии при хроническом гепатите С у взрослых и детей, отличающийся тем, что до начала лечения определяют уровень интерферона в плазмоцитоидных дендритных клетках крови и при его значении 136,7 пг/мл и более прогнозируют эффективность противовирусной терапии.

Гепатит С является одной из самых серьезных патологий в мире. Заразиться может любой человек, пользующийся услугами стоматолога, косметолога, мастера по маникюру. Статистически при гепатите С прогноз благоприятен для людей, которые получают необходимое лечение. Но наиболее точно оценить перспективы в конкретном случае можно, рассмотрев все факторы, влияющие на протекание патологии.
Что влияет на продолжительность жизни больных с гепатитом
Летальный исход при гепатите С обычно наступает не от самой болезни, а от осложнений, которые она вызывает. Более чем в 50 % случаев гепатит провоцирует цирроз, в остальных случаях на продолжительность жизни отрицательно влияет рак печени.
Но точно сказать, сколько живут с гепатитом С, невозможно. На прогноз влияют различные факторы, многие из которых напрямую зависят от образа жизни человека. Печень будет разрушаться быстрее при следующих условиях:
- неправильное питание с преобладанием жирной пищи;
- прием алкоголя, наркотических препаратов;
- неблагоприятные условия жизни и работы, связанные с токсическими веществами;
- бесконтрольный прием препаратов.
Правильный образ жизни, повышающий шансы на благоприятный прогноз при гепатите, должен учитывать нагрузку на печень от всех внешних и внутренних факторов.
Но существуют и другие аспекты, влияющие на количество времени, за которые гепатит С разрушит клетки печени.
Гепатит С бывает острым и хроническим, но острая форма встречается в медицинской практике крайне редко. В 80% случаев он протекает без единого клинического проявления. В оставшихся случаях симптомы настолько неспецифические, что распознать в них воспаление печени без клинических исследований невозможно. Поэтому гепатит С после первой волны проявлений на 2-4 неделе от заражения переходит в хроническую форму. И только через несколько лет человек с вирусом гепатита в крови может начать испытывать дискомфорт. Полное поражение органа по усредненному прогнозу происходит через 20-30 лет.
Гепатит С имеет 6 форм (генотипов), маркируемых римскими цифрами соответственно. Они примерно разделяются по географическому признаку, но путешествующий человек может заразиться любой формой.
Самый неблагоприятный прогноз имеет генотип номер 3. Скорость развития фиброза в тканях печени при третьем генотипе выше вдвое: статистически цирроз развивается за 7-10 лет вместо 20.
В Евразии наиболее распространен первый генотип гепатита. Он считался трудноизлечимым до появления препаратов нового поколения, улучшивших прогноз: Даклатасвира, Ледипасвира, Софосбувира и других лекарств, целенаправленно уничтожающих вирус. До этого применялись противовирусные препараты интерферон и Рибавирин, которые влияли на работу всего иммунитета. Генотипы 1 и 4 обладают высокой устойчивостью к интерферону, что усугубляет течение хронического гепатита.
Прогноз и лечение при гепатите С 2 генотипа при прочих благоприятных обстоятельствах не отличаются. Заболевание медленно бессимптомно развивается на протяжении 20 лет, пока не возникнет рак или цирроз.
По статистике, прогноз гепатита С у детей и стариков наименее благоприятен. У этих групп пациентов иммунная система слаба, а печень наиболее уязвима.
Процент выздоровления выше у людей в возрасте 18-30 лет, а также у женщин – у них фиброз происходит медленнее.
Для наиболее благоприятного прогноза масса тела должна быть в норме, то есть при среднем росте не превышать 74 кг. Люди с ожирением чаще сталкиваются с осложнениями гепатита С, которые влияют на продолжительность и качество жизни.
При дефиците массы тела поражение печени также может протекать сложнее. Обычно люди резко худеют на фоне заболевания, так как процесс пищеварения нарушается пропорционально распространенности фиброза.
Риск цирроза повышается у алкоголиков и наркоманов, которые составляют 50% зараженных.
Задача печени – нейтрализовать токсины, попадающие в организм, поэтому на фоне патологии нужно отказаться от употребления всего, что увеличивает нагрузку на орган. Пациенты, соблюдающие назначения врача, имеют более благоприятный прогноз.
В борьбе с вирусом участвует защитная система организма, поэтому прогноз менее благоприятен при патологиях иммунитета:
- ВИЧ-инфицированные;
- аллергики;
- на фоне аутоиммунных процессов.
После заражения выздоровление может наступить произвольно. Такое происходит в 15% случаев, если иммунитет человека активен, а количество попавшего в организм вируса невелико. Заражение и выздоровление у таких людей протекают незаметно, но специфические антитела в крови могут оставаться навсегда.
Вирусное воспаление более опасно, если ему сопутствуют цирроз, диабет, поражение почек.
Сколько можно прожить с гепатитом С без терапии
Если лечение не проводится, прогноз неблагоприятен, так как болезнь неуклонно прогрессирует. Когда поражение печени спровоцирует осложнение в виде потери функции органа, потребуется трансплантация, без которой человек погибнет.
Прогноз при качественном лечении
До 2013 года для терапии гепатита С применялось только противовирусное лечение интерфероном и Рибавирином. Выздоровление после первого курса терапии наблюдалось примерно в половине случаев, остальным пациентам требовалась повторная терапия.
После появления препаратов направленного действия, например, Софосбувира (Совальди), лечить хронический гепатит стало проще и быстрее. Прогноз благоприятен для 95-98% пациентов без цирроза печени. Выздоровление наступает в течение 12-24 недель после начала лечения. Терапия не сопровождается многочисленными побочными эффектами, человек получает возможность жить обычной жизнью, соблюдая предписания врача по здоровому образу жизни.
Читайте также:


