Прием ацикловира при гепатите в
После того как в 70-х годах ХХ века были выделены возбудители гепатитов А и В, стало очевидным существование еще нескольких вирусных гепатитов, которые стали называть гепатитами ни А, ни В. В 1989 г. удалось идентифицировать возбудитель гепатита ни А, ни В с парентеральным (через кровь) механизмом передачи. Его назвали вирусом гепатита С (ВГС).
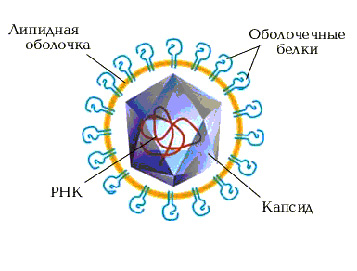
Как устроен этот чрезвычайно опасной вирус и что делает его таким ? По внешним параметрам — это обычный мелкий сферический вирус, имеющий оболочку. Как известно, свойства живых существ кодируются в генах, совокупность которых составляет геном. У вируса гепатита С очень маленький геном, в нем всего 1 ген, в котором зашифрована структура 9 белков. Эти белки участвуют в проникновении вируса в клетку, в создании и сборке вирусных частиц и в переключении на себя некоторых функции клетки. Три белка вируса, участвующие в формировании вирусной частицы, называются структурными, остальные 6 белков выполняют разные ферментативные функции и называются неструктурными. Геном вируса гепатита С представлен 1 нитью рибонуклеиновой кислоты ( РНК ), которая заключена в капсулу. Эту капсулу называют капсидом, а образующий ее белок — нуклеокапсидным белком. Для обозначения этого белка часто используют другие названия — кор или сердцевинный белок. Этот белок играет очень важную функцию в сборке вируса, регуляции синтеза вирусной РНК и, что самое неприятное, он может нарушать иммунный ответ инфицированного человека. Капсид с РНК, в свою очередь, заключен в оболочку из липидов (жироподобных веществ) и белков. Эти белки имеют свое название — оболочечный белок 1 (краткое обозначение Е1) и оболочечный белок 2 (Е2). Белки Е1 и Е2 образуют комплекс, главными функциями которого являются обеспечение связывания вируса с клеткой и проникновения в нее.
Если бы удалось создать лекарственный препарат, нарушающий эти процессы, можно было бы победить гепатит С. Но, к сожалению, до сих пор нет возможности детально изучить связывание вируса с клеткой и проникновение в нее. Вирус, попав в кровь, разносится по всему организму. В печени он присоединяется к поверхностным структурам гепатоцита (клетка печени ) и проникает в него. Жизнедеятельность гепатоцита нарушается, основные структуры клетки теперь работают на вирус, синтезируя вирусные белки и РНК. Новые собранные вирусные частицы выходят из клетки и начинают заражать здоровые гепатоциты. Длительное присутствие вируса в печени приводит к гибели ее клеток и даже к их перерождению в злокачественные (раковые) клетки.Одна из ярких особенностей генома вируса заключается в существовании в нем участков, где очень часто происходят мутации (замена компонентов гена), что сказывается на свойствах вирусных белков, в особенности оболочечных. Из-за этого в белках Е1 и Е2 быстро меняются поверхностные участки. Но именно эти участки у ВГС формируют “антигенное лицо” оболочечных белков, которое распознают антитела. Быстро меняющееся “антигенное лицо” антитела не узнают и соответственно не могут уничтожить вирус. В результате вирус ускользает из-под иммунного контроля и постепенно разрушает печень. Иногда он может проникать в другие ткани и органы, например, в иммунные клетки или сердце, тогда развиваются серьезные сопутствующие заболевания.
Но вернемся к еще одной важной особенности ВГС. Она заключается в способности вируса существовать в человеке в виде набора близкородственных, но не совсем идентичных вирусных частиц, называемых квазивидами. Среди вирусов такая способность встречается редко. В каждом квазивидовом наборе есть главный, преобладающий вариант, который чаще инфицирует клетки, и есть редкие вирусные варианты. Когда иммунной системе удается уничтожить преобладающий вирус, один из редких занимает его место. Предпочтение всегда получает недоступный для существующих антител вариант. Таким образом, происходит своеобразное состязание между ВГС, который стремится создать много разных вариантов, и иммунной системой, которая уничтожает доступные варианты, способствуя распространению менее доступных.
Резюмируя можно сказать, что быстрая изменчивость некоторых белков ВГС и его квазивидовая природа играют важную роль в развитии хронического гепатита С. Однако иммунная система может, хотя и редко , уничтожить вирус. Известно, что около 15% больных острым гепатитом С выздоравливают. К сожалению, нет четких представлений об особенностях иммунного ответа выздоравливающих людей. Но строго доказано, что ослабление иммунной системы сопутствующими заболеваниями или нездоровым образом жизни, способствует развитию хронического гепатита С.
Изучая РНК вируса, выделенного от разных больных в разных странах, ученые пришли к необходимости классифицировать (разделить) ВГС на 6 генотипов и несколько десятков субтипов. Генотипы обозначают арабскими цифрами, а субтипы латинскими буквами. Субтипы различаются по чувствительности к лечению интерфероном, по виремии (содержании вируса в крови), по географическому распространению.
Клиническая картина
Для гепатитов характерны:
- Диспепсические явления;
- Желтуха (бывает не во всех случаях);
- Умеренное увеличение и уплотнение печени и селезенки;
- Нарушение функций печени, определяемые лабораторными методами и методом радиогепатографии;
Больных беспокоят чувство тяжести или тупые боли в области правого подреберья, снижение аппетита, горечь во рту, тошнота, отрыжка, слабость, похудание, лихорадка, кожный зуд. Нередки кровотечения из носа. При пальпации поверхность печени гладкая, край умеренно плотный, слегка болезненный.
Течение доброкачественного гепатита может бить очень длительным – до 20 лет. Обострения возникают очень редко и только под воздействием сильных провоцирующих факторов. Развитие цирроза наблюдается редко. Агрессивный гепатит характеризуется рецидивами, частота которых может быть различной. Частые рецидивы приводят к более быстрому прогрессированию дистрофических и воспалительно-рубцовых изменений печени и развитию цирроза. Прогноз при этой форме – более тяжелый.
Вирусный гепатит – профессиональное заболевание медицинского персонала .
Медицинский персонал лечебно-профилактических учреждений относится к категории повышенного риска заражения и заболевания вирусными гемоконтактными гепатитами. По частоте выявления маркеров инфицирования вирусом гепатита медицинский персонал оказался распределен на 3 группы:
- 1-ю (наивысшие показатели) составляют сотрудники гемодиализного и гематологических отделений;
- 2-ю — работники лабораторного, реанимационных и хирургических отделений;
- 3-ю (наименьшие показатели) — сотрудники терапевтических отделений.
Эпидемиология
Распространенность. Вирус гепатита С (ВГС), как предполагается, проник в человеческую популяцию около 300 лет назад и в настоящее время представляет серьезную угрозу здоровью людей. Число инфицированных вирусом превышает 200 млн. человек, что составляет около 3% населения земного шара. Большинство из них является скрытыми носителями. У 85% заболевших остром гепатитом С развивается хроническая (персистирующая) ВГС-инфекция, при которой вирус размножается в организме в течение десятков лет. ВГС широко распространен в человеческом обществе. Природный резервуар вируса не известен. Известно, что кроме человека гепатитом С болеют только шимпанзе. Данные о частоте встречаемости гепатита С неоднородны и колеблются от 0,5-3% от общей численности населения (США, Западная Европа) до 4-20% (Африка, Азия, Восточная Европа). Столь большие различия в результатах выборочных эпидемиологических исследований в разных странах и регионах объясняются как различной доступностью диагностических систем последнего поколения, так и чрезвычайной неоднородностью ВГС.
На территории бывшего Советского Союза чаще всего гепатит С встречается в республиках Средней Азии и в Молдове (5-10%). Имеется некоторая связь между высоким уровнем распространенности ВГС и низким уровнем жизни. Вместе с тем, даже в экономически развитых странах количество ВГС-инфицированных часто превышает число носителей HBsAg (маркер гепатита В) в несколько раз и еще более ВИЧ-инфицированных. Самым распространенным субтипом ВГС в России является 1в (более 70% от общего числа случаев), считающийся наиболее опасным и плохо поддающимся лечению интерфероном. Следующими по частоте обнаружения являются подтипы 1а и 3а, значительно реже обнаруживается подтип 2а.
Пути передачи.
Основным механизмом заражения гепатитом С является парентеральный, т.е. преимущественно через кровь. Хотя возможно заражение и через другие биологические жидкости: через сперму, вагинальный секрет, слюну, мочу (в последних двух случаях очень редко). Общепринято в эпидемиологии вирусных гепатитов различать “горизонтальный” и “вертикальный” путь передачи. “Вертикальный” путь передачи ВГС (от инфицированной матери новорожденному ребенку) в настоящее время рассматривается как менее вероятный по сравнению с вирусом гепатита В. Действительно большинство детей рожденных от матерей, инфицированных ВГС, имеют материнские антитела к ВГС, которые исчезают через 6-8 месяцев. При обследовании новорожденных на РНК ВГС удалось доказать, что вероятность передачи вируса от матери к ребенку все же имеет место (по разным данным до 5% случаев). Риск инфицирования существенно повышается при высокой концентрации вируса в крови и при сопутствующей ВИЧ-инфекции, а также при родовых травмах и кормлении грудью.
Подавляющее большинство случаев инфицирования ВГС происходит при “горизонтальном” пути передачи (от индивидуума к индивидууму). В недалеком прошлом наиболее распространенным способом инфицирования являлся посттрансфузионный, т.е. при переливании крови. В основной группе риска находились больные гемофилией, талассемией и другими заболеваниями крови. Среди гемофиликов доля инфицированных ВГС была очень высока (до 90%). Известны случаи инфицирования больших групп беременных женщин с резус-конфликтом, получавших внутривенные инъекции иммуноглобулина Д. Благодаря установленным сейчас нормативам обследования доноров, переливание крови, внутривенный прием гемоконцентратов и других продуктов крови стали более безопасными. В настоящее время крупнейшей и постоянно растущей группой повышенного риска являются не больные гемофилией, а наркоманы, использующие наркотики внутривенно. Это так называемый “инъекционный” путь заражения. Передача вируса происходит при использовании общего шприца или иглы. Бывают случаи, когда зараженным оказывается сам наркотик. Доля инфицированных вирусом среди наркоманов высока, но колеблется значительно в разных странах и доходит до 50% в некоторых регионах России. Дополнительными факторами риска для этой группы служат сопутствующая ВИЧ-инфекция и увлечение татуировками.
Небольшую часть заразившихся “инъекционным” путем составляют пациенты, инфицированные в медицинских центрах, где не используются одноразовые шприцы и нарушаются правила стерилизации медицинских инструментов. Не полностью исключена возможность инфицирования в центрах гемодиализа, и даже в стоматологических и гинекологических кабинетах при несоблюдении всех требований безопасности. Определенное значение имеет инфицирование медперсонала из-за возможности случайных травм при медицинских манипуляциях. Наряду с этим существуют и менее очевидные способы передачи вируса. Например, в Японии, где ВГС-инфекция является гиперэндемичной (выявление антител у 20% населения), основной причиной столь высокой распространенности является использование нестерильных иголок в практике народной медицины (включая акупунктуру и подобные методики). Таким образом, как традиционная, так и нетрадиционная медицина может быть повинны в инфицировании гепатитом С некоторой части пациентов и медперсонала.
Возможна половая передача вируса. Вероятность инфицирования половым путем велика при сопутствующей ВИЧ-инфекции, при большом количестве сексуальных партнеров и, возможно, при большой продолжительности брака. Есть данные о более частом инфицировании женщин, контактировавших с больными гепатитом С мужчинами, чем мужчин — партнеров больных женщин. У гомосексуалистов, не принимавших внутривенно лекарственные препараты или наркотики, антитела к ВГС (маркеры инфицирования) обнаруживаются в 1-18% случаев, и тем чаще, чем больше было в жизни обследованных сексуальных партнеров.
В исследованиях, посвященных бытовому способу передачи ВГС, его маркеры обнаруживаются у 0-11% лиц, контактировавших с больными гепатитом С. Определение идентичных субтипов ВГС в семьях подтверждает малую вероятность его бытовой передачи. Однако у 40-50% больных гепатитом С не удается выявить никаких парентеральных факторов риска, и эти случаи рассматриваются как контактно-приобретенный гепатит С, при котором заражение осуществленные через случайную травму кожи.
Итак, основные факторы риска инфицирования гепатитом С:
- внутривенное введение лекарств и наркотиков,
- переливание крови и ее препаратов,
- гемодиализ,
- татуировка,
- сексуальное поведение с высоким риском заражения,
- пересадка органов от ВГС-положительных доноров
- несоблюдение санитарно-гигиенических норм в медицинских учреждениях.
В современных условиях, когда вакцины не существует, а лечение является дорогостоящим и часто неэффективным, своевременная диагностика ВГС имеет важнейшее значение для ограничения и выявления групп эпидемиологического риска.
Лечение
Лечение гепатита С является одной из наиболее сложных проблем современной клинической медицины и, кроме того, затрагивает немаловажные социальные аспекты, поскольку является длительным и дорогостоящим. Ежегодно в рамках государственных программ всех развитых госудаств расходуются огромные средства, направленные на поиски путей повышения эффективности и разработку новых схем терапии. Основным и практически единственным действительно эффективным препаратом для терапии гепатита С в настоящее время является рекомбинантный альфа 2b — интерферон. Однако, применение его связано с большим количеством проблем:
- инъекционная форма введения, что при длительных курсах лечения создает серьезный дискомфорт для пациента;
- высокая стоимость препарата;
- большой процент рецидивов заболевания после отмены терапии;
- резистентность к препарату;
- выраженные побочные эффекты, в ряде случаев вызывающие необходимость его отмены.
Наиболее часто среди побочных эффектов встречаются пирогенные реакции, миалгии, отмечены случаи развития алопеции и депрессивных состояний. Помимо альфа –интерферона для лечения гепатита С в ряде случаев испольуются рибавирин (и ряд других противовирусных препаратов), кортикостероиды.
Хотя основным препаратом для терапии гепатита С является альфа- интерферон, существует несколько схем терапии гепатита С.
- только альфа-интерферон
- интерферон в комбинации с рибавирином
- только рибавирин – (1000 и 1200 мг/сут в течение 12 недель.)
- кортикостероиды в комбинации с рибавирином.
Целесообразность применения этих схем (за исключением первой) оспаривается и в настоящее время нет единого мнения на этот счет. Однако, у части больных такое “альтернативное” лечение дает удовлетворительный эффект. Считается, что наиболее эффективно лечение альфа-интерфероном у больных с изначально низким уровнем РНК вируса и умеренными гистопатологическими изменениями.
Наиболее предпочтительными в настоящее время считают следующие варианты терапии альфа интерфероном:
- 3 МЕ 3 раза в неделю в течение года
- 6 МЕ 3 раза в неделю — в течение 6 месяцев.
- 3 МЕ 3 раза в неделю в теч 3 мес, затем по 6 МЕ 3 раза в неделю в течение следующих 6 мес
В целом терапия интерфероном оказывается абсолютно эффективной у 35% больных, способствует положительной динамике биохимических показателей в 65% случаев и в 29% случаев оказывает поддерживающий эффект.
Эффективность лечения альфа-интерфероном в целях наиболее быстрого достижения ремиссии заболевания считается доказанной. Долгосрочный эффект при применении альфа- интерферона остается неясным. Несмотря на то, что у 33-50 % наблюдается полноценный ответ на терапию альфа – интерфероном, у 50% — 90% больных после отмены препарата наблюдается повторное обострение. Лечение альфа – интерфероном в низких дозах (3-5 000 000 ЕД) в целом несколько менее эффективно, чем лечение в более высоких дозах. Отсутствие же ответа на лечение альфа-интерфероном в течение 4-6 недель говорит о неэффективности этого препарата у пациента, и дальнейшее продолжение лечения с увеличением дозировки в этих случаях, как правило, не имеет смысла.
Исследования показали, что некоторые пациенты, “отвечаюшие” на лечение интерфероном, не восприимчивы к лечению ацикловиром или стероидами. Лечение рибавирином позволяет достигать достаточно хороших результатов, однако после отмены препарата у большинства больных наблюдается повторная активация инфекционного процесса.
Профилактика
Механизмы иммунного ответа при гепатите С – инфекции до сих пор остаются не вполне ясными. Эксперименты на животных показали, что перенесенная гепатит – инфекция не исключает заражения другими штаммами вируса С, что является одной из причин отсутствия вакцины для профилактики этой инфекции. В связи с этим основными методами профилактики гепатита С остаются тщательный контроль препаратов крови и всех биологических препаратов, используемых в медицине, использование одноразовых медицинских инструментов для инвазивных процедур, активная просветительская деятельность.
Образ жизни
Что делать, как жить, если у Вас обнаружили гепатит С ? Да, это опасное инфекционное заболевание. Но его хроническая форма очень долго (15-25 лет) имеет мягкое течение, которое практически не сказывается на самочувствии. Хотя некоторые изменения в Вашу жизнь придется внести. Во-первых, периодически обследоваться у врача-гепатолога и выполнять все его рекомендации. Во-вторых, отказаться от приема алкоголя и других гепатотоксических веществ. В-третьих, вести образ жизни, щадящий Ваше здоровье: спать около 8 часов, избегать физических и эмоциональных перегрузок и, конечно, соблюдать диету, ограничивающую жирное, жареное, острое. В-четвертых, соблюдать меры безопасности, чтобы не заразить окружающих Вас людей. Помните: Ваша кровь и биологические жидкости (в основном секреты половых желез) содержат вирус и могут заразить окружающих людей. Перевязывайте свои раны, не оставляйте кровь на бытовых предметах, практикуйте “защищенный” секс.
Можно ли беременеть женщинам, хронически инфицированным ВГС? Да, если не возражает наблюдающий Вас врач-гепатолог. Иногда при очень высоком содержании вируса в крови возможно проникновение его через плаценту и инфицирование плода. Желательно таким женщинам отказаться от естественного родоразрешения, заменив его кесаревым сечением. Так как во время естественных родов возможна травма кожных покровов матери и ребенка, результатом которой может стать инфицирование новорожденного. Вероятно, придется отказаться от грудного вскармливания, потому что очень редко, но все-таки возможно инфицирование ребенка при грудном кормлении.
Если известие о Вашем заболевании очень гнетет Вас, и Вы чувствуете, что у Вас развивается депрессия, обратитесь за помощью к врачу-психиатру.
Помните: Ваша доброта и радушие и, конечно, забота о Вас и любовь Ваших близких помогут сохранить Вам полноценную жизнь и перенести любые невзгоды.
Русское название
Латинское название вещества Ацикловир
Химическое название
2-Амино-1,9-дигидро-9-[(2-гидроксиэтокси)метил]-6H-пурин-6-он (в виде натриевой соли)
Брутто-формула
Фармакологическая группа вещества Ацикловир
Нозологическая классификация (МКБ-10)
Код CAS
Характеристика вещества Ацикловир
Ацикловир — белый кристаллический порошок, максимальная растворимость в воде (при 37 °C) 2,5 мг/мл, молекулярная масса 225,21. Ацикловира натриевая соль — максимальная растворимость в воде (при 25 °C) превышает 100 мг/мл, молекулярная масса 247,19; приготовленный раствор (50 мг/мл) имеет pH примерно 11.
Фармакология
Является синтетическим аналогом пуриновых нуклеозидов. После поступления в инфицированные клетки, содержащие вирусную тимидинкиназу, ацикловир фосфорилируется и превращается в ацикловира монофосфат, который под влиянием клеточной гуанилаткиназы преобразуется в дифосфат, и затем под действием нескольких клеточных ферментов — в трифосфат. Ацикловира трифосфат взаимодействует с вирусной ДНК-полимеразой, включается в цепочку вирусной ДНК , вызывает обрыв цепи и блокирует дальнейшую репликацию вирусной ДНК без повреждения клеток хозяина.
Ацикловир ингибирует in vitro и in vivo репликацию герпесвирусов человека, включая следующие (перечислены в порядке снижения противовирусной активности ацикловира в культуре клеток): вирус Herpes simplex 1 и 2 типов, вирус Varicella zoster, вирус Эпштейна-Барр и ЦМВ .
При длительном лечении или повторном применении ацикловира у больных с выраженным иммунодефицитом развивается устойчивость вирусов Herpes simplex и Varicella zoster к ацикловиру. В большинстве клинических изолятов, полученных от ацикловир-резистентных больных, обнаруживается относительный дефицит вирусной тимидинкиназы, либо нарушение структуры вирусной тимидинкиназы или ДНК-полимеразы.
При герпесе предупреждает образование новых элементов сыпи, снижает вероятность кожной диссеминации и висцеральных осложнений, ускоряет образование корок, снижает боль в острой фазе опоясывающего герпеса. Оказывает иммуностимулирующее действие.
При приеме внутрь частично абсорбируется из ЖКТ , биодоступность — 20% (15–30%), не зависит от лекарственной формы, снижается с увеличением дозы; пища не оказывает значимого влияния на всасывание ацикловира. После приема внутрь по 200 мг ацикловира каждые 4 ч у взрослых средние равновесные значения Cmax — 0,7 мкг/мл и Cmin — 0,4 мкг/мл; Tmax — 1,5–2 ч.
После в/в капельного введения взрослым средние значения Сmax через 1 ч после инфузии в дозе 2,5; 5 и 10 мг/кг составляли 5,1; 9,8 и 20,7 мкг/мл соответственно. Сmin через 7 ч после инфузии соответственно равнялись 0,5; 0,7 и 2,3 мкг/мл. У детей старше 1 года значения Сmax и Сmin при введении в дозе 250 и 500 мг/м 2 были аналогичны таковым у взрослых при дозах 5 и 10 мг/кг соответственно. У новорожденных и младенцев в возрасте до 3 мес, которым ацикловир вводился в дозе 10 мг/кг в/в капельно в течение 1 ч каждые 8 ч Сmax составляла 13,8 мкг/мл), Cmin — 2,3 мкг/мл.
Связывание с белками низкое (9–33%). Проходит через ГЭБ , плацентарный барьер, обнаруживается в грудном молоке (при дозе 1 г/сут внутрь с молоком матери в организм ребенка поступает 0,3 мг/кг). Хорошо проникает в органы, ткани и жидкости организма, включая головной мозг, почки, печень, легкие, водянистую влагу, слезную жидкость, кишечник, мышцы, селезенку, матку, слизистую оболочку и секрет влагалища, сперму, спинно-мозговую жидкость, содержимое герпетических пузырьков. Наиболее высокие концентрации обнаруживаются в почках, печени и кишечнике. Концентрация в спинно-мозговой жидкости составляет 50% таковой в плазме крови. Метаболизируется в печени, под действием алкоголь- и альдегиддегидрогеназы и, в меньшей степени, альдегидоксидазы в неактивные метаболиты. Метаболизм ацикловира не связан с ферментами цитохрома P450.
Основной путь элиминации — через почки путем клубочковой фильтрации и канальцевой секреции. При приеме внутрь в неизмененном виде выводится примерно 14%, при в/в введении — 45–79%. Основной метаболит, обнаруживаемый в моче — 9-карбоксиметоксиметилгуанин. На долю основного метаболита приходится до 14% (при нормальной функции почек). Менее 2% выводится с фекалиями, следовые количества определяются в выдыхаемом воздухе.
T1/2 при приеме внутрь у взрослых — 2,5–3,3 ч. T1/2 при в/в введении: у взрослых — 2,9 ч, у детей и подростков от 1 года до 18 лет — 2,6 ч, у детей в возрасте до 3 мес — 3,8 ч (при введении в/в капельно 10 мг/кг в течение 1 ч 3 раза в сутки). У пациентов с хронической почечной недостаточностью T1/2 — 19,5 ч, во время проведения гемодиализа — 5,7 ч, при постоянном амбулаторном перитонеальном диализе — 14–18 ч. При однократном сеансе гемодиализа в течение 6 ч концентрация ацикловира в плазме снижается на 60%, при перитонеальном диализе клиренс ацикловира значительно не изменяется.
При нанесении на пораженную кожу (например при опоясывающем герпесе) всасывание умеренное; у больных с нормальной функцией почек концентрации в сыворотке крови составляют до 0,28 мкг/мл, при нарушении функции почек — до 0,78 мкг/мл. Выводится почками (примерно 9% суточной дозы).
Глазная мазь легко проникает через эпителий роговицы и создает терапевтическую концентрацию в глазной жидкости.
Канцерогенность, мутагенность, влияние на фертильность, тератогенность
У крыс и мышей, получавших в течение жизни ацикловир в дозах до 450 мг/кг/сут через желудочный зонд (при этом значения Cmax были выше наблюдаемых у человека в 3–6 раз у мышей и в 1–2 раза у крыс), канцерогенного действия не обнаружено.
Ацикловир проявлял мутагенное действие в некоторых тестах: из 16 in vivo и in vitro тестов на генную токсичность ацикловира результаты 5 тестов были позитивными.
Ацикловир не оказывал влияния на фертильность и репродукцию у мышей при введении внутрь в дозах 450 мг/кг/сут и у крыс при п/к введении в дозе 50 мг/кг/сут, при этом плазменные уровни были в 9–18 раз выше (у мышей) или в 8–15 раз выше (у крыс), чем у человека. При высшей дозе (50 мг/кг/сут п/к) у крыс и кроликов (плазменные уровни составляли 11–22 или 16–31 таковых у человека) установлено снижение эффективности имплантации.
Тератогенность. Ацикловир не оказывал тератогенного действия при введении в период органогенеза мышам (450 мг/кг/сут, внутрь), кроликам (50 мг/кг/сут, п/к и в/в), а также в стандартном тесте у крыс (50 мг/кг/сут, п/к).
Исследований канцерогенности ацикловира при наружном применении не проводили.
У человека нарушений сперматогенеза, подвижности или морфологии сперматозоидов не зарегистрировано. Однако высокие дозы ацикловира — 80 или 320 мг/кг/сут интраперитонеально у крыс, а также 100 или 200 мг/кг/сут в/в у собак — вызывали атрофию семенников и асперматогенез. Тестикулярных нарушений не наблюдалось при в/в введении ацикловира собакам в дозах 50 мг/кг/сут в течение 1 мес или 60 мг/кг/сут внутрь в течение 1 года.
Применение вещества Ацикловир
Для системного применения: первичные и рецидивирующие инфекции кожи и слизистых оболочек, вызванные вирусом простого герпеса (типа 1 и 2), включая генитальный герпес, герпетические поражения у больных иммунодефицитом (лечение и профилактика); опоясывающий лишай, ветряная оспа.
Для наружного применения: простой герпес кожи и слизистых оболочек, генитальный герпес (первичный и рецидивирующий); локализованный опоясывающий лишай (вспомогательное лечение).
Для местного применения в офтальмологии: герпетический кератит.
Противопоказания
Гиперчувствительность к ацикловиру или валацикловиру.
Ограничения к применению
При в/в введении: дегидратация, почечная недостаточность (риск нефротоксического действия), неврологические нарушения или неврологические реакции на прием цитотоксичных ЛС , в т.ч. в анамнезе.
При приеме внутрь: дегидратация, почечная недостаточность.
Применение при беременности и кормлении грудью
Беременность. Возможно, если ожидаемый эффект терапии превышает потенциальный риск для плода (адекватных и строго контролируемых исследований безопасности применения у беременных женщин не проведено). Ацикловир проходит через плаценту. Данные об исходе беременности у женщин, принимавших ацикловир системного действия в I триместре беременности, не показали увеличения числа врожденных пороков у детей по сравнению с общей популяцией. Поскольку в наблюдение было включено небольшое количество женщин, достоверных и определенных выводов о безопасности ацикловира при беременности сделать нельзя.
Кормление грудью. Ацикловир проникает в грудное молоко. После приема ацикловира внутрь, он определялся в грудном молоке в концентрациях, соотношение которых с концентрациями в плазме крови составляло 0,6–1,4. При таких концентрациях в грудном молоке дети, находящиеся на грудном вскармливании, могут получать ацикловир в дозе 0,3 мг/кг/сут. Учитывая это, следует назначать ацикловир кормящим женщинам с осторожностью, только в случае необходимости.
Побочные действия вещества Ацикловир
При системном применении:
Со стороны органов ЖКТ : при в/в введении — анорексия, тошнота и/или рвота; при приеме внутрь — тошнота и/или рвота, диарея, боль в животе.
Со стороны нервной системы: при в/в введении — головокружение, признаки энцефалопатии (спутанность сознания, галлюцинации, судороги, тремор, кома), делирий, угнетенное состояние или психоз (неврологические нарушения обычно наблюдаются у пациентов с предрасполагающими состояниями); при приеме внутрь — недомогание, головная боль, головокружение, ажитация, сонливость.
Со стороны сердечно-сосудистой системы и крови: при в/в введении — анемия, нейтропения/нейтрофилия, тромбоцитопения/тромбоцитоз, лейкоцитоз, гематурия, ДВС-синдром, гемолиз, снижение АД .
Со стороны мочеполовой системы: при в/в введении — транзиторное повышение уровня азота мочевины в крови и уровня креатинина в сыворотке крови (связано с величиной Cmax в плазме и состоянием водного баланса пациента), острая почечная недостаточность (чаще при быстрой в/в инъекции).
Прочие: анафилактические реакции, кожные аллергические реакции (зуд, сыпь, синдром Лайелла, крапивница, многоформная эритема и др.), нарушение зрения, лихорадка, лейкопения, лимфаденопатия, периферические отеки, транзиторное повышение активности печеночных трансаминаз и уровня билирубина; при в/в введении — реакции в месте в/в введения: флебит или локальное воспаление (боль, отечность или покраснение), некроз (при попадании препарата под кожу); при приеме внутрь — миалгия, парестезия, алопеция.
При наружном применении: болезненность, жжение, зуд, кожная сыпь, вульвит.
При применении глазной мази: жжение в месте нанесения, блефарит, конъюнктивит, точечная поверхностная кератопатия.
Взаимодействие
Другие нефротоксичные ЛС повышают риск нефротоксического действия. При одновременном применении с пробенецидом (блокирует канальцевую секрецию) увеличиваются T1/2 и AUC ацикловира, снижается почечный клиренс и замедляется выведение, возможно усиление токсического действия.
Передозировка
Симптомы: головная боль, неврологические нарушения, одышка, тошнота, рвота, диарея, почечная недостаточность, летаргия, судороги, кома.
Лечение: симптоматическая терапия, поддержание жизненно важных функций, достаточная гидратация, гемодиализ (особенно при острой почечной недостаточности и анурии).
Нет данных о передозировке при местном применении.
Пути введения
В/в (капельно), внутрь, местно.
Меры предосторожности вещества Ацикловир
При лечении ацикловиром рекомендуется прием большого количества жидкости (для предупреждения образования осадка ацикловира в почечных канальцах).
Следует соблюдать осторожность при в/в введении пациентам с неврологическими расстройствами, нарушениями функции печени, нарушениями электролитного баланса, выраженной гипоксией, а также с нарушением функции почек (и при назначении внутрь). Для снижения риска поражения почек при в/в введении препарат следует вводить медленно, в течение 1 ч. При появлении симптомов нефропатии препарат отменяют.
Токсическое действие ацикловира на ЦНС более вероятно у больных с нарушенным иммунитетом, у пациентов пожилого возраста, при использовании высоких доз.
При терапии ацикловиром в клинической практике регистрировали тромбоцитопеническую пурпуру и/или гемолитический уремический синдром, в редких случаях с летальным исходом, у пациентов с клинически выраженными формами ВИЧ-инфекции.
Не рекомендуется для назначения детям при лечении ветряной оспы, если заболевание протекает в легкой форме.
При лечении генитального герпеса следует избегать половых контактов или использовать презервативы, т.к. применение ацикловира не предупреждает передачу вируса партнеру.
Крем и мазь для наружного применения (5%) не рекомендуется наносить на слизистые оболочки полости рта и глаз, т.к. возможно развитие выраженного местного воспаления.
При лечении глазной мазью не следует носить контактные линзы.
Читайте также:


