Основные структуры вируса фага т-4
Сборка фага Т4 - гораздо более сложный процесс, чем сборка ВТМ, так как капсид фага Т4 значительно сложнее по своей структурной организации и содержит примерно 40 различных белков. Еще тринадцать дополнительных белков (по сравнению с ВТМ) участвуют в сборке фага Т4, но не входят в состав капсида. Механизм сборки этого вируса был исследован с помощью сочетания генетических, биохимических и электронно-микроскопических методов. Работы Вильяма Вуда и Роберта Эдгара (William Wood , Robert Edgar), посвященные мутантам фага Т4, дефектным по способности к сборке, позволили установить следующее.
1. Существует три основных пути превращений, которые приводят к образованию вируса . В результате этих превращений независимо формируются головка, отросток и нити отростка (рис. 30.11). Если блокировать образование одного из перечисленных компонентов, это не повлияет на синтез двух других.
Рис. 30.11. Морфогенез фага Т4. Числа возле стрелок обозначают гены, продукты которых необходимы для соответствующих этапов сборки

2. Каждая из этих последовательностей превращений идет в строго определенном порядке. Все белки капсида синтезируются одновременно во второй половине цикла заражения. Таким образом, строгой последовательности сборки головки, отростка и нитей отростка способствуют структурные особенности самих промежуточных продуктов. Ни один из этих процессов ассоциации не может идти с заметной скоростью, пока не закончится предыдущий. Возможно, часть энергии связывания на каждом этапе используется для снижения энергии активации следующего процесса ассоциации и таким образом увеличивает его скорость.
3. Головка и отросток должны быть полностью собраны, прежде чем они соединяются друг с другом. Затем готовые нити отростка присоединяются к базальной пластинке. И в этом случае строгая последовательность событий обеспечивает выход только готовых вирусных частиц.
При репликации линейных молекул ДНК, в частности ДНК фага Т4, возникает особая проблема. 5'-концы новообразованной дочерней ДНК застроены не до конца, так как РНК-затравка была удалена, но не была замещена ДНК (рис. 30.12). Напомним, что ДНК-полимераза не способна синтезировать цепи ДНК de novo в направлении 3' → 5' (разд. 24.19). При репликации кольцевых молекул ДНК такой проблемы не возникает, так как 3'-конец новой цепи служит затравкой для завершения синтеза дочерней цепи. Как же решают эту проблему фаг Т4 и другие вирусы, геном которых представляет собой линейную ДНК? Важным указанием на то, как решается эта проблема, послужило открытие, что эти линейные молекулы обладают концевой избыточностью, т.е. последовательность оснований левого конца ДНК в точности повторяется на правом конце:

Рис. 30.12. 5'-концы новосинтезированных линейных молекул ДНК застроены не до конца. Родительские цепи ДНК показаны красным цветом, а дочерние - синим

К тому же при репликации этих молекул ДНК образуются длинные конкатемеры. Эти открытия позволили предложить механизм заполнения 5'-концов дочерних цепей. Поскольку одноцепочечные концы новообразованных двухцепочечных молекул взаимно комплементарны, они быстро реассоциируют (рис. 30.13). Эта комплементарность - следствие концевой избыточности последовательности оснований. В конкатемерной цепочке, состоящей из повторяющихся звеньев - двухспиральных молекул фаговой ДНК, 3'-конец одной молекулы служит затравкой для заполнения 5'-конца другой.
Рис. 30.13. Конкатемерный промежуточный продукт репликации линейных двухцепочечных молекул ДНК. Двухцепочечные молекулы ДНК с незастроенными концами ассоциируют друг с другом благодаря спариванию комплементарных одноцепочечных концов (АВ с ab). Затем одноцепочечные пробелы застраиваются

Рис. 30.14. Схема упаковки ДНК при сборке головки фага Т4

Одновременно происходит разбухание головки. Наконец, когда в головку входит фрагмент ДНК, соответствующий длине одного генома, конкатемерная ДНК расщепляется. Нуклеаза действует не путем узнавания какой-либо определенной последовательности, а расщепляет ДНК именно в тот момент, когда головка наполнена. Этим и объясняется тот факт, что концы молекул ДНК Т4 обладают концевой избыточностью, ДНК упаковывается таким образом, что она может быть очень быстро введена в бактерию при следующем цикле заражения. Чем обеспечивается такая поразительная подвижность, остается загадкой.
Биологическая библиотека - материалы для студентов, учителей, учеников и их родителей.
Наш сайт не претендует на авторство размещенных материалов. Мы только конвертируем в удобный формат материалы, которые находятся в открытом доступе и присланные нашими посетителями.
Если вы являетесь обладателем авторского права на любой размещенный у нас материал и намерены удалить его или получить ссылки на место коммерческого размещения материалов, обратитесь для согласования к администратору сайта.
Разрешается копировать материалы с обязательной гипертекстовой ссылкой на сайт, будьте благодарными мы затратили много усилий чтобы привести информацию в удобный вид.








БАКТЕРИОФАГ Т4 КАК МОДЕЛЬНЫЙ ОБЪЕКТ В СОВРЕМЕННОЙ МОЛЕКУЛЯРНОЙ БИОЛОГИИ
Бактериофаги – наиболее многочисленная и весьма распространенная, а возможно, и самая древняя группа вирусов. Они были обнаружены для большинства бактерий, патогенных, и также сапротрофных. В природе фаги также встречаются там, где есть чувствительные к ним бактерии: в почве и воде, в кишечнике человека и животных, в растениях и т. д. Чем богаче субстрат будет обогащен микроорганизмами, тем намного больше в нем будет бактериофагов.
Модельный объект - бактериофаг очень широко используют для научных исследований. Многие фундаментальные открытия в молекулярной биологии были открыты именно с помощью бактериофага, таковыми являются: генетический код, рекомбинация и репликация нуклеиновых кислот. Его очень легко культивировать самыми примитивными биологическими методами и получать в очень больших количествах.
Бактериофаг Т4 очень удобный модельный объект для развития методов молекулярной биологии и выяснения структурных основ инфекционности вируса. Enterobacteriaphage T4— один из самых изученных вирусов, бактериофаг, поражающий бактерию E. coli. Имеет геномную ДНК порядка 169—170 тысяч пар нуклеотидов, упакованную в икосаэдрическую головку. Вирион также имеет ствол, основание ствола и стволовые отростки — шесть длинных и шесть коротких. Enterobacteriaphage T4 является крупным фагом, имеющий диаметр около 90 нм и длину около 200 нм. Фаг T4 использует только литический цикл развития, но не лизогенный. Рассмотрев строение бактериофага, мы выяснили, что все известные бактериофаги состоят из двух основных компонентов: белков и нуклеиновых кислот. По типу нуклеиновой кислоты они делятся на ДНК - и РНК-содержащие.
Базальная пластинка бактериофага – это сложная молекулярная структура, содержащая не менее 15 различных белков, которая узнает рецепторы на поверхности клеток хозяина и осуществляет структурную перестройку хвоста вируса, необходимую для инфицирования клеток. С помощью криоэлектронной микроскопии, удалось реконструировать трехмерную структуру базальной пластинки фага.
Бактериофаги, способные репродуцироваться в бактерии, разрушать их и выходить при этом в виде полноценных частиц в среду, называются вирулентными фагами.
Наряду с такими фагами существуют и другие - умеренные фаги. ДНК таких фагов после заражения клетки внедряется в ДНК самих бактерий, не нарушая их жизнедеятельности. Она удваивается и в результате передается потомству. Бактерия, в ДНК которой присутствует ДНК умеренного фага, называется лизогенной, а фаговая ДНК, объединенная с бактериальной ДНК, профагом. Если лизогенную бактерию облучить ультрафиолетовым светом или обработать химическими мутагенами, то можно вызвать превращение профага в фаг, т. е. возбудить в бактериальной клетке воспроизведение полноценных частиц фага, в результате которого клетка погибает. Следовательно, в лизогенной бактерии в составе единой бактериальной хромосомы сосуществуют генетический аппарат бактерии с геном вируса, который передается от родительской клетки потомству и может быть активирован (индуцирован).
Из этого можно сделать вывод, что фаги это не только средства против бактерий, но и главный их помощник. Именно бактериофаги помогают меняться бактериям, встраивая свой генетический материал в ее ДНК. Разработка новых антибиотиков - чрезвычайно дорогой и долгий процесс. Но даже появление нового лекарства не гарантирует того, что микробы не выработают от него защиты. Эти условия заставляют специалистов искать средства, которые на современном этапе могут помочь при лечении бактериальных инфекций и повысить его эффективность. Такими препаратами в настоящий момент называют бактериофаги.
Список использованной литературы:
1. Материалы международной научно-практической конференции «Бактериофаги: Тео-
ретические и практические аспекты применения в медицине, ветеринарии и пищевой про-
2. Раутенштейн Я.И., Бактериофагия, М., 1955
![]()
Бактериофаг T4 - один из самых изученных вирусов в мире. Он поражает энтеробактерии, в том числе кишечную палочку, сальмонеллы и чумную палочку.
Этот вирус может стать эффективным способом борьбы с опасными инфекциями. Так что бактериофаг T4 никаких болезней не вызывает, а даже наоборот - помогает с ними бороться. С помощью нитей вирус прикрепляется к клетке болезнетворной бактерии, ДНК вируса попадает в клетку, в следствии чего она разрушается.


![]()
Для того, чтобы люди не пили антибиотики, ученые синтезировали лекарства из естественных для иммунитета человека бактериофагов.
Бактериофаги - это пожиратель микробов в организме, чистильщики.
В данном случае бактериофаг Т4 пожирает кишечную палочку при заражении и человек выздоравливает без антибиотиков.
![]()
Вирус Т4 уже не столь опасен, поскольку выявлены все его особенности развития в организме человека. Сейчас же напротив данный вирус используется, как помощник, который моет уничтожить клетки бактерий.
![]()
Страшный на вид, но полезный для человека вирус Т-4 является бактериофагом, то есть поражает энтеробактерии. Он относительно крупный фаг, его изучали нобелевские лауреаты, такие как Сальвадор Лурия, Альфред Херши, Макс Дельбрюк и другие.
Никакой опасности для здоровья человека этот вирус не несет, а только помогает, пожирая бактерии, словно бы высасывая их.

![]()
Вирус Т4 самый известный и изученный бактериофаг, который пожирает бактерии. Никаких заболеваний этот вирус у человека не вызывает, а даже наоборот, помогает ему бороться с бактериями. Так что беспокоиться по поводу этого вируса не стоит.
Вот как выглядит вирус T4 на фото, сделанном при помощи электронного микроскопа.
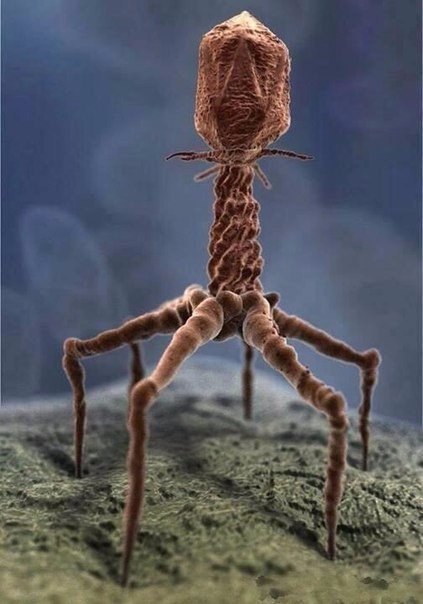
![]()
Есть такой давно известный бактериофаг или фаг Т4 - это действительно вирус и он поражает, одним словом пожирает бактерии и изменяет ее, встраивая свой генетический материал в ДНК этой бактерии. Бактериофаги давно известны, еще с начала прошлого века и с помощью этих интересных микроорганизмов нашли лекарство от бубонной чумы, туберкулеза. Когда открыли антибиотики про эти очень интересные микроорганизмы забыли и очень зря. Сейчас ученые вновь с интересом взялись за изучение бактериофагов.
![]()
Этот вирус называется бактериофаг T4. Батериофаг переводится как пожиратель бактерий, то есть он живет в теле бактерии и ест своего хозяина, за счет чего и живет. К примеру, Т4 кушает кишечную палочку.
То есть этот вирус не только не вызывает сам никаких заболеваний, но еще и помогает человеку бороться с опасными болезнями. Т4 убивает кишечную палочку, другие бактериофаги поедают туберкулезные палочки или даже бактерии бубонной чумы.
![]()
Вирус Т4, называемый иначе как Бактериофаг, является га самом деле полезным для человека вирусом и при этом он очень хорошо изучен. Этот вирус поможет преодолеть организму человека некоторые инфекции: сальмонеллу, кишечные палочки и т.д. Очень широко применим в медицине. Этот вирус пожирает вредные бактерии и помогает обойтись без антибиотиков.
![]()
Вирус Т4 или правильное название Бактериофаг. Что же это такое? Бактериофаги(фаги) - это фирус или если быть точнее бактерии, которые пожирают вредные бактерии. Они заменили антибиотики, которые очень сильно влияют на организм человека, а бактериофаги они не вредны для организма человека. В общем еще одна разработка в сфере медицины, которая позволит людям быть сдоровее, а также лечить рак, так как бактериофаги убивают(высасывают) бактерии, которые находятся в раковых клетках. История возникновения бактериофага(вируса Т4)
Сборка фага Т4 - гораздо более сложный процесс, чем сборка ВТМ, так как капсид фага Т4 значительно сложнее по своей структурной организации и содержит примерно 40 различных белков. Еще тринадцать дополнительных белков (по сравнению с ВТМ) участвуют в сборке фага Т4, но не входят в состав капсида. Механизм сборки этого вируса был исследован с помощью сочетания генетических, биохимических и электронно-микроскопических методов. Работы Вильяма Вуда и Роберта Эдгара (William Wood , Robert Edgar), посвященные мутантам фага Т4, дефектным по способности к сборке, позволили установить следующее.
1. Существует три основных пути превращений, которые приводят к образованию вируса . В результате этих превращений независимо формируются головка, отросток и нити отростка (рис. 30.11). Если блокировать образование одного из перечисленных компонентов, это не повлияет на синтез двух других.
Рис. 30.11. Морфогенез фага Т4. Числа возле стрелок обозначают гены, продукты которых необходимы для соответствующих этапов сборки

2. Каждая из этих последовательностей превращений идет в строго определенном порядке. Все белки капсида синтезируются одновременно во второй половине цикла заражения. Таким образом, строгой последовательности сборки головки, отростка и нитей отростка способствуют структурные особенности самих промежуточных продуктов. Ни один из этих процессов ассоциации не может идти с заметной скоростью, пока не закончится предыдущий. Возможно, часть энергии связывания на каждом этапе используется для снижения энергии активации следующего процесса ассоциации и таким образом увеличивает его скорость.
3. Головка и отросток должны быть полностью собраны, прежде чем они соединяются друг с другом. Затем готовые нити отростка присоединяются к базальной пластинке. И в этом случае строгая последовательность событий обеспечивает выход только готовых вирусных частиц.
При репликации линейных молекул ДНК, в частности ДНК фага Т4, возникает особая проблема. 5'-концы новообразованной дочерней ДНК застроены не до конца, так как РНК-затравка была удалена, но не была замещена ДНК (рис. 30.12). Напомним, что ДНК-полимераза не способна синтезировать цепи ДНК de novo в направлении 3' → 5' (разд. 24.19). При репликации кольцевых молекул ДНК такой проблемы не возникает, так как 3'-конец новой цепи служит затравкой для завершения синтеза дочерней цепи. Как же решают эту проблему фаг Т4 и другие вирусы, геном которых представляет собой линейную ДНК? Важным указанием на то, как решается эта проблема, послужило открытие, что эти линейные молекулы обладают концевой избыточностью, т.е. последовательность оснований левого конца ДНК в точности повторяется на правом конце:
Рис. 30.12. 5'-концы новосинтезированных линейных молекул ДНК застроены не до конца. Родительские цепи ДНК показаны красным цветом, а дочерние - синим
К тому же при репликации этих молекул ДНК образуются длинные конкатемеры. Эти открытия позволили предложить механизм заполнения 5'-концов дочерних цепей. Поскольку одноцепочечные концы новообразованных двухцепочечных молекул взаимно комплементарны, они быстро реассоциируют (рис. 30.13). Эта комплементарность - следствие концевой избыточности последовательности оснований. В конкатемерной цепочке, состоящей из повторяющихся звеньев - двухспиральных молекул фаговой ДНК, 3'-конец одной молекулы служит затравкой для заполнения 5'-конца другой.
Рис. 30.13. Конкатемерный промежуточный продукт репликации линейных двухцепочечных молекул ДНК. Двухцепочечные молекулы ДНК с незастроенными концами ассоциируют друг с другом благодаря спариванию комплементарных одноцепочечных концов (АВ с ab). Затем одноцепочечные пробелы застраиваются

Рис. 30.14. Схема упаковки ДНК при сборке головки фага Т4

Одновременно происходит разбухание головки. Наконец, когда в головку входит фрагмент ДНК, соответствующий длине одного генома, конкатемерная ДНК расщепляется. Нуклеаза действует не путем узнавания какой-либо определенной последовательности, а расщепляет ДНК именно в тот момент, когда головка наполнена. Этим и объясняется тот факт, что концы молекул ДНК Т4 обладают концевой избыточностью, ДНК упаковывается таким образом, что она может быть очень быстро введена в бактерию при следующем цикле заражения. Чем обеспечивается такая поразительная подвижность, остается загадкой.
Биологическая библиотека - материалы для студентов, учителей, учеников и их родителей.
Наш сайт не претендует на авторство размещенных материалов. Мы только конвертируем в удобный формат материалы, которые находятся в открытом доступе и присланные нашими посетителями.
Если вы являетесь обладателем авторского права на любой размещенный у нас материал и намерены удалить его или получить ссылки на место коммерческого размещения материалов, обратитесь для согласования к администратору сайта.
Разрешается копировать материалы с обязательной гипертекстовой ссылкой на сайт, будьте благодарными мы затратили много усилий чтобы привести информацию в удобный вид.
Открытие вирусов Д.И.Ивановским в 1892г. положило начало развитию науки вирусологии. Более быстрому ее развитию способствовали: изобретение электронного микроскопа, разработка метода культивирования микроорганизмов в культурах клеток.
Слово “вирус” в переводе с латинского- яд (животного происхождения). Этот термин применяют для обозначения уникальных представителей живой природы, не имеющих клеточного (эукариотического или прокариотического) строения и обладающих облигатным внутриклеточным паразитизмом, т.е. которые не могут жить без клетки.
В настоящее время вирусология- бурно развивающаяся наука, что связано с рядом причин:
- ведущей ролью вирусов в инфекционной патологии человека (примеры- вирус гриппа, ВИЧ- вирус иммунодефицита человека, цитомегаловирус и другие герпесвирусы) на фоне практически полного отсутствия средств специфической химиотерапии;
- использованием вирусов для решения многих фундаментальных вопросов биологии и генетики.
Основные свойства вирусов (и плазмид), по которым они отличаются от остального живого мира.
1.Ультрамикроскопические размеры (измеряются в нанометрах). Крупные вирусы (вирус оспы) могут достигать размеров 300 нм, мелкие- от 20 до 40 нм. 1мм=1000мкм, 1мкм=1000нм.
2.Вирусы содержат нуклеиновую кислоту только одного типа- или ДНК (ДНК- вирусы) или РНК (РНК- вирусы). У всех остальных организмов геном представлен ДНК, в них содержится как ДНК, так и РНК.
3.Вирусы не способны к росту и бинарному делению.
4.Вирусы размножаются путем воспроизводства себя в инфицированной клетке хозяина за счет собственной геномной нуклеиновой кислоты.
5.У вирусов нет собственных систем мобилизации энергии и белок- синтензирующих систем, в связи с чем вирусы являются абсолютными внутриклеточными паразитами.
6.Средой обитания вирусов являются живые клетки- бактерии (это вирусы бактерий или бактериофаги), клетки растений, животных и человека.
Все вирусы существуют в двух качественно разных формах: внеклеточной- вирион и внутриклеточной- вирус. Таксономия этих представителей микромира основана на характеристике вирионов- конечной фазы развития вирусов.
Строение (морфология) вирусов.
1.Геном вирусов образуют нуклеиновые кислоты, представленные одноцепочечными молекулами РНК (у большинства РНК- вирусов) или двухцепочечными молекулами ДНК (у большинства ДНК- вирусов).
2.Капсид - белковая оболочка, в которую упакована геномная нуклеиновая кислота. Капсид состоит из идентичных белковых субъединиц- капсомеров. Существуют два способа упаковки капсомеров в капсид- спиральный (спиральные вирусы) и кубический (сферические вирусы).
При спиральной симметрии белковые субъединицы располагаются по спирали, а между ними, также по спирали, уложена геномная нуклеиновая кислота (нитевидные вирусы). При кубическом типе симметрии вирионы могут быть в виде многогранников, чаще всего- двадцатигранники - икосаэдры.
3.Просто устроенные вирусы имеют только нуклеокапсид, т.е. комплекс генома с капсидом и называются “голыми”.
4. У других вирусов поверх капсида есть дополнительная мембраноподобная оболочка, приобретаемая вирусом в момент выхода из клетки хозяина- суперкапсид. Такие вирусы называют “одетыми”.
Кроме вирусов, имеются еще более просто устроенные формы способных передаваться агентов - плазмиды, вироиды и прионы.
Основные этапы взаимодействия вируса с клеткой хозяина.
1.Адсорбция- пусковой механизм, связанный со взаимодействием специфических рецепторов вируса и хозяина (у вируса гриппа- гемагглютинин, у вируса иммунодефицита человека- гликопротеин gp 120).
2.Проникновение- путем слияния суперкапсида с мембраной клетки или путем эндоцитоза (пиноцитоза).
3.Освобождение нуклеиновых кислот- “раздевание” нуклеокапсида и активация нуклеиновой кислоты.
4.Синтез нуклеиновых кислот и вирусных белков, т.е. подчинение систем клетки хозяина и их работа на воспроизводство вируса.
5.Сборка вирионов- ассоциация реплицированных копий вирусной нуклеиновой кислоты с капсидным белком.
6.Выход вирусных частиц из клетки, приобретения суперкапсида оболочечными вирусами.
Исходы взаимодействия вирусов с клеткой хозяина.
1.Абортивный процесс- когда клетки освобождаются от вируса:
- при инфицировании дефектным вирусом, для репликации которого нужен вирус- помощник, самостоятельная репликация этих вирусов невозможна ( так называемые вирусоиды). Например, вирус дельта (D) гепатита может реплицироваться только при наличии вируса гепатита B, его Hbs - антигена, аденоассоциированный вирус- в присутствии аденовируса);
- при инфицировании вирусом генетически нечувствительных к нему клеток;
- при заражении чувствительных клеток вирусом в неразрешающих условиях.
2.Продуктивный процесс- репликация (продукция) вирусов:
- гибель (лизис) клеток (цитопатический эффект)- результат интенсивного размножения и формирования большого количества вирусных частиц - характерный результат продуктивного процесса, вызванного вирусами с высокой цитопатогенностью. Цитопатический эффект действия на клеточные культуры для многих вирусов носит достаточно узнаваемый специфический характер;
- стабильное взаимодействие, не приводящее к гибели клетки (персистирующие и латентные инфекции) - так называемая вирусная трансформация клетки.
3.Интегративный процесс- интеграция вирусного генома с геномом клетки хозяина. Это особый вариант продуктивного процесса по типу стабильного взаимодействия. Вирус реплицируется вместе с геномом клетки хозяина и может длительно находиться в латентном состоянии. Встраиваться в ДНК- геном хозяина могут только ДНК- вирусы (принцип “ДНК- в ДНК”). Единственные РНК- вирусы, способные интегрироваться в геном клетки хозяина- ретровирусы, имеют для этого специальный механизм. Особенность их репродукции- синтез ДНК провируса на основе геномной РНК с помощью фермента обратной транскриптазы с последующим встраиванием ДНК в геном хозяина.
Основные методы культивирования вирусов.
1.В организме лабораторных животных.
2.В куриных эмбрионах.
3.В клеточных культурах - основной метод.
Типы клеточных культур.
1.Первичные (трипсинизированные) культуры- фибробласты эмбриона курицы (ФЭК), человека (ФЭЧ), клетки почки различных животных и т.д. Первичные культуры получают из клеток различных тканей чаще путем их размельчения и трипсинизации, используют однократно, т.е. постоянно необходимо иметь соответствующие органы или ткани.
2.Линии диплоидных клеток пригодны к повторному диспергированию и росту, как правило не более 20 пассажей (теряют исходные свойства).
3.Перевиваемые линии (гетероплоидные культуры), способны к многократному диспергированию и перевиванию, т.е. к многократным пассажам, наиболее удобны в вирусологической работе- например, линии опухолевых клеток Hela, Hep и др.
Специальные питательные среды для культур клеток.
Используются разнообразные синтетические вирусологические питательные среды сложного состава, включающие большой набор различных факторов роста- среда 199, Игла, раствор Хэнкса, гидролизат лактальбумина. В среды добавляют стабилизаторы рН (Hepes), различные в видовом отношении сыворотки крови (наиболее эффективной считают эмбриональную телячью сыворотку), L-цистеин и L-глютамин.
В зависимости от функционального использования среды могут быть ростовые (с большим содержанием сыворотки крови) - их используют для выращивания клеточных культур до внесения вирусных проб, и поддерживающие (с меньшим содержанием сыворотки или ее отсутствием)- для содержания инфицированных вирусом клеточных культур.
Выявляемые проявления вирусной инфекции клеточных культур.
2.Выявление телец включений.
3. Выявление вирусов методом флюоресцирующих антител (МФА), электронной микроскопией, авторадиографией.
4.Цветная проба. Обычный цвет используемых культуральных сред, содержащих в качестве индикатора рН феноловый красный, при оптимальных для клеток условиях культивирования (рН около 7,2)- красный. Размножение клеток меняет рН и соответственно- цвет среды с красного на желтый за счет смещения рН в кислую сторону. При размножении в клеточных культурах вирусов происходит лизис клеток, изменения рН и цвета среды не происходит.
5.Выявление гемагглютинина вирусов- гемадсорбция, гемагглютинация.
6.Метод бляшек (бляшкообразования). В результате цитолитического действия многих вирусов на клеточные культуры образуются зоны массовой гибели клеток. Выявляют бляшки- вирусные “ клеточно- негативные” колонии.
Название семейства вирусов заканчивается на “viridae”, рода- “virus”, для вида обычно используют специальные названия, например - вирус краснухи, вирус иммунодефицита человека- ВИЧ, вирус парагриппа человека типа 1 и т.д.
Вирусы бактерий (бактериофаги).
Естественной средой обитания фагов является бактериальная клетка, поэтому фаги распространены повсеместно (например, в сточных водах). Фагам присущи биологические особенности, свойственные и другим вирусам.
Наиболее морфологически распространенный тип фагов характеризуется наличием головки- икосаэдра, отростка (хвоста) со спиральной симметрией (часто имеет полый стержень и сократительный чехол), шипов и отростков (нитей), т.е. внешне несколько напоминают сперматозоид.
Взаимодействие фагов с клеткой (бактерией) строго специфично, т.е. бактериофаги способны инфицировать только определенные виды и фаготипы бактерий.
Основные этапы взаимодействия фагов и бактерий.
1.Адсорбция (взаимодействие специфических рецепторов).
2.Внедрение вирусной ДНК (инъекция фага) осуществляется за счет лизирования веществами типа лизоцима участка клеточной стенки, сокращения чехла, вталкивания стержня хвоста через цитоплазматическую мембрану в клетку, впрыскивание ДНК в цитоплазму.
4.Выход дочерних популяций.
Основные свойства фагов.
Различают вирулентные фаги, способные вызвать продуктивную форму процесса, и умеренные фаги, вызывающие редуктивную фаговую инфекцию (редукцию фага). В последнем случае геном фага в клетке не не реплицируется, а внедряется (интегрируется) в хромосому клетки хозяина (ДНК в ДНК), фаг превращается в профаг. Этот процесс получил название лизогении. Если в результате внедрения фага в хромосому бактериальной клетки она приобретает новые наследуемые признаки, такую форму изменчивости бактерий называют лизогенной (фаговой) конверсией. Бактериальную клетку, несущую в своем геноме профаг, называют лизогенной, поскольку профаг при нарушении синтеза особого белка- репрессора может перейти в литический цикл развития, вызвать продуктивную инфекцию с лизисом бактерии.
Умеренные фаги имеют важное значение в обмене генетическим материалом между бактериями- в трансдукции (одна из форм генетического обмена). Например, способностью вырабатывать экзотоксин обладают только возбудитель дифтерии, в хромосому которого интегрирован умеренный профаг, несущий оперон tox, отвечающий за синтез дифтерийного экзотоксина. Умеренный фаг tox вызывает лизогенную конверсию нетоксигенной дифтерийной палочки в токсигенную.
По спектру действия на бактерии фаги разделяют на :
- поливалентные (лизируют близкородственные бактерии, например сальмонеллы);
- моновалентные (лизируют бактерии одного вида);
- типоспецифические (лизируют только определенные фаговары возбудителя).
На плотных средах фаги обнаруживают чаще с помощью спот (spot) - теста (образование негативного пятна при росте колоний) или методом агаровых слоев (титрования по Грациа).
Практическое использование бактериофагов.
1.Для идентификации (определение фаготипа).
2.Для фагопрофилактики (купирование вспышек).
3.Для фаготерапии (лечение дисбактериозов).
4.Для оценки санитарного состояния окружающей среды и эпидемиологического анализа.
Читайте также:




