Организация генома вируса гепатита с
Вирус гепатита С (ВГС) представляет собой небольшой (55-65 нм в размере) сферический РНК-содержащий вирус из семейства Flaviviridae. HCV является причиной развития гепатита С в организме человека. ВГС состоит из основного генетического материала (РНК), окруженной защитной белковой оболочкой, а также липидной (жировой) оболочкой сотовой структуры, которая содержит два оболочечных белка — гликопротеины E1, E2, встроенные в липидные оболочки. 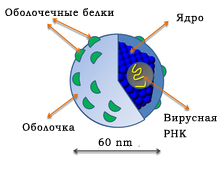
Белки E1 и E2 обеспечивают проникновение вируса в клетку и закрепление в ней.
Геном HCV включает в себя одноцепочную РНК, имеющую 9600 нуклеотидных оснований. На 5' и 3' концах РНК ВГС расположены нетранслируемые регионы, имеющие приблизительно 340 и 60 оснований, которые важны для жизнедеятельности и репликации вирусной РНК. Гены, кодирующие структурные белки, расположены у 5' области генома вируса, а неструктурные — у 3' области. 5' участок генома вируса гепатита С кодирует три структурных белка ВГС: два оболочечных белка, кодированных зоной Е1 и Е2 и C (кор) нуклеокапсидный белок.
3' область генома кодирует неструктурные белки NS2 , NS3, NS4 , NS4A, NS4B, NS5 , NS5A и NS5B. 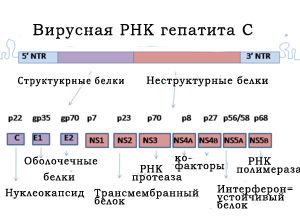
Белки, кодированные с зон NS2 и NS4, выполняют клеточную мембранную функцию. Белок зоны NS3 является РНК-протеазой. Белок, синтезированный NS4A зоной, выполняет стабилизирующую функцию. Зона NS5B представляет собой РНК-полимеразу. NS5A устойчив к интерферону и играет значительную роль в вирусном патогенезе.
Репликация HCV включает в себя несколько этапов. Вирус размножается в основном в гепатоцитах печени, где, по оценкам, ежедневно каждая инфицированная клетка производит около пятидесяти вирионов (вирусных частиц). Вирус может также реплицировать в мононуклеарных клетках периферической крови, что способствует высокому уровню иммунологических нарушений, обнаруживаемых у инфицированных хроническим гепатитом С (ХВГС). 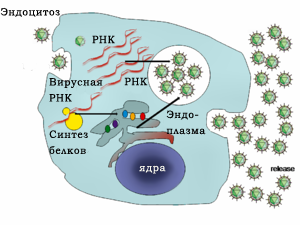
Вступление в клетки хозяина происходит через сложные взаимодействия между вирионами и клеточными поверхностями молекул. Оказавшись внутри гепатоцитов, ВГС использует внутриклеточный механизм репликации. Геном ВГС использует для получения одного белка более 3000 аминокислот. Полипротеин взаимодействует с вирусной и клеточной протеазой для производства трех структурных и семи неструктурных (NS) белков. РНК формируется с помощью РНК-зависимой полимеразы NS5B, которая производит отрицательную цепь промежуточных РНК. Отрицательные цепи РНК затем служат шаблоном для производства новых позитивно-ориентированных вирусных геномов. Находящиеся в стадии становления геномы могут далее реплицироваться и образовывать новые вирусные частицы, которые впоследствии выходят из клетки.
Наиболее широко используются классификация вируса гепатита С по следующим генотипам (основным типам): 1, 2, 3, 4, 5, 6, 7, 8, 9, 10 и 11. Генотипы ВГС могут быть разбиты на подтипы, некоторые из которых включают в себя:
HCV эволюционировал в течение нескольких тысяч лет. Этот факт может объяснить нынешние особенности глобального распространения генотипов и подтипов:
1а — распространен в основном в Северной и Южной Америке, а также в Австралии
1b — чаще всего встречается в Европе и Азии.
2a — наиболее распространен в Японии и Китае.
2b — в США и Северной Европе
2c — в Западной и Южной Европе.
3а — Австралия, Европа и Южная Азия.
4а — Египет
4с — Центральная Африка
5а — Южная Африка
6а — Гонконг, Макао и Вьетнам
7а и 7b — Таиланд
8а, 8b и 9а — Вьетнам
10а и 11а — Индонезия
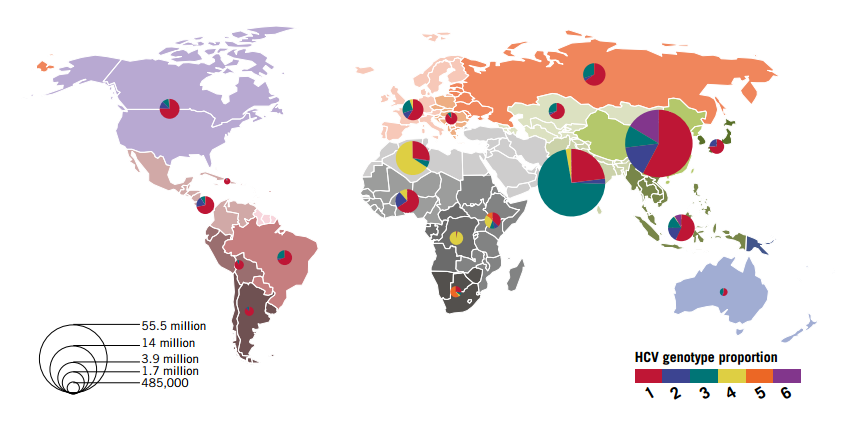
Всемирная организация здравоохранения на сегодня выделяет 6 основных генотипов вируса, их распространенность представлена ниже:
В Европе и России частота определения генотипов располагается в следующем порядке: 1b, 3а, 2а, 2b. Генотип является клинически важным при определении потенциального ответа на терапию различными препаратами и продолжительности такой терапии.
Анимация действия вируса HCV

В статье представлены рекомендации по лечению хронического гепатита С при инфицировании генотипом 2 ВГС и рекомбинантным вариантом вируса RF2k/1b, который при использовании коммерческих тест-систем типируется как генотип 2 в связи с особенностями организа
The paper presents the guidelines on treatment of chronic hepatitis c, in infecting with genotype 2 VHS and with recombinant variant of RF2k/1b virus which, in use of commercial test-systems, is classified as genotype 2B in connection with characteristics of its genome structure. The algorithm for diagnostic and therapeutic strategy in this category of patients was suggested.
Главной целью лечения хронического гепатита С (ХГС) является полное излечение от заболевания, что возможно только при условии эрадикации вируса из организма. Инфекция вирусом гепатита С (ВГС) излечивается у 99% пациентов после завершения курса противовирусной терапии (ПВТ) при наличии устойчивого вирусологического ответа (УВО) [1], который считается достигнутым, если РНК ВГС в организме пациента отсутствует через 12 (УВО12) или 24 (УВО24) недели после завершения курса лечения (Европейская ассоциация по изучению болезней печени, European Association for the Study of the Liver, EASL, 2015) [2].
До 2011 г. в Европе, США и России для лечения ХГС была утверждена комбинация пегилированного интерферона (ПЕГ ИФН) и рибавирина (РИБ) с продолжительностью курса 24 или 48 недель в зависимости от генотипа ВГС. У пациентов, инфицированных генотипом 1 ВГС, частота достижения УВО в результате лечения данной комбинацией в течение 48 недель достигала приблизительно 50% у пациентов-европеоидов (не афроамериканцев и не азиатов). Более высокая частота УВО регистрировалась у пациентов, инфицированных генотипами 2 и 3 ВГС (до 80%, и в большей степени это относилось к пациентам с генотипом 2 ВГС) [3].
С внедрением в клиническую практику ПППД для лечения ХГС, вызванного ВГС 2-го генотипа, в Европе начиная с 2014 г. широкое применение получили схемы лечения, не содержащие ИФН. Для лечения пациентов, инфицированных генотипом 2 ВГС, одобрены для применения следующие ПППД: Софосбувир (SOF) — пангенотипный нуклеотидный аналог, ингибитор РНК-зависимой РНК-полимеразы NS5B ВГС (одобрен в январе 2014 г.), Даклатасвир (DAC) — пангенотипный ингибитор белка NS5A ВГС — (одобрен в августе 2014 г.). Применение комбинации SOF и РИБ рекомендовано больным ХГС при наличии инфицирования генотипом 2 ВГС (12 недель) или генотипом 3 ВГС (24 недели). Данная комбинация обеспечивает частоту УВО порядка 80–95% даже в случае предшествующей неудачи лечения ПЕГ ИФН + РИБ.
В то же время в рекомендациях EASL 2015 г. [2] указано, что, несмотря на то, что эта комбинация является оптимальным вариантом для пациентов, инфицированных генотипом 2 ВГС, можно использовать и другие схемы терапии (SOF + DAC ± РИБ), особенно для пациентов, не достигших УВО в результате лечения сочетанием препаратов SOF + РИБ. Например, для пациентов, не ответивших в прошлом на двойную терапию ПЕГ ИФН + РИБ, применять 12-недельный курс терапии комбинацией препаратов ПЕГ ИФН + РИБ + SOF, которая рекомендована для всех генотипов ВГС. А если нет возможности применения SOF и DAC, можно назначать сочетание ПЕГ ИФН + РИБ в соответствии с предыдущими рекомендациями Европейской ассоциации по изучению болезней печени [3] и Всемирной организации здравоохранения 2015 г. [4]. В табл. 1 представлены рекомендации Европейской ассоциации по изучению болезней печени 2015 г. по лечению больных ХГС, инфицированных генотипами 1, 2 и 3 ВГС.
Для пациентов с циррозом печени изменения в рекомендуемых Европейской ассоциации по изучению болезней печени (2015 г.) схемах лечения касаются в основном длительности курса и наличия/отсутствия в применяемой схеме рибавирина (табл. 2).
Для российских пациентов с ХГС, инфицированных генотипом 2 ВГС, в соответствии с российскими рекомендациями по лечению взрослых больных гепатитом С 2014 г. [5] и в связи с тем, что SOF начинает применяться в России в 2016 г., пока в основном доступно лечение ПЕГ ИФН + РИБ. Необходимо отметить, что эффективность лечения данной группы пациентов двойной терапией ПЕГ ИФН + РИБ в течение 24 недель превышает 80%, как показали регистрационные исследования этой терапии у больных ХГС, инфицированных данным генотипом [6, 7]. По данным исследований последних лет, эффективность остается очень высокой (87–97%) и при сокращении курса терапии до 12–16 недель по данным исследований NORDynamIC, CLEO и других исследований, опубликованных в период с 2007 г. по 2016 г., особенно при условии достижения быстрого вирусологического ответа (БВО) к 4-й неделе лечения [8–13]. Кроме того, на фоне высокой стоимости безинтерфероновых схем лечения (более миллиона рублей) двойная терапия ПЕГ ИФН + РИБ в течение 24 недель у пациентов без цирроза печени имеет значительное преимущество с фармакоэкономической точки зрения, поскольку затраты на ее проведение могут составлять не более 200 тысяч рублей, а эффективность лечения сопоставима с таковой при лечении безинтерфероновыми схемами (SOF + РИБ по данным исследований FISSION, POSITRON и VALENCE (97%, 93% и 97% соответственно)) [14–16]. Однако, принимая во внимание существенно меньшую эффективность лечения пациентов с циррозом печени (независимый от генотипа предиктор ответа на ПВТ), безусловно, безинтерфероновые схемы лечения являются предпочтительными для данной категории пациентов (по данным исследования VALENCE 92% достижения УВО после 24 недель лечения у пациентов с циррозом, не получавших ранее лечение).
К 2015 г. опубликованы данные по эффективности лечения ПЕГ ИФН + РИБ в целом только у 23 пациентов, инфицированных рекомбинантным вариантом RF2k/1b ВГС. Эффективность лечения в небольших группах пациентов описана в работах как российских авторов, так и исследователями из Грузии, где рекомбинатный вариант составляет 76% в структуре популяции генотипа 2 ВГС, а также исследователями из США, которые представили данные об эффективности лечения этого варианта не только ПЕГ ИФН + РИБ, но и SOF + РИБ. Эффективность лечения ПЕГ ИФН + РИБ варьировала от 20% до 48%, и только в 30% случаев достигнут успех в результате лечения SOF + РИБ по схеме лечения для генотипа 2–12 недель [23–25].
В исследовании, посвященном клиническому значению предикторов успеха терапии, в том числе генетически детерминированных (как со стороны ВГС, так и человека), выполняемом авторами статьи в течение двух лет, получены данные о том, что из 19 обследованных больных московской популяции больных ХГС, инфицированных генотипом 2 ВГС по данным коммерческих тест-систем, у 7 (37%) пациентов выявлен межгенотипный рекомбинант RF2k/1b по результатам генотипирования на основе анализа фрагментов NS5B области генома ВГС. При этом у пяти из них был опыт терапии ПЕГ ИФН + РИБ в течение 24–32 недель, и у всех (100%) не был достигнут УВО.
Проведенное нами в 2015 г. сравнительное исследование результатов типирования вариантов ВГС с использованием различных коммерческих тест-систем российского производства и результатов генотипирования на основе анализа фрагментов NS5B и core областей генома подтвердило невозможность идентификации в клинической лабораторной практике рекомбинантного варианта RF2k/1b ВГС, который при использовании коммерческих тест-систем типируется как генотип 2 в связи с особенностями организации его генома. Для идентификации этого варианта вируса необходимо проводить генотипирование, основанное на полимеразной цепной реакции с применением типоспецифических праймеров, соответствующих двум областям, вторая из которых должна находиться в области неструктурных генов, в частности, в гене, кодирующем РНК-зависимую РНК-полимеразу. К сожалению, пока такой подход не реализован ни в одной российской зарегистрированной коммерческой тест-системе, но в принципе реализуем в лабораторной практике.
Принимая во внимание, что генотип ВГС определяет схемы назначаемой терапии, а имеющиеся данные результатов ПВТ указывают на то, что комбинации противовирусных препаратов, используемых для генотипа 2 ВГС, не позволяют достичь УВО большинству пациентов, инфицированных рекомбинантным вариантом RF2k/1b, существует потребность включения в клиническую лабораторную практику субтипирования всех изолятов генотипа 2 на основе анализа фрагмента NS5B области генома. Такие мероприятия позволят успешно выявлять рекомбинантные формы ВГС и повысят эффективность ПВТ.
На рисунке приведен предлагаемый нами алгоритм по диагностике и лечению больных ХГС, у которых по данным коммерческих тест-систем выявлен генотип 2 ВГС.
Литература
О. О. Знойко* , 1 , доктор медицинских наук, профессор
К. Р. Дудина*, доктор медицинских наук
А. Н. Козина*
С. А. Шутько*, кандидат медицинских наук
В. В. Огарев*
О. В. Калинина**
Н. Д. Ющук*, доктор медицинских наук, профессор, академик РАН
* ГБОУ ВПО МГМУ им. А. И. Евдокимова МЗ РФ, Москва
** ФБУН СПбНИИЭМ им. Пастера, Санкт-Петербург
Вирус гепатита С – возбудитель инфекционного заболевания, сопровождающегося постоянным прогрессированием некротических изменений тканей печени, вплоть до злокачественного перерождения и формирования метастатических опухолей.

РНК вируса обнаруживается в крови лабораторными методиками уже спустя 7–14 дней после инфицирования. Но выделение патогена в отдельной культуре и его искусственная репликация до недавнего времени представляли серьезную проблему.
И только в середине 2000-х годов удалось выделить главные структурные протеины и неструктурные белки вируса, механизмы его репликации в гепатоцитах.
Основные случаи инфицирования вирусом HCV связаны с непосредственным попаданием патогена в кровь при гемотрансфузии, с засохших частиц контаминированного материала на медицинских, диагностических и косметологических инструментах.
Гораздо реже возбудитель HCV передается при половом акте. Вероятность внутриутробного инфицирования не превышает 3–5%. При этом окончательно не установлено, происходит передача вируса через плаценту либо во время родов.
История и эпидемиология инфекционной болезни
Изначально большинство специалистов склонялось к мнению, что заболевание является асимптоматическим расстройством функциональной активности печени. При этом утверждалось, в отличие от других известных на тот момент инфекционных болезней органа, гепатит С не способен вызвать значимых осложнений (за исключением неспецифического увеличения концентрации аминотрансфераз).
Но последующее наблюдение за пациентами с HCV продемонстрировало, что у каждого пятого без лечения спустя 10–11 лет развивался цирроз.
С появлением лабораторных методик, позволяющих подробно изучить, как выглядит вирус под микроскопом, выделить из сыворотки крови специфические антитела стали возможными долговременные клинические исследования. Провели культивирование и анализ образцов биологического материала, ранее полученных от пациентов, инфицированных HCV (до 5–10 –15 и более лет назад). Таким образом появились убедительные данные относительно эволюции HCV-инфекции.
Одним из главных выводов стало подтверждение возможности самостоятельной эрадикации вируса на острой стадии течения заболевания. Причем чаще это происходит у больных младше 12 лет.
Риск развития цирроза установили на уровне 15%, и подобные нарушения печени формировались спустя 20–25 лет. Позже, по мере накопления клинического и практического опыта, данные были скорректированы.
Сформировалось четкое представление о прогрессировании вирусной инфекции. Установлена взаимосвязь между HCV и разнообразными внепеченочными проявлениями. Изучение иммунологического ответа на антигены вируса позволило предположить вероятность формирования аутоиммунных нарушений, которые затрагивают щитовидную железу, сосудистую систему, опорно-двигательный аппарат.
Причем если доктора могут с уверенностью сказать, как HCV повлияет на работу печени через 5–20 и более лет после заражения, то прогнозировать внепеченочные проявления инфекции невозможно.
Только недавно частицы вируса были обнаружены в различных структурах нервной системы, в частности, головном мозге. Это позволило предположить прямую связь первых симптомов инфекции (усталости, слабости, психоэмоциональных расстройств и т.д.) с особенностями патогенеза заболевания.
Постоянно появляются новые тест-системы. Причем каждое последующее поколение диагностических наборов отличается большей специфичностью, точностью и чувствительностью.
Общее количество инфицированных колеблется в пределах 3–5% населения земного шара. Но медицинская статистика учитывает только официальные данные, на практике эта цифра гораздо выше. Патология преимущественно распространена в странах, расположенных на севере Африканского континента, в Европе – на юге Италии.
Недавно появились данные относительно увеличения количества заболевших в Китае, Пакистане и некоторых других азиатских странах. Минимальное число пациентов (менее 0,1%) зарегистрировано в Великобритании и странах Скандинавии.
Эпидемиология гепатита С на территории России изучена недостаточно. Полагают, что количество заболевших составляет 2,0–2,9%.
Передача инфекционного гепатита С возможна при:
- переливании крови и ее продуктов;
- трансплантации органов, изъятых у инфицированных доноров;
- инъекциях и другие инвазивных процедурах, выполняемых контаминированным инструментарием.
С появлением высокочувствительных тест-систем вероятность инфицирования при гемотрансфузии практически сведена к нулю. А большая часть случаев заболевания связана с заражением при использовании общих игл (например, в США эта цифра достигает 60% от общего количество заболевших).
По сравнению с парентеральным путем передачи, вероятность заразиться при половом контакте либо внутриутробно низка. Так, при случайном, единоразовом повреждении кожи контаминированным инструментом риск заражения оценивают в 7–10%, перинатально – не более 5–6%.
Данные относительно полового пути передачи HCV противоречивы. Известны случаи длительных постоянных отношений, когда один из партнеров инфицирован, при этом другой оставался совершенно здоровым. Точный источник заражения вирусом установить чаще всего затруднительно.
Что значит РНК вируса гепатита С
К настоящему моменту идентифицировано 6 основных генотипов инфекционного гепатита С, которые отличаются специфической географической привязанностью. Определение конкретной разновидности заболевание имеет огромное значение в подборе схемы терапии патологии. Установлено, что если выявлен 1 генотип, вероятность положительного эффекта лечения ниже.
HCV относится к семейству Flaviviridae. Как и другие представители этого класса, представляет собой заключенный в оболочку нуклеокапсид, который проникает в клетки печени из кровотока. После попадания в гепатоциты внешняя мембрана патогена разрушается, и высвобождаются частицы вируса, размер которых не превышает 70 нм.

N-участок полипротеинов кодирует структурные белки, включая основной элемент нуклеокапсида core и гликопротеины оболочки Е1 и Е2, которые в сочетании с неструктурными протеинами NS2–NS5B формируют вирусные частицы (NS3, NS4A, NS4B, NS5A и NS5B также играют огромную роль в репликации HCV).
С-конечный участок core и протеины оболочки при помощи специфических пептидаз обеспечивают проникновение вируса в клетку печени и последующее взаимодействие с эндоплазматическим ретикулумом и другими органеллами гепатоцита.
Core и фактически каждый из неструктурных протеинов являются антигенами, провоцирующими выработку антител (АТ). Установление их титра лежит в основе иммуноферментного анализа – одного из основных диагностических тестов для подтверждения болезни. При позитивном результате обследование пациентов продолжают при помощи полимеразной цепной реакции, основная цель которой – определение РНК HCV.
Если РНК не обнаружена, лечение не назначают, даже при позитивном ИФА. Но наличие РНК, подтвержденное результатами ПЦР, свидетельствует об инфицировании. При минимальной виремии (без роста показателей) человек долгое время может оставаться носителем болезни. Но в любой момент распространение процесса может ускориться.
После постановки диагноза у пациента возникает вопросы:
- HCV является вирусом или бактерией?
Возбудитель заболевания – РНК-содержащий вирус, поэтому прием антибиотиков не только нецелесообразен, но и опасен из-за гепатотоксичности подавляющего большинства антибактериальных средств. - Когда лучше делать анализ на HCV?
Антитела к патогену выделяются сразу же после проникновения вируса в организм. Но в количестве, достаточном для определения лабораторным путем, иммуноглобулины накапливаются в среднем через 2 месяца. Что касается ПЦР, сроки выявления зависят от аналитической чувствительности РНК. При использовании современных тестов анализ можно делать уже через 10–14 суток.
Изучение под микроскопом и при помощи других технологий строение вируса позволило создать высокоэффективные препараты, необратимо останавливающие процессы деления РНК.
Устойчивость возбудителя
Распространенность HCV и существующий риск заражения при различных манипуляциях, включая эстетические процедуры, обуславливает устойчивость вируса гепатита С во внешней среде. Перечень биологических жидкостей, где содержится возбудитель в концентрациях, достаточных для заражения, ограничен.
В слюне вирус практически не обнаруживается. Это связывают с находящимися в ротовой полости ферментами, которые разрушают белки, составляющие структуру HCV. Поэтому вероятность передачи патогена при поцелуях минимальна.
Жизненный цикл вируса таков, что он сохраняет активность и контагиозность продолжительное время в засохшей крови. При благоприятных температурных условиях (от 6 до 20 градусов выше нуля) этот срок длится до 4–6 недель. При повышении температуры данный период сокращается до 5–6 суток. При заморозке (в том числе донорского материала) HCV остается жизнеспособным на протяжении неопределенного времени и является заразным и после размораживания.
Какие процессы запускаются после инфицирования
Но применительно к течению патологии у человека эта информация требует подтверждения. Достоверно известно, что HCV отличается тропностью именно к тканям печени.
Выявить возбудителя гепатита С в крови можно при помощи ряда диагностических тестов:
- иммуноглобулины к HCV определяют иммуноферментным анализом;
- установить наличие РНК можно методом качественной или количественной ПЦР.
Косвенно на вирусное поражение печени могут указывать результаты печеночных проб и биохимического анализа крови. Если антитела или РНК патогена в крови не обнаружены, но риск заражения слишком велик (например, после случайного пореза, незащищенного полового акта и т.д.) исследования повторяют через 2–3 месяца.

Генотипирование вируса гепатита С
Разница в структуре между разновидностями патогена составляет порядка 30–35%. Внутри одного генотипа выделяют субтипы, различия между ними не превышают 25%. У каждого пациента Hepatitis C Virus может мутировать с формированием так называемых квази-типов.
Генотипирование вируса гепатита С – один из основных анализов, назначается только один раз и обязательно проводится перед началом курса противовирусной терапии.
Для определения разновидности патогена РНК HCV должна содержаться в крови в достаточно высокой концентрации. Поэтому, если не определяется генотип патогена, исследование повторяют через 1–2 недели.
Тип возбудителя гепатита С в целом влияет как на медикаменты, составляющие схему лечения, так и на прогноз. При 3 генотипе обязательны инструментальные исследования печени из-за высокого риска осложнений. Первый тип крайне сложно поддается терапии.
Генотипирование проводится методом ПЦР.
Эффективность противовирусной терапии напрямую зависит от стадии болезни, когда был поставлен диагноз. Софосбувир, Даклатасвир, Велпатасвир и другие медикаменты прямого действия позволяют вывести вирус из организма практически у всех пациентов вне зависимости от генотипа.
Поэтому при подозрении на заражение следует сдать кровь на ИФА или ПЦР. Для постановки диагноза на ранней стадии эти исследования повторяют ежегодно.
Специфической профилактики (вакцины) от гепатита С не существует.
Для обработки медицинских инструментов и рабочей поверхности используют химические растворы и соединения, способные убить вирус, т. е. содержащие хлористоводородную, фосфорную кислоту, пропанол, этанол.
Когда пациенты интересуются, убивает ли спирт вирус, доктора дают положительный ответ. Но объясняя, погибает ли от спирта возбудитель гепатита С, врач подчеркивает, что концентрация этанола должна быть не менее 70%.
Также патоген уничтожается при термической обработке. При какой температуре убивается возбудитель HCV? При 60°для этого требуется 20–30 минут, при температуре кипячения – до 5 минут, при дезинфекции в автоклаве – около 1,5–2 минут. Подобные режимы обработки подходят для стерилизации медицинского и косметического инструментария, стирки белья, загрязненного контаминированным материалом.

Эффективность нового поколения методов лечения гепатита С — противовирусных средств прямого действия (ПППД), зависит от генотипа, подтипа и связанных с резистентностью замен, присутствующих у отдельных пациентов. Целью данного исследования была оценка массивной платформы секвенирования для анализа генотипов и подтипов вируса гепатита С (ВГС) с целью оптимизации терапии.
Всего было проанализировано 84 пациента с гепатитом С. Методология рутинного генотипирования ВГС, используемая в лечебном учреждении (Versant HCV Assay, LiPA), была сопоставлена с платформой глубокого секвенирования (454/GS-Junior и Illumina MiSeq).
Пациенты, посещающие амбулаторную клинику Университетской больницы Вальме (январь 2015 — май 2016) с хронической активной инфекцией ВГС, были отобраны и классифицированы по генотипу, определенному с помощью анализатора ВГС Genotype 2.0 (LiPA ВГС V.2.0). Все данные пациентов были закодированы для сохранения анонимности. Для определения вирусной нагрузки и генотипов использовали образцы сыворотки крови, полученные от пациентов до лечения ВГС. Средняя вирусная нагрузка составила 6,89 × 10^6 ± 7,02 × 10^5.
Всего было обследовано 84 пациента: 51 мужчина и 33 женщины. Их средний возраст на исходном уровне составил 53,8 ± 8,3 года. Тридцать пять пациентов (42%) получали тройную терапию ВГС (пегилированный интерферон + рибавирин + телапревир / боцепревир). Сорок девять пациентов (58%) получили без-интерфероновую терапию, основанную на софосбувире. Семнадцать (14%) пациентов, не ответили на противовирусную терапию: 15 не отреагировали на тройную схему ИНФ+РБВ+ТЕЛ, и два не ответили на терапию софосбувиром.
Распределение генотипов ВГС для исследования пациентов в зависимости от используемого метода генотипирования — анализатор (LiPA) и глубокого секвенирования представлены на рисунке 1 (см. ниже). Основное различие выявлено у больных, инфицированных генотипами ВГС 3 и 4, которые не могли быть классифицированы по подтипам обычным методом. Для еще двух образцов подтип не удалось определить с помощью LiPA. Эта проблема была решена при использовании метода глубокого секвенирования.
Благодаря методу глубокого секвенирования удалось выявить пациентов с микст-инфекцией ВГС — шесть из 84 пациентов (7%) были инфицированы более чем одним подтипом одновременно. Четыре из них (4/6, 67%) были инфицированы подтипами 1a и 1b, а два других (2/6, 33%) — подтипами 1b и 3a.