Определение титра вируса методом бляшек
Прочитайте:
|
Бляшками называются округлые участки разрушенных по действием вируса клеток однослойной культуры. Это своеобразные "негативные колонии" вирусов, образовавшиеся на месте попадания одного вириона.
Для получения бляшек клеточный монослой заражают небольшой концентрацией вируса и фиксируют адсорбировавшиеся на клетках вирионы с помощью агарового покрытия, в которое добавлен витальный краситель - нейтральный красный. В таких условиях ЦПД вирусов имеет очаговый характер, погибшие клетки дегенерируют, теряют способность удерживать нейтральный красный и обесцвечиваются. В результате на непрозрачном равномерно розовом фоне клеточного монослоя появляются бляшки в виде более прозрачных неокрашенных округлых пятен.
Одним из первых были получен бляшки вирусов полиомиелита в однослойной культуре клеток, выращиваемой в чашках Петри с подачей стерильного воздуха с 3% СО2 (Дюльбекко, 1962г.)
В настоящее время бляшки получают, выращивая культуру клеток в обычном термостате в плоских флаконах-матрацах, закрытых резиновыми пробками, иногда в чашках Петри, герметизированных лейкопластырем.
Покровная среда. Агаровое покрытие готовят из высококачественного агара в концентрации 1-1,5% и других компонентов - солевых буферных растворов, дополнительных питательных факторов, антибиотиков. Раствор нейтрального красного входит в состав среды или его добавляют во флакон или чашку незадолго до учета опыта. Существуют различные рецепты покровных сред, применяемые с учетом типа клеточной культуры и вируса.
В последнее время хорошо зарекомендовали себя покровные среды, в которых вместо агара используют гель бентионита (5-6%).Это алюмосиликат природного происхождения, который биологически инертен и не токсичен для культур клеток. Под бентионитовым питательным покрытием бляшки хорошо выявляются.
Обнаружение и титрование вирусов методом бляшек. Для
получения бляшек вирусов во флаконы или чашки наливают взвесь
клеток в питательной среде (№ 199 или среда с гидролизатом
лактальбумина). Флаконы закрывают резиновыми пробками,
чашки заклеивают лейкопластырем и помещают в термостат на 5-6
дней для получения монослоя клеток, который должен быть
сплошным, без признаков дегенерации. Перед заражением среду из
флаконов или чашек удаляют и однослойную культуру клеток
осторожно отмывают раствором Хенкса, который затем тщательно
отсасывают. Заражение производят путем внесения разведенного
исследуемого материала в объеме 0,1-0,25 мл равномерного
распределения этого материала по поверхности клеточного слоя с
помощью покачивания. Через 30-60 минут зараженную культуру
клеток заливают покровной средой. Флаконы или чашки с
застывшей средой помещают в термостат (клеточным слоем
кверху) и выдерживают до образования бляшек (2-5 суток), после
чего производят их подсчет и изучение. Существует
пропорциональная зависимость между разведением
вируссодержащего материала и количеством образовавшихся бляшек, позволяющая считать, что каждая бляшка образуется в результате размножения в клетках одного вириона.
Способность к образованию бляшек в настоящее время обнаружена у многих вирусов: полиомиелита, Коксаки, ECHO, энцефалита, гриппа, кори и ряда других.
При изучении морфологии бляшек установлено, что разные вирусы, как правило, образуют бляшки, отличающиеся по величине, форме, характеру краев, по срокам появления и другим свойствам, что может быть использовано для предварительной идентификации вируса.
Наиболее часто метод бляшек применяют для титрования вирусов. Для этой цели приготовляют серийные разведения вирусе од ержащего материала и каждое из разведений вносят во флакон или чашку со слоем культуры клеток. Подсчитав образовавшиеся бляшки (с учетом разведения вируса) вычисляют титр вируса - количество вирионов в 1,0 мл, исходного материала. Титр вируса, определяемый методом бляшек, принято выражать числом бляшкообразующих единиц (БОЕ) в 1 мл.
Идентификация вирусов и титрование антител.Метод бляшек дает возможность провести точную идентификацию вируса с помощью диагностических специфических сывороток. При соответствии между сывороткой и вирусом происходит нейтрализация вируса и при заражении монослоя клеток такой смесью бляшки не образуются или их количество значительно снижается. Благодаря своей чувствительности и точности метод приобрел большое значение в изучении тонких антигенных различий у вирусов.
С помощью метода бляшек удается также обнаружить антитела в сыворотке больных и определить их титр, что имеет диагностическое значение. За титр сыворотки принимают ее наибольшее разведение, снижающее количество бляшек на 50%.
Дата добавления: 2014-12-11 | Просмотры: 2414 | Нарушение авторских прав
Из локальных повреждений, вызываемых вирусами, наиболее известны бляшки (островки мертвых, не окрашенных клеток в слое окрашенных живых) в зараженных культурах клеток, залитых агаровой средой с красителем нейтральрот и оспины (некротические узелки) на ХАО куриных эмбрионов, зараженных оспенными и некоторыми другими вирусами.
Количество вируса при этом может быть измерено, соответственно, в бляшкообразуюших единицах (БОЕ) и оспообразующих единицах (ООЕ): 1 БОЕ = доза вируса, вызвавшая образование одной бляшки; 1 ООЕ = доза вируса, вызвавшая образование одной оспины. Методика определения титра вируса в БОЕ (ООЕ) заключается в следующем:
1. Точно отмеренными и строго одинаковыми объемами исследуемого вируссодержащего материала заражают несколько культур клеток в матрасах или куриных эмбрионов на ХАО.
2. Подсчитывают количество образовавшихся в каждом матрасе бляшек или в каждом курином эмбрионе оспин.
3. Рассчитывают среднее арифметическое этого количества, которое равно количеству БОЕ или ООЕ вируса в заражающей дозе вируссодержащего материала.
4. Титр вируса (Т) рассчитывают по формуле:
Т = среднее арифметическое количество бляшек (оспин) / объем заражающей дозы х разведение вируссодержащего материала.
Считается, что счету поддаются бляшки и оспины, если их количество не превышает 50 на матрас или ХАО. Иногда, в случае высокой концентрации вируса в материале, бляшки в культуре клеток или оспины на ХАО могут сливаться, и их невозможно будет сосчитать. В таких случаях готовят несколько десятикратных разведений испытуемого материала и каждым разведением в одинаковых дозах заражают равные группы культур клеток или куриных эмбрионов, затем рассчитывают среднее арифметическое количество бляшек или оспин для каждого разведения. Титр вируса в этом случае рассчитывается по более сложной формуле:
Т = сумма средних арифметических количества бляшек (оспин) в каждом разведении / объем заражающей дозы х сумму разведений вируссодержащего материала
Метод титрования вирусов в БОЕ дает наиболее достоверные данные о концентрации вирусов, но он встречает технические трудности с подсчетом бляшек. Что касается оспин, то их использование ограничивается довольно немногочисленными вирусами, способными образовывать узелки на ХАО куриных эмбрионов.
Метод образования бляшек основан на образовании вирусом в однослойных культурах, залитых агаровой средой, содержащей витальный краситель - нейтральрот, негативных колоний или бляшек. Бляшки представляют собой обесцвеченные участки культуры, состоящие из погибших под действием вируса клеток. Некоторые вирусы дают бляшки без покрытия слоем агара: вирус чумы крупного рогатого скота, осповакцины, некоторые вирусы герпеса.
При постановке бляшек лучше использовать культуры, выращенные во флаконах или матрасах, культура должна быть без признаков дегенерации. На клетки, промытые раствором Хенкса, наносят вирус в определенных разведениях и обеспечивают контакт вируса с клетками, периодически покачивая в течение 1-2 часов при температуре 37-38°С. Неадсорбировавшийся вирус удаляют путем промывания раствором Хенкса или отсасывают пастеровской пипеткой, а на слой клеток наносят специальное агаровое покрытие, содержащее раствор Эрла, краситель, бычью сыворотку, антибиотики и другие компоненты. Выбор среды покрытия определяется видом клеток и вируса. После застывания с поверхности агара сливают конденсированную влагу, флаконы переносят в термостат и инкубируют клетками вверх при оптимальной для конкретного вируса температуре. За это время вирусы начинают поражать клетки. При этом раствор красителя окрашивает только живые клетки. Поэтому на сплошном красновато-розовом фоне слоя живых клеток появляются бесцветные пятна (бляшки) - пораженные вирусом клетки. Если вирус высокой концентрации, бляшки быстро сливаются. Время появления и морфология бляшек зависят от вида и штамма вируса, типа клеток и условий культивирования.
Дата добавления: 2014-12-17 ; просмотров: 1719 ; ЗАКАЗАТЬ НАПИСАНИЕ РАБОТЫ
Ознакомление с методикой титрования вирусов.
Оборудование и материалы
Задачи на определение титра вируса в ЭД50 по фактическим данным, выписанным на карточки (на каждого студента по одной карточке, всего не менее 10 вариантов задач); аллантоисная жидкость куриных эмбрионов, зараженных вирусом ньюкаслской болезни; 1- процентная суспензия отмытых эритроцитов кур; физиологический раствор (изотонический раствор NaCl); плексигласовые панели с лунками; градуированные пипетки на 1 мл; резиновые груши; сосуды с дезраствором; карандаши для записи по стеклу, калькуляторы, логарифмические таблицы, мультимедийное оборудование, презентации MS Office Power Point по теме занятия.
Методика проведения занятия и методические указания по теме.
В лабораторных работах с вирусами, биофабричном производстве и в ветеринарной практике постоянно возникает необходимость определения количества вирусов в том или ином материале. Без такого определения невозможны экспериментальное заражение вирусами живых лабораторных систем, производство живых и инактивированных противовирусных вакцин и диагностических препаратов, оценка активности живых противовирусных вакцин, получение иммунных сывороток и многие другие работы.
Количество вируса в каком-либо материале определяют по титру вируса в этом материале. Под титром вируса понимают выражение его концентрации в материале.
Титр вируса - это количество вируса, содержащееся в единице объема материала
Поскольку количество вируса невозможно выразить в обычно применяемых (объем, масса и т. и.) единицах, прибегают к измерению в единицах действия или единицах активности. Вирусы обладают инфекционным и гемагглютинирующим действием. Отсюда и единицы количества вирусов инфекционные и гемагглютинирующие.
Размерность этих единиц зивисит от соотношения полноценных и неполноценных вирионов в используемой суспензии, объекта, способа титрования и других факторов. В практике нашли применение три типа единиц количества вируса: 1-й - инфекционные единицы локальных повреждений, вызываемых вирусами и оцениваемых по единичному эффекту; 2-й - инфекционные единицы 50-процентного действия вирусов на чувствительные живые объекты, оцениваемые статистически; 3-й - гемагглютинирующие единицы.
Из локальных повреждений, вызываемых вирусами, наиболее известны бляшки в зараженных культурах клеток (островки мертвых клеток в слое живых) и оспины (некротические узелки) на ХАО куриных эмбрионов, зараженных оспенными и некоторыми другими вирусами. В случаях такого проявления инфекционной активности вирусов количество вируса может быть измерено в бляшкообразующих единицах (БОЕ) или оспообразующих единицах (ООЕ). Одна БОЕ равна дозе вируса, способной вызвать образование одной бляшки, а одна ООЕ - одной оспины.
Наиболее универсален метод определения титра вируса в единицах 50-процентного инфекционного действия. По этому методу за единицу количества вируса принимается такая его доза, которая способна вызывать инфекционный эффект у 50 % зараженных тест-объектов. Она обозначается как ЭД50 - эффективная 50-процентная доза.
Число таких доз вируса в единице объема материала и будет выражать титр вируса в этом материале.
Таблица 6 - Виды единиц количества вирусов при определении _ по 50-процентному инфекционному действию_
Виды инфекционного действия вирусов
Единицы количества вирусов
50-процентная летальная доза
Клинические симптомы или патологоанатомические изменения
50-процентная эмбриональная летальная доза
В качестве тест-объектов в лабораториях обычно используют белых мышей, куриные эмбрионы и культуры клеток, у которых инфекционное действие вируса может проявляться гибелью, клиническими симптомами, патологоанатомическими изменениями и цитопа- тическим эффектом. Для каждого вируса подбирают чувствительный к нему тест-объект и форму учета его инфекционного действия, по которой оценивают эффект заражения. В зависимости от вида тест- объекта и формы проявления инфекционного действия ЭД50 принимает один из следующих видов, приведенных в таблице 6.
- 1 ЛД50 - это доза вируса, убивающая 50 % лабораторных животных (обычно белых мышей);
- 1 ИД50 — доза вируса, вызывающая клинические симптомы или патологоанатомические изменения у 50 % зараженных лабораторных животных;
- 1 ЭЛД — доза вируса, убивающая 50 % куриных эмбрионов;
- 1 ЭИД5о — доза вируса, вызывающая патологоанатомические изменения у 50 % зараженных куриных эмбрионов;
- 1 ЦПД50 — доза вируса, вызывающая цитопатический эффект у 50 % зараженных культур клеток (обычно пробирок с культурами клеток).
Количество ЭД50 (ЛД50, ИД ЭЛД50, ЭИД50 или ЦПД50) вируса, содержащееся в единице объема вируссодержащего материала, и будет выражением титра (Т) вируса в этом материале. Например, Т=10 3,4 ЦПД5о/0,1 мл означает, что в каждой 0,1 мл вируссодержащего материала содержится 10 3 ’ 48 доз вируса (т. е. более 1000, но менее 10 000, а именно 10 3 ’ 48 = 3020), каждая из которых способна вызвать цитопатический эффект в 50 % пробирок с культурой клеток.
Названные единицы 50-процентного инфекционного действия вируса (ЛД50, ИД50, ЭЛД50, ЭИД50, ЦПД50) используются в случаях оценки инфекционного действия вируса со статистически оцениваемым эффектом, имеющим место, когда учет инфекционного действия вируса ведется по летальному действию, клиническим симптомам, патологоанатомическим изменениям или цитопатическому действию.
Титрование вирусов по 50-процентному инфекционному действию - наиболее универсальный прием, пригодный для титрования практически любого вируса, если подобрать чувствительную к нему живую систему (текст-объект). Однако этот метод титрования вирусов довольно трудоемкий, длительный и требует статистических расчетов.
Задача определения титра вируса в единицах 50-процентного инфекционного действия (ЛД50, ИД50, ЭЛД50, ЭИД50, ЦПД50) сводится к тому, чтобы найти такое разведение испытуемого вируссодержащего материала, в объеме заражающей дозы которого содержалась бы одна ЭД50, а затем рассчитать, сколько таких единиц вируса содержится в таком же объеме вируссодержащего материала, что и будет показателем титра вируса в этом материале.
Чтобы решить эту задачу, сначала из исследуемого вируссодержащего материала готовят ряд последовательных 10-кратных разведений. 10-кратные разведения берут по двум причинам:
во-первых, как видно из графика зависимости инфекционного эффекта от дозы вируса (рис. 36), кривая этой зависимости вблизи точки, соответствующей ЭД5о, на значительном отрезке приближается к прямой.

Рисунок 36 - График зависимости инфекционного эффекта от дозы вируса
Это означает, что в определенных пределах, центр которых в точке ЭД50, между логарифмом дозы (разведения) вируса и инфекционным эффектом существует прямолинейная зависимость, т. е. величина инфекционного эффекта пропорциональна логарифму дозы вируса (или его разведения), в области малых и особенно больших доз эта зависимость нарушается;
во-вторых, при 10-кратном разведении облегчаются последующие расчеты.
Одинаковыми объемами каждого из 10-кратных разведений исследуемого вируссодержащего материала заражают равные группы чувствительных к данному вирусу живых тест-объектов (мышей, куриных эмбрионов или культур клеток). При этом в каждой группе должно быть не менее 4-6 тест-объектов, так как при меньшем количестве статистически рассчитываемая величина титра вируса будет иметь слишком большую погрешность (статистическая величина тем точнее, чем на большем количестве исходных данных она основана).
После заражения учитывают результат действия вируса (гибель, клинические симптомы, патологоанатомические изменения или ЦПЭ) на зараженные объекты и определяют, в каком разведении вирус проявил свое действие на 50 % чувствительных объектов. Разведение, дающее 50-процентный эффект, рассчитывают методом прямолинейной интерполяции. Когда такое разведение нашли, то считают, что в заражающем объеме вируса, разведенного в найденное (соответствующее 50-процентному эффекту) число раз, содержится 1 ЭД50. В таком же объеме исходного (неразведенного) вируссодержащего материала таких доз (ЭД5о) содержится больше во столько раз, во сколько был разведен материал, давший 1 ЭД50. Затем пересчитывают, сколько таких единиц 50-процентного инфекционного действия вируса содержится в единице объема (мл) вируссодержащего материала, что и будет выражением титра вируса в данном материале.
- 1 Рассчитать титр вируса в единицах 50-процентного инфекционного действия по предложенным фактическим данным.
- 20пределить титр вируса ньюкаслской болезни в аллантоисной жидкости в единицах гемагглютинирующего действия.
Самостоятельная работа студентов
- а) подготовка панелей, пипеток и материала;
- б) получение последовательных 2-кратных разведений вируса по 0,5 мл или по 0,2 мл;
- в) добавление 1-процентной суспензии эритроцитов;
- г) учет результатов и их интерпретация. Во время экспозиции переписывание в тетрадь (с доски или таблицы) схемы титрования антител к вирусу ньюкаслской болезни в РТГА.
Подведение итогов занятия Задание к следующему занятию Контрольные вопросы
- 1 Что такое титр вируса?
- 2 Каковы единицы измерения количества вируса?
- 3 Каков принцип определения титра вируса в БОЕ и ООЕ?
- 4 В чем принцип определения титра вируса в единицах 50- процентного инфекционного действия?
- 5 Какова методика расчета титра вируса в единицах 50- процентного инфекционного действия?
- 6 В чем принцип определения титра вируса в ГАЕ?
- 7 Каковы достоинства и недостатки разных методов титрования вирусов?
Для выявления (индикации) вирусов применяются следующие методы.
Индикация вирусов в культуре клеток осуществляется, прежде всего, по цитопатическому действию (ЦПД) вирусов, сроки и характер которого зависят от свойств вируса, проявляясь дегенеративными изменениями клеток с последующей их гибелью и отслаиванием от стекла (рис. 29).
Полная дегенерация клеток сопровождается значительными изменениями в виде пикноза ядра и цитоплазмы, отслаиванием клеточного монослоя от стекла.
Частичная дегенерация культур клеток может протекать по следующим типам:
- гроздеобразования (округление, увеличение и слияние клеток с образованием гроздевидных скоплений, типично для аденовирусов),
- очаговой деструкции (очаги пораженных клеток на фоне в целом сохранившегося монослоя), характерной для вирусов гриппа;
- симпластообразования (слияние клеток с образованием гигантских многоядерных клеток в виде симпластов или синцитиев, характерных для вирусов кори, паротита, парагриппа, респираторно-синцитиального, герпеса, иммунодефицита человека).
Пролиферативный тип ЦПД с трансформацией клеток в злокачественные, обладающие неограниченными потенциями к росту, способны вызывать онкогенные вирусы.
Сроки, в течение которых наступает ЦПД, вариабельны (например, 1-2 дня у полиовирусов, 7-14 суток у аденовирусов).


А б
Рис. 29. Культура клеток почек обезьян (а – незараженная, б – цитопатическое действие вируса) х 200
Индикация вирусов с помощью реакции гемадсорбции (РГад).
Сущность этой реакции заключается в способности эритроцитов человека или животных адсорбироваться на поверхности клеток, инфицированных рядом вирусов (например, орто и парамиксовирусов и др.) в ранние сроки их репродукции (до развития ЦПД) в результате действия гемагглютининов – гликопротеидов, входящих в состав суперкапсида вируса. Для постановки РГад в культуру клеток добавляют 0,2 мл 0,5%-й взвеси эритроцитов, выдерживают 15-20 мин при температуре 4 0 , 20 0 или 37 0 С в зависимости от свойств вируса, после чего взвесь эритроцитов удаляют и производят учет реакции под малым увеличением микроскопа по скоплению эритроцитов на отдельных клетках или на всем монослое.
Индикация вирусов по цветной пробе.
Принцип метода основан на определении кислых продуктов метаболизма, накаливающихся в клетке в процессе ее жизнедеятельности с помощью индикатора фенолового красного, меняющего свой цвет с красного в щелочной среде на оранжево-желтый в кислой среде. При заражении культуры клеток вирусами, вызывающими ЦПД (например, аденовирусы, энтеровирусы и др.), метаболизм клеток подавляется, рН среды не меняется и она остается окрашенной в красный цвет.
Индикация вирусов по внутриклеточным включениям.
Репродукция некоторых вирусов (оспы, герпеса, бешенства) приводит к образованию внутриклеточных включений, локализующихся в цитоплазме или в ядре клеток и представляющих собой скопления вируса (или его антигенов). Включения выявляют путем световой микроскопии культур клеток, окрашенных по Романовскому - Гимзе или другими методами, а также с помощью прямого флюорохромирования (например акридиновым оранжевым) с последующей микроскопией препаратов в люминесцентном микроскопе.
Индикация вирусов с помощью прямой РИФ – выявлениевирусных антигенов, находящихся в инфицированной клетке культуры ткани, с помощью антител диагностической иммунной сыворотки, специфических иммуноглобулинов или моноклональных антител, меченых флюорохромом, обычно флюоресцеином (рис. 30).
Индикация вирусов с помощью электронно-микроскопического метода (ЭММ) применяется, в основном, в научных исследованиях. Материал для ЭММ концентрируют различными методами (ультрацентрифугирование, хроматография на колонках, адсорбцией с помощью специальных сорбентов или антител – для метода иммунной электронной микроскопии). ЭММ позволяет обнаружить в ядре или цитоплазме клеток отдельные вирионы, а также их скопления. В практических целях ЭММ может быть полезен для индикации и идентификации вирусов с типичной морфологией (оспенные вирусы, ротавирусы, коронавирусы, ВИЧ и т.д.).
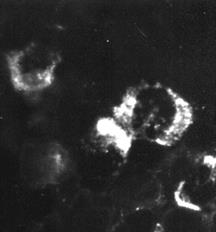
Рис. 30. Реакция иммунофлюоресценции (РИФ) – выявление вирус-специфических антигенов. х 900
Индикация вирусов по образованию бляшек - очагов разрушенных вирусом монослоя культуры клеток под агаровым покрытием. Количество бляшек отражает инфекционную активность вируса.
Для постановки этой пробы вирусную суспензию в разных разведениях вносят в культуры ткани, находящиеся в плоских сосудах, после чего монослой клеток заливают гелем (слой агара или бентонита с индикатором нейтральным красным). Время бляшкообразования для большинства вирусов, обладающих ЦПД, варьирует от 36 до 48 ч. Бляшки выглядят в виде неокрашенных светлых пятен на розово-красном фоне окрашенного монослоя. В бентонитовом методе монослой клеток молочного цвета, бляшки прозрачные.
Зараженные РКЭ инкубируют в термостате при 35- 37 0 С в течение 48 -72 ч., после чего производят их вскрытие, амниотическую и аллантоисную жидкость отсасывают шприцем, а оболочки и эмбрион извлекают и помещают в стерильные чашки Петри. При репродукции некоторых вирусов (натуральной оспы, осповакцины, простого герпеса) на ХАО куриных эмбрионах появляются характерные бляшки - беловатые пятна диаметром 1-2 мм, количество которых соответствует числу инфекционных частиц.
В аллантоисной и амниотической жидкости зараженных эмбрионов ряд вирусов (например, ортомиксовирусы, парамиксовирусы, аденовирусы и т.д.) может быть выявлен с помощью реакция гемагглютинации (РГА). Принцип реакции состоит в способности гемагглютининов - поверхностных вирусных структур гликопротеидной природы этих вирусов склеивать (агглютинировать) эритроциты определенных видов животных, птиц или человека. РГА не относится к иммунологическим реакциям, поскольку в ее основе отсутствует взаимодействие АГ и AT.
Гемагглютинационный титр (максимальное разведение вирусосодержащей жидкости, вызывающее агглютинацию эритроцитов - одна гемагглютинирующая единица вируса,1 ГЕ) соответствует концентрации вируса. Агглютинацию эритроцитов могут вызывать также некоторые бактерии (стафилококки, эшерихии, сальмонеллы, шигеллы, холерный вибрион Эль-Тор), что необходимо учитывать при трактовке результатов РГА при исследовании вирус-содержащего материала, загрязненного бактериальной микрофлорой.
Определение титра вирусов можно проводить также на хорионаллантоисной оболочке.Для этого в лунки стерильных полистироловых пластин помещают кусочки скорлупы 11-12-дневного куриного эмбриона с неповрежденной ХАО, добавляют вирусосодержащую жидкость в десятикратных разведениях на буфере, накрывают пластины фольгой и инкубируют при 35-37 0 С в течение 24-72 часов. После этого скорлупу удаляют, добавляют 0,5% взвесь куриных эритроцитов и производят учет реакции по эффекту гемагглютинации, который свидетельствует о репродукции вируса.
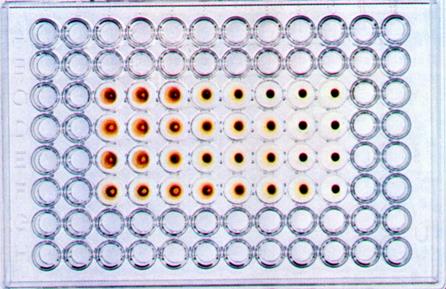
Рис. 31. Реакция гемагглютинации для выявления вируса гриппа в хорион-аллантоисной жидкости куриного эмбриона.
Индикация вирусов в организме лабораторных животных находится в зависимости от вируса и вида чувствительного лабораторного животного, будет описана в лабораторной диагностике конкретных вирусных инфекций.
Идентификация вирусов проводится с помощью следующих методов .
Учет вирусиндуцированных патологических изменений в чувствительных живых системах.
Изучение антигенных свойств вирусов в серологических реакциях с противовирусными сыворотками является основным методом идентификации вирусов. Для этого используют ряд иммунологических реакций.
Реакция нейтрализации основана на способности антител нейтрализовать инфекционную активность вирусов в культурах ткани, РКЭ, чувствительных лабораторных животных. Из вирус-содержащего материала готовят десятикратные разведения и добавляют к ним специфическую сыворотку в разведении в соответствии с титром, указанным на этикетке ампулы. Смеси вирус-сыворотка инкубируют 30 — 60 мин при 37 °С для обеспечения связывания антигенов с антителами, после чего смесью заражают культуру ткани, куриные эмбрионы или лабораторных животных. Контролем является чувствительная биосистема, зараженная вирусом без сыворотки.
Реакция считается положительной в случае нейтрализации ЦПД в культуре клеток, а также при отсутствии патологических изменений в куриных эмбрионах или в организме животных. По результатам РН высчитывается индекс нейтрализации (ИН - отношение титра вируса в контроле к титру вируса в опыте). При ИН менее 10 реакция расценивается как отрицательная, от 11 до 49 — сомнительная, от 50 и выше — положительная.
РН может быть поставлена в наиболее чувствительном варианте - подавления вирусного бляшкообразования под действием вирусспецифической антисыворотки. Для этого к вирус-содержащему материалу добавляют соответствующую искомому вирусу антисыворотку и после инкубации в термостате при 37 0 С течение 30-60 мин смесь вносят в культуру чувствительных клеток. Бляшкообразование выявляют в слое агара или бентонита. Идентичность вируса антителам сыворотки проявляется подавлением бляшкообразования.
Другим вариантом РН является цветная проба. Положительный результат пробы в случае соответствия вируса противовирусным антителам проявляется блокадой репродукции вируса, клетка при этом остается жизнеспособной, вырабатывая кислые продукты метаболизма, под влиянием которых цвет индикатора (фенолового красного) меняется с красного на желтый. Для постановки пробы в пробирки вносят по 0,25 мл рабочего разведения вируса и соответствующую антисыворотку.
Смесь выдерживают при комнатной температуре 30-60 мин, добавляют в каждую пробирку по 0,25 мл клеточной суспензии и закрывают их резиновыми пробками. Пробирки инкубируют в термостате при 37 0 С 6-8 дней, результаты реакции учитывают по изменению цвета индикатора (красный цвет индикатора соответствует щелочному характеру рН - 7,4 указывая на репродукцию вируса и подавление метаболизма клеток; желтый цвет свидетельствует о кислом рН - ниже 7,2 в результате нейтрализации вируса антителами и активном метаболизме клеток с выработкой кислых продуктов обмена).
Перед постановкой РТГА сыворотки обрабатывают периодатом калия, каолином, бентонитом, ацетоном или другими веществами для удаления неспецифических ингибиторов гемагглютинации. После этого к двукратным разведениям сыворотки добавляют равное количество вируссодержащей жидкости с активностью 4 ГЕ, смесь инкубируют 30-60 мин при оптимальной для данного вируса температуре (4 0 , 20 0 , 37 0 С), а затем добавляют равный объем 0,5-1,0% взвеси эритроцитов. Смесь снова инкубируют 30-45 мин и производят учет результатов реакции. Титром сыворотки считают ее наибольшее разведение, которое вызывает торможение гемагглютинации.
Реакция торможения гемадсорбции (РТГадс) основана на нейтрализации эффекта адсорбции эритроцитов на поверхности клеток, инфицированных вирусами, способными вызывать гемадсорбцию. Для постановки реакции по 0,2 мл специфической сыворотки, разведенной 1:5, вносят в пробирки, инкубируют 30-60 мин в термостате при оптимальной для данного вируса температуре, затем добавляют по 0,2 мл 0,5% взвеси эритроцитов. Контрольные пробы содержат неиммунную сыворотку и эритроциты. Пробирки снова инкубируют 20-30 мин, после чего производят учет реакции. Идентификация вируса основывается на признаке отсутствия адсорбции эритроцитов на клетках в присутствии иммунной сыворотки при наличии гемадсорбции в контрольных пробирках.
Для антигенной идентификации вирусов в клетках культур тканей используются также РПГ, РСК, РИФ, РОПГА ИФА, РИА со специфическими иммунными противовирусными сыворотками или моноклональными AT.
- выявление вирусной НК методами генодиагностики с помощью метода молекулярной гибридизации и ПЦР;
- электронно-микроскопическое изучение вирусов (см. выше).
Читайте также:


