Онкогенные вирусы что это такое
Главная > Консультации > Детский врач > Существуют ли инфекции, способные спровоцировать рак? Онкогенные инфекции
В настоящее время доказано, что от 15 до 20% новообразований человека имеют вирусное происхождение.
Вирусами называют мельчайшие организмы, большую часть из которых нереально разглядеть, даже используя обыкновенный микроскоп. Они состоят из небольшого количества ДНК и РНК генов, которые находятся в белковой капсуле. Эти вирусы проникают в живые клетки, где впоследствии начинают размножаться. Бывают также вирусы вызывающие рак, которые могут помещать свою ДНК в клетки, в скором времени спровоцировав появление онкологических заболеваний. Характерной чертой онкогенных вирусов является то, что они могут стимулировать клетки размножаться с необычно высокой скоростью, что может привести к повреждению генетического материала в этих клетках. Дополнительные факторы, такие как курение или воздействие определенных канцерогенов, могут вызывать окончательное превращение нормальных клеток в раковые. Эти воздействия (дополнительные факторы), наряду с индивидуальными генетическими особенностями каждого человека, могут объяснить, почему у некоторых людей с онкогенными инфекциями развивается рак, а у других нет.
К онковирусам относятся инфекции, которые провоцируют появление раковых заболеваний, а также вирусы, которые способствуют развитию воспалительных процессов, носящих хронический характер.
По заключению экспертов Международного Агентства по Изучению Рака (МАИР) прямым канцерогенным действием на человека обладают следующие вирусы:
- вирусы гепатита В и С, вызывающие рак печени;
- определенные типы папилломавирусов человека, являющиеся причинным агентом рака шейки матки, некоторых опухолей ано-генитальной области и других локализаций;
- вирус Эпштейна-Барр, принимающий участие в возникновении целого ряда злокачественных новообразований;
- герпесвирус человека 8-го типа, играющий важную роль в возникновении саркомы Капоши, первичной выпотной лимфомы, болезни Кастлемана и некоторых других патологических состояний;
- вирус Т-клеточного лейкоза человека, являющийся этиологическим агентом Т-клеточного лейкоза взрослых, перHIVной выпотной лимфомы (Primary Effusion Lymphoma, PEL), а также тропического спастического парапареза (TSP) и ряда других неонкологических заболеваний;
- вирус иммунодефицита человека (ВИЧ), не обладающий трансформирующими генами, но создающего необходимые условия (иммунодефицит) для возникновения рака.
Все они включены в санитарные правила и нуждаются в кратких комментариях.
В настоящее время существует глобальная эпидемия вируса гепатита В (HBV): на планете инфицировано этим вирусом более 350 млн. человек. Каждый год от инфекции HВV умирает 2 млн. человек, из них более 300 тыс. от рака печени. Вирусом гепатита С в мире инфицировано более 170 млн. человек, и их число ежегодно увеличивается на 3–4 млн. По данным экспертов, вирус гепатита С ежегодно становится причиной смерти 250–350 тыс. человек от цирроза, печеночной недостаточности и гепатоцеллюлярной карциномы. Из общего числа случаев рака печени (гепатокарцином) более половины связано с инфицированием HBV, четверть — с инфицированием HCV и 22% случаев — с другими причинами.
Инфицированность населения HBV колеблется от низкой, не превышающей 2% в США и странах Западной Европы, до высокой в странах Африки и Юго-Восточной Азии, приближающейся к 10%. Россия по уровню инфицированности населения HBV занимает промежуточное положение. В окружающих Россию странах (Средняя Азия, Закавказье, Молдавия) инфицированность населения по данным ВОЗ достигает 8%.
Пути заражения вирусом гепатита В (HBV): перинатальный (от матери к плоду), парентеральный (главным образом с кровью или другими биологическим жидкостями больного человека, попадающими непосредственно в кровь инфицируемого, особенно при употреблении инъекционных наркотиков) и половым путем. Заразиться можно в местах, где собираются лица, употребляющие инъекционные наркотики, в салонах пирсинга и татуажа, парикмахерских (маникюр, педикюр — при совместном пользовании общими бритвами и маникюрными принадлежностями). Половой контакт с партнером носителем инфекции в 30% случаев заканчивается инфицированием партнера. Велика вероятность заразиться вирусом, если человек имеет много половых партнеров. У инфицированной HBV матери может родиться инфицированный ребенок. Заражение происходит при родах или нарушении целостности плаценты в ходе беременности. Вирус гепатита B обнаруживается в слюне, слезах, моче и кале инфицированных лиц. Риск заражения, хотя и незначительный, существует при попадании их на поврежденную кожу и слизистые оболочки другого человека. С пищей, при разговоре, т. е. контактно-бытовым путем гепатит В не передается.
Пути заражения вируса гепатита С (HCV): в основном такие же как при HBV. Половой путь передачи гепатита С мало актуален (не более 3–5%), однако значение его возрастает при наличии большого количества партнеров, случайных связей. От инфицированной матери плоду вирус гепатита С передается редко, не более, чем в 5% случаев и только в процессе родов при прохождении родовых путей. Не отмечена передача вируса с молоком матери и контактно-бытовым путем.
Профилактика. Исходя из вирусной природы указанных заболеваний, вакцинация является наиболее эффективным способом предотвращения распространения инфекции, возникновения острого и хронического гепатита, а, следовательно, и рака печени. В 1980 г. приготовлена вакцина против вируса гепатита В. Согласно рекомендациям, принятым в 1999 г. в США и практикуемым в России, вакцина рекомендована для лиц от 0 до 19 лет. В настоящее время во многих странах мира, включая Россию, введена обязательная вакцинация против гепатита В (HBV) среди новорожденных, детей раннего возраста, подростков и лиц из групп риска. С целью профилактики распространения HBV и рака печени проводится тестирование всех беременных и доноров крови на поверхностный антиген вируса (HbsAg) и антитела к нему (HBs).
Вирусы папилломы человека (HPV) принадлежат к группе Papillomavirus и являются вирусами, которые поражают клетки эпителия эктодермального происхождения (кожа, слизистые половых органов, ротовой полости).
В настоящее время известно более 100 типов HPV, которые могут вызывать бородавки на различных частях тела, но лишь немногие из них связывают с различными злокачественными новообразованиями. Некоторые штаммы вируса папилломы распространяются половым путем и вызывают остроконечные бородавки. Передаваемые половым путем вирусы папилломы связаны с развитием рака шейки матки, полового члена и анального прохода (последние встречаются не так часто). К группе высокого онкогенного риска относят наиболее распространенные в Европе и в России 16-й и 18-й типы вируса (HPV 16 и HPV 18), а также менее распространенные 31, 33, 35, 39, 45, 51, 52, 56, 58, 59 типы, ответственные, соответственно, за возникновение 65–75% и 18–20% случаев рака шейки матки (РШМ). Раннее обнаружение и лечение может уменьшить риск рака шейки матки, поэтому врачи советуют женщинам с выявленными вирусами папиломы периодически проводить тест мазок Папаниколау. Вирус папилломы человека является довольно распространенными венерическим заболеваниям с несколькими миллионами новых случаев инфицирования, диагностируемых каждый год.
Пути заражения. Передача инфекции осуществляется половым путем, возможны перинатальный (от матери к плоду) и оральный пути заражения. Большинство лиц обоего пола инфицируется вирусом в первые годы половой жизни. В последние 20–30 лет уровень инфицированности существенно возрос. У 90% женщин HPV инфекция протекает без явных клинических проявлений и вирус исчезает самостоятельно через год после инфицирования под влиянием иммунной системы организма. В трети случаев вирусную ДНК можно выявить более чем через год и в 10% — более чем через два года. Инфекция данным вирусом очень распространена среди здоровых женщин. К 50-летнему возрасту ею переболевает 8 женщин из 10.
Факторами риска для развития рака шейки матки служат раннее начало половой жизни, частая смена партнеров, сопутствующие урогенитальные инфекции (например, хламидийная или герпетическая), снижение клеточного иммунитета, гормональные воздействия (аборт, беременность, прием гормональных контрацептивов и др.), курение, неправильное питание (дефицит фолиевой кислоты), а также индивидуальные генетические особенности.
Вирус Эпштейн-Барра широко известен как вирус, который вызывает инфекционный мононуклеоз. Вирусом Эпштейн-Барра инфицировано практически всё население планеты. В развивающихся странах почти у каждого ребенка к пятилетнему возрасту выявляются антитела к этому вирусу. В развитых странах инфицированность несколько меньше: в США антитела выявляются у 50% выпускников средних школ, к сорока годам антитела к этому вирусу появляются у 90% населения. 15–25% взрослых являются выделителями вируса.
Данный вирус передается через контакт с жидкостью полости рта и носа инфицированного человека. Дети редко имеют выраженные симптомы вируса Эпштейн-Барра, но даже если они есть, симптомы, как правило, являются такими же, как при широко распространенных вирусных инфекциях. Вирус Эпштейн-Барра после заражения остается в организме, главным образом в лимфоцитах, всю остальную части жизни человека. Он находится в состоянии покоя в течение большей части времени, иногда проявляя себя, но не причиняя никакого реального вреда. При ослаблении организма и снижении защитных сил иммунной системы — вирус может активироваться и вызывать более агрессивные воздействия. Вирус Эпштейн-Барра ассоциируется, в первую очередь с развитием лимфобластомы, болезни Ходжкина, лимфомы носоглотки и лимфомы Беркитта, редкой формой рака, возникающего в лимфатических узлах. Кроме лимфобластомы, следует назвать такие вызываемые вирусом доброкачественные и злокачественные новообразования, как волосатоклеточная лейкоплакия полости рта, рак носоглотки и др., возникающие на фоне иммунодефицита организма различного происхождения.
Пути заражения. Основной путь передачи вируса — воздушно-капельный, но наиболее часто передача вируса происходит при непосредственных контактах слизистой рта (поцелуях). Заражение возможно и через содержащие вирус пищевые продукты, а также бытовым путём через руки и предметы обихода, при переливании крови и других парентеральных вмешательствах. Зафиксирован также половой путь передачи.
Ко-факторы. Поскольку у большинства лиц, инфицированных EBV, какой-либо патологии не возникает, то для ее появления, включая злокачественные новообразования, очевидно, необходимо воздействие на организм дополнительных факторов. Среди известных следует назвать паразитарные инфекции типа малярии; массивную инфекцию EBV в. раннем детском возрасте; ослабление иммунной системы; хроническое недоедание, а также использование в пищу продуктов, обладающих коканцерогенным действием; влияние любых факторов, вызывающих хромосомные мутации. Таким образом, можно сделать вывод, что инфицирование EBV является важным, но недостаточным условием для возникновения ассоциированных с ним онкологических заболеваний, чтобы возникла опухоль, необходимо действие ряда дополнительных факторов.
Открытый в 1994 г. герпесвирус саркомы Капоши в семействе герпесвирусов обозначен под номером 8 (HHV-8). В настоящее время считается доказанной его этиологическая роль в возникновении довольно редко встречающихся заболеваний, а именно саркомы Капоши (СК), выпотной В-клеточной лимфомы полостей тела (PEL) и болезни Кастлемана.
Распространенность HHV-8. Инфицированность населения HHV-8 в различных географических регионах существенно отличается и варьирует от долей процента в США и большинстве стран Западной Европы до 8–10% в странах Средиземноморья (Греция, Италия). Самый высокий процент серопозитивных лиц обнаружен в странах Восточной, Центральной и Западной Африки — странах, эндемичных для СК, где уровень инфицированности населения этим вирусом достигал 50–70%. В России уровень инфицированности HHV-8 среди доноров крови находится в пределах 4%.
Пути заражения. Основной путь передачи HHV-8 — половой, но также со слюной (при поцелуе), и с кровью (редко).
Профилактика. Учитывая половой путь передачи вируса основной профилактической мерой является практика безопасного секса, лечение хронического уропростатита у больных с выявленным HHV-8 в эякуляте и/или секрете предстательной железы, применение противовирусных препаратов в группах риска (больные, нуждающиеся в трансплантации органов и ВИЧ-инфицированные).
Профилактическая анти-вирусная (противоопухолевая) вакцина не создана, над ее изготовлением ведется работа.
Вирус Т-клеточного лейкоза человека (HTLV-1) — это онкогенный ретровирус, являющийся этиологическим фактором Т-клеточного лейкоза/лимфомы взрослых, протекающей чрезвычайно агрессивно со средней продолжительностью жизни около 6 месяцев, и нейро-дегенеративного заболевания под названием HTLV-1-ассоциированная миелопатия или тропического спастического парапареза. В регионах с высокой инфицированностью данным вирусом диагностируются также ассоциированные с вирусом увеиты, артриты, базедова болезнь, инсулинзависимый диабет, синдром Цезаря и др.
Распространенность. Спорадические случаи HTLV-1 инфекции встречаются во многих странах мира, включая Россию. Эндемичными же для этой инфекции являются некоторые регионы Японии, Южной Америки, Африки и часть стран Карибского бассейна.
Пути заражения. Существуют 3 основных пути передачи инфекции от инфицированных лиц: а) с молоком матери; б) при половом контакте главным образом через сперму; и в) с переливаемой кровью при гемотрансфузиях.
Ко-факторы. У большинства лиц, инфицированных HTLV-1, какой-либо патологии не возникает. После заражения вирусом ATL регистрируют не более чем у 1–5% вирусоносителей даже в эндемических для этого заболевания регионах и после длительного латентного периода, длящегося порой десятилетиями. Факторами, способствующими развитию ATL, являются паразитарные инфекции типа эписторхоза, использование иммунодепрессантов любого происхождения, ВИЧ-инфекция и др.
Профилактика. Для профилактики инфекции рекомендованы: отмена кормления грудным молоком младенцев инфицированными матерями; предохраняемый секс и контроль на присутствие HTLV-1 донорской крови не только в регионах с высоким уровнем распространения HTLV-1 среди населения, но и в других, т. к. переливание инфицированной вирусом крови, может способствовать его распространению и появлению заболеваний, связанных с HTLV-1 там, где они сейчас отсутствуют.
Этот вирус был открыт в 1983 г. и его ассоциация с синдромом приобретенного иммунодефицита (СПИД) доказана в 1984 г. Как уже упоминалось ранее, ВИЧ не обладает трансформирующим геном (онкогеном). Инфицированные им клетки (главным образом СD4+ Т-клетки и макрофаги) не подвергаются усиленной пролиферации (делению), а разрушаются, вызывая у инфицированного лица нарастающую степень иммунодефицита, и создавая тем самым условия, необходимые для возникновения опухоли. Доказано, что у больных СПИД`ом примерно 50% новообразований ассоциировано с Эпштейн-Барр вирусом или герпес вирусом саркомы Капоши (HHV-8). Чаще всего у таких больных диагностируют саркому Капоши либо одну из разновидностей не-ходжкинских лимфом. Характеристика этих новообразований, механизмы канцерогенеза, а также методы профилактики и лечения даны в предыдущих разделах, их можно найти также в многочисленных отечественных и зарубежных публикациях.
Несмотря на различную организацию онкогенных вирусов человека, неодинаковый спектр их клеток-мишеней, они обладают рядом общих биологических свойств, а именно:
- вирусы лишь инициируют патологический процесс, усиливая пролиферацию (разрастание ткани организма путём размножения клеток делением) и генетическую нестабильность инфицированных ими клеток;
- у инфицированных онкогенными вирусами лиц возникновение опухоли, как правило, событие нечастое: один случай новообразования возникает среди сотен, иногда тысяч инфицированных;
- продолжительность латентного периода от инфицирования до возникновения опухоли составляет иногда десятилетия;
- у большинства инфицированных лиц возникновение опухоли не является обязательным, но они могут составить группу риска, с более высокой возможностью ее возникновения;
- для злокачественной трансформации инфицированных клеток в организме человека необходимы дополнительные факторы и условия, приводящие к возникновению опухоли.
Профилактика активации вирусов и развития рака
- отказ от курения;
- коррекция питания и образа жизни;
- сокращение воздействия канцерогенных веществ;
- повышение защитной функции организма;
- определение и терапия заболеваний, находящихся в предраковой стадии;
- наблюдение групп высокого риска появления онкологий;
- диагностика рака на ранних стадиях.
Можно ли заразиться раком от больного человека, либо от носителя вируса?
То, что окружающие в безопасности рядом с онкобольными людьми, уже неоднократно доказано и подтверждено проведенными опытами. В 19 веке французским хирургом был выделен экстракт рака молочной железы. Затем он ввел его себе, и еще нескольким людям, участвовавшим в опыте добровольно, этот экстракт под кожу. В месте, куда была проведена инъекция, начались острые воспалительные процессы, которые прошли спустя несколько дней. Опыт в скором времени был проведен еще раз и результаты оказались те же.
Современные ученые также проводили исследования, которые подтвердили, что заразиться раком от другого человека невозможно. Медицинские работники провели анализ 350 тысяч процедур переливания крови, проводимые в течение 35 лет. У трех процентов доноров был обнаружен рак, однако ни один из людей, которым переливали кровь онкобольных, не был заражен.
Еще один важный вывод после проведенных медицинских исследований — генетика на появление раковых образований влияет гораздо больше, чем вирусы и другие факторы. Это значит, что попавший в организм онковирус имеет в развитии рака практически нулевую значимость, тогда как сбой в генетическом коде — ключевую.
Выводы
Вирусы, вызывающие рак — очень опасны для жизни и здоровья человека. Их профилактика и своевременная диагностика поможет максимально снизить риск появления серьезных последствий. При появлении каких-либо признаков вирусной инфекции необходимо срочно обратиться к компетентному специалисту и сдать анализы, которые помогут их выявить и вовремя принять необходимые меры.

Инфекция, вызванная онкогенными вирусами, является причиной 15,4% заболеваний раком по всей земле. Первый онкогенный вирус, который был идентифицирован — это куриный вирус саркомы Рауса в 1911 году. Десятилетиями позже были обнаружены серии других онкогенных вирусов, в том числе вирус папилломы Шопа (вирус папилломы кроличьего хвоста), вирус опухоли молочной железы мыши, аденовирус, вирус SV40 (обезьяний вирус sv40). Теория опосредованного вирусом онкогенеза в итоге была экспериментально продемонстрирована в 1976 году Гарольдом Вармусом и Майклом Бишопом путем превращения инфицированных клеток в опухолевые вирусом саркомы (ген v-src вызывает образование опухоли после захвата протоонкогена человеческой клетки в результате трансдукции).
Несмотря на то, что онкогенные вирусы нашли в исследованиях онкогенной активности животных клеток, они были не в состоянии преобразовать человеческие клетки. Теория вирусного онкогенеза в человеческой клетке оставалась спорной до 1965 года, когда вирус Эпштейн-Барр (EBV) был обнаружен в клетках лимфомы Беркитта. В ходе последующих исследований, в том числе выделении Т-лимфотропного вируса человека (HTLV) из клеток Т-клеточной лимфомы и выявлении роли папилломовирусов человека с высокой онкогенной активностью в развитии рака шейки матки, был определен путь для понятия человеческих онкогенных вирусов. Обнаружение связи между герпес-вирусом и саркомой Капоши (KSHV) и лимфомой и между полиомавирусом клеток Меркеля (MCV) и карциномой клеток Меркеля (MCC) подчеркнуло возможность открытия еще большего количества онкогенных вирусов с помощью современных технологий. Далее каждый вирус будет рассмотрен отдельно.
Вирус Эпштейн-Барр
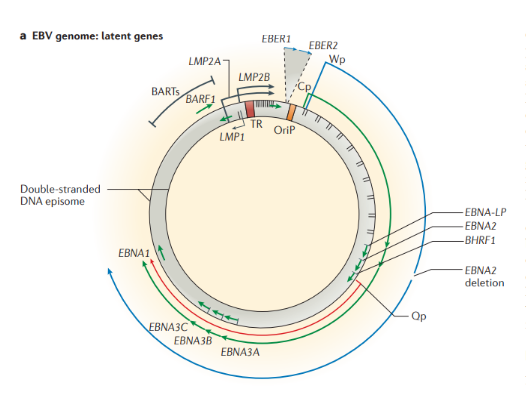
Вирус Эпштейн-Барр (ВЭБ, EBV) — ДНК-содержащий вирус, который преимущественно поражает B-лимфоциты, также является митогеном для них; вызывает лимфопролиферативные болезни (лимфома Беркитта, носоглоточная карцинома, NK-клеточная лейкемия, лимфома Ходжкина и т.д.), а также инфекционный мононуклеоз. Вирионы вируса были обнаружены при электронной микроскопии биоптата лимфомы Беркитта в начале 1964 года Энтони Эпштейном и Ивонной Барр.
Строение. ВЭБ имеет вирусный капсидный антиген (VCA), ядерные антигены-EBNAs 1, 2, 3, 3a, 3b, 3c; латентные мембранные протеины (LMPs) 1, 2 и две маленькие Эпштейна-Барр-кодируемые РНК (EBER) молекулы — EBER1 и EBER2. EBNAs и LMPs являются ДНК-связывающими белками, считающимися необходимыми для развития инфекции и фиксации.
- необходим для трансформации В-лимфоцитов;
- функционирует как конститутивный активатор рецептора ФНО и имеет сходство с CD-40 рецептором;
- активирует сигнальные пути, которые делают вклад в онкогенный эффект.
В зависимости от набора экспрессируемых вирусных генов в пораженных клетках выделяют три типа латентности (I, II и III тип), характерные для различных видов лимфом: I тип подразумевает избирательную экспрессию EBNA-1 при ВЭБ-положительной лимфоме Беркитта; II тип заключается в экспрессии EBNA-1, LMP-1 и LMP-2 и является отличительным признаком ВЭБ-положительной ходжкинской лимфомы, периферических T/NK-клеточных лимфом; латентность III типа, характеризуемая экспрессией всего набора из девяти латентных белков ВЭБ, наблюдается при лимфопролиферативных поражениях, возникающих у пациентов с тяжелым иммунодефицитом (после трансплантации паренхиматозных органов или стволовых клеток, ВИЧ-инфекции). Тип латентности определяет восприимчивость инфицированных клеток к различным иммунотерапевтическим тактикам. Индуцированные ВЭБ злокачественные новообразования связаны с экспрессией латентных генов. У большинства иммунокомпетентных носителей ВЭБ вирус не индуцирует опухолевый процесс. Новообразования развиваются при комплексном взаимодействии ВЭБ, иммуногенетических факторов, факторов внешней среды (паразитарных инфекций — чаще, малярии, недоедании, потреблении пищи, содержащей канцерогены) и иммунодефицита (ВИЧ-инфекция, трансплантация).
Папилломавирусы человека
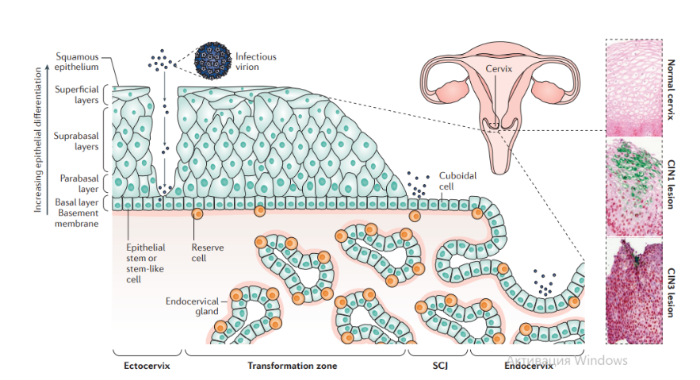
Описано около 200 папилломавирусов. Вирусы передаются при контактах через микротравмы кожи и слизистых оболочек, а также половым путем. Папилломавирусы человека вызывают доброкачественные кожные, генитальные, оральные и конъюнктивальные папилломы; индуцируют пролиферацию эпителия, обладают онкогенным потенциалом. С папилломавирусом, особенно ПВЧ-5 и ПВЧ-8, тесно связано развитие немеланомных разновидностей рака кожи. Различают низкоонкогенные папилломавирусы, вызывающие бородавки, которые не малигнизируются, и высокоонкогенные, способные вызвать рак шейки матки, — ПВЧ-16, 18, 31, 33, 35, 45, 51, 52, 58.
Строение. Капсид икосаэдрический, состоит из двух капсидных белков (L1-L2), формирующих 72 пентамера. Геном — двунитевая циркулярная ДНК; имеет в зависимости от вируса восемь ранних генов (E1-E8) и два поздних гена (L1-L2). Гены E6-E7 обладают онкогенной активностью.
Патогенез. В целом, для развития продуктивного поражения ВПЧ (высокого или низкого риска) требуется, чтобы вирус имел доступ к эпителию базального слоя как только эпителиальный барьер был подвержен риску. Папилломавирусы должны инфицировать делящуюся клетку, чтобы стать признанными как малое количество копий ядерной эписомы, и для развития стойкого поражения первичная инфицированная клетка, вероятно, должна быть похожа на долгоживующую эпителиальную стволовую клетку или похожую на нее. Кроме того, связанные с заживлением ран изменения в местном микроокружении, включая увеличение количества факторов роста, могут играть ключевую роль в создании резервуара инфекции в базальном слое. Способность ВПЧ инфицировать, и реплицироваться, и управлять прогрессированием рака зависит от функции вирусного белка, положении в эпителии, где эти белки экспрессируются. Как только инфицированные базальные клетки поделились и в конечном итоге вошли в парабазальный слой, они начинают проходить программу экспрессии генов, которая связана с дифференциацией. Амплификация вирусного генома обычно происходит в срединно-эпителиальных слоях, тогда как сбор и выход вируса происходит вблизи наружной поверхности эпителия.
Несмотря на то, что эффективная амплификация генома требует комбинированного действия множественных продуктов вирусного гена, включая E6, E7, E2 и кодированную вирусом геликазы E1, поддержание репликации в базальном слое эпителия может зависеть от факторов репликации клетки хозяина. Программа, зависящая от дифференциации, которая происходит в надбазальных слоях эпителиальной клетки, включает как временные изменения в активности промотора, так и изменения в шаблонах сплайсинга мРНК, которые облегчают производство различных продуктов вирусных генов на разных стадиях во время программы дифференциации. Функция вирусного белка далее регулируется посттрансляционной модификацией, включая фосфорилирование и протеолитическое деление клетки.
Герпесвирус, ассоциированный с саркомой Капоши
KSHV, или человеческий герпесвирус 8, был обнаружен в 1994 году как член семейства гамма-герпеса человека, присоединившись к ВЭБ. Инфекция иммунокомпрометированных индивидуумов с KSHV была связана с развитием саркомы Капоши, полученной из эндотелиальных клеток, и по меньшей мере двумя B-лимфоцит лимфопролиферативными заболеваниями: первичная выпотная лимфома и многоцентричная болезнь Кастлмана. Однако изучение патогенеза и онкогенеза KSHV затруднено отсутствием значимой модели животных и восприимчивой клеточной культуры.
Онкогенное действие. Две иммортализованные клеточные линии, KS Y-1 и SLK, когда-то использовались для исследований KS и KSHV, но в KS Y-1 были также обнаружены клетки линии рака мочевого пузыря T 24, что затруднило дальнейшую работу. Первичные эмбриональные метанефрические мезенхимальные клетки-предшественники почек крысы восприимчивы к инфекции и трансформации KSHV, но из них распространяются ограниченное количество инфекционных вирионов. Линии B-клеток, полученные из первичной выпотной лимфомы, обычно заражаются KSHV на латентной стадии и могут быть индуцированы для получения малого количества вирионов KSHV, но первичные B-лимфоциты из периферической крови или тонзиллярной ткани являются устойчивыми к инфекции KSHV, и для их инфицирования может потребоваться совместный рост с KSHV-позитивными клетками.
KSHV кодирует несколько важных белков, которые обладают некоторой онкогенной активностью для индуцирования пролиферации клеток, иммортализации, трансформации и передачи сигналов; производства цитокинов; иммунного контроля; антиапоптозной активности; и ангиогенеза. К ним относятся вирусные латентные белки, латентный ассоциированный ядерный антиген (LANA), vFLIP (FADD (Fas-ассоциированный белок с доменом смерти), подобный ферменту, ингибирующему синтез интерферона или ингибирующему белок каспазы 8 (FLICE)), vCyclin и вирусные литические белки G-белкового рецептора (vGPCR), интерферон-регуляторный фактор 1 (vIRF-1) и K1. Хотя истинную онкогенную природу каждого белка еще предстоит определить, накопление доказательств указывает на то, что каждый из них вносит свой вклад в онкогенез KSHV. Таким образом, полный спектр вызванной KSHV злокачественности может потребовать, чтобы несколько онкогенных продуктов работали вместе в присутствии клеток хозяев и экологических факторов. Например, как LANA, так и vIRF-1 нацелены на клеточный опухолевый супрессор p53. LANA также ингибирует pRB и PP2A.vCyclin, активатор CDK4 6,198, подавляет p27kip1, ингибитор CDK199 и вызывает реакцию на задержку старения G1, результаты от гиперактивации NF-κB. vFLIP и K1 активируют путь сигнала NF-κB для предотвращения апоптоза B-клеток. vGPCR и K1 влияют на сигнальные пути AKT и NF-κB и способствуют ангиопролиферативному и воспалительному поражению саркомой Капоши.
Т-лимфотропный вирус человека (HTLV)
T-лимфотропный вирус человека (HTLV) относится к семейству ретровирусов, является возбудителем T-клеточного лимфолейкоза взрослых. Вирус впервые был изолирован в 1980 году от больного Т-лимфомой.
Геном. Gag, Pol и Env являются вирусными структурными белками, другие — вирусными регуляторными/вспомогательными белками. За исключением гена hbz, который кодируется минус-цепью провирусного генома HTLV из 3'-LTR, все остальные гены кодируются плюсовой нитью по направлению 5'-LTR. Следует отметить, что 5'-LTR часто удаляется или метилируется по мере прогрессирования заболевания. Кроме того, на поздних стадиях лейкемиогенеза в гене tax часто возникают нонсенс- или миссенс-мутации. Хотя белок tax и ген HBZ индуцируют опухоли у трансгенных мышей, а p12 проявляет слабую онкогенную активность, ни один из вирусных белков/генов, кроме tax, не требуется для опосредованного HTLV-1 опухолеобразования. Продукт tax гена действует на терминальные повторы LTR, стимулируя синтез вирусной иРНК, а также образование рецепторов IL-2 на поверхности зараженной клетки.
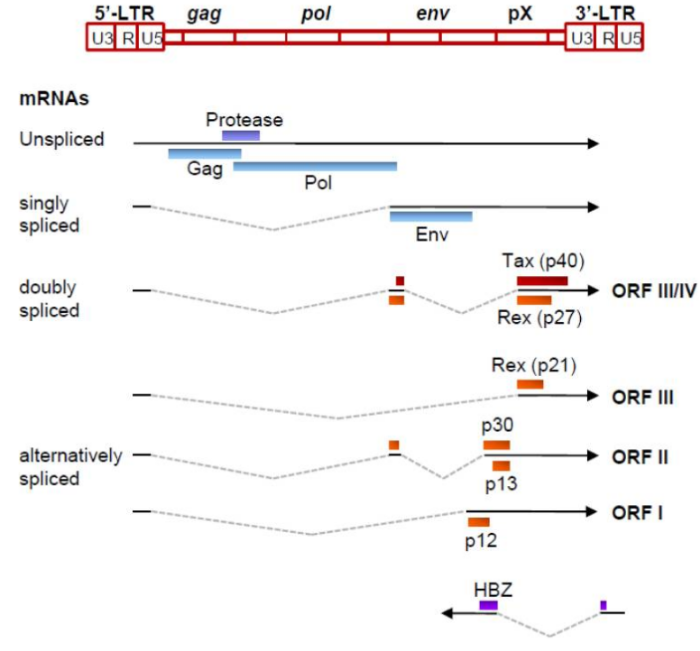
Рисунок 3. Gag, Pol и Env вирусные регуляторные/вспомогательные белки HTLV
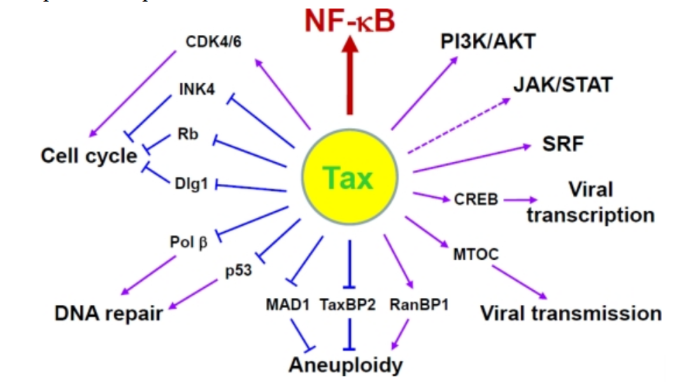
Рисунок 4. К леточные пути вирусного онкобелка tax
Патогенез. Проникновение HTLV-1 в клетку человека охарактеризовывает начало выживания и репликации вируса. HTLV-1 связывается с рецептором клеток, имеющих необходимый антиген, что инициирует процесс инвазии. Рецепторный комплекс состоит из транспортера глюкозы (GLUT1), гепаринсульфат протеогликана (HSPG) и рецептора VEGF-165 нейропилина-1 (NRP-1). HTLV-1 взаимодействует с HSPG. Процесс слияния происходит через комбинацию GLUT1 с HSPG/NRP-1, после чего ядро, содержащее вирусную РНК, доставляется в цитоплазму клеток-мишеней. После обратной транскрипции HTLV-1 встраивает свой геном в генома хозяина, чтобы сформировать провирус, окруженный двумя LTR на 5' и 3' концах. Затем провирус транскрибируется и кодирует структурные, регуляторные и вспомогательные белки. Впоследствии вирусные геномные РНК и Gag, Env и Gag-Pol белки переносятся в плазматическую мембрану, чтобы начать собираться в зрелую вирусную частицу.
Вирусы гепатита
Вирус гепатита В (HBV) и вирус гепатита С (HCV) представляют собой несвязанные вирусы, имеющие тропность к гепатоцитам и реплицирующиеся в них. Около 2 миллиардов человек инфицированы HBV, и более 350 миллионов человек становятся хроническими носителями. Только 5-10% взрослых, которые приобретают инфекцию, становятся хроническими носителями, у 30% развиваются прогрессирующие хронические заболевания печени: гепатит, фиброз, цирроз и, наконец, гепатоцеллюлярная карцинома (HCC).
Патогенез. HCC, индуцированная посредством HBV и HCV, развивается в области воспаления и регенерации, что является результатом хронического повреждения печени, а это в свою очередь указывает на то, что патогенез HCC иммунно-опосредован. Эти вирусы постоянно реплицируются в культуре клеток без явных повреждений и смерти клеток, подразумевая, что они являются не цитопатическими. Постоянная репликация вируса является фактором риска для образования HCC, потому что воспаление часто приводит к длительным хроническим заболеваниям печени CLD без выведения вируса. В этом контексте HBV и HCV генерируют белки, подавляющие иммунитет, который должен контролировать хронические инфекции. HBV- и HCV-кодированные белки изменяют экспрессию гена хозяина и клеточный фенотип, что является признаком рака. Эти изменения способствуют независимой от фактора роста пролиферации, сопротивлению к ингибированию роста, инвазии тканей и метастазированию, ангиогенезу, перепрограммированию энергетического метаболизма и устойчивости к апоптозу. Хроническое воспаление также способствует генетической нестабильности в клетках опухоли. Вклад HBV в развитие HCC включает в себя экспрессию гена гепатита Bx (HBx) и, возможно, усеченные пре-S или S-полипептиды карбоксимицина; основной белок и неструктурные (NS) белки NS3 и NS5A HCV способствуют онкогенной трансформации. Изменения в экспрессии гена хозяина, которые способствуют возникновению опухолевого генеза, также, похоже, поддерживают репликацию вируса и/или защиты вирусных гепатоцитов от иммунного опосредованного повреждения и разрушения.
Читайте также:


