Обнаружение факта репродукции вируса
Взаимодействие вируса с клеткой начинается с процесса адсорбции, т. е. прикрепления вирусов к поверхности клетки. Это высокоспецифический процесс. Вирус адсорбируется на определенных участках клеточной мембраны — так называемых рецепторах. Клеточные рецепторы могут иметь разную химическую природу, представляя собой белки, углеводные компоненты белков и липидов, липиды. Число специфических рецепторов на поверхности одной клетки колеблется от 104 до 105. Следовательно, на клетке могут адсорбироваться десятки и даже сотни вирусных частиц.
Биосинтез компонентов вируса. Проникшая в клетку вирусная нуклеиновая кислота несет генетическую информацию, которая успешно конкурирует с генетической информацией клетки. Она дезорганизует работу клеточных систем, подавляет собственный метаболизм клетки и заставляет ее синтезировать новые вирусные белки и нуклеиновые кислоты, идущие на построение вирусного потомства. Реализация генетической информации вируса осуществляется в соответствии с процессами транскрипции, трансляции и репликации.
Схема синтеза белков: геномная РНК вируса --- комплементраная ДНК -------- транскрипция иРНК -----трансляция белка вируса. Репликация вирусного генома (синтез вирусных нукл. к-т) приводит к накоплению в кл-ке копий исходных вирусных геномов, кот. используются при сборке вирионов. Обратная транскриптаза ретровирусов синтзирует мину-нить ДНК, с которой копируется плюс-нить ДНК, с образованием двойной нити ДНК, замкнутой в кольцо. Далее двойная нить ДНК интегрирует с хромосомой клетки, образуя провирус. Многочисленные вирионные РНК обр-ся в результате транскрипции одной из нитей интегрированной ДНК при участии клеточной ДНК-зависимой РНК-полимеразы.
Культивирование вирусов производится в 3-х биологич. моделях: в организме лаб. животных, в развивающихся эмбрионах птиц (куриные эмбрионы), культурах кл. Выращенные вирусы определяют с помощью методов индикации (обнаружение факта их репродукции, основанная на выявлении различных биол. св-в вирусов и особенностей их взаимод.) и идентификации (определение вида, типа, осущ-ся с помощбю иммунологич. реакций, основанных на взаимод. АГ вирусов с соответствующими АТ). О репродукции вирусов в орг-ме животных судят по развитию у них видимых клинич. проявлений заболев. и на основании реакции гемагглютинации с суспензией изи органов, содержащих вирусы. О репродукции вируса в эмбрионе свидетельствуют специф. поражения оболочек и тела эмбриона, гибель эмбриона, положит. РГА с вируссодержащей жидкостью. Этот метод используют при промышленном выращивании вирусов. Культуры клеток в зависимости от техники приготовления различают однослойные (способны прикрепляться и размножаться на поверхности хим. нейтрального стекла лаб. посуды в виде монослоя), суспензионные (кл-ки размнож. во всем объеме пит. среды при пост. ее перемешивании), органные (цельные кусочки органов и тк., сохранившие исходную структуру). По числу жизнеспособных генераций культуры клеток подразделяют на: первичные (выдерживают не более 5-10 пассажей), перевиваемые (способны размнож. в лаб. условиях неопределенно длит. срок), полуперевиваемые (выдерждивают 40-50 пассажей).
3.От двух человек выделена культура стафилококка. Один из них болел пиодермией, второй – здоров. От чего это зависит, от каких качеств микроба? Как доказать, что выделенный штамм стафилококка причастен к развитию болезни? Как определить возможный источник?
ЭКЗАМЕНАЦИОННЫЙ БИЛЕТ № 29
1.Патогенные спирохеты, сифилис.
Сифилис — хроническое венерическое заболевание, характеризующееся последовательной сменой отдельных периодов болезни. Возбудитель сифилиса был. открыт в 1905 г. немецким ученым Шаудином.
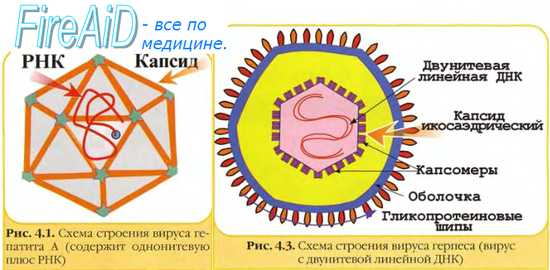
Морфология и биологические свойства. Treponema pallidum представляет собой тонкую извитую нить размером 15x0,25—0,5 мкм, имеющую 8—14 равномерных витков спирали, расположенных близко друг к другу. С трудом окрашивается анилиновыми красками и поэтому получила название бледной спирохеты. Для окраски используют метод Романовского — Гимзы (спирохеты окрашиваются в бледно-розовый цвет), негативное окрашивание раствором туши (спирохеты остаются неокрашенными и видны на темном фоне). Для выявления спирохет в инфицированных тканях используют метод импрегнации серебром (метод Левадити), при котором трепонемы, окрашенные в черный цвет, видны на фоне желтых клеток ткани. При исследовании материала в темном поле зрения бледная спирохета отличается от сапрофитных спирохет, встречающихся на слизистых оболочках полости рта и половых органов, равномерными завитками, плавными волнообразными движениями. Она тоньше других трепонем, способна сгибаться под углом и совершать характерные маятникообразные движения. Культивируется возбудитель сифилиса с трудом, в анаэробных условиях. Для выращивания используют среды, содержащие кроличью или лошадиную сыворотку (среды Уленгута и Терских). При этом культуральные (полученные на питательных средах) штаммы спирохет теряют вирулентность и изменяют антигенную структуру. Трепонемы содержат эндотоксин, имеют сложное антигенное строение.
Устойчивость. Бледная спирохета вне тканей больного быстро погибает, неустойчива при высушивании, действии обычных дезинфицирующих веществ и высокой температуры; даже при 40°С погибает через 2 ч. К низким температурам более устойчива: выдерживает замораживание до года.
Единственным источником инфекции является человек во все периоды болезни. Путь передачи — непосредственный контакт с больным (чаще всего при половом сношении), реже—через предметы обихода. Возможна передача инфекции новорожденному через плаценту от больной матери.
Профилактика. Неспецифическая - привлечение к обследованию и лечению лиц, являющихся источником заражения, и контактировавших с ними, массовые профилактические осмотры, диспансерные методы работы. Существенную роль в профилактике играют раннее выявление источников инфекции, своевременное лечение, ликвидация беспорядочных половых связей. Специфическая профилактика не проводится.
Лечение. Новарсенол, препараты висмута, ртути, пенициллин.
Культивирование вирусов человека и животных проводят с целью лабораторной диагностики вирусных инфекций, для изучения патогенеза и иммунитета при вирусных инфекциях, а также для получения диагностических и вакцинных препаратов. Вирусы культивируют на трех биологических моделях: в организме лабораторных животных, в развивающихся эмбрионах птиц и культурах клеток.
Вирусы определяют с помощью индикации и идентификации. Индикация вирусов, т.е. обнаружение факта их репродукции, основана на выявлении различных биологических свойств вирусов и особенностей их взаимодействия с чувствительными клетками. Идентификация (определение вида, типа) вирусов осуществляется, в основном, с помощью иммунологических реакций, основанных на взаимодействии антигенов вирусов и соответствующих им антител.
Лабораторные животные Использование животных для культивирования вирусов в диагностических целях весьма ограничено из-за видовой невосприимчивости животных ко многим вирусам человека, контаминации животных посторонними микробами, а также по экономическим и этическим соображениям.
О репродукции вирусов в организме животных судят по развитию у них видимых клинических проявлений заболевания, патоморфологическим изменениям органов и тканей, а также на основании реакции гемагглютинации (РГА) с суспензией из органов, содержащих вирусы. РГА основана на способности многих вирусов вызывать склеивание (агглютинацию) эритроцитов человека, птиц и млекопитающих в результате взаимодействия вирусных белков (гемагглютининов) с рецепторами эритроцитов.
Куриные эмбрионы (5—12-дневные) заражают путем введения исследуемого материала в различные полости и ткани зародыша. Таким образом можно культивировать вирусы гриппа, герпеса, натуральной оспы. Достоинствами модели являются: возможность накопления вирусов в больших количествах; отсутствие скрытых вирусных инфекций; доступность для любой лаборатории. О репродукции вирусов в куриных эмбрионах свидетельствуют: специфические поражения оболочек и тела эмбриона (оспины, кровоизлияния); гибель эмбриона; положительная РГА с вируссодержащей жидкостью, полученной из полостей зараженного зародыша. Однако многие вирусы не размножаются в эмбрионах птиц.
Культуру клеток (тканей) наиболее часто применяют для культивирования вирусов. Клетки, полученные из различных органов и тканей человека, животных, птиц и других биологических объектов, размножают вне организма на искусственных питательных средах в специальной лабораторной посуде. Большое распространение получили культуры клеток из эмбриональных и опухолевых (злокачественно перерожденных) тканей, обладающих, по сравнению с нормальными клетками взрослого организма, более активной способностью к росту и размножению.
При выращивании культур клеток необходимо выполнение ряда условий:
1) соблюдение правил асептики; 2) использование лабораторной посуды из нейтрального стекла (пробирки, флаконы, матрасы); 3) использование сложных по составу питательных сред (среда 199, Игла), содержащих минеральные соли, аминокислоты, витамины, глюкозу, сыворотку крови животных или человека, буферные растворы для поддержания стабильного рН; 4) добавление антибиотиков к питательной среде для подавления роста посторонних микробов; 5) соблюдение оптимальной температуры (36—38,5 °С) роста клеток.
Культуры клеток в процессе их культивирования способны проходить десятки генераций. По числу жизнеспособных генераций культуры клеток подразделяют на: 1) первичные, или первично-трипсинизированные; 2) перевиваемые, или стабильные; 3) полуперевиваемые.
Первичные культуры способны размножаться только в первых генерациях, т. е. выдерживают не более 5—10 пассажей после выделения из тканей.
Перевиваемые, или стабильные, культуры клеток способны размножаться в лабораторных условиях неопределенно длительный срок (десятки лет), т. е. выдерживают многочисленные пассажи. Их получают преимущественно из опухолевых или эмбриональных тканей, обладающих большой потенцией роста.
Полуперевиваемые культуры клеток имеют ограниченную продолжительность жизни и выдерживают 40—50 пассажей. Их обычно получают из диплоидных клеток эмбриона человека. В процессе пассажей эти культуры сохраняют диплоидный набор хромосом, характерный для соматических клеток исходной ткани, и не претерпевают злокачественной трансформации. Поэтому полуперевиваемые культуры клеток могут быть использованы как в диагностике, так и в производстве вакцин.
О репродукции вирусов в культуре клеток, зараженных вируссодержащим материалом, можно судить на основании следующих феноменов:.
ЦПД — патологические изменения морфологии клеток, вплоть до их гибели, возникающие в результате репродукции вирусов, и наблюдаемые под микроскопом (рис. 3.11). В зависимости от особенностей репродуцирующихся вирусов ЦПД может отличаться.
По внутриклеточным включениям, которые образуются в ядре или цитоплазме зараженных клеток. Часто включения представляют собой скопления вирусных частиц или отдельных компонентов вирусов, иногда могут содержать клеточный материал. Выявляют включения с помощью светового или люминесцентного микроскопа после окрашивания зараженных клеток соответственно анилиновыми красителями или флюорохромами. Включения могут отличаться по величине (от 0,2 до 25 мкм), форме (округлые или неправильные) и численности (одиночные и множественные).
В основе реакции гемадсорбции лежитспособность культур клеток, инфицированных вирусами, адсорбировать на своей поверхности эритроциты. Целый ряд вирусов (гриппа, парагриппа и др.) обладают гемадсорбирующими свойствами, что позволяет использовать реакцию гемадсорбции для индикации этих вирусов даже при отсутствии выраженного ЦПД в культуре клеток.
Сайт СТУДОПЕДИЯ проводит ОПРОС! Прими участие :) - нам важно ваше мнение.
В большинстве случаев перед обнаружением вируса в живой системе его следует освободить от компонентов клеток хозяина. Для этого предусмотрены следующие процедуры:
1) для разрушения клеток в материале используют трехкратное замораживание с последующим оттаиванием или растирание материала в гомогенизаторе со стерильным песком или стеклянными бусами;
2) для очистки от клеточного детрита и посторонних примесей полученный таким образом материал подвергают центрифугированию с последующим исследованием надосадочной жидкости или пропускают через бактериальные фильтры. При этом вирус ввиду малых размеров не осаждается при центрифугировании и не задерживается бактериальными фильтрами, оставаясь в жидкости;
3) полученный материал обрабатывают антибиотиками для деконтаминации и предотвращения бактериального загрязнения.
Полученный таким образом материал принято называть вируссодержащим материалом.
Для выявления вирусов в зараженном объекте в настоящее время применяют различные способы (рисунок 1).
Выявление по цитопатическому действию (ЦПД)
Обнаружение ЦПД вирусов в культуре клеток микроскопическим способом.ЦПД представляет собой дегенеративные изменения в клетках, которые появляются в результате репродукции в них вирусов. Одни вирусы проявляют ЦПД в первые дни после заражения культур клеток (вирус оспы, полиомиелита и др.), другие – значительно позже, иногда спустя 2 недели после заражения (аденовирусы, вирусы парагриппа и др.). Характер ЦПД зависит в основном от вида вируса (рисунок 2).
Рисунок 1 – Методы выявления вирусов в зараженном объекте

А – незараженный монослой; Б – зараженный монослой: видно разрушение монослоя и признаки клеточной дегенерации (а – сморщивание и образование звездчатых клеток; b – округление клеток; с – вздутие клеток; d – лизис и образование гранулярного детрита).
Рисунок 2 – Цитопатическое действие вируса полиомиелита на культуре клеток почки обезьяны в неокрашенных препаратах
Различают полную и частичную дегенерацию клеток монослоя. При полной дегенерации, вызываемой, например, вирусами полиомиелита, Коксаки и ECHO, клетки монослоя подвергаются значительным изменениям, большее их количество слущивается со стекла. Остающиеся единичные клетки сморщены (пикноз ядра и цитоплазмы), для них характерно двойное лучепреломление – сильное свечение при микроскопии. Частичная дегенерация культур клеток имеет несколько разновидностей:
а) по типу гроздеобразования – клетки округляются, увеличиваются, частично сливаются между собой с образованием особых гроздевидных скоплений (характерна для аденовирусов);
б) по типу очаговой деструкции – на фоне в целом сохранившегося монослоя появляются очаги пораженных клеток – микробляшки (характерна для некоторых штаммов вирусов оспы, гриппа);
в) по типу симпластообразования – под действием вирусов клетки сливаются между собой с образованием гигантских многоядерных клеток – симпластов, синцитиев (характерна для вирусов кори, паротита, парагриппа, респираторно-синцитиального, герпеса, иммунодефицита человека).
Пролиферативный тип изменений характерен для некоторых онкогенных вирусов, трансформирующих клетки в злокачественные, что проявляется в приобретении ими способности к неограниченному делению.
Выявление по цветной пробе. Принцип данного теста заключается в следующем. В результате жизнедеятельности клеток в питательной среде накапливаются кислые продукты. В результате цвет входящего в состав среды индикатора (фенолового красного) становится оранжевым. При заражении культуры клеток такими цитопатогенными вирусами, как энтеровирусы или реовирусы, метаболизм клеток подавляется, рН среды и ее цвет не изменяются (она остается красной).
Бляшки вирусов представляют собой очаги разрушенных вирусом клеток монослоя под агаровым покрытием. Вирусные бляшки подсчитывают для количественного анализа инфекционной активности вирусов.
Для получения бляшек разные разведения вирусной суспензии наносят на однослойные культуры ткани в плоских флаконах или чашках Петри и покрывают их слоем агарового покрытия. При этом репродукция вируса и ЦПД ограничиваются только первоначально инфицированными и соседними с ними клетками. Очаги клеточной дегенерации (бляшки) выявляют путем окрашивания культуры нейтральным красным, который либо включают в состав агарового покрытия, либо добавляют непосредственно перед учетом результатов. Бляшки состоят из погибших клеток, не окрашиваются нейтральным красным и поэтому выглядят в виде светлых пятен на фоне розово-красного монослоя.
Известны и другие способы выявления вирусных бляшек в культурах клеток. Так, например, используется определение бляшек под бентонитовым покрытием. Мелкодисперсный очищенный бентонит добавляют к жидкой питательной среде, и этой смесью заливают инфицированный монослой клеток. В результате адсорбции частиц бентонита на поверхности клеток монослой приобретает молочный цвет. В месте размножения вируса, где клетки частично или полностью слущены со стекла, бентонитовое покрытие нарушено (бляшки).
Для выявления вирусных бляшек под бентонитовым питательным покрытием применяют многослойные культуры перевиваемых клеток человека или животных, чувствительные к исследуемому вирусу, пригодны 2-суточные негустые монослои клеток. Готовят 10-кратные разведения из исследуемого материала, каждым разведением инфицируют не менее двух матрацев (колб Эрленмейера или пенициллиновых флаконов) с культурой клеток. После адсорбции вируса (от 30 до 40 мин) монослои от 3 до 4 раз отмывают стерильным ИХН и заливают бентонитовым питательным покрытием: бидистиллированная вода – 415 мл, 6 %-й гель бентонита – 5 мл, раствор Эрла (десятикратный концентрат) – 50 мл, нативная бычья сыворотка – 15 мл, 7,5 %-й раствор гидрокарбоната натрия – 15 мл, пенициллин – 200 ЕД/мл, стрептомицин или линкомицин – 100 ЕД/мл. Монослой зараженных клеток в колбах Эрленмейера емкостью 50 мл заливают от 20 мл до 30 мл бентонитового покрытия, а монослой клеток на дне пенициллинового флакона – от 5 мл до 6 мл.
Гель бентонита получают из сухого минерала. Чтобы улучшить сорбционные свойства бентонита, его насыщают катионами натрия. Затем его стерилизуют 40 мин при 111 °С. Сорбционные свойства геля бентонита не изменяются в процессе хранения при комнатной температуре в течение ряда лет.
Время бляшкообразования под бентонитовым покрытием для различных вирусов неодинаково. Результаты образования бляшек для энтеровирусов, например, учитывают через промежуток времени от 36 до 48 ч. Культуральные сосуды переворачивают монослоем вверх, смывая средой дегенерировавшие клетки. Бляшки, образуемые различными типами энтеровирусов, отличаются по величине, интенсивности развития и характеру краев. Поскольку одна вирусная инфекционная частица (вирион) образует одну бляшку, метод бляшкообразования позволяет точно определить количество инфекционных единиц в материале, а также измерить нейтрализующую активность вирусных антител.
Выявление по реакции гемадсорбции (РГАд)
Реакцию гемадсорбции (РГАд) применяют для индикации в зараженных культурах клеток вируса, обладающего гемагглютинирующей активностью. Сущность реакции заключается в том, что на поверхности клеток, зараженных вирусами, адсорбируются эритроциты, чувствительные к гемагглютинирующему действию вирусов. Так, например, на клетках, зараженных вирусом натуральной оспы, адсорбируются эритроциты кур; вирусом кори – эритроциты обезьян; аденовирусами – обезьян и крыс и др. (рисунок 3).

1 – островковый тип адсорбции эритроцитов на зараженных клетках; 2– незаряженные клетки.
Рисунок 3 –Реакция гемадсорбции
Методика РГадс следующая. Из пробирок с зараженными и незараженными культурами клеток удаляют питательную среду и вносят по 0,2 мл 0,4 % взвеси в изотоническом растворе хлорида натрия трижды отмытых эритроцитов. Пробирки оставляют в наклонном положении на промежуток времени от 20 до 30 мин при температуре 37 °С, 22 °С или 4 °С. Затем пробирки осторожно встряхивают и исследуют под малым увеличением микроскопа. На клетках монослоя, зараженных вирусом, наблюдается диффузная или локальная адсорбция эритроцитов в виде скоплений, гроздей и розеток. При отрицательном результате на монослое адсорбируются лишь единичные эритроциты. Гемадсорбция предотвращается обработкой зараженного вирусами монослоя специфической сывороткой.
Эта реакция позволяет выявить вирусы до развития ЦПД благодаря адсорбции эритроцитов на поверхности клеток, инфицированных гемадсорбирующими вирусами. Эти сложные вирусы имеют в составе супер-капсида специфические гликопротеиды – гемагглютинины (например, орто- и парамиксовирусы). Для воспроизведения РГАд в культуру клеток (контрольную и зараженную вирусом) после определенного для каждого вируса срока инкубации добавляют 0,2 мл 0,5 %-й взвеси эритроцитов так, чтобы был покрыт монослой и оставляют ее на время от 15 до 20 мин при 4 °С, 20 °С или 37 °С (в зависимости от свойств вируса). Затем пробирки встряхивают для удаления неадсорбированных эритроцитов и учитывают под малым увеличением микроскопа скопление их на отдельных клетках или на всем монослое. На незараженных клетках эритроцитов не должно быть. Следует отметить, что не все вирусы, агглютинирующие эритроциты in vitro, способны вызывать гемадсорбцию в культуре клеток. Гемадсорбция наблюдается лишь в том случае, если в процессе взаимодействия вируса с клеткой вирусный гемагглютинин встраивается в структуру наружной клеточной мембраны и тем самым изменяет ее свойства.
Нам важно ваше мнение! Был ли полезен опубликованный материал? Да | Нет
|