| D-0596 |
РеалБест ВГВ ПЦР (вариант 2)
Набор реагентов для выявления и количественного определения ДНК вируса гепатита В методом ПЦР в режиме реального времени. Не содержит реагентов для выделения ДНК.
Изобретение относится к медицине, в частности к проблеме изучения инфекционных вирусных заболеваний, и касается поиска новых направлений в специфической диагностике хронического вирусного гепатита В.
Клинические проявления хронического вирусного гепатита В многообразны и зависят, в основном, от биологических свойств вируса и его взаимодействия с иммунной системой хозяина. Вирус гепатита В характеризуется высокой степенью генетической гетерогенности в связи с использованием обратной транскриптазы в процессе репликации вируса. Определение генотипов и субтипов вируса гепатита В важно для лучшего понимания эпидемиологических и вирусологических особенностей заболевания, а также предоставляет дополнительную информацию для принятия решения о выборе тактики противовирусной терапии. Одной из форм естественного течения хронического вирусного гепатита В является оккультный гепатит В, характеризующийся сохранением ДНК вируса гепатита B в печени и, в значительно более низкой, часто не идентифицируемой, концентрации в периферической крови пациентов с негативным HBsAg. Более 20% больных серонегативны по всем маркерам вируса гепатита В [Torbenson М., Thomas D.L. Occult hepatitis В // Lancet Infect. Dis. 2002. vol. 2. P. 479-486]. При этом оккультный ВГВ может играть существенную роль в развитии фиброза печени и гепатоцеллюлярной карциномы [Raimondo G., Pollicino Т., Cacciola I. et al. Occult hepatitis В virus infection // J. Hepatol. 2007. vol. 46. P. 160-170].
Глубокое типирование, позволяющее выявлять субтипы вируса, важно для лучшего понимания эпидемиологических и вирусологических особенностей заболевания, что обретает большую значимость в связи с общемировой тенденцией к смещению за счет миграционной активности распространенности тех или иных генотипов и субтипов ВГВ в различных регионах и выявлению редких субтипов в нехарактерных для них географических ареалах [Raimondo G., Pollicino Т., Cacciola I. et al. Occult hepatitis В virus infection // J. Hepatol. 2007. vol. 46. P. 160-170]. Глубокое типирование также предоставляет дополнительную информацию для принятия решения о выборе тактики противовирусной терапии, так как, например, для ВГВ субтипа D1 показана высокая частота мутаций в промоторе гена Core, ассоциированных с развитием гепатоцеллюлярной карциномы, а также значительно более высокая, чем при ВГВ субтипа D2, частота двойной мутации, приводящей к уменьшению или предотвращению синтеза HBeAg, в то время как субтип А2 редко ассоциируется с HBeAg(-) заболеванием или раком печени [Bissinger A.L., Fehrle С, Werner C.R., Lauer U.M., Malek N.P., Berg CP. Epidemiology and Genotyping of Patients with Chronic Hepatitis B: Genotype Shifting Observed in Patients from Central Europe // Pol J Microbiol. - 2015 - 64(1): 15-21; Khan, A. Novel point mutations and mutational complexes in the enhancer II, core promoter and precore regions of hepatitis В virus genotype D1 associated with hepatocellular carcinoma in Saudi Arabia / Khan A., Al Balwi M.A., Tanaka Y., Hajeer A., Sanai P.M., Al Abdulkarim I., Al Ayyar L., Badri M., Saudi D., Tamimi W., Mizokami M., Al Knawy B. // Int. J. Cancer. - 2013. - vol. 133 (12). P. 2864-2871).
Субтипы Al, С, B2-B5 и H связаны с более серьезными осложнениями, чем субтипы А2, В1 и В6 [Khan, A. Novel point mutations and mutational complexes in the enhancer II, core promoter and precore regions of hepatitis В virus genotype D1 associated with hepatocellular carcinoma in Saudi Arabia / Khan A., Al Balwi M.A., Tanaka Y., Hajeer A., Sanai P.M., Al Abdulkarim I., Al Ayyar L., Badri M., Saudi D., Tamimi W., Mizokami M., Al Knawy B. // Int. J. Cancer. - 2013. - vol. 133 (12). P. 2864-2871].
В то время как прямое секвенирование нуклеотидной последовательности является золотым стандартом для классификации генотипов и субгенотипов вируса гепатита В [Banerjee, P.A Rare HBV Subgenotype D4 with Unique Genomic Signatures Identified in North-Eastem India - An Emerging Clinical Challenge? / Banerjee P., Mondal R.K., Nandi M., Ghosh S., Khatun M., Chakraborty N., Bhattacharya S., RoyChoudhury A., Banerjee S., Santra A., Sil S., Chowdhury A., Bhaumik P., Datta S. // PLoS One. -2014. - vol. 9 (10). e109425], используемые для выявления вируса гепатита В методики на основе технологии ПЦР недостаточно чувствительны для выявления вируса гепатита В низких концентраций при малых объемах клинического материала и/или основаны на выявлении коротких консервативных фрагментов нуклеотидных последовательностей, что не позволяет осуществлять глубокое типирование вируса.
Наиболее близким по сущности к заявляемому изобретению и выбранным за прототип является метод, предложенный в работе зарубежных коллег, посвященной передаче ВГВ от матери ребенку [Candotti D., Danso K., Allain J-P. Matemofetal transmission of hepatitis В vims genotype E in Ghana, west Africa // J. Gen. Virol. - 2007. - vol. 88. - P. 2686-2695, doi: 10.1099/vir.0.83102-0]. Метод заключается в гнездовой ПЦР с последовательным использованием двух пар праймеров: на первом этапе прямой праймер 5'-ACATACTCTTTGGAAGGCKG-3' и обратный праймер 5'-CGTCAGCAAACACTTGGC-3', на втором этапе прямой праймер 5'-GCCTCATTTTGYGGGTCA-3' и обратный праймер 5'-AGCAAARCCCAAAAGACC-3'. При этом ПЦР для каждого раунда проводили в конечном объеме 50 мкл с 2,25 мМ MgCl2, 0,2 мМ каждого из дНТФ, 1 мкМ каждого праймера, 1X ПЦР-буфера II, 1 ед. полимеразы AmpliTaq (Applied Biosystems, Warrington, United Kingdom), ДНК-матрицы 10 мкл. при следующих условиях: тридцать пять циклов, включающих денатурацию при 95°С в течение 30 секунд, отжиг при 48°С в течение 30 секунд и элонгацию при 72°С в течение 30 секунд. Чувствительность предложенного метода достигала 10 МЕ/мл. Недостаток метода заключается в необходимости большого объема плазмы крови для экстракции ДНК (500 мкл), а также в невозможности убедиться в полноценности генома вируса за счет секвенирования как минимум двух из четырех участков генома ВГВ, как это было рекомендовано на совещании по оккультному ВГВ [Statements from the Taormina expert meeting on occult hepatitis В virus infection. // Journal of Hepatology. - 2008. - vol. 49. №4. - Р. 652-657].
Технический результат - повышение специфичности, чувствительности и возможности дифференцировать изоляты вируса гепатита В с высокой идентичностью нуклеотидных последовательностей.
Сущность метода заключается в том, что на первом этапе проводится амплификация ДНК методом асимметричной полимеразной цепной реакции с использованием протяженных олигонуклеотидных праймеров с разной температурой плавления, комплементарных области наибольшего сходства геномов различных изолятов вируса гепатита В. Для повышения чувствительности проводится вторая полимеразная цепная реакция с использованием продукта амплификации первой реакции и внутренних (вложенных, гнездовых) праймеров, некоторые из которых были предложены на совещании по оккультному вирусному гепатиту В [Candotti D., Danso K., Allain J-P. Matemofetal transmission of hepatitis В virus genotype E in Ghana, west Africa // J. Gen. Virol. - 2007. - vol. 88. - P. 2686-2695, doi: 10.1099/vir.0.83102-0]. При этом состав реакционного буфера изменяется на разных этапах.
На первом этапе используются протяженные олигонуклеотидные праймеры:
Прямой праймер 5'-CTGCGCACCAGCACCATGCAACTTTTTCACCTCTGC-3'
Обратный праймер 5'-CAGACCAATTTATGCCTACAGCCTCCTA-3'
Состав амплификационной смеси на первом этапе:
3 пмоль/л прямого праймера, 30 пмоль/л обратного праймера, по 0,7 ммоль/л аденин- и тиминнуклеозидтрифосфата, по 1 ммоль/л гуанин- и цитозиннуклеозидтрифосфата, 7,5 ммоль/л MgCl2, 1 ед. рекомбинантной Taq ДНК-полимеразы (Fermentas), буфер для Taq ДНК-полимеразы (750 ммоль/л Трис-HCl, (рН 8,8), 200 ммоль/л (NH4)2SO4, 0,1% (v/v) твин 20), формамид 4% от конечного объема, глицерин 6% от конечного объема, 10 мкл раствора ДНК, вода без нуклеаз до конечного объема 30 мкл.
ПЦР проводят при следующих условиях:
после денатурации при 95°C в течение 5 минут устанавливали 35 циклов амплификации в режиме: 95°C - 30 сек, 68°C - 5 мин; затем финальная элонгация при 72°C - 5 мин.
На втором этапе используют одну из пар праймеров:
Прямой праймер 5'-GGTCACCATATTCTTGGGAA-3'
Обратный праймер 5'-AATGGCACTAGTAAACTGAG-3'
Прямой праймер 5'-GCCTTAGAGTCTCCTGAGCA-3'
Обратный праймер 5'-GAGGGAGTTCTTCTTCTAGG-3'
Прямой праймер 5'-CCATACTGCGGAACTCCTAGC-3'
Обратный праймер 5'-CCCAAGGCACAGCTTGGAGG-3'
Прямой праймер 5'-TCTAGACTCGTGGTGGACTTCTCTC-3'
Обратный праймер 5'-AGTTCCGCAGTATGGATCGG-3'
Состав амплификационной смеси на втором этапе:
15 пмоль/л каждого праймера, по 0,7 ммоль/л аденин- и тиминнуклеозидтрифосфата, по 1 ммоль/л гуанин- и цитозиннуклеозидтрифосфата, 6,7 ммоль/л MgCl2, 1 ед. рекомбинантной Taq ДНК-полимеразы (Fermentas), буфер для Taq ДНК-полимеразы (750 ммоль/л Трис-HCl, (рН 8,8), 200 ммоль/л (NH4)2SO4, 0,1% (v/v) твин 20), DMSO 10% от конечного объема, формамид 4% от конечного объема, 10 мкл продукта амплификации первого этапа, вода без нуклеаз до конечного объема 30 мкл.
ПЦР проводят при следующих условиях:
после денатурации при 95°C в течение 5 минут устанавливали 35 циклов амплификации в режиме: 95°C - 30 сек, 52°C - 30 сек, 72°C - 1 мин 30 сек; затем финальная элонгация при 72°C - 5 мин.
Таким образом, предложенный метод отличается от прототипа тем, что на первом этапе используется асимметричная ПЦР с протяженными праймерами (прямой праймер 5'-ctgcgcaccagcaccatgcaactttttcacctctgc-3', обратный праймер 5'-cagaccaatttatgcctacagcctccta-3'), на втором этапе используются праймеры к одному из четырех регионов геном ВГВ, при этом в составе амплификационной смеси на каждом этапе неравномерное соотношение дезоксинуклеозидтрифосфатов и высокая концентрация MgCl2, на первом этапе в смеси присутствуют формамид и глицерин в количестве 4% и 6% от конечного объема соответственно, а на втором этапе формамид и DMSO в количестве 4% и 10% от конечного объема соответственно.
Аналитическую чувствительность метода проверяли методом поэтапного разведения.
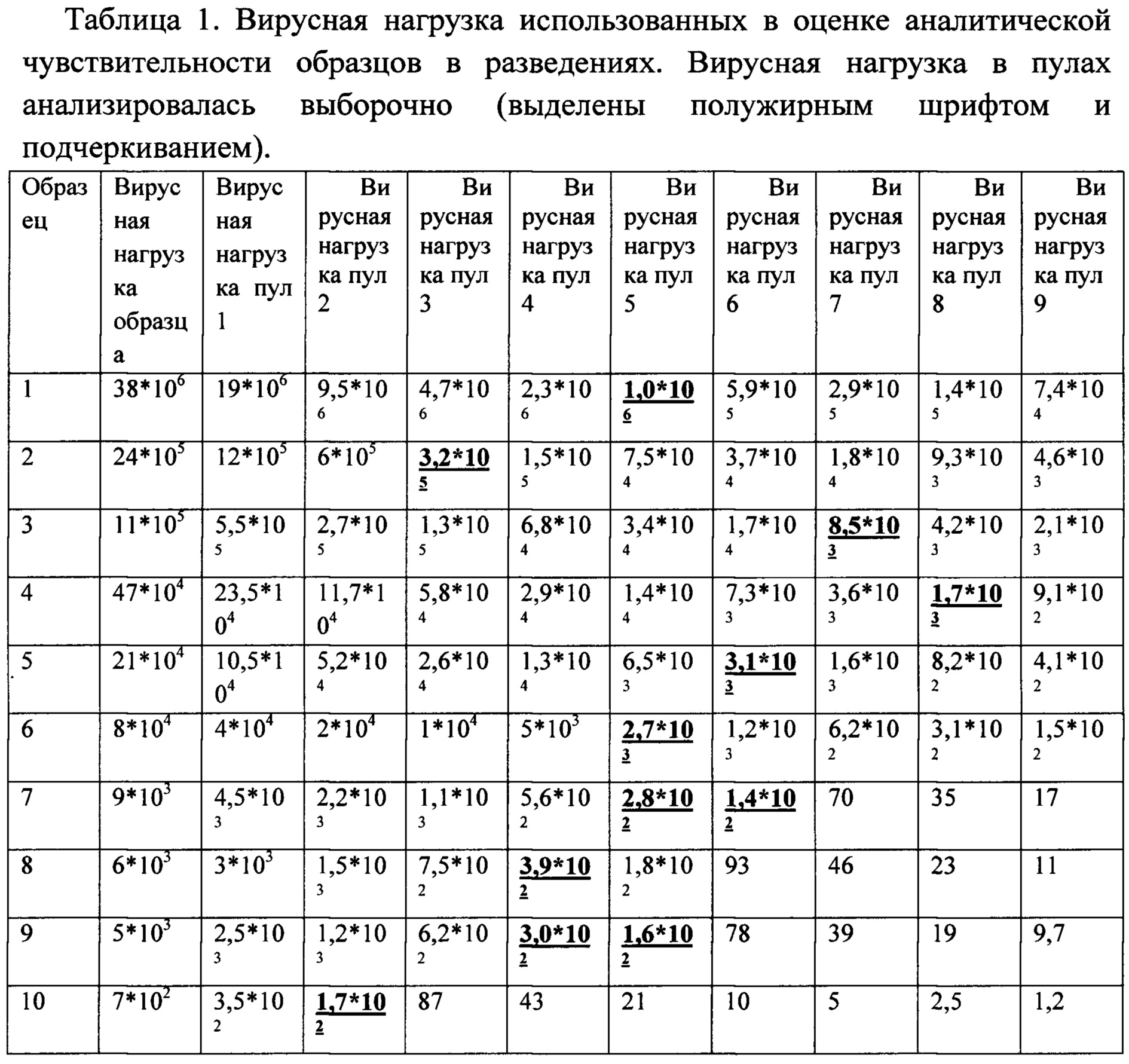
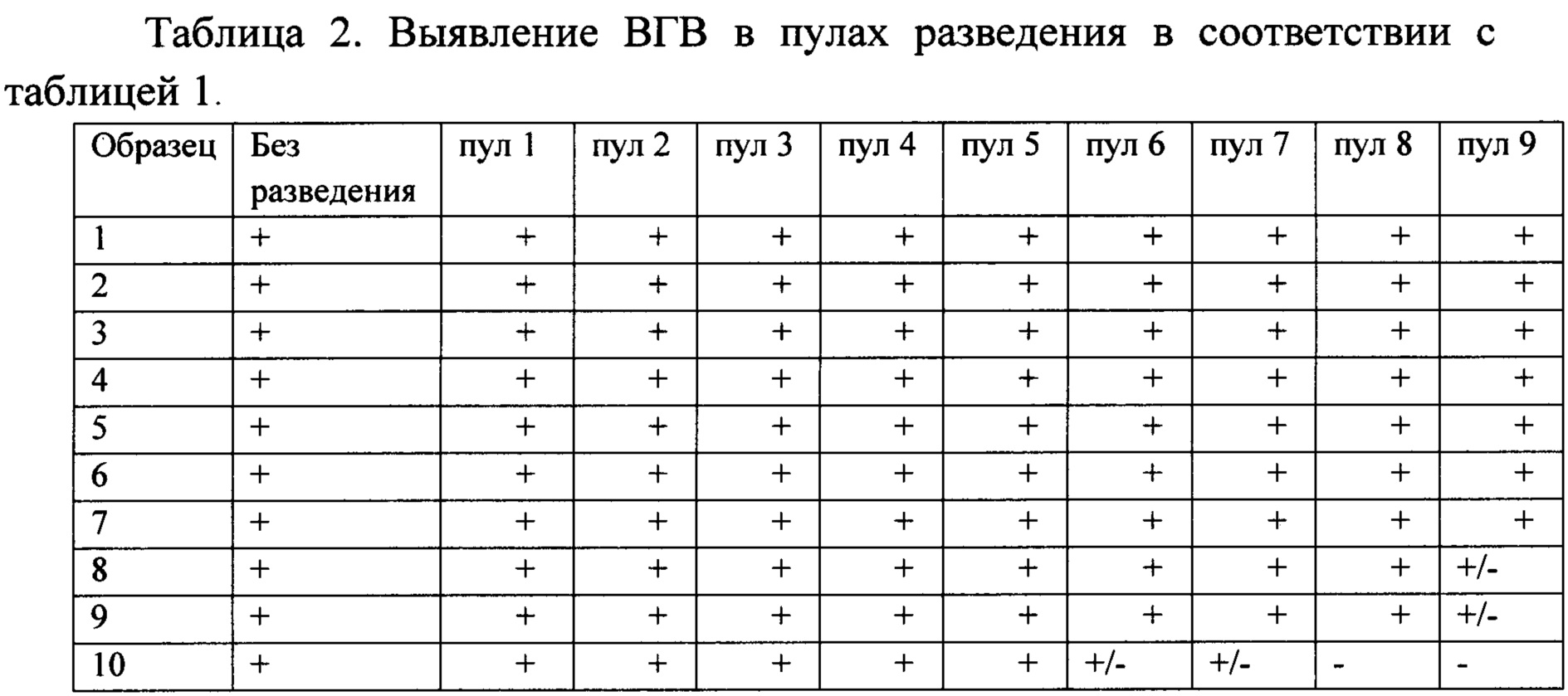
Каждый образец поэтапно разводили предварительно проанализированной плазмой крови без ВГВ (чистой плазмой) следующим образом. Аликвоту образца объемом 100 мкл вносили в микропробирку Eppendorf объемом 1,5 мл, добавляли 100 мкл чистой плазмы, тщательно пипетировали и переносили 100 мкл полученного пула в новую микропробирку, куда снова добавляли 100 мкл чистой плазмы, пипетировали и 100 мкл нового пула переносили в третью пробирку и т.д. до десятикратного последовательного разведения (таб. 1).
![]()
![]()
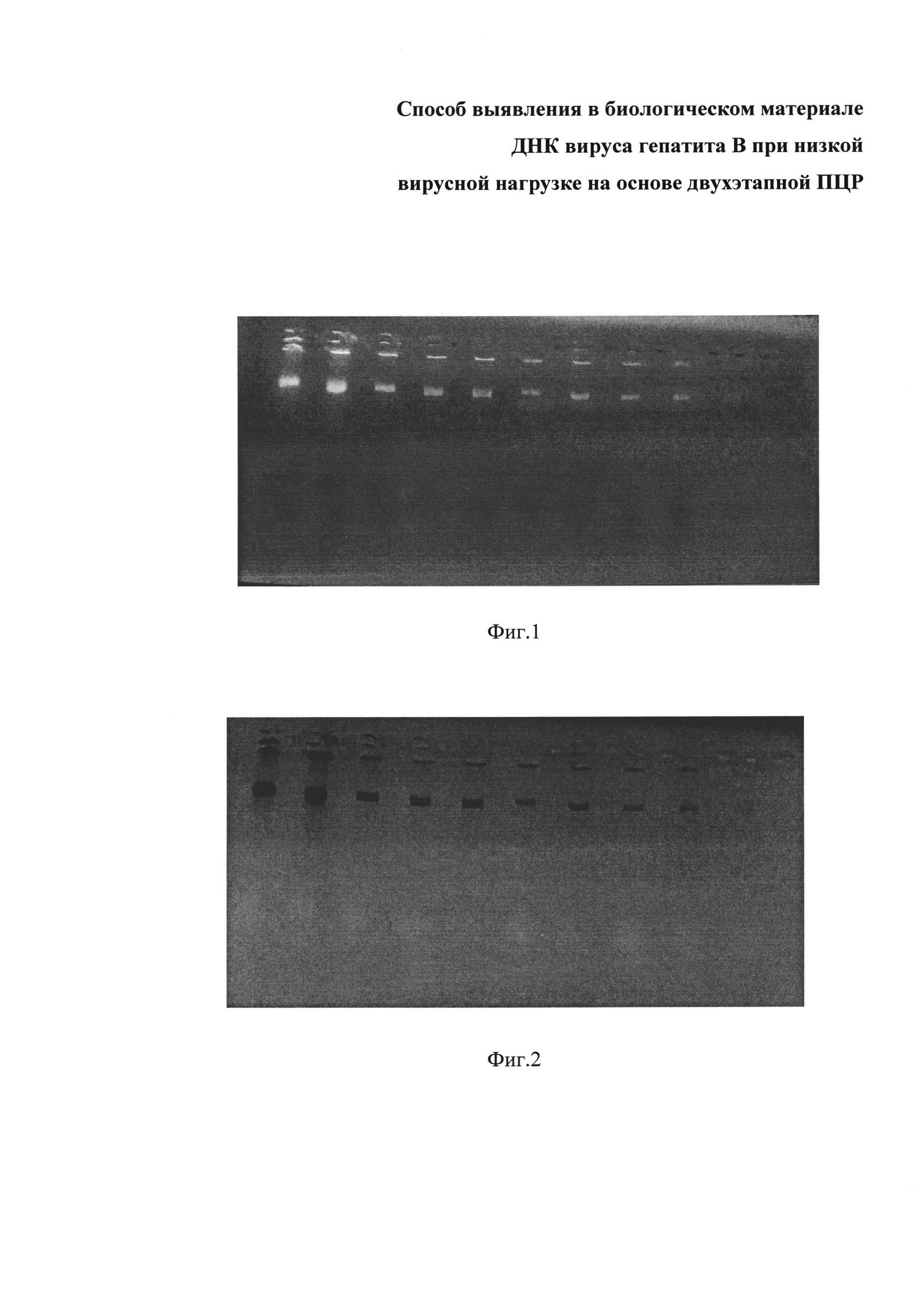
Сущность изобретения поясняется чертежами, где на фиг. 1 представлен электрофорез продуктов амплификации второго этапа (праймеры 5'-GGTCACCATATTCTTGGGAA-3', 5'-AATGGCACTAGTAAACTGAG-3') последовательных разведений образца №9, вирусная нагрузка 5*10 3 МЕ/мл. Продукт амплификации последнего разведения (предположительно около 9,7 МЕ/мл) виден очень слабо. На фиг. 2 представлен Черно-белый негатив фотографии 1. Продукт амплификации последнего разведения (предположительно около 9,7 МЕ/мл) обозначен овалом.
Ниже приведены примеры конкретного использования предложенного метода.
Больные с различной степенью выраженности фиброза печени и циррозом: 11 пациентов с хроническим вирусным гепатитом С, 5 пациентов с гепатитом неясной этиологии. Все пациенты серонегативны к вирусу гепатита В. При использовании стандартных наборов ДНК вируса гепатита В не была выявлена в плазме крови. При использовании нашего метода ДНК вируса гепатита В в плазме крови была выявлена у 6 пациентов с ХВГС и у всех пациентов с криптогенным гепатитом. Полученные результаты были подтверждены при получении биопсийного материала печени.
Больная с клинической картиной острого гепатита, начавшейся после пребывания в стационаре по причине, не связанной с заболеваниями печени. Высказаны подозрения об инфицировании пациентки в клинике. ДНК вируса гепатита В стандартными методами не выявлен. При использовании нашего метода ДНК вируса гепатита В в плазме крови выявлен, осуществлено секвенирование региона Pre-S1/Pre-S2/S, проведен филогенетический анализ для сравнения с вирусом гепатита В, выявленным у пациентов стационара (предположительный источник инфекции). Показаны значимые отличия изолятов. Высказано предположение об активации репликации оккультного вируса гепатита В на фоне иммуносупресси.
Больной из Центральной Африки спустя несколько месяцев после пребывания в РФ поступил в госпиталь с симптомами острого гепатита в тяжелой форме. При использовании стандартных методов был выявлен вирус гепатита В, генотипировать вирус не удалось. При использовании нашего метода в плазме крови больного были выявлены и типированы два изолята вируса гепатита В: субтипа D2 и субтипа А1, не характерного для РФ. Предположительно невозможность типирования стандартным методом с использованием коммерческого набора объясняется множественными мутациями вируса. Высказано предположение об активации репликации оккультного вируса гепатита В субтипа А1 на фоне подавления иммунитета при инфицировании вирусом гепатита В субтипа D2.
Представлены 155 клинических образцов из Республики Гвинея, в том числе 130 образцов сыворотки крови в объеме, не превышающем 80 мкл, а также 25 клинических образцов посмертных ротоглоточных соскобов. ДНК Вируса гепатита В не удалось выявить при использовании стандартных методов. При использовании предлагаемого нами способа выявлена ДНК вируса гепатита В в 19 образцах, полученных из сыворотки крови, а также в 13 образцах, полученных из ротоглоточных соскобов, при этом ДНК вируса гепатита В выявлена как в HBsAg (+) образцах, так и в HBsAg (-) образцах. Проведено секвенирование региона Pre-S1/Pre-S2/S. Представлены субтипы ВГВ: А2, A3, D1, D2, D3, Е. Таким образом, подтверждается возможность использования предлагаемого способа для выявления в малых объемах клинических образцов вируса гепатита В разных генотипов и субтипов, включая генотипы и субтипы не характерные для РФ.
Также в течение 2015-2016 года было проведено более 800 исследований предложенным методом на основе технологии ПЦР. Выявлен высокий процент встречаемости оккультного гепатита В среди доноров в географических регионах с высокой распространенностью вирусных гепатитов. Показана широкая распространенность оккультного вируса гепатита В у ВИЧ-инфицированных пациентов.
Способ выявления ДНК вируса гепатита B в биологическом материале на основе двухэтапной полимеразной цепной реакции (ПЦР) с последующим секвенированием амплифицированных фрагментов четырех регионов вируса, отличающийся тем, что на первом этапе применяется асимметричная ПЦР с протяженными олигонуклеотидными праймерами, а именно прямой праймер 5'-CTGCGCACCAGCACCATGCAACTTTTTCACCTCTGC-3' и обратный праймер 5'-CAGACCAATTTATGCCTACAGCCTCCTA-3', продукты которой затем используют для второго этапа амплификации с одной из следующих пар вложенных праймеров: пара 1 прямой праймер 5'-GGTCACCATATTCTTGGGAA-3' обратный праймер 5'-AATGGCACTAGTAAACTGAG-3' или пара 2 прямой праймер 5'-GCCTTAGAGTCTCCTGAGCA-3' обратный праймер 5'-GAGGGAGTTCTTCTTCTAGG-3', или пара 3 прямой праймер 5'-CCATACTGCGGAACTCCTAGC-3' обратный праймер 5'-CCCAAGGCACAGCTTGGAGG-3', или пара 4 прямой праймер 5'-TCTAGACTCGTGGTGGACTTCTCTC-3' обратный праймер 5'-AGTTCCGCAGTATGGATCGG-3', причем амплификационная смесь для первого этапа содержит: 0,3 мкл прямого праймера (конц. 10 пмоль/л), 3 мкл обратного праймера (концентрация 10 пмоль/л), 2,5 мкл смеси дезоксинуклеозидтрифосфатов (где содержится по 0,7 ммоль/л аденин- и тиминнуклеозидтрифосфата, по 1 ммоль/л гуанин- и цитозиннуклеозидтрифосфата), 6 мкл MgCl (25 мМ), 2,5 мкл буфера для Taq ДНК-полимеразы (включает 750 ммоль/л Трис-HCl, (рН 8,8), 200 ммоль/л (NH4)2SO4, 0,1% (v/v) твин 20), 1,2 мкл формамида, 1,8 мкл глицерина, 0,5 мкл рекомбинантной Taq ДНК-полимеразы (Fermentas, 1 ед.), 10 мкл раствора ДНК, 2,2 мкл вода без нуклеаз, общий объем смеси 30 мкл. амплификационная смесь для второго этапа содержит: по 1,5 мкл прямого и обратного праймеров (концентрация 10 пмоль/л), 2,5 мкл смеси дезоксинуклеозидтрифосфатов, (содержащей по 0,7 ммоль/л аденин- и тиминнуклеозидтрифосфата, по 1 ммоль/л гуанин- и цитозиннуклеозидтрифосфата), 5 мкл MgCl (25 мМ), 2,5 мкл буфера для Taq ДНК-полимеразы (включает 750 ммоль/л Трис-HCl, (рН 8,8), 200 ммоль/л (NH4)2SO4, 0,1% (v/v) твин 20), 1,2 мкл формамида, 3 мкл DMSO, 0,5 мкл рекомбинантной Taq ДНК-полимеразы (Fermentas, 1 ед.), 10 мкл продукта амплификации первого этапа, 2,3 мкл вода без нуклеаз, общий объем смеси 30 мкл.
![]()
по применению набора реагентов
для выявления и дифференциации генотипов A, B, C и D
вируса гепатита B (HBV) в клиническом материале
методом полимеразной цепной реакции (ПЦР) с
Федеральное бюджетное учреждение науки
Российская Федерация, 111123,
город Москва, улица Новогиреевская, дом 3а
ФОРМАТЫ И ФОРМЫ ВЫПУСКА НАБОРА РЕАГЕНТОВ
ДОПОЛНИТЕЛЬНЫЕ МАТЕРИАЛЫ И ОБОРУДОВАНИЕ
ВЗЯТИЕ, ТРАНСПОРТИРОВАНИЕ И ХРАНЕНИЕ ИССЛЕДУЕМОГО МАТЕРИАЛА. 8
ЭКСТРАКЦИЯ ДНК ИЗ ИССЛЕДУЕМЫХ ОБРАЗЦОВ
ПРОВЕДЕНИЕ АМПЛИФИКАЦИИ С ДЕТЕКЦИЕЙ В РЕЖИМЕ «РЕАЛЬНОГО
А. Подготовка пробирок для амплификации
СРОК ГОДНОСТИ. УСЛОВИЯ ТРАНСПОРТИРОВАНИЯ И ХРАНЕНИЯ
СИМВОЛЫ, ИСПОЛЬЗУЕМЫЕ В ПЕЧАТНОЙ ПРОДУКЦИИ
Формат FRT Форма 2: REF R-V5-G-F / VER 15.11.12 / стр. 2 из 19
СПИСОК СОКРАЩЕНИЙ
В настоящей инструкции применяются следующие сокращения и обозначения:
(производства ФБУН ЦНИИ Эпидемиологии Роспотребнадзора), использующих гибридизационно-флуоресцентную детекцию.
ВНИМАНИЕ! Результаты ПЦР-исследования учитываются в комплексной диагностике заболевания1.
ПРИНЦИП МЕТОДА
Определение генотипов А, В, С и D HBV проводится в одной пробирке. Набор В соответствии с Директивой Европейского Союза 98/79/EC.
ФОРМАТЫ И ФОРМЫ ВЫПУСКА НАБОРА РЕАГЕНТОВ
Набор реагентов выпускается в 1 формате.
Набор реагентов выпускается в 3 формах комплектации:
вариант FRT-50 F.
Форма 3 включает наборы реагентов оптом, расфасованные по отдельным реагентам, с маркировкой реагентов на их оптовой фасовке.
Форма комплектации 3 предназначена для производственных целей для последующей маркировки на языке заказчика и комплектации по наборам.
ВНИМАНИЕ! Форма комплектации 3 используется только в соответствии с регламентом, утвержденным ФБУН ЦНИИ Эпидемиологии Роспотребнадзора.
Аналитическая специфичность Оценка аналитической специфичности набора реагентов показала отсутствие перекрестных реакций между генотипами A, B, C, D, E, F, G и H вируса гепатита В при использовании высококонцентрированных рекомбинантных положительных контрольных образцов и образцов плазмы крови соответствующих генотипов HВV.
МЕРЫ ПРЕДОСТОРОЖНОСТИ
При работе всегда выполнять следующие требования:
Лабораторный процесс должен быть однонаправленным. Анализ проводится в отдельных помещениях (зонах). Работу следует начинать в Зоне Экстракции, продолжать в Зоне Амплификации и Детекции. Не возвращать образцы, оборудование и реактивы в зону, в которой была проведена предыдущая стадия Формат FRT Форма 2: REF R-V5-G-F / VER 15.11.12 / стр. 5 из 19 процесса.
ВНИМАНИЕ! При удалении отходов после амплификации (пробирок, содержащих продукты ПЦР) недопустимо открывание пробирок и разбрызгивание содержимого, поскольку это может привести к контаминации продуктами ПЦР лабораторной зоны, оборудования и реагентов.
Использовать и менять при каждой операции одноразовые наконечники для автоматических дозаторов с фильтром. Одноразовую пластиковую посуду необходимо сбрасывать в специальный контейнер, содержащий дезинфицирующее средство, которое может быть использовано для обеззараживания медицинских отходов.
Поверхности столов, а также помещения, в которых проводится постановка ПЦР, до начала и после завершения работ необходимо подвергать ультрафиолетовому облучению в течение 30 мин.
Применять набор строго по назначению, согласно данной инструкции.
Допускать к работе с набором только специально обученный персонал.
Не использовать набор по истечении срока годности.
Использовать одноразовые перчатки, лабораторные халаты, защищать глаза во время работы с образцами и реактивами. Тщательно вымыть руки по окончании работы.
Избегать контакта с кожей, глазами и слизистой оболочкой. При контакте немедленно промыть пораженное место водой и обратиться за медицинской помощью.
Листы безопасности материалов (MSDS – material safety data sheet) доступны по запросу.
ДОПОЛНИТЕЛЬНЫЕ МАТЕРИАЛЫ И ОБОРУДОВАНИЕ
ЗОНА 1. Экстракция ДНК из клинического материала
8. Одноразовые полипропиленовые завинчивающиеся или плотно закрывающиеся пробирки объемом 1,5 мл (например, Axygen, США).
9. Одноразовые наконечники с фильтром до 200 мкл и до 1000 мкл в штативах (например, Axygen, США).
10. Одноразовые наконечники до 200 мкл (например, Axygen, США).
11. Штативы для пробирок объемом 1,5 мл (например, Axygen, США).
12. Холодильник от 2 до 8 °С.
13. Отдельный халат, шапочки, обувь и одноразовые перчатки по МУ 1.3.2569-09.
14. Емкость для сброса наконечников.
4. Одноразовые наконечники с фильтром до 100 мкл, до 200 мкл в штативах (например, Axygen, США).
6. Холодильник от 2 до 8 °С с морозильной камерой не выше минус 16 °С для выделенных проб ДНК.
7. Отдельный халат, шапочки, обувь и одноразовые перчатки по МУ 1.3.2569-09.
8. Емкость для сброса наконечников.
Формат FRT Форма 2: REF R-V5-G-F / VER 15.11.12 / стр. 7 из 19
10. Одноразовые полипропиленовые пробирки для ПЦР объемом 0,2 мл или 0,1 мл:
а) тонкостенные пробирки для ПЦР объемом 0,2 мл с круглой (например, Axygen, США) или плоской оптически прозрачной крышкой – при использовании прибора планшетного типа;
б) тонкостенные пробирки для ПЦР объемом 0,2 мл с плоской крышкой (например, Axygen, США) или пробирки для ПЦР к Rotor-Gene, объемом 0,1 мл в стрипах по 4 шт. с крышками (например, Corbett Research, Австралия;
QIAGEN, Германия) – при использовании прибора роторного типа.
ВЗЯТИЕ, ТРАНСПОРТИРОВАНИЕ И ХРАНЕНИЕ ИССЛЕДУЕМОГО МАТЕРИАЛА
Материалом для исследования служит плазма периферической крови. Для получения плазмы кровь отбирают в пробирку с 3 % раствором ЭДТА из расчета 20:1 (20 частей крови на 1 часть ЭДТА). Закрытую пробирку с кровью несколько раз переворачивают. В течение 6 ч с момента взятия крови следует отобрать плазму и перенести в новую пробирку. Для этого пробирку с кровью центрифугируют 20 мин при 800-1600 g, после чего отбирают плазму и переносят в отдельную одноразовую пробирку. Хранить плазму можно не более 3 дней при температуре от 2 до 8 °С и длительно при температуре не выше минус 68 °С.
ПРОВЕДЕНИЕ ПЦР-ИССЛЕДОВАНИЯ
ПЦР-исследование состоит из следующих этапов:
Экстракция ДНК из исследуемых образцов.
Анализ и интерпретация результатов.
ЭКСТРАКЦИЯ ДНК ИЗ ИССЛЕДУЕМЫХ ОБРАЗЦОВ
В качестве отрицательного контроля экстракции (В–) используется реагент ОКО.
ПРОВЕДЕНИЕ АМПЛИФИКАЦИИ С ДЕТЕКЦИЕЙ В РЕЖИМЕ «РЕАЛЬНОГО
Для внесения в пробирки реагентов, проб ДНК и контрольных образцов используются одноразовые наконечники с фильтрами.
А. Подготовка пробирок для амплификации Общий объем реакционной смеси – 25 мкл, включая объем пробы ДНК –
4. Тщательно перемешать полученную реакционную смесь на вортексе и осадить капли кратковременным центрифугированием с помощью центрифуги/вортекса..
5. Внести в каждую пробирку, предназначенную для проведения амплификации, по 15 мкл подготовленной смеси.
6. В подготовленные пробирки внести по 10 мкл проб ДНК, полученных в Число клинических образцов + 1 контроль этапа экстракции ДНК + 3 контроля ПЦР (N+4, N – количество клинических образцов).
Объемы вносимых реагентов приведены с запасом на 1 образец.
Формат FRT Форма 2: REF R-V5-G-F / VER 15.11.12 / стр. 11 из 19ФОРМАТ FRT
результате экстракции из клинических образцов.
7. Поставить контрольные реакции:
а) отрицательный контроль экстракции (В–) – внести в пробирку 10 мкл пробы, выделенной из ОКО.
б) отрицательный контроль ПЦР (К–) – внести в пробирку 10 мкл TE-буфера.
в) положительный контроль ПЦР (К+B/A) – внести в пробирку 10 мкл ПКО ДНК HBV генотипы B/A;
г) положительный контроль ПЦР (К+C/D) – внести в пробирку 10 мкл ПКО ДНК HBV генотипы С/D.
Например, Rotor-Gene 3000, Rotor-Gene 6000 (Corbett Research, Австралия), Rotor-Gene Q (QIAGEN, Германия) и рекомендованные ФБУН ЦНИИ Эпидемиологии Роспотребнадзора в методических рекомендациях по применению данного набора реагентов.
Названия каналов детекции для соответствующего прибора см. в методических рекомендациях к набору реагентов.
Формат FRT Форма 2: REF R-V5-G-F / VER 15.11.12 / стр. 12 из 19 ФОРМАТ FRT
3. Запустить выполнение программы амплификации с детекцией флуоресцентного сигнала.
4. По окончании выполнения программы приступить к анализу и интерпретации результатов.
Результаты интерпретируются на основании наличия (или отсутствия) пересечения кривой флуоресценции с установленной на соответствующем уровне пороговой линией, что определяет наличие (или отсутствие) для данной пробы ДНК значения порогового цикла Ct в соответствующей графе в таблице результатов.
Результат амплификации по каналу считается положительным, если кривая флуоресценции однократно пересекается с пороговой линией в области достоверного прироста флуоресценции, отрицательным в случае отсутствия пересечения с пороговой линией (нет значения Ct или Cp) и сомнительным во всех других случаях.
Учет результатов в контрольных образцах Результаты ПЦР-исследования считаются достоверными, если получены правильные результаты для положительных и отрицательного контролей амплификации и отрицательного контроля экстракции ДНК в соответствии с табл. 5.
Учет результатов в исследуемых клинических образцах
5. Если в таблице результатов для пробы определены два и более значения Ct, то выдается двойной, тройной и т. д. генотип.
1. Если значение Ct хотя бы в одной пробе с положительным контролем этапа ПЦР (К+B/A или К+C/D) превышает указанное во вкладыше граничное значение или отсутствует, необходимо повторить ПЦР-исследование для всех отрицательных образцов, начиная с этапа ПЦР.
2. Если для отрицательного контроля экстракции ДНК (В–) и/или отрицательного контроля ПЦР (К–) по любому из используемых каналов детектируется положительный сигнал, необходимо повторить ПЦР-исследование для всех положительных образцов, начиная с этапа ПЦР.
Формат FRT Форма 2: REF R-V5-G-F / VER 15.11.12 / стр. 15 из 19
СРОК ГОДНОСТИ. УСЛОВИЯ ТРАНСПОРТИРОВАНИЯ И ХРАНЕНИЯ
Срок годности. 12 мес. Набор реагентов с истекшим сроком годности применению не подлежит. Срок годности вскрытых реагентов соответствует сроку годности, указанному на этикетках для невскрытых реагентов, если в инструкции не указано иное.
Транспортирование. Набор реагентов транспортировать при температуре от 2 до 8 С не более 5 сут. При получении разукомплектовать в соответствии с указанными температурами хранения.
Условия отпуска. Для лечебно-профилактических и санитарно-профилактических учреждений.
направлять на предприятие-изготовитель ФБУН ЦНИИ Эпидемиологии Роспотребнадзора (111123 г. Москва, ул. Новогиреевская, д. 3а) в отдел по работе с рекламациями и организации обучения (тел. (495) 974-96-46, факс (495) 916-18-18, email: products@pcr.ru)8.
Формат FRT Форма 2: REF R-V5-G-F / VER 15.11.12 / стр. 16 из 19
ЭКСТРАКЦИЯ ДНК
1. Раствор для лизиса (если он хранился при температуре от 2 до 8 С) прогреть при температуре до 65 °С до полного растворения кристаллов.
2. Отобрать необходимое количество одноразовых пробирок объемом 1,5 мл (включая отрицательный контроль экстракции).
3. В пробирки внести по 300 мкл раствора для лизиса. Промаркировать пробирки.
4. В пробирки с раствором для лизиса внести по 100 мкл пробы, используя наконечники с фильтром. В пробирку отрицательного контроля экстракции (В–) внести 100 мкл ОКО.
5. Содержимое пробирок тщательно перемешать на вортексе, процентрифугировать в течение 5 с на микроцентрифуге для удаления капель с внутренней поверхности крышки и прогреть 5 мин при 65 С в термостате.
6. Добавить в пробирки по 400 мкл раствора для преципитации, тщательно перемешать на вортексе.
7. Центрифугировать пробирки на микроцентрифуге при 12 тыс g (например, 13 400 об/мин для центрифуги MiniSpin, Eppendorf) в течение 5 мин.
8. Аккуратно отобрать надосадочную жидкость, не задевая осадок, используя вакуумный отсасыватель и отдельный наконечник для каждой пробы.
9. Добавить в пробирки по 500 мкл раствора для отмывки 3, плотно закрыть крышки, осторожно промыть осадок, переворачивая пробирки 3-5 раз. Можно провести процедуру одновременно для всех пробирок, для этого необходимо накрыть пробирки в штативе сверху крышкой или другим штативом, прижать их и переворачивать штатив.
10. Центрифугировать при 12 тыс g в течение 1-2 мин на микроцентрифуге.
11. Осторожно, не захватывая осадок, отобрать надосадочную жидкость, используя вакуумный отсасыватель и отдельный наконечник для каждой пробы.
12. Добавить в пробирки по 200 мкл раствора для отмывки 4, плотно закрыть крышки и осторожно промыть осадок, переворачивая пробирки 3-5 раз. Можно провести процедуру одновременно для всех пробирок, для этого необходимо накрыть пробирки в штативе сверху крышкой или другим штативом, прижать
Формат FRT Форма 2: REF R-V5-G-F / VER 15.11.12 / стр. 17 из 19ЭКСТРАКЦИЯ ДНК
их и переворачивать штатив.
13. Центрифугировать при 12 тыс g в течение 2 мин на микроцентрифуге.
14. Осторожно, не захватывая осадок, тщательно отобрать надосадочную жидкость, используя вакуумный отсасыватель и отдельный наконечник для каждой пробы.
15. Поместить пробирки в термостат при температуре 65 °С на 5 мин для подсушивания осадка (при этом крышки пробирок должны быть открыты).
16. Добавить в пробирки по 50 мкл РНК-буфера. Перемешать на вортексе.
Поместить в термостат при температуре 65 °С на 5 мин, периодически встряхивая на вортексе.
17. Центрифугировать пробирки при 12 тыс g в течение 1 мин на микроцентрифуге. Надосадочная жидкость содержит очищенную ДНК. Пробы готовы к постановке ПЦР.
ВНИМАНИЕ! Очищенная ДНК может храниться до 24 ч при температуре от 2 до 8 °С и до года при температуре не выше минус 16 °С.
Читайте также:
 Пожалуйста, не занимайтесь самолечением!При симпотмах заболевания - обратитесь к врачу.
Пожалуйста, не занимайтесь самолечением!При симпотмах заболевания - обратитесь к врачу.