Наблюдение за вирусом в микроскоп
Относящийся к данному классу атомно-силовой микроскоп оказался инструментом, подходящим для исследования биологических объектов и позволил не только визуализировать наноразмерные структуры, но и манипулировать ими. В частности, принципиально возможной оказалась манипуляция одиночными вирионами и прямое измерение сил, возникающих при их контакте с поверхностью клетки. Такие эксперименты позволяют получать подробные данные о самом первом и во многих случаях еще недостаточно исследованном этапе заражения клетки – адгезии вируса к ее поверхности. Данные исследования представляют и значительный практический интерес, т.к. могут дать ключ к созданию эффективных противовирусных препаратов, защищающих клетки от проникновения вирусов.
Вирусы являются чрезвычайно малыми объектами – их размеры лежат в диапазоне от нескольких десятков до нескольких сотен нанометров. Первым и на долгое время единственным методом прямой визуализации наноразмерных частиц стала электронная микроскопия (ЭМ), которая начала развиваться в 1930-е гг. Метод, оказавшийся очень информативным, позволил не только детально охарактеризовать структуру различных вирусов, но и исследовать процессы, происходящие в зараженной клетке.
Оказалось, что форма вирусных частиц отличается большим разнообразием: от правильных сфер до сложных структур, напоминающих кирпичи, обклеенные трубочками (вирус натуральной оспы), или щетинистых червей (вирус геморрагической лихорадки Эбола).
Вне клетки любой вирус является всего лишь молекулярным контейнером с генетическим материалом (ДНК или РНК) и вряд ли может считаться полноценным живым организмом, хотя по этому вопросу в научной среде до сих пор нет окончательной терминологической определенности.
Так, исследование репликации вируса методом просвечивающей электронной микроскопии на ультратонких срезах выглядит следующим образом: зараженные клетки обрабатывают фиксирующим раствором, обезвоживают спиртом и заливают специальной смолой. После отвердевания смолы с помощью специального прибора – ультратома – делают ультратонкие (≈ 50 нм) срезы, которые затем наносят на специальную сетку и обрабатывают растворами солей тяжелых металлов. Во время самого микроскопического исследования образец находится в вакуумной камере и подвергается действию пучка электронов с энергией в несколько десятков кэВ. Очевидно, что прижизненная визуализация в данном случае принципиально невозможна.
В течение почти полувека электронная микроскопия оставалась единственным методом визуализации наноразмерных объектов. Однако в начале 1980-х гг. эта монополия была нарушена появлением сканирующей зондовой микроскопии (СЗМ). Основным принципом СЗМ является сканирование – прецизионное (с высокой точностью) перемещение зонда вблизи исследуемой поверхности, сопряженное с отслеживанием определенного параметра, характеризующего взаимодействие между зондом и образцом. Результатом такого сканирования является топографическая карта рельефа поверхности образца.
Первым прибором СЗМ стал сканирующий туннельный микроскоп (СТМ), который мог лишь весьма ограниченно использоваться для визуализации биологических объектов, так как для его работы требовалась высокая электрическая проводимость исследуемой поверхности.
В 1986 г. швейцарский физик Г. Бинниг и его коллеги создали новый прибор семейства СЗМ – атомно-силовой микроскоп (АСМ). В основе его работы лежит силовое (Ван-дер-Ваальсово) взаимодействие атомов зонда и поверхности. АСМ не требуется электрическая проводимость поверхности образца, и он может осуществлять съемку в жидкой среде. Поэтому этот прибор оказался удобным инструментом для исследования биологических объектов.

С момента появления атомно-силового микроскопа было опубликовано огромное число работ, посвященных АСМ-визуализации самых разнообразных биологических образцов. Следует все же признать, что в большинстве случаев в плане визуализации АСМ не дает ничего принципиально нового в сравнении с обычной электронной микроскопией, поэтому зачастую данный метод воспринимается биологами как техническая экзотика, а не как полноценный исследовательский инструмент.
Однако важнейшим, пусть и почти единственным преимуществом визуализации биологических объектов при помощи АСМ по сравнению с электронной микроскопией является возможность выполнения исследований нативных, природных образцов без какой-либо фиксации и специальной пробоподготовки, при физиологических параметрах среды.
Помимо визуализации рельефа поверхности с субнанометровым разрешением АСМ позволяет осуществлять прямое измерение сил, возникающих при взаимо¬действии одиночных наноразмерных объектов.
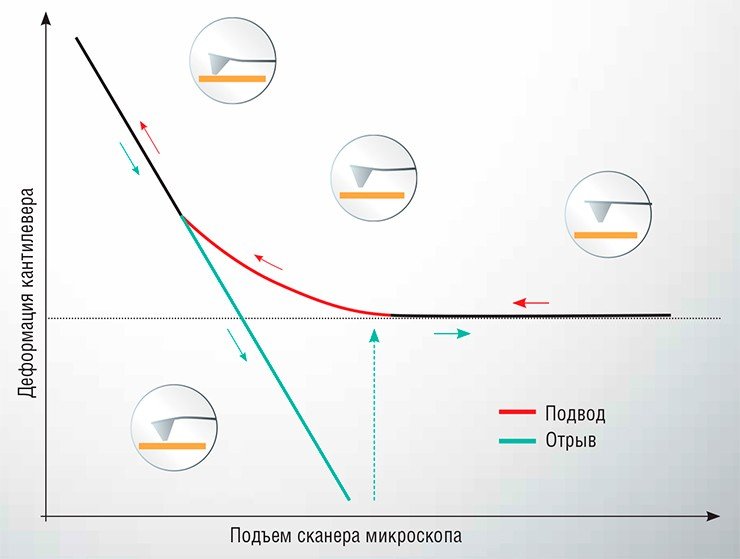
Проводятся такие измерения следующим образом: один объект закрепляется на острие зонда АСМ, а второй фиксируется на подложке, после чего зонд подводится к поверхности подложки до достижения механического контакта, а затем возвращается обратно. В ходе этого перемещения отслеживается деформация упругой консоли (кантилевера). Зависимость этого параметра от расстояния между зондом и подложкой называется силовой кривой. С ее помощью можно определить величину силы, действующей между исследуемыми объектами. Этот метод, названный атомно-силовой спектроскопией (АСС), может использоваться для исследования силовых характеристик взаимодействия самых разнообразных малых объектов: от неорганических наночастиц до вирусов и живых клеток.
Начальным этапом заражения клетки вирусом является адгезия (прилипание) вирусной частицы (вириона) к клеточной поверхности с последующим проникновением генетического материала вируса внутрь клетки. Этот процесс, определяемый взаимодействием белковых рецепторов, расположенных на поверхности клетки, с поверхностными белками вириона, является критически важным для размножения вируса. И, надо отметить, в большинстве случаев изучен недостаточно.

Однако фиксация одиночной вирусной частицы на острие зонда атомно-силового микроскопа является весьма непростой задачей. Для успешного проведения эксперимента требуется большая подготовительная работа:
- получить как можно более чистый и концентрированный препарат вируса;
- подготовить на острие зонда площадку подходящего размера для посадки вириона;
- химически активировать поверхность зонда для образования ковалентных связей при контакте с белками вируса;
- убедиться в том, что на зонде закрепился действительно вирион, а не молекулы свободного белка или мелкие фрагменты клеток, всегда присутствующие в препаратах вирусов.
Оценка концентрации и степени чистоты препарата вируса обычно проводится методом просвечивающей электронной микроскопии. Площадку на острие АСМ-зонда, которое обычно изготавливают из кремния или его нитрида, формируют путем длительного сканирования кремниевой или сапфировой подложки при больших значениях развертки и силы прижатия зонда к поверхности. Наиболее наглядной иллюстрацией для этого процесса служит изменение формы острия карандаша в ходе интенсивного рисования.
По меркам микроскопии, клетка высших организмов является относительно крупным (≈ 10 мкм) объектом, поэтому хорошо видна в световом микроскопе, при помощи которого на нее наводится кантилевер атомно-силового микроскопа. Но как быть с самим зондом, на острие которого предполагается наличие вириона? Строго говоря, вместо вириона там может оказаться все, что угодно: монослой белковых молекул, фрагмент клетки или вириона, агрегат из нескольких вирионов, случайное загрязнение и т. д. Кроме того, в процессе измерения вирион может разрушиться или оторваться от зонда. Визуализация же зонда с вирусной частицей методом электронной микроскопии до силовых измерений недопустима, так как под воздействием высушивания, вакуума и пучка электронов вирион приобретет необратимые изменения.
Наиболее эффективным методом решения данной проблемы оказалась визуализация острия зонда АСМ с помощью электронной микроскопии, осуществляемая непосредственно после силовых измерений. Если на острие будет обнаружена вирусная частица, уцелевшая в ходе эксперимента, то все сомнения развеются.
В течение последних пятидесяти лет в результате поистине титанической работы, проделанной электронными микроскопистами всего мира, накоплен огромный багаж знаний в области ультраструктурных аспектов репликации различных вирусов. Создание атомно-силового микроскопа и техники силовой спектроскопии позволило вплотную приблизиться к произвольной механической манипуляции одиночными вирусными частицами. Это выводит изучение взаимодействия вируса с клеткой на принципиально другой уровень – от структурных исследований к функциональным.
При этом атомно-силовая спектроскопия не является конкурентом для электронной микроскопии, а открывает новое самостоятельное направление исследований – наномеханику взаимодействия вирусной частицы с поверхностью клетки. Весьма вероятно, что в самом ближайшем будущем в данном направлении будут совершены фундаментальные открытия, соизмеримые по значимости с достижениями электронной микроскопии в середине прошлого века.
Изучение механизмов связывания вирусных частиц с поверхностью клетки вызывает значительный интерес не только с позиции фундаментальной науки, но и в контексте практических приложений. Более детальное понимание этих механизмов на молекулярном уровне может дать человечеству ключ к созданию эффективных противовирусных препаратов, защищающих клетки от проникновения вирусов.
*Просвечивающая электронная микроскопия с использованием специальной жидкостной ячейки и сканирующая электронная микроскопия при атмосферном давлении позволяют исследовать биологические объекты без фиксации, но из-за ряда технических трудностей и относительно низкого пространственного разрешения эти методы не получили широкого распространения
Корнеев Д. В., Бессуднова Е. В., Зайцев Б. Н. Изучение взаимодействия наночастиц TiO2 и поверхности эритроцитов человека методом атомно-силовой спектроскопии // УНЖ. 2012. № 4. С. 73—77.
Миронов В. Л. Основы сканирующей зондовой микроскопии. Нижний Новгород: ИФМ РАН, 2004. 182 с.
Alsteens D., Pesavent E., Cheuvart G. et al. Controlled manipulation of bacteriophages using single-virus force spectroscopy // ACSNANO. 2009. V. 3(10). P. 3063—3068.
Alsteens D., Trabelsi H., Soumillion P., Dufrene Y. F., Multiparametric atomic force microscopy imaging of single bacteriophages extruding from living bacteria // Nature Communications. V. 4. Article number: 2926.
Binnig G., Quate C. F., Gerber Ch. Atomic force microscope // Phys. Rev. Lett. 1986. V. 56(9). P. 930—933.
Cappella B., Dietler G. Force-distance curves by atomic force microscopy // Surf. Sci. Rep. 1999. V. 34. P. 1—104.
Malkin A.J., Plomp M., McPherson A. Unraveling the architecture of viruses by high-resolution atomic force microscopy // Methods Mol. Biol. 2005. V. 292. P. 85—108.
В публикации использованы фото автора
11 октября 2013
- 28761
- 23,8
- 7
- 5
Подсчёт эритроцитов в камере Горяева. Увеличение: 100×.

Спонсор конкурса — дальновидная компания Thermo Fisher Scientific. Спонсор приза зрительских симпатий — фирма Helicon.
Вот уже два года, как я наблюдаю за этим миром у себя дома, и год, как делаю фотоснимки. За это время я успел увидеть собственными глазами, какие бывают клетки крови, что опадает с крыльев бабочек и молей, как бьётся сердце у улитки. Конечно, многое можно было бы почерпнуть из учебников, видеолекций и с тематических веб-сайтов. Единственное, что осталось бы не почерпнутым — это ощущение присутствия и близости к тому, чего не видно невооружённым глазом. То, что прочитано в книге или увидено в телепередаче, скорее всего, сотрется из памяти в весьма сжатые сроки. Что увидено лично в объектив микроскопа — останется с тобой навсегда. И останется не столько сам образ увиденного, сколько понимание, что мир устроен именно так, а не иначе. Что это не просто слова из книжки, а личный опыт. Опыт, который в наше время доступен каждому.
Что купить?
Наблюдение при больших увеличениях требует хорошего освещения в силу небольшой апертуры соответствующих объективов. Канули те времена, когда препарат исследовали в отражённом от зеркала свете. Сейчас микроскопы представляют собой комплексные оптико-механо-электрические приборы, в которых всецело используются достижения научно-технического прогресса. В современных устройствах имеется своя лампочка, свет от которой распространяется через специальное устройство — конденсор, — которое и освещает препарат. В зависимости от типа конденсора можно выделить различные способы наблюдения, самыми популярными из которых являются методы светлого и тёмного поля. Первый метод, знакомый многим ещё со школы, предполагает, что препарат освещается равномерно снизу. При этом в тех местах, где препарат оптически прозрачен, свет распространяется от конденсора в объектив, а в непрозрачной среде свет поглощается, приобретает окраску и рассеивается. Поэтому на белом фоне получается тёмное изображение — отсюда и название метода.
С темнопольным конденсором всё иначе. Он устроен так, что лучи света, выходящие из него, направлены в разные стороны, кроме непосредственно отверстия объектива. Поэтому они проходят сквозь оптически прозрачную среду, не попадая в поле зрения наблюдателя. С другой стороны, лучи, попавшие на непрозрачный объект, рассеиваются на нём во все стороны, в том числе и в направлении объектива. Поэтому в итоге на тёмном фоне будет виден светлый объект. Такой метод наблюдения хорош для исследования прозрачных объектов, которые на светлом фоне не являются контрастными. По умолчанию большинство микроскопов являются светлопольными. Поэтому, если вы планируете расширить набор методов наблюдения, то стоит выбирать модели микроскопов, в которых предусмотрена установка дополнительного оборудования: конденсоров, устройств фазового контраста, поляризаторов и т.п.
Конечно, это не весь список параметров, которые следует учитывать при покупке микроскопа. Иногда бывает важно обратить внимание на устройство и расположение предметного столика и рукояток для управления им. Стоит выбрать и тип осветителя, которым может быть как обычная лампа накаливания, так и светодиод, который светит ярче и греется меньше. Также микроскопы могут иметь индивидуальные особенности. Но основное, что стоило бы сказать об их устройстве, пожалуй, сказано. Каждая дополнительная опция — это добавка к цене, поэтому выбор модели и комплектации — это удел конечного потребителя.
Как смотреть?
Любительское наблюдение не предполагает исключительных навыков ни в работе с микроскопом, ни в подготовке препаратов. Конечно, можно купить далеко не дешёвые наборы уже готовых препаратов, но тогда не таким ярким будет ощущение вашего личного присутствия в исследовании, да и готовые препараты рано или поздно наскучат. Поэтому, купив микроскоп, стоит задуматься о реальных объектах для наблюдения. Кроме того, вам понадобятся хоть и специальные, но доступные средства для подготовки препаратов.
Наблюдение в проходящем свете предполагает, что исследуемый объект является достаточно тонким. Даже не каждая кожура с ягоды или фрукта сама по себе обладает необходимой толщиной, поэтому в микроскопии исследуют срезы. В домашних условиях достаточно адекватные срезы можно делать обычными лезвиями для бритья. При определённой сноровке можно достигнуть толщины среза в несколько клеточных слоёв, что во многом повысит дифференцируемость объектов препарата. В идеале стоит работать с моноклеточным слоем ткани, ибо несколько слоёв клеток, наложенных друг на друга, создают нечёткое и сумбурное изображение.
Для взятия образцов крови следует приобрести скарификаторы, пипетки и вату. Всё это есть в продаже в медицинских магазинах и аптеках. Кроме того, для сбора объектов из дикой природы следует запастись маленькими пакетиками и баночками. Брать с собой баночку для набора воды из ближайшего водоёма при выезде на природу должно стать у вас хорошей привычкой.
Что смотреть?
Микроскоп приобретён, инструменты закуплены — пора начинать. И начать следует с самого доступного. Что может быть доступнее кожуры репчатого лука (рис. 1 и 2)? Являясь тонкой сама по себе, кожура лука, будучи подкрашенной йодом, обнаруживает в своём строении чётко дифференцируемые ядра. Этот опыт, хорошо знакомый со школы, пожалуй, и стоит провести первым. Саму кожуру лука нужно залить йодом и оставить окрашиваться на 10–15 минут, после чего нужно промыть её под струёй воды.
Кроме того, йод можно использовать для окраски картофеля (рис. 3). Не стоит забывать, что срез необходимо делать как можно более тонким. Буквально 5–10 минут пребывания среза картофеля в йоде проявят пласты крахмала, которые окрасятся в синий цвет. Йод является достаточно универсальным красителем. Им можно окрашивать широкий спектр препаратов.
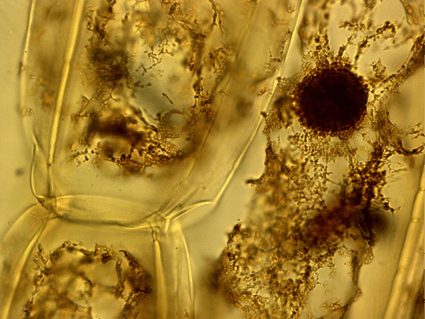
Рисунок 1. Кожица лука (увеличение: 1000×). Окраска йодом. На фотографии дифференцируется ядро в клетке.
Фотография автора статьи.
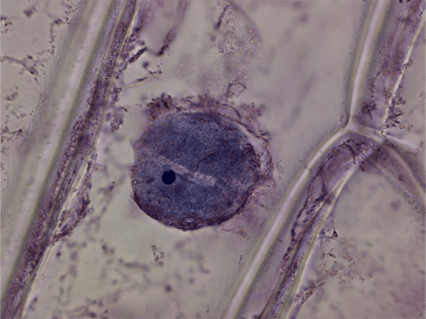
Рисунок 2. Кожица лука (увеличение: 1000×). Окраска Азур-Эозином. На фотографии в ядре дифференцируется ядрышко.
Фотография автора статьи.
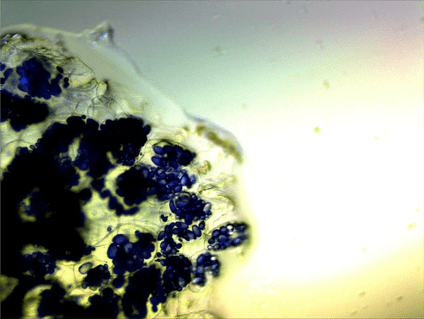
Рисунок 3. Зерна крахмала в картофеле (увеличение: 100×). Окраска йодом.
Фотография автора статьи.

Рисунок 4. Крыло божьей коровки (увеличение: 400×).
Фотография автора статьи.

Рисунок 5. Крыло бибионида (увеличение: 400×).
Фотография автора статьи.

Рисунок 6. Крыло бабочки боярышницы (увеличение: 100×).
Фотография автора статьи.
Кроме того, можно поверхностно изучить строение конечностей членистоногих (рис. 8), рассмотреть хитиновые плёнки — например, на спине таракана (рис. 9). При должном увеличении можно убедиться, что такие плёнки состоят из плотно прилегающих (возможно, сросшихся) чешуек.

Рисунок 7. Чешуйки с крыльев моли (увеличение: 400×).
Фотография автора статьи.

Рисунок 8. Конечность паука (увеличение: 100×).
Фотография автора статьи.
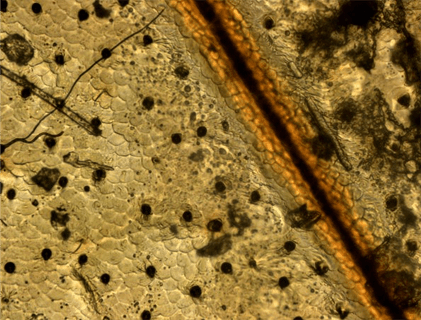
Рисунок 9. Плёнка на спине таракана (увеличение: 400×).
Фотография автора статьи.
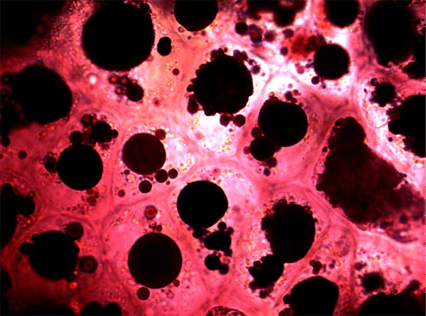
Рисунок 10. Кожура чёрного винограда (увеличение: 1000×).
Фотография автора статьи.
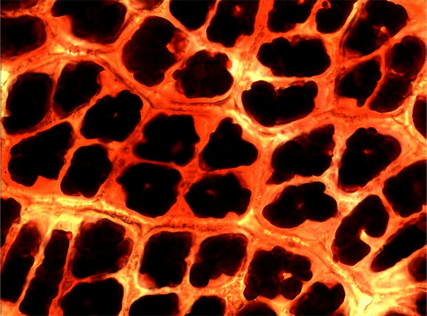
Рисунок 11. Кожура сливы (увеличение: 1000×).
Фотография автора статьи.
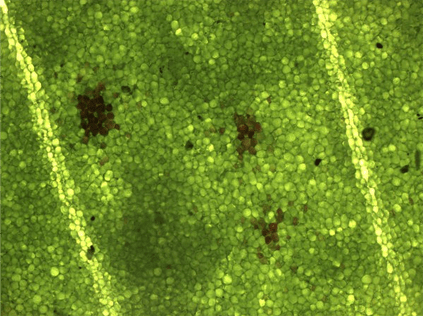
Рисунок 12. Лист клевера (увеличение: 100×). Некоторые клетки содержат тёмнокрасный пигмент.
Фотография автора статьи.
Достаточно доступным для исследования объектом является зелень: трава, водоросли, листья (рис. 12 и 13). Но, несмотря на повсеместную распространённость, выбрать и приготовить хороший образец бывает не так-то просто.
Самым интересным в зелени являются, пожалуй, хлоропласты (рис. 14 и 15). Поэтому срез должен быть исключительно тонким. Нередко приемлемой толщиной обладают зелёные водоросли, встречающиеся в любых открытых водоёмах.

Рисунок 13. Лист земляники (увеличение: 40×).
Фотография автора статьи.
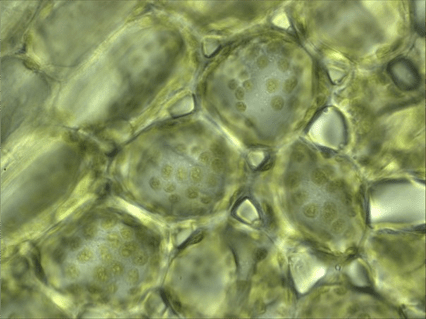
Рисунок 14. Хлоропласты в клетках травы (увеличение: 1000×).
Фотография автора статьи.
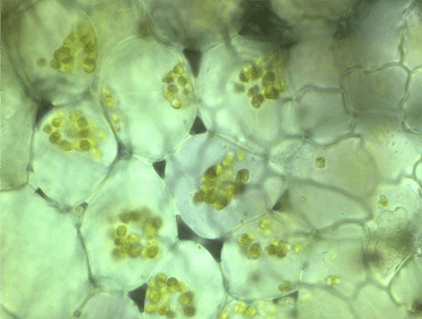
Рисунок 15. Хлоропласты в клетках водоросли (увеличение: 1000×).
Фотография автора статьи.
Там же вы встретите и плавучие водоросли и других водных микроорганизмов (рис. 16). Вам также может посчастливиться встретить малька улитки или другого животного, живущего в водоёме (рис. 17 и 18). Маленький детёныш улитки, будучи достаточно оптически прозрачным, позволяет разглядеть у себя биение сердца (видео 1).
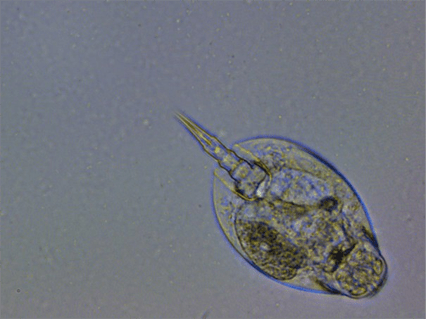
Рисунок 16. Плавающая водоросль со жгутиком (увеличение: 400×).
Фотография автора статьи.

Рисунок 17. Детёныш улитки (увеличение: 40×).
Фотография автора статьи.
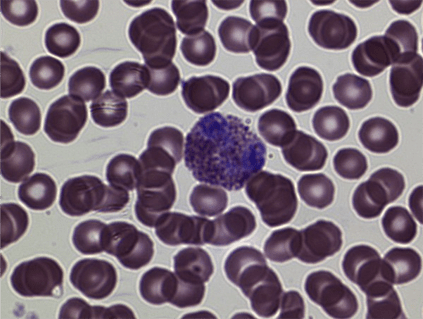
Рисунок 18. Мазок крови. Окраска Азур-Эозином по Романовскому (увеличение: 1000×). На фотографии эозинофил на фоне эритроцитов.
Фотография автора статьи.
Сам себе учёный
Видео 1. Биение сердца улитки (увеличение оптического микроскопа 100×).
После исследования простых и доступных препаратов естественным желанием является усложнение техник наблюдения и расширение класса изучаемых объектов. Для этого, во-первых, понадобится литература по специальным методам исследования, а, во-вторых, специальные средства. Эти средства, хотя и являются своими для каждого типа объектов, всё-таки обладают некоторой общностью и универсальностью. Например, всеобще известный метод окраски по Граму, когда разные виды бактерий после окраски дифференцируются по цветам, может быть применён и при окраске других, не бактериальных, клеток. Близким к нему по сути является и метод окраски мазков крови по Романовскому. В продаже имеется как уже готовый жидкий краситель, так и порошок, состоящий из таких красящих веществ, как азур и эозин. Все красители можно купить в специализированных медико-биологических магазинах, либо заказать в интернете. Если же по каким-то причинам вы не можете достать краситель для крови, можно попросить лаборанта, делающего вам анализ крови в больнице, приложить к анализу стёклышко с окрашенным мазком вашей крови.
Продолжая тему исследования крови, нельзя не упомянуть камеру Горяева — устройство для подсчёта форменных элементов крови. Будучи важным инструментом для оценки количества эритроцитов в крови ещё в те времена, когда не было устройств для автоматического анализа её состава, камера Горяева также позволяет измерять размеры объектов благодаря нанесённой на неё разметке с известными размерами делений. Методы исследования крови и других жидкостей с помощью камеры Горяева описаны в специальной литературе.
Заключение
В данной статье я постарался рассмотреть основные моменты, связанные с выбором микроскопа, подручных средств и основные классы объектов для наблюдения, которые нетрудно встретить в быту и на природе. Как уже было сказано, специальные средства наблюдения предполагают наличие хотя бы начальных навыков работы с микроскопом, поэтому их обзор выходит за рамки данной статьи. Как видно из фотографий, микроскопия может стать приятным хобби, а может быть, для кого-то даже и искусством.
В современном мире, где разнообразные технические средства и устройства находятся в шаговой доступности, каждый сам решает, на что ему потратить собственные деньги. Из развлекательных соображений это может быть дорогостоящий ноутбук или телевизор с запредельным размером диагонали. Но находятся и те, кто отводит свой взор от экранов и направляет его либо далеко в космос, приобретая телескоп, либо, смотря в окуляр микроскопа, проникают взглядом глубоко внутрь. Внутрь той природы, частью которой мы являемся.

Относящийся к данному классу атомно-силовой микроскоп оказался инструментом, подходящим для исследования биологических объектов и позволил не только визуализировать наноразмерные структуры, но и манипулировать ими. В частности, принципиально возможной оказалась манипуляция одиночными вирионами и прямое измерение сил, возникающих при их контакте с поверхностью клетки. Такие эксперименты позволяют получать подробные данные о самом первом и во многих случаях еще недостаточно исследованном этапе заражения клетки — адгезии вируса к ее поверхности. Данные исследования представляют и значительный практический интерес, т.к. могут дать ключ к созданию эффективных противовирусных препаратов, защищающих клетки от проникновения вирусов.

Вирусы являются чрезвычайно малыми объектами — их размеры лежат в диапазоне от нескольких десятков до нескольких сотен нанометров. Первым и на долгое время единственным методом прямой визуализации наноразмерных частиц стала электронная микроскопия (ЭМ), которая начала развиваться в 1930-е гг. Метод, оказавшийся очень информативным, позволил не только детально охарактеризовать структуру различных вирусов, но и исследовать процессы, происходящие в зараженной клетке.
Оказалось, что форма вирусных частиц отличается большим разнообразием: от правильных сфер до сложных структур, напоминающих кирпичи, обклеенные трубочками (вирус натуральной оспы), или щетинистых червей (вирус геморрагической лихорадки Эбола).
Вне клетки любой вирус является всего лишь молекулярным контейнером с генетическим материалом (ДНК или РНК) и вряд ли может считаться полноценным живым организмом, хотя по этому вопросу в научной среде до сих пор нет окончательной терминологической определенности.
Так, исследование репликации вируса методом просвечивающей электронной микроскопии на ультратонких срезах выглядит следующим образом: зараженные клетки обрабатывают фиксирующим раствором, обезвоживают спиртом и заливают специальной смолой. После отвердевания смолы с помощью специального прибора — ультратома — делают ультратонкие (≈ 50 нм) срезы, которые затем наносят на специальную сетку и обрабатывают растворами солей тяжелых металлов. Во время самого микроскопического исследования образец находится в вакуумной камере и подвергается действию пучка электронов с энергией в несколько десятков кэВ. Очевидно, что прижизненная визуализация в данном случае принципиально невозможна.
В течение почти полувека электронная микроскопия оставалась единственным методом визуализации наноразмерных объектов. Однако в начале 1980-х гг. эта монополия была нарушена появлением сканирующей зондовой микроскопии (СЗМ). Основным принципом СЗМ является сканирование — прецизионное (с высокой точностью) перемещение зонда вблизи исследуемой поверхности, сопряженное с отслеживанием определенного параметра, характеризующего взаимодействие между зондом и образцом. Результатом такого сканирования является топографическая карта рельефа поверхности образца.
Первым прибором СЗМ стал сканирующий туннельный микроскоп (СТМ), который мог лишь весьма ограниченно использоваться для визуализации биологических объектов, так как для его работы требовалась высокая электрическая проводимость исследуемой поверхности.
В 1986 г. швейцарский физик Г. Бинниг и его коллеги создали новый прибор семейства СЗМ — атомно-силовой микроскоп (АСМ). В основе его работы лежит силовое (Ван-дер-Ваальсово) взаимодействие атомов зонда и поверхности. АСМ не требуется электрическая проводимость поверхности образца, и он может осуществлять съемку в жидкой среде. Поэтому этот прибор оказался удобным инструментом для исследования биологических объектов.

Принципиальная схема работы атомно-силового микроскопа (АСМ). Чувствительным элементом АСМ является упругая консоль (кантилевер), на конце которой закреплен острый зонд. Силы, возникающие между атомами острия зонда и исследуемой поверхностью приводят к деформации кантилевера, которая в свою очередь фиксируется при помощи оптической системы, реализованной в большинстве современных АСМ на основе полупроводникового лазера и четырехсекционного фотоприемника. Размер кантилевера — 100÷300 × 20÷40 мкм при толщине около 2 мкм. Высота зонда — около 10 мкм
С момента появления атомно-силового микроскопа было опубликовано огромное число работ, посвященных АСМ-визуализации самых разнообразных биологических образцов. Следует все же признать, что в большинстве случаев в плане визуализации АСМ не дает ничего принципиально нового в сравнении с обычной электронной микроскопией, поэтому зачастую данный метод воспринимается биологами как техническая экзотика, а не как полноценный исследовательский инструмент.
Однако важнейшим, пусть и почти единственным преимуществом визуализации биологических объектов при помощи АСМ по сравнению с электронной микроскопией является возможность выполнения исследований нативных, природных образцов без какой-либо фиксации и специальной пробоподготовки, при физиологических параметрах среды.
Помимо визуализации рельефа поверхности с субнанометровым разрешением АСМ позволяет осуществлять прямое измерение сил, возникающих при взаимодействии одиночных наноразмерных объектов.
Проводятся такие измерения следующим образом: один объект закрепляется на острие зонда АСМ, а второй фиксируется на подложке, после чего зонд подводится к поверхности подложки до достижения механического контакта, а затем возвращается обратно. В ходе этого перемещения отслеживается деформация упругой консоли (кантилевера). Зависимость этого параметра от расстояния между зондом и подложкой называется силовой кривой. С ее помощью можно определить величину силы, действующей между исследуемыми объектами. Этот метод, названный атомно-силовой спектроскопией (АСС), может использоваться для исследования силовых характеристик взаимодействия самых разнообразных малых объектов: от неорганических наночастиц до вирусов и живых клеток.

Метод атомно-силовой спектроскопии позволяет определить величину силы, действующей между исследуемыми объектами. Для этого один объект закрепляется на острие зонда АСМ, а второй фиксируется на подложке. Зонд подводится к поверхности подложки и затем поднимается обратно. Зависимость деформации кантилевера от расстояния между зондом и подложкой называется силовой кривой
Начальным этапом заражения клетки вирусом является адгезия (прилипание) вирусной частицы (вириона) к клеточной поверхности с последующим проникновением генетического материала вируса внутрь клетки. Этот процесс, определяемый взаимодействием белковых рецепторов, расположенных на поверхности клетки, с поверхностными белками вириона, является критически важным для размножения вируса. И, надо отметить, в большинстве случаев изучен недостаточно.
Однако фиксация одиночной вирусной частицы на острие зонда атомно-силового микроскопа является весьма непростой задачей. Для успешного проведения эксперимента требуется большая подготовительная работа:
- получить как можно более чистый и концентрированный препарат вируса;
- подготовить на острие зонда площадку подходящего размера для посадки вириона;
- химически активировать поверхность зонда для образования ковалентных связей при контакте с белками вируса;
- убедиться в том, что на зонде закрепился действительно вирион, а не молекулы свободного белка или мелкие фрагменты клеток, всегда присутствующие в препаратах вирусов.
Оценка концентрации и степени чистоты препарата вируса обычно проводится методом просвечивающей электронной микроскопии. Площадку на острие АСМ-зонда, которое обычно изготавливают из кремния или его нитрида, формируют путем длительного сканирования кремниевой или сапфировой подложки при больших значениях развертки и силы прижатия зонда к поверхности. Наиболее наглядной иллюстрацией для этого процесса служит изменение формы острия карандаша в ходе интенсивного рисования.

Адекватным методом контроля геометрических параметров зонда атомно-силового микроскопа (а) при создании площадки для посадки вириона, является электронная микроскопия, как сканирующая, так и просвечивающая: б — площадка на острие зонда для посадки крупной вирусной частицы; в — вирусоподобная частица, закрепленная на острие зонда. Просвечивающая электронная микроскопия (JEM 1400, Jeol, Япония)
По меркам микроскопии, клетка высших организмов является относительно крупным (≈ 10 мкм) объектом, поэтому хорошо видна в световом микроскопе, при помощи которого на нее наводится кантилевер атомно-силового микроскопа. Но как быть с самим зондом, на острие которого предполагается наличие вириона? Строго говоря, вместо вириона там может оказаться все, что угодно: монослой белковых молекул, фрагмент клетки или вириона, агрегат из нескольких вирионов, случайное загрязнение и т. д. Кроме того, в процессе измерения вирион может разрушиться или оторваться от зонда. Визуализация же зонда с вирусной частицей методом электронной микроскопии до силовых измерений недопустима, так как под воздействием высушивания, вакуума и пучка электронов вирион приобретет необратимые изменения.
Наиболее эффективным методом решения данной проблемы оказалась визуализация острия зонда АСМ с помощью электронной микроскопии, осуществляемая непосредственно после силовых измерений. Если на острие будет обнаружена вирусная частица, уцелевшая в ходе эксперимента, то все сомнения развеются.
В течение последних пятидесяти лет в результате поистине титанической работы, проделанной электронными микроскопистами всего мира, накоплен огромный багаж знаний в области ультраструктурных аспектов репликации различных вирусов. Создание атомно-силового микроскопа и техники силовой спектроскопии позволило вплотную приблизиться к произвольной механической манипуляции одиночными вирусными частицами. Это выводит изучение взаимодействия вируса с клеткой на принципиально другой уровень — от структурных исследований к функциональным.
При этом атомно-силовая спектроскопия не является конкурентом для электронной микроскопии, а открывает новое самостоятельное направление исследований — наномеханику взаимодействия вирусной частицы с поверхностью клетки. Весьма вероятно, что в самом ближайшем будущем в данном направлении будут совершены фундаментальные открытия, соизмеримые по значимости с достижениями электронной микроскопии в середине прошлого века.
Изучение механизмов связывания вирусных частиц с поверхностью клетки вызывает значительный интерес не только с позиции фундаментальной науки, но и в контексте практических приложений. Более детальное понимание этих механизмов на молекулярном уровне может дать человечеству ключ к созданию эффективных противовирусных препаратов, защищающих клетки от проникновения вирусов.
В публикации использованы фото автора
Литература
1. Корнеев Д. В., Бессуднова Е. В., Зайцев Б. Н. Изучение взаимодействия наночастиц TiO2 и поверхности эритроцитов человека методом атомно-силовой спектроскопии // УНЖ. 2012. № 4. С. 73–77.
2. Миронов В. Л. Основы сканирующей зондовой микроскопии. Нижний Новгород: ИФМ РАН, 2004. 182 с.
3. Alsteens D., Pesavent E., Cheuvart G. et al. Controlled manipulation of bacteriophages using single-virus force spectroscopy // ACSNANO. 2009. V. 3 (10). P. 3063–3068.
4. Alsteens D., Trabelsi H., Soumillion P., Dufrene Y. F. Multiparametric atomic force microscopy imaging of single bacteriophages extruding from living bacteria // Nature Communications. V. 4. Article number: 2926.
5. Binnig G., Quate C. F., Gerber Ch. Atomic force microscope // Phys. Rev. Lett. 1986. V. 56 (9). P. 930–933.
6. Cappella B., Dietler G. Force-distance curves by atomic force microscopy // Surf. Sci. Rep. 1999. V. 34. P. 1–104.
7. Malkin A. J., Plomp M., McPherson A. Unraveling the architecture of viruses by high-resolution atomic force microscopy // Methods Mol. Biol. 2005. V. 292. P. 85–108.
* Просвечивающая электронная микроскопия с использованием специальной жидкостной ячейки и сканирующая электронная микроскопия при атмосферном давлении позволяют исследовать биологические объекты без фиксации, но из-за ряда технических трудностей и относительно низкого пространственного разрешения эти методы не получили широкого распространения.
Читайте также:


