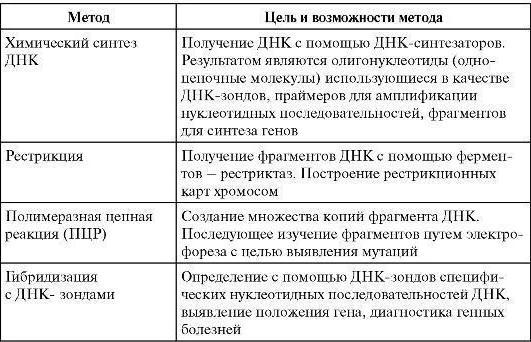
Молекулярно-генетический метод исследования вирусов
Полимеразная цепная реакцияпозволяет обнаружить микроб в исследуемом материале (воде, продуктах, материале от больного) по наличию в нем ДНК микроба без выделения последнего в чистую культуру.
Для проведения этой реакции из исследуемого материала выделяют ДНК, в которой определяют наличие специфичного для данного микроба гена. Обнаружение гена осуществляют его накоплением. Для этого необходимо иметь праймеры комплементарного З'-концам ДНК. исходного гена. Накопление (амплификация) гена выполняется следующим образом. Выделенную из исследуемого материала ДНК нагревают. При этом ДНК распадается на 2 нити. Добавляют праймеры. Смесь ДНК и праймеров охлаждают. При этом праймеры, при наличии в смеси ДНК искомого гена, связываются с его комплементарными участками. Затем к смеси ДНК и праймера добавляют ДНК-полимеразу и нуклеотиды. Устанавливают температуру, оптимальную для функционирования ДНК-полимеразы. В этих условиях, в случае комплементарное™ ДНК гена и праймера, происходит присоединение нуклеотидов к З'-концам праймеров, в результате чего синтезируются две копии гена. После этого цикл повторяется снова, при этом количество ДНК гена будет увеличиваться каждый раз вдвое. Проводят реакцию в специальных приборах — амплификаторах. ПЦР применяется для диагностики вирусных и бактериальных инфекций.
Рестрикционный анализ.Данный метод основан на применении ферментов, носящих название рестриктаз. Рестриктазы представляют собой эндонук-леазы, которые расщепляют молекулы ДНК, разрывая фосфатные связи не в произвольных местах, а в определенных последовательностях нуклеотидов. Особое значение для методов молекулярной генетики имеют рестриктазы, которые узнают последовательности, обладающие центральной симметрией и считывающиеся одинаково в обе стороны от оси симметрии. Точка разрыва ДНК может или совпадать с осью симметрии, или быть сдвинута относительно нее.
В настоящее время из различных бактерий выделено и очищено более 175 различных рестриктаз, для которых известны сайты (участки) узнавания (рестрикции). Выявлено более 80 различных типов сайтов, в которых может происходить разрыв двойной спирали ДНК.
В геноме конкретной таксономической единицы находится строго определенное (генетически задетерминированное) число участков узнавания для определенной рестриктазы.
Если выделенную из конкретного микроба ДНК обработать определенной рестриктазой, то это приведет к образованию строго определенного количества фрагментов ДНК фиксированного размера.
Размер каждого типа фрагментов можно узнать с помощью электрофореза в агарозном геле: мелкие фрагменты перемещаются в геле быстрее, чем более крупные фрагменты, и длина их пробега больше. Гель окрашивают бромистым этидием и фотографируют в УФ-излучении. Таким образом, можно получить рестрикционную карту определенного вида микробов.
Сопоставляя карты рестрикции ДНК, выделенных из различных штаммов, можно определить их генетическое родство, выявить принадлежность к определенному виду или роду, а также обнаружить участки, подвергнутые мутациям.
Этот метод используется также как начальный этап метода определения последовательности нуклеотидных пар (секвенирования) и метода молекулярной гибридизации.
Метод молекулярной гибридизациипозволяет выявить степень сходства различных ДНК. Применяется при идентификации микробов для определения их точного таксономического положения.
Метод основан на способности двухцепочечной ДНК при повышенной температуре (90 °С) в щелочной среде денатурировать, т. е. расплетаться на две нити, а при понижении температуры на 10 °С вновь восстанавливать исходную двухцепочечную структуру. Метод требует наличия молекулярного зонда.
Зондомназывается одноцепочечная молекула нуклеиновой кислоты, меченная радиоактивными нуклидами, с которой сравнивают исследуемую ДНК.
Для проведения молекулярной гибридизации исследуемую ДНК расплетают указанным выше способом, одну нить фиксируют на специальном фильтре, который затем помещают в раствор, содержащий радиоактивный зонд. Создаются условия, благоприятные для образования двойных спиралей. В случае наличия комплементарности между зондом и исследуемой ДНК, они образуют между собой двойную спираль.
Риботипирование и опосредованная транскрипцией амплификация рибосомальной РНК.Последовательность нуклеотидных оснований в оперонах, кодирующих рРНК, отличается консервативностью, присущей каждомувиду бактерий. Эти опероны представлены на бактериальной хромосоме в нескольких копиях. Фрагменты ДНК, полученные после обработки ее рестриктазами, содержат последовательности генов рРНК, которые могут быть обнаружены методом молекулярной гибридизации с меченой рРНК соответствующего виды бактерий. Количество и локализация копий оперонов рРНК и рестрикционный состав сайтов как внутри рРНК-оперона, так и по его флангам варьируют у различных вида бактерий. На основе этого свойства построен метод риботипирования, который позволяет производить мониторинг выделенных штаммов и определение их вида. В настоящее время риботипирование проводится в автоматическом режиме в специальных приборах.
Опосредованная транскрипцией амплификация рРНКиспользуется для диагностики смешанных инфекций. Этот метод основан на обнаружении с помощью молекулярной гибридизации амплифицированных рРНК, специфичных для определенного вида бактерий. Исследование проводится в три этапа:
1. Амплификация пула рРНК на матрице выделенной из исследуемого материала ДНК при помощи ДНК-зависимой РНК-полимеразы.
2. Гибридизация накопленного пула рРНК с комплементарными видоспецифическим рРНК олигонуклеотидами, меченными флюорохромом или ферментами.
3. Определение продуктов гибридизации методами денситометрии, иммунофермент-ного анализа (ИФА).
Реакция проводится в автоматическом режиме в установках, в которых одномоментное определение рРНК, принадлежащих различным видам бактерий, достигается разделением амплифицированного пула рРНК на несколько проб, в которые вносятся комплементарные видоспецифическим рРНК меченые олигонуклеотиды для гибридизации.
Что такое молекулярно-генетическая диагностика
Итак, молекулярно-генетическая диагностика — сравнительно новый метод обследования организма, позволяющий точно и быстро выявить вирусы и инфекции, мутации генов, вызывающих патологию, оценить риски наследственных и иных заболеваний. И это далеко не полный спектр возможностей исследования ДНК.
Важнейшим достоинством молекулярно-генетической диагностики является минимальная степень медицинского вмешательства, поскольку исследование проводят in vitro. Метод успешно применяют даже для диагностики заболеваний у эмбрионов, а также у ослабленных и тяжелобольных пациентов. Самый распространенный материал для исследования — кровь из вены, однако возможно выделение ДНК/РНК из других жидкостей и тканей: слюны, соскоба слизистой рта, выделений из половых органов, околоплодной жидкости, волос, ногтей и т.д.
Молекулярная диагностика — значительный шаг к персонализированной медицине, она позволяет учитывать все особенности конкретного пациента при обследовании и терапии.
Итак, исследование ДНК/РНК используется во многих разделах медицины. Давайте рассмотрим задачи и области, в которых активно применяют молекулярную диагностику:
- Выявление существующих патологий. Например, к молекулярной диагностике прибегают в тех случаях, когда инфекционное или вирусное заболевание не может быть определено обычными методами. Она позволяет обнаружить болезнь даже на ранней стадии, когда внешних проявлений нет.
- Исследование аллергических реакций. Молекулярная диагностика успешно применяется для определения аллергии: в отличие от традиционных методов, она более точна и при этом безопасна для пациента, так как отсутствует непосредственный контакт с аллергеном.
- Индивидуальная оценка рисков развития наследственных заболеваний. Молекулярная диагностика помогает выявить у взрослых и детей опасность в будущем подвергнуться различным патологиям. Нужно отметить, что есть болезни, которые вызваны исключительно мутацией гена (моногенные) и те, которые обусловлены в том числе генетическими особенностями (мультифакторные). Информация о первых позволяет, к примеру, оценить риски передачи наследственных заболеваний от родителей к ребенку. Знание о предрасположенности к мультифакторной патологии необходимо еще и для профилактики болезней с помощью изменения образа жизни.
- Перинатальная медицина. Как уже было сказано, молекулярная диагностика способна дать информацию о состоянии здоровья и генетических предрасположенностях человека. Это относится и к эмбрионам: анализ ДНК еще не родившегося ребенка позволяет распознать синдромы Дауна, Эдвардса, Патау, Тернера, Клайнфельтера. Также молекулярная диагностика применяется в области вспомогательных репродуктивных технологий: она позволяет установить генетические причины бесплодия и невынашивания беременности.
- Фармакогенетика. Молекулярная диагностика объясняет, почему на некоторых действуют одни препараты, а на других — иные: все дело в генетических особенностях пациентов. Возможность определения эффективности веществ имеет особое значение при лечении тяжелых заболеваний, например, онкологических.
- Спортивная медицина. Настоящие чудеса исследования ДНК и РНК творят и в области оценки спортивных перспектив. Например, родители малышей могут узнать о том, какой вид занятий принесет ребенку наибольшую пользу для здоровья или позволит достичь спортивных результатов.
Итак, обращение к генетическим исследованиям актуально в тех случаях, когда пациент стремится получить сведения о состоянии своего организма. Обычно это необходимо в следующих ситуациях:
Отдельной группой стоит выделить исследования ДНК, которые проводят в связи с планированием или рождением ребенка. Чаще всего родители обращаются в лабораторию, чтобы:
- изучить свою генетическую совместимость, оценить риски наследственных заболеваний потомства;
- исследовать состояние плода, выявить синдромы и опасные патологии;
- диагностировать заболевания (и оценить риски) и аллергические реакции у малыша;
- определить, какие спортивные занятия, какое питание и образ жизни будут наиболее полезны для ребенка, а чего стоит избегать;
- установить отцовство или материнство.
Независимо от выбранного метода молекулярно-генетического исследования, оно будет включать в себя следующие этапы:
- взятие биоматериала. Как уже было сказано, чаще для исследования используют кровь пациента. Полученный материал маркируют и транспортируют в лабораторию;
- выделение ДНК/РНК;
- проведение исследований в соответствии с выбранным методом;
- изучение и интерпретацию результатов;
- выдачу заключения.
Цитогенетический анализ позволяет выявить наследственные заболевания, психические отклонения, врожденные пороки развития. Суть метода — в изучении хромосом с помощью специальных микроматриц, нанесенных на ДНК-чипы. Для этого из образца крови выделяют лимфоциты, которые затем помещают на 48–72 часа в питательную среду и по истечении этого времени исследуют. Назначают такой анализ нечасто, в основном для изучения причин бесплодия и невынашивания беременности, для уточнения диагноза у детей при подозрении на врожденные заболевания. Анализ очень точен, но достаточно трудоемок и длителен (результат можно получить лишь через 20–30 дней после сдачи).
Достоинство и в то же время недостаток метода — в его специфичности: цитогенетика может выявить лишь небольшое количество патологий (например, аутизм), однако делает это практически без погрешностей.
Полимеразная цепная реакция — метод, изобретенный в 1983 году, по сей день самый популярный и фундаментальный в молекулярной диагностике. Характеризуется высочайшей точностью и чувствительностью, а также скоростью проведения исследования. Молекулярная диагностика ДНК/РНК методом ПЦР позволяет выявить такие патологии, как ВИЧ, вирусные гепатиты, инфекции, передающиеся половым путем, туберкулез, боррелиоз, энцефалит и многие другие.
Для анализа выбирают участок ДНК и многократно дублируют его в лаборатории с помощью специальных веществ. Для диагностики подходит большой перечень биоматериалов: кровь, слюна, моча, выделения из половых органов, плевральная и спинномозговая жидкость, ткани плаценты и т.д.
В данном молекулярном методе объектом исследования становятся уникальные нуклеотидные соединения отдельно взятой хромосомы или ее участок. Для этого используются меченые флуоресцентными маркерами короткие ДНК-последовательности (зонды), которые позволяют выявить фрагменты с атипичными генами. Биоматериал для анализа может быть любой: кровь, костный мозг, плацента, ткани эмбриона, биопсия и т.д. Важно, чтобы образец был доставлен в лабораторию сразу после его изъятия.
Метод особенно активно используют в онкологии (например, для наблюдения за остаточными злокачественными клетками после химиотерапии), а также в пренатальной диагностике (для определения риска развития у плода врожденных пороков), гематологии. FISH-метод очень чувствителен и точен для выявления поврежденных фрагментов ДНК (погрешность около 0,5%), при этом достаточно быстр: результат придется ждать не более 72-х часов. Однако у него есть и недостатки: FISH еще более специфичен, чем микроматричный цитогенетический анализ, и может служить лишь для подтверждения или опровержения предполагаемого диагноза.
Этот метод похож на предыдущий — здесь так же используются меченные флуоресцентом последовательности ДНК. Однако эти зонды сначала выделяют из проб, полученных от пациента, и затем сравнивают с образцами, нанесенными на микрочипы. ДНК-микрочип представляет собой основание (стеклянное, пластиковое, гелевое), на которое может быть нанесено до нескольких тысяч микротестов длиной от 25 до 1000 нуклеотидов. Полученные после очистки биоматериала пробы (зонды) совмещают с микротестами на чипе и наблюдают за реакцией маркёров. Результаты исследования готовы через 4–6 дней после забора материала.
Для анализа используется любой биоматериал, из которого можно получить образец ДНК/РНК. Используют такой метод в онкологии и кардиологии (в том числе для изучения генетической предрасположенности), он точен и чувствителен, однако в России его применяют редко — в этом его главный минус.
Итак, молекулярная диагностика — неинвазивный и точный метод обследования организма с широким спектром применения в разных областях медицины. Если на Западе исследования ДНК/РНК уже распространены повсеместно, то в России подобную услугу предлагают далеко не все клиники.
Сегодня медицина позволяет уже во время планирования беременности узнать о возможных рисках для будущего малыша, поэтому не пожалейте времени и средств — пройдите генетическое исследование еще до зачатия ребенка или, если беременность стала для вас сюрпризом, во время вынашивания. Так вы сможете избежать множества проблем для себя и для малыша в будущем.
Метод основан на многократном избирательном копировании определённого участка нуклеиновой кислоты ДНК при помощи ферментов в искусственных условиях (in vitro). При этом происходит копирование только того участка, который удовлетворяет заданным условиям, и только в том случае, если он присутствует в исследуемом образце. В отличие от амплификации ДНК в живых организмах (репликации), с помощью ПЦР амплифицируются относительно короткие участки ДНК. В обычном ПЦР-процессе длина копируемых ДНК-участков составляет не более 3000 пар оснований (3 kbp[8]). С помощью смеси различных полимераз, с использованием добавок и при определённых условиях длина ПЦР-фрагмента может достигать 20—40 тысяч пар нуклеотидов. Это всё равно значительно меньше длины хромосомной ДНК эукариотической клетки. Например, геном человека состоит примерно из 3 млрд пар оснований[9].
Компоненты реакции
Для проведения ПЦР в простейшем случае требуются следующие компоненты:
1-ДНК-матрица, содержащая тот участок ДНК, который требуется амплифицировать.
2-Два праймера, комплементарные противоположным концам разных цепей требуемого фрагмента ДНК.
3-Термостабильная ДНК-полимераза — фермент, который катализирует реакцию полимеризации ДНК.
4- Полимераза для использования в ПЦР должна сохранять активность при высокой температуре длительное время, поэтому используют ферменты, выделенные из термофилов — Taq-полимераз/Pfu-полимераза/Pwo-полимераза/Tth-полимераза и другие.
Чтобы избежать испарения реакционной смеси, в пробирку добавляют высококипящее масло, например, вазелиновое. Если используется амплификатор с подогревающейся крышкой, этого делать не требуется.
Простота в исполнении
АТФ, ГТФ, ЦТФ, ТТФ
Анализируемый образец ДНК
Использование термостабильной полимеразы
Полимераза достраивает специфические затравки
Амплификацию проводят в течении 30-40 циклов
За 30 циклов происходит умножение амплифицируемого фрагмента ДНК в более чем 1млн раз.
Вопрос-99 Электрофарез
Методики проведения электрофореза
Чтобы повысить эффективность данной процедуры, постоянно разрабатываются и совершенствуются методики электрофореза лекарственного. В настоящее время используют следующие:
Лабильная гальванизация.Один электрод во время процедуры закрепляется неподвижно, а второй находится в движении и перемещается со скоростью 3-5 см в секунду по поверхности кожи. Чтобы исключить колебания тока, в аппарат вводят стабилизирующее устройство. Процедура хорошо повышает метаболизм, улучшает кровоснабжение органов и тканей и нервно-мышечную проводимость.
Внутритканевый электрофорез. Проведение процедуры лекарственного электрофореза по данной методике сводится к введению через канюлю подкожно или внутримышечно препарата или смеси веществ. Вводиться лекарство может струйно или капельно. К очагу поражения поперек накладывают электроды, чтобы увеличить концентрацию медицинского препарата. Если лекарство вводят струйно, то ток включают одновременно с этим, а при капельном - после введения.
Вопрос-100 Блот гибридизации
Блот-гибридизация — гибридизация рестриктазных фрагментов исследуемой ДНК, предварительно разделенных электрофоретически и перенесенных на нитроцеллюлозный фильтр при помощи фильтровальной бумаги, со специфичным нуклеотидным зондом. Методика проведения Б.-г. состоит из нескольких этапов.
1-й этап — получение ДНК из исследуемого материала. В зависимости от вида биологического материала (ткань, кровь, молоко) методика выделения ДНК имеет специфические особенности. Главным моментом на данном этапе является депротеинизация ДНК, ее отделение от белка, осаждение и отмывание.
2-й этап— обработка ДНК рестриктазами (рестрикционными эндонуклеазами). Обработка происходит в стандартных условиях на протяжении 3-16 ч. Вследствие гидролиза длинноцепочечная ДНК превращается в смесь коротких фрагментов.
3-й этап — нанесение смеси фрагментов ДНК на электрофоретическую пластинку агарозным гелем и проведение электрофореза.Вследствие различной молекулярной массы фрагменты ДНК будут двигаться в электрическом поле от отрицательного полюса к положительному с различной скоростью.После окончания электрофореза каждый фрагмент ДНК занимает определенное положение в виде дискретной полосы в конкретном месте геля.
4-й этап— непосредственно блоттинг, или получение оттиска картины электрофореза на нитроцеллюлозном фильтре. Сразу после окончания электрофореза на пластинку агарозного геля, которая находится в буферном растворе, накладывают нитроцеллюлозный фильтр, а сверху на него — несколько листов фильтровальной бумаги, и все это помещают под пресс. За счет капиллярного эффекта создается ток буфера, перпендикулярный плоскости геля, который вместе с ДНК-рестриктами проходит через нитроцеллюлозный фильтр. ДНК-фрагменты адсорбируются на фильтре строго в соответствии с их положением в геле. Таким способом получают от печаток полученных рестриктов на нитроцеллюлозном фильтре. Помимо нитроцеллюлозных фильтров используются различные нейлоновые или капроновые мембраны. Нейлоновые мембраны ковалентно связывают ДНК-фрагменты, что позволяет осуществлять их последующую регенерацию и многократное использование. Для ускорения процедуры блоттинга и его эффективности применяют вакуум и электроперенос.
5-й этап — гибридизация рестриктных фрагментов с ДНК-зондами. ДНК-цепи закрепляют на фильтре прогреванием, а далее фильтр инкубируется с меченым нуклеотидным зондом. В качестве метки в классическом варианте используют изотопные маркеры, чаще 32Р. В таком случае дальнейшая идентификация гибридов производится путем радиоавтографии. Различают несколько видов блот-гибридизации: Саузерн-блоттинг(см.) — для визуализации фрагментов ДНК; нозерн-блоттинг (см.) — для РНК; вестернблоттинг, или иммуноблоттинг, — для связывания электрофоретически разделенных белков, фиксированных на фильтрах с мечеными антителами.
Дата добавления: 2018-02-28 ; просмотров: 610 ;
Сайт СТУДОПЕДИЯ проводит ОПРОС! Прими участие :) - нам важно ваше мнение.
Молекулярно-генетические методы. Эти методы позволяют анализировать фрагменты ДНК, находить и изолировать отдельные гены и их сегменты и устанавливать в них последовательность нуклеотидов.
Методы гибридизации нуклеиновых кислот. После разрезания ДНК на фрагменты рестриктазами проводится их электрофорез на агарозном или полиакриламидном геле с целью разделения этих фрагментов. Далее осуществляется идентификация фрагментов ДНК.
Для выявления специфических фрагментов ДНК используется метод блот-гибридизации по Саузерну. Эта методика состоит из следующих этапов:
1) после окончания электрофореза гели помещают в щелочной раствор для денатурации фрагментов ДНК — получают одноцепочечные ДНК;
2) одноцепочечные ДНК вымывают из геля на нитроцеллюлозный или нейлоновый фильтры перпендикулярным поверхности геля током буфера; одноцепочечные фрагменты ДНК фиксируют на фильтре;
3) для визуального выявления нужных фрагментов проводят гибридизацию исследуемого образца со специфическим по нуклеотид-ной последовательности меченным радиоактивно или флюоресцентной меткой олигонуклеотидным синтетическим зондом; радиоактивно меченные участки выявляют путем экспонирования фильтра с рентгеновской пленкой (ауторадиография); флюоресцентные метки выявляют в люминесцентном микроскопе.
Этот метод позволяет обнаружить единственный ген среди десятков тысяч. Гомологичные последовательности можно идентифицировать как полностью, так и частично. Различные модификации этого метода позволяют в клинике анализировать очень малые количества ДНК, взятые у больного.
Для успешного применения в практическом здравоохранении молекулярно-генетических методов необходимо создание библиотек радиоактивных зондов всех последовательностей ДНК генома человека, и в этом направлении уже немало сделано.
Методы генетики соматических клеток. Наибольший интерес для генетики человека представляет метод гибридизации клеток. В 1960 г. французский ученый Ж. Барский, выращивая в культуре клетки двух линий мышей, обнаружил, что некоторые из них по своим морфологическим и биохимическим свойствам оказались промежуточными между исходными родительскими клетками. Это были гибридные клетки. Такое спонтанное слияние соматических клеток в культуре ткани происходит довольно редко. В дальнейшем было установлено, что при введении в культуру клеток РНК-содержащего вируса парагриппа Сендай, инактивированного ультрафиолетом, частота гибридизации клеток значительно повышается. В смешанной культуре разных типов клеток образуются гетерокарионы — клетки, содержащие два ядра разных клеток в одной цитоплазме. Часть таких клеток способна размножаться митозом. После митоза из двуядерного гетерокариона образуются две одноядерные клетки, каждая из которых представляет собой синкарион — настоящую гибридную клетку, содержащую хромосомы обеих родительских клеток, то есть происходит объединение двух геномов.
Гибридизация возможна между клетками не только организмов разных видов (человек — мышь), но и разных типов (человек — комар). Синкарионы обычно удается получать при гибридизации в пределах класса. Например, гибридные клетки человека и мыши имеют 43 пары хромосом: 23 — от человека и 20 — от мыши. В дальнейшем происходит постепенное удаление хромосом того организма, клетки которого имеют более медленный темп размножения. У гибридных клеток человека — мыши удаляются хромосомы человека.
В гибридных клетках функционируют хромосомы как человека, так и мыши, гены которых детерминируют синтез соответствующих белков. Морфологически можно отличить каждую из хромосом (дифференциальное окрашивание). Если в гибридной клетке отсутствует какая-либо хромосома и не происходит синтез каких-то белков, то можно предположить, что гены, детерминирующие синтез этих белков, локализованы в ней. Таким образом, этот метод позволяет устанавливать группы сцепления у человека, а используя нехватки и транслокации, — выяснять и последовательность расположения генов, то есть строить генетические карты хромосом человека.
Экспресс-методы — это быстрые предварительные методы изучения генетики человека. Они часто используются для исследования больших контингентов людей с целью выявления наследственной патологии как скрининг-методы, применяемые при проведении просеивающих программ. Например, скрининг новорожденных на фенилкетонурию, гипотиреоз, беременных
на альфа-фетопротеин, при помощи которого можно пренаталь-но определить у плода некоторые пороки развития (например, анэнцефалию, открытые формы спинномозговых грыж, синдром Дауна).
К этим методам предъявляются определенные требования:
1) метод должен быть диагностически значимым, то есть положительные и отрицательные результаты должны соответствовать наличию или отсутствию заболевания;
2) метод должен быть надежным: один и тот же образец при независимой двукратной проверке должен одинаково оцениваться;
3) исследованию должен подвергаться легкодоступный материал (кровь, моча) в малых количествах (например, пятна капиллярной крови, высушенной на фильтровальной бумаге);
4) метод должен быть приемлемым для обследуемых, исполнителей и врачей;
5) метод должен быть экономичным.
Микробиологический ингибиторный тест Гатри позволяет выявлять некоторые биохимические нарушения у новорожденных. Из пятки новорожденного берут кашпо крови на диски фильтровальной бумаги, которые помещают на агаровую культуру В. subtillis. Последнюю выращивают на минимальной питательной среде, содержащей антиметаболит искомой аминокислоты (например, фенилаланина). Антиметаболит должен одновременно тормозить рост микроба. При наличии в крови младенца большого количества фенилаланина антиметаболит разрушается и микробы начинают бурно расти. Меняя антиметаболиты, можно диагностировать наличие в крови определенных аминокислот и углеводов (лейцина, гистидина, фруктозы, галактозы и др.).
Биохимические и микробиологические экспресс-методы (флюорометрические, хроматографические, радиоиммунологические и др.) широко используются для быстрой предварительной диагностики наследственных болезней обмена веществ. Выявление Х- и Y-хроматина чаще осуществляется посредством соскоба клеток слизистой оболочки щеки (буквальный эпителий). Для выявления Х-хроматина мазки окрашивают ацеторсеином (или любой другой ядерной краской) и препараты просматривают в обычном световом микроскопе. Этот метод позволяет определить количество Х-хромосом в кариотипе по количеству телец Барра (их на одну больше, чем количество глыбок Х-хроматина).
Для выявления Y-хроматина мазки окрашивают 0,005 % раствором акрихин-иприта и просматривают в люминесцентный микроскоп — Y-хромосома дает яркое зеленое свечение. Этот метод позволяет установить количество Y-хромосом в кариотипе.
Методы пренаталъной диагностики наследственных болезней. Пренатальная диагностика связана с решением ряда биологических и этических проблем до рождения ребенка, так как при этом речь идет не об излечении болезни, а о предупреждении рождения ребенка с патологией, не поддающейся лечению (обычно путем прерывания беременности с согласия женщины). При современном уровне развития пренатальной диагностики можно установить диагноз всех хромосомных болезней, большинства врожденных пороков развития, энзимопатий, при которых известен биохимический дефект. Часть из них можно установить практически в любом сроке беременности (хромосомные болезни), часть — после 12-й недели (редукционные пороки конечностей, атрезии, анэнцефалию), часть — только во второй половине беременности (пороки сердца, почек).
Нам важно ваше мнение! Был ли полезен опубликованный материал? Да | Нет
Для изучения и выявления вариантов в структуре ДНК применяется молекулярно-генетический метод. Для каждого участка ДНК, который исследуется, регион это хромосомы, ген или аллель, методы отличаются. В основе каждый молекулярно-генетический метод содержит те или иные манипуляции с РНК и ДНК. Все данные методы отличаются огромной сложностью, без лабораторных условий проводиться не могут, и персонал должен быть высококвалифицированный. Проводится эта работа в несколько этапов.

Этапы
Сначала образцы РНК или ДНК нужно получить. Здесь молекулярно-генетический метод может применяться по отношению к практически любому материалу: капля крови, лейкоциты, культура фибропластов, слизистая оболочка (соскоб), даже волосяные луковицы, - ДНК можно получить из любого образца. Она пригодна для того, чтобы применить любой молекулярно-генетический метод и различные их варианты, а уже выделенная ДНК долго хранится в заморозке. Второй этап посвящён накоплению нужных фрагментов (амплификации) ДНК, обеспечить же его помогает цепная полимеразная реакция in vitro (в пробирке, без участия живого организма). В результате выбранный фрагмент ДНК размножается с помощью этой цепной реакции, и количество ДНК возрастает буквально в миллион раз.
Третьим этапом молекулярно-генетических методов исследования предполагается рестрикция размноженных ДНК (это фрагментирование, разрывание или разрезание). Рестрикция проводится с помощью электрофореза на полиакриламидном или агарозном геле. Этот молекулярно-генетический метод изучения ДНК позволяет каждому фрагменту занять в геле определённое положение. После этого гель обрабатывается этидием бромида, способным связываться в ДНК, проводится облучение ультрафиолетом, после чего можно наблюдать участки свечения. Молекулярно-генетические методы диагностики разнообразны и многочисленны, однако первые два этапа характерны для всех. А вот для того, чтобы выявить фрагменты ДНК, гель можно окрашивать и многими другими существующими способами.
Разновидности
К самым прямым и распространённым способам обнаружения микобактерий можно отнести вышеописанный молекулярно-генетический метод изучения ДНК. Сущность его состоит в том, чтобы выявить в диагностическом материале специфические фрагменты цепочки ДНК-возбудителей. Молекулярно-генетические методы диагностики пока не имеют более эффективного способа распознавать такое заболевание, как туберкулёз. Применяя полимеразную цепную реакцию (ПЦР), можно быть уверенным, что исходная ДНК увеличит количество копий в миллион раз, то есть произойдёт амплификация, и это позволит визуализировать результаты. Уровень чувствительности здесь очень высок - более девяноста пяти процентов, что и является главным достоинством данного метода.
Остальные молекулярно-генетические методы исследования по эффективности уступают многократному копированию буквально вдвое, поскольку в этом случае редакционная проба показывает специфическую олигонуклеотидную последовательность возросшей в сто шесть раз. Даже культуральная диагностика туберкулёза органов дыхания значительно ниже по своей чувствительности. Именно поэтому современная медицина опирается на молекулярно-генетические методы диагностики туберкулеза. А описанный метод особо эффективен при встрече с возбудителями высокой антигенной изменчивости, определить которые другим способом гораздо более сложно - требуются особые питательные среды и длительное время культивирования. Биохимический и молекулярно-генетический методы дают совершенно разные по эффекту результаты.
Диагностика туберкулёза
Выстраивают ПЦР-диагностику туберкулёза наиболее часто с использованием тех последовательностей ДНК, которые специфичны для всех четырёх видов этого заболевания. Для достижения поставленной цели чаще всего используют праймеры, выявляющие последовательности IS элементов (IS-986, IS-6110), так как эти мигрирующие элементы характеризуют сугубо виды микобактерий туберкулёза и всегда присутствуют несколькими копиями в геноме. Также выделение ДНК можно осуществить из чистых культур и клинических (мокрота больных) любым другим приемлемым методом. Например, есть метод Boom, где используется лизирующий буфер на основе гуанидина, двуокиси кремния и тиоционата как носителя ДНК. Число больных, отличающихся скудным бактериовыделением, с каждым годом увеличивается, и потому в клинической практике утвердился совершенно другой уровень организации: молекулярно-генетический метод изучения ДНК играет уже главную роль в диагностике.
Однако нужно признать, что и он не без недостатков. Применение ПЦР-метода часто приносит огромное количество ложноположительных результатов, и виной здесь не только технические погрешности, но и особенности самого метода. Помимо всего прочего, с помощью данного способа диагностики определить степень жизнеспособности микобактерий, которые выявлены, просто невозможно. Но и этот недостаток не самый главный. Молекулярно-генетические методы ПЦР-диагностики влекут за собой опасность контаминации микобактериальных ДНК. Сертификационные требования по этой причине для ПЦР-лабораторий разработаны исключительно жёсткие, они требуют наличия трёх изолированных помещений. Технология ПЦР современная и очень сложная, её использование требует соответствующей аппаратуры и высококлассно подготовленного персонала.

Бактериоскопия
При установлении диагноза результаты ПЦР-исследования обязательно должны сопоставляться с остальными данными: клиническое обследование, рентгенография, микроскопия мазка, посев и даже ответ на специфическое лечение здесь очень важны. В этом ряду исследований ПЦР является только одним из компонентов. Обнаружить возбудитель в самом начале диагностики можно наиболее простыми и быстрыми методами - бактериологическими.
Здесь используется световой микроскоп (окраска по Цилю-Нильсену) и люминесцентный (окраска флюорохромами). Преимуществом бактериоскопии является быстрота получения результатов. А недостатком её справедливо считается ограниченность возможностей из-за низкой чувствительности. Однако именно этому методу отдана рекомендация ВОЗ как наиболее экономичного и основного для выявления больных туберкулёзом. Обнаружение микобактерий бактериологическим методом имеет значение прогноза, и оценивается бактериовыделение количественно. Гораздо увереннее с этим справляются молекулярно-генетические методы исследования туберкулеза.
Культуральные исследования
Лучшим выявлением микобактерий признают культуральные исследования. Посев патологического материала производится в яичные среды: Мордовского, Финна II, Левенштейна-Йенсена и тому подобные. Ориентировочным показателем развития устойчивости микобактерий к препаратам и косвенным свидетельством эффективности является количество микобактерий или их колоний в пробирке, если применён культуральный метод исследования. Чтобы повысить процент выделения микобактерий, посев патологического материала проводится на несколько сред.
Удовлетворяя многочисленные культуральные потребности, возбудителю в том числе предоставляют и жидкие среды. Используются при этом и автоматизированные системы учёта роста типа ВАНТЕС. Посевы должны провести в инкубации до семи-восьми недель. К этому времени посев с отсутствием роста можно считать отрицательным. Самым действенным способом выявления микобактерий туберкулёза считают биологические пробы: заражают диагностическим материалом морских свинок, которые к туберкулёзу чрезвычайно чувствительны.
Немного цифр
Интереснейшей областью исследования, которая открылась посредством ПЦР-диагностики, стало изучение M. tuberculosis - латентной инфекции. Современная концепция туберкулёзной инфекции говорит о том, что из ста человек, которые находились в контакте с M. tuberculosis, девяносто вполне могут инфицироваться, но только у десяти из них активная болезнь получает развитие. Остальные имеют противотуберкулёзный иммунитет, и потому в девяноста процентах случаев инфекция останется латентной. Обнаружить такую закономерность помог именно молекулярно-генетический метод.
Генетики утверждают, что пятьдесят пять процентов лиц, у которых посевы патологического материала были отрицательными, и восемьдесят процентов лиц, заражённых M. tuberculosis, но с протекающей без каких-либо рентгенографических проявлений болезнью, ответы ПЦР получили положительные. Именно генетический метод диагностики помог выявить больных из групп риска с помощью ПЦР-исследований, причём результаты их анализов (микроскопия и посевы) были отрицательными, а субклиническая инфекция M. tuberculosis присутствовала.

Современные исследования
Бактериологические лаборатории Российской Федерации используют и ускоренный метод абсолютных концентраций: тестируется нитратредуктазная активность микобактерий посредством реактива Грисса. Противотуберкулёзные центры пользуются методом, который позволяет определить лекарственную устойчивость. Это посев в жидкие среды, где автоматизирована радиометрическая и флюоресцентная система учёта роста микобактерий. Такой анализ делается быстро - до двух недель.
В настоящее время и новые методы разрабатываются: лекарственная устойчивость микобактерий оценивается на уровне генотипа. Изучение молекулярных механизмов резистентности показывает наличие генов и у микобактерий. Гены эти связаны с устойчивостью к определённым препаратам. Например, гены kasA, inhA, katG устойчивы к изониазиду, ген rpoB - к рифампицину, гены 16Sp РНК и rpsL - к стрептомицину, emb1 - к этамбутолу, gyrA - к фторхинолону и так далее.

Мутации
В современной диагностике значительно повысился молекулярно-генетический уровень метода изучения ДНК и позволил проводить широкомасштабные исследования мутаций во всём их спектре. Теперь мы знаем, что наиболее распространены мутации в 516, 526 и 531 кодонах гена rpoB, а также выявлены устойчивости к различным препаратам. Существует целый комплекс методов для типирования микобактерий с использованием не только методов традиционных - биохимических, биологических и культуральных, но широко применяются и современные молекулярно-генетические методы. Уже существуют адекватные и обеспечивающие верную диагностику методики обнаружения моногенных болезней. Они основываются на исследованиях ДНК в точном районе определённого гена. Это, как правило, процесс сложный, трудоёмкий и дорогостоящий, зато данные, которые предоставляют методы молекулярно-генетического анализа, значительно более точны и информативны, чем данные всех других анализов.
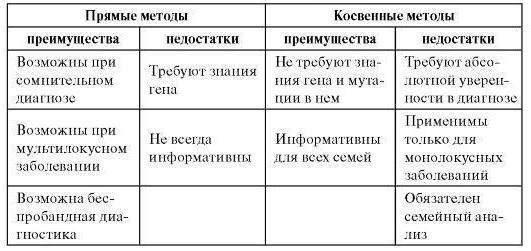
Давно известно, что ДНК не изменяется за всю жизнь организма, что она в любой ядерной клетке однакова, и это даёт возможность брать на анализ абсолютно любые клетки организма, на любых стадиях онтогенеза. Повреждённый ген можно обнаружить до появления первых симптомов, до развёрнутой клиники заболевания, а также у здоровых гетерозиготных людей, но имеющих в гене мутацию. Молекулярно-генетические методы диагностики наследственных болезней позволяют выявить её (прямым подходом ДНК-диагностики), а также проанализировать сегрегацию заболевания в семье с маркерными локусами ДНК (полиморфными участками), которые тесно сцеплены с повреждённым геном (то есть косвенным подходом ДНК-диагностики). Прямая или косвенная - любая ДНК-диагностика основывается на методах, идентифицирующих строго определённый участок ДНК человека.
Прямые методы
Прямыми методами ДНК-диагностики пользуются в случаях, когда ген-виновник наследственного заболевания известен, а также известны и типы его мутаций. Например, целесообразны прямые методы при целом ряде заболеваний. Это хорея Гентингтона (расширение CTG-повторов), фенилкетонурия (R408W), муковисцидоз (delF508, мажорная мутация) и тому подобные. Главным преимуществом прямого метода является стопроцентная точность диагностики, а также нет необходимости делать ДНК-анализ остальной семьи. Если мутация в соответствующем гене обнаружена, это позволяет совершенно точно утвердить диагноз наследственности, определить генотип для всей остальной отягощённой семьи.
Другим достоинством прямой диагностики считается выявление гетерозиготного носительства нехороших мутаций у родственников и родителей умершего от болезни. Это особенно актуально для заболеваний аутосомно-рецессивных. Недостатки у прямых методов тоже имеются. Чтобы их применить, нужно точно знать локализацию патологического гена, экзон-интронную его структуру и спектр его мутаций. Далеко не все моногенные болезни сегодня получили подобную информацию. Информативность прямых методов не может считаться полной, поскольку один и тот же ген может иметь большое количество патологических мутаций, что и обусловливает развитие наследственных болезней.
Косвенные методы
Косвенные методы в ДНК-диагностике применяются совсем в других случаях: если повреждённый ген не идентифицирован, а всего лишь локализован на хромосоме, или если прямая диагностика не дала результата (это бывает, если у гена сложная молекулярная организация или значительная протяжённость, если в нём много патологических мутаций). Косвенными методами проводится анализ сегрегации полиморфных маркеров в семье аллелей. Маркеры находятся в этом же хромосомном районе или тесно сцеплены с локусом заболевания и представляют собой делеции или инсерции, точковые замены, повторы, а их полиморфизм обусловлен разным количеством в блоке элементов.
Самыми удобными для косвенной диагностики считаются микросателлитные и минисателлитные полиморфные маркеры, которые широко распространены в геноме человека. Ценность их выражается в высокой информативности, если генетическое расстояние между повреждением в гене и маркером не оказывается слишком большим. В последнем случае точность оценки определяется в большой степени частотой рекомбинации между полиморфным маркером и повреждением. Косвенные методы диагностики также предусматривают обязательный предварительный этап исследования частоты аллелей анализируемых популяций среди носителей мутаций и больных, плюс к этому необходимость определения вероятности неравновесия и рекомбинации сцепления маркеров и мутантных аллелей гена.
Другие методы
Короткие сегменты РНК или ДНК, а также отдельный ген при микроскопическом исследовании визуализирован быть не может, поэтому, чтобы идентифицировать мутации, необходимы методы молекулярно-генетической диагностики. Существующий "Проект генома человека", как и другие достижения молекулярной генетики, во многом расширил возможность диагностики наследственных заболеваний - как пре-, так и постнатальной. Эти методы могут обеспечить раннее обнаружение и сделать прогноз поли- и моногенных болезней, у которых дебют происходит во взрослом возрасте. К сожалению, по техническим возможностям молекулярно-генетические исследования иногда выходят за этические рамки, которые установлены относительно наследственности, особенно когда диагностика проводится в подростковом и детском возрасте.
Структурные и количественные аномалии хромосом являются самыми распространёнными причинами и онкологических заболеваний, и многих пороков развития. Хромосомные аберрации необходимо идентифицировать, что важно для семейного консультирования - дать оценку прогноза наряду с репродуктивным риском при будущих беременностях. Хромосомный анализ является "золотым стандартом" генетической диагностики, но и у него возможности ограничены. Только методы молекулярно-генетического анализа могут сделать большее, потому что там применяются основанные технологиями клонирования флюоресцирующие метки, способны с их высокой чувствительностью выявить тонкие хромосомные изменения, которые невозможно обнаружить классическим цитогенетическим исследованием. Эти техники всё более расширяют наши диагностические возможности, когда обследуются дети с пороками развития, с умственной отсталостью, со многими другими наследственными заболеваниями.
Выводы
Очень важными для человечества явились знания структуры и функций генов, видов их изменчивости, умение распознавать наследственные болезни, что произошло в связи с развитием молекулярной генетики. Методы её направлены на исследование молекулы ДНК - и когда она находится в норме, и при повреждении её. Получение последовательностей нуклеотидов дезоксирибонуклеиновой кислоты (ДНК) проходит поэтапно от получения образцов до идентификации отдельных фрагментов. Выделение геномной ДНК из клеток, рестрикция (разрывание), амплификация (клонирование), электрофорез фрагментов (разделение их по электрическому заряду и молекулярной массе с помощью агарозного геля). Идентификация определённых фрагментов, расположенных на его поверхности дискретной полосой.
Потом в дело вступают специальные фильтры, с помощью которых проходит гибридизация каждого фрагмента с клонированными фрагментами ДНК или с синтетическими радиоактивными зондами, являющимися контрольными, по которым и будет равняться каждый исследуемый фрагмент. Если изменилось положение или его длина сравнительно с зондом, если появился новый фрагмент или исчез, - всё это говорит о том, что исследуемый ген подвергся перестройке в последовательности нуклеотидов. Существует восемь основных методов молекулярно-генетического исследования: секвенирование (определение последовательности ДНК), полимеразная цепная реакция (увеличение числа последовательностей), получение праймеров известных генов, клонирование ДНК, получение рекомбинантных молекул, получение белков за счёт рекомбинантных молекул, создание полного набора (коллекции, библиотеки) клонированных фрагментов, которые получились с помощью рестрикции.
Читайте также:


