Механизм персистенции вирусов герпеса
Среди вирусных инфекций герпес занимает одно из ведущих мест в силу повсеместного распространения вирусов, многообразия проявлений, хронического течения, а также различных путей передачи вирусов. Герпес входит в число наиболее распространенных и плохо контролируемых инфекций человека.
Семейство герпесвирусов включает в себя 8 классифицируемых видов вирусов человека: вирусы простого герпеса — вирус простого герпеса (ВПГ-1) и вирус генитального герпеса (ВПГ-2), вирус varicella zoster, вирус Эпстайна-Барр, цитомегаловирус, вирус герпеса 6, 7, 8-го типа. А также около 80 неклассифицируемых вирусов герпеса человека и животных.
В настоящее время в семействе Herpesviridae сформированы 3 подсемейства: Alphaherpesvirinae, Bethaherpesvirinae, Gammaherpesvirinae. Вирусы подсемейства Alphaherpesvirinae характеризуются коротким циклом репродукции с цитопатическим эффектом в клетках инфицированных культур. К ним относятся:
Вирусы подсемейства Bethaherpesvirinae характеризуются строго выраженной патогенностью для одного вида хозяев. В состав их входят цитомегаловирусы и в т.ч.:
Вирусы подсемейства Gammaherpesvirinae характеризуются строго выраженным тропизмом к В- или Т-лимфоцитам, в которых они длительно персистируют. К ним относятся:
Герпесвирусы могут находиться в организме человека с нормальной иммунной системой бессимптомно, а у людей с иммуносупрессией вызывают тяжелые заболевания со смертельным исходом.
По данным ВОЗ, смертность от герпетических инфекций среди вирусных заболеваний находится на втором месте (15,8%) после гепатита (35,8%). По данным многочисленных исследований, к 18 годам более 90% жителей городов инфицируются одним или несколькими штаммами , 7 клинически значимых герпесвирусов (простого герпеса 1 и 2 типов, варицелла зостер, цитомегаловирусом, Эпстайна-Барр, герпеса человека 6 и 8 типов).
Строение вирусов герпеса.
Герпесвирусы имеют ряд общих признаков, главными из которых являются строение вириона (структурно зрелой вирусной частицы в окружающей среде), структура молекулы ДНК. Вирионы герпесвирусов представляют собой довольно крупные (для вирусов) частицы (150-200 нм в диаметре) и состоят из нуклеокапсида и наружной оболочки (суперкапсида).

Механизм размножения вируса герпеса в клетке (схема)
Основной чертой вирусов является то, что они могут размножаться, только паразитируя в клетках зараженного организма. Все вирусы, и герпесвирусы в том числе, не обладают собственным аппаратом для синтеза органических молекул, поэтому для самовоспроизведения они используют ресурсы клетки хозяина.


Пути заражения
В большинстве случаев первичное и повторное заражение происходит воздушно-капельным путем, при прямом контакте или через предметы обихода и гигиены (общие полотенца, носовые платки и т. п.). Доказаны также оральный, генитальный, орогенитальный, трансфузионный (при переливании крови), трансплацентарный (от матери к плоду), трансплантационный (при пересадке органов) пути передачи.
Важное свойство герпесвирусов — это способность после первичного попадания в организм в детском возрасте пожизненно там находиться и реактивироваться под влиянием различных провоцирующих факторов, к которым относятся переохлаждение, стресс, солнечный загар, инфекции, менструации.

Прочитайте другие статьи раздела Заболевания

Похожее по меткам: Уро-Биофон, Уро-Биофон ЭКСТРА класса
В последние годы в инфекционной патологии все большее значение приобретают герпес-вирусы (от греч. herpes — ползучий). Внимание, которое вирусологи и клиницисты проявляют в последние 25 лет к герпес-вирусным заболеваниям человека, связано
В последние годы в инфекционной патологии все большее значение приобретают герпес-вирусы (от греч. herpes — ползучий). Внимание, которое вирусологи и клиницисты проявляют в последние 25 лет к герпес-вирусным заболеваниям человека, связано с их значительной эпидемиологической ролью и социальной значимостью в современном мире. Неуклонный рост числа герпетических заболеваний у взрослых и детей обусловливает необходимость всестороннего изучения герпетической инфекции и разработки эффективных методов профилактики и лечения разнообразных форм этой инфекции. Среди вирусных инфекций герпес занимает одно из ведущих мест в силу повсеместного распространения вирусов, многообразия клинических проявлений, как правило, хронического течения, а также различных путей передачи вирусов.
Он входит в число наиболее распространенных и плохо контролируемых инфекций человека. Герпес-вирусы могут циркулировать в организме с нормальной иммунной системой бессимптомно, но у людей с иммуносупрессией вызывают тяжелые заболевания со смертельным исходом. По данным ВОЗ, смертность от герпетической инфекции среди вирусных заболеваний находится на втором месте (15,8%) после гепатита (35,8%).
Герпес-вирусы объединены в обширное семейство Herpesviridae и в настоящее время наиболее четко классифицированы. Семейство Herpesviridae включает в себя более 80 представителей, 8 из которых для человека наиболее патогенны (human herpes virus-HHV). Герпес-вирусы — филогенетически древнее семейство крупных ДНК-вирусов — подразделяются на 3 подсемейства в зависимости от типа клеток, в которых протекает инфекционный процесс, характера репродукции вируса, структуры генома, молекулярно-биологических и иммунологических особенностей: α, β и γ (табл. 1, по данным Н. Г. Перминова, И. В. Тимофеева и др., Государственный научный центр вирусологии и биотехнологий).
α-герпес-вирусы, включающие HSV-1, HSV-2 и VZV, характеризуются быстрой репликацией вируса и цитопатическим действием на культуры инфицированных клеток. Репродукция α-герпес-вирусов протекает в различных типах клеток, вирусы могут сохраняться в латентной форме, преимущественно в ганглиях.
β-герпес-вирусы видоспецифичны, поражают различные виды клеток, которые при этом увеличиваются в размерах (цитомегалия), могут вызывать иммуносупрессивные состояния. Инфекция может принимать генерализованную или латентную форму, в культуре клеток легко возникает персистентная инфекция. К этой группе относятся CMV, HHV-6, HHV-7.
γ-герпес-вирусы характеризуются тропностью к лимфоидным клеткам (Т- и В-лимфоцитам), в которых они длительно персистируют и которые могут трансформировать, вызывая лимфомы, саркомы. В эту группу входят вирус Эпштейна-Барр и HHV-8-герпес — вирус, ассоциированный с саркомой Капоши (KSHV). KSHV является наиболее близким по геномной организации Т-клеточно-тропному обезьяньему герпес-вирусу Саймири (HVS).
Герпес-вирусы ассоциированы с малигнизацией и способны (по крайней мере, EBV и HVS) трансформировать клетки in vitro. Все герпес-вирусы сходны по морфологическим признакам, размерам, типу нуклеиновой кислоты (двухцепочечная ДНК), икосадельтаэдрическому капсиду, сборка которого происходит в ядре инфицированной клетки, оболочке, типу репродукции, способности вызывать хроническую и латентную инфекцию у человека.
В эпидемиологическом плане наиболее интересны следующие сведения о герпес-вирусах: вирионы чрезвычайно термолабильны — инактивируются при температуре 50–52°С в течение 30 мин, при температуре 37,5°С — в течение 20 ч, устойчивы при температуре 70°С; хорошо переносят лиофилизацию, длительно сохраняются в тканях в 50-процентном растворе глицерина. На металлических поверхностях (монеты, дверные ручки, водопроводные краны) герпес-вирусы выживают в течение 2 ч, на пластике и дереве — до 3 ч, во влажных медицинских вате и марле — до их высыхания при комнатной температуре (до 6 ч).
Уникальными биологическими свойствами всех герпес-вирусов человека является тканевой тропизм, способность к персистенции и латенции в организме инфицированного человека. Персистенция представляет собой способность герпес-вирусов непрерывно или циклично размножаться (реплицироваться) в инфицированных клетках тропных тканей, что создает постоянную угрозу развития инфекционного процесса. Латенция герпес-вирусов — это пожизненное сохранение вирусов в морфологически и иммунохимически видоизмененной форме в нервных клетках регионарных (по отношению к месту внедрения герпес-вируса) ганглиев чувствительных нервов. Штаммы герпес-вирусов обладают неодинаковой способностью к персистенции и латенции и чувствительностью к противогерпетическим препаратам в связи с особенностями их ферментных систем. У каждого герпес-вируса свой темп персистенции и латенции. Среди изучаемых наиболее активны в этом отношении вирусы простого герпеса, наименее — вирус Эпштейна-Барр.
По данным многочисленных исследований, к 18 годам более 90% жителей городов инфицируются одним или несколькими штаммами по меньшей мере 7 клинически значимых герпес-вирусов (простого герпеса 1 и 2 типов, варицелла зостер, цитомегаловирусом, Эпштейна-Барр, герпеса человека 6 и 8 типов). В большинстве случаев первичное и повторное инфицирование происходит воздушно-капельным путем, при прямом контакте или через предметы обихода и гигиены (общие полотенца, носовые платки и т. п.). Доказаны также оральный, генитальный, орогенитальный, трансфузионный, трансплантационный и трансплацентарный пути передачи инфекции.
Герпес-вирусные инфекции широко распространены в мире и имеют тенденцию к неуклонному росту. Особенностью герпес-вирусной инфекции является возможность вовлечения в инфекционный процесс многих органов и систем, чем и обусловлено многообразие вызываемых герпес-вирусами заболеваний, варьирующих от простых кожно-слизистых до угрожающих жизни генерализованных инфекций. Важное свойство герпес-вирусов — это способность после первичного инфицирования в детском возрасте пожизненно персистировать в организме и реактивироваться под влиянием различных экзо- и эндогенных провоцирующих факторов.
Инфицирование человека указанными герпес-вирусами сопровождается клиническими симптомами соответствующего острого инфекционного заболевания в среднем не более чем у 50% людей, в основном у детей: внезапная эритема (вирус герпеса человека 6 типа), афтозный стоматит (вирусы простого герпеса 1 или 2 типов), ветряная оспа (вирус варицелла зостер), инфекционный мононуклеоз (вирус Эпштейна-Барр), мононуклеозоподобный синдром (цитомегаловирус). У остальных пациентов инфекция протекает бессимптомно, что особенно характерно для подростков и взрослых людей. Помимо биологических свойств штамма герпес-вируса, влияние на течение острых и рецидивирующих герпес-вирусных заболеваний оказывают индивидуальные (возрастные, половые, фило- и онкогенетические) особенности иммунного ответа инфицированного человека на многочисленные антигены вируса.
Часто, особенно при снижении иммунореактивности организма, герпес-вирусы выступают в качестве вирусов-оппортунистов, приводя к более тяжелому, с необычными клиническими проявлениями, течению основного заболевания. Вирусы простого герпеса 1 и 2 типов, а также ЦМВ входят в число возбудителей TORCH-инфекций. Они играют важную роль в нарушении репродуктивной функции человека, развитии серьезных заболеваний матери, плода, новорожденного и детей младшего возраста.
Вызываемые вирусами ВПГ, CMV, ВЭБ заболевания рассматриваются как СПИД-индикаторные в связи с их частым обнаружением при данной патологии. В 1988 г. они включены в расширенное определение случаев, подлежащих эпидемиологическому надзору по поводу СПИДа. Результаты исследований последних лет свидетельствуют о роли некоторых герпес-вирусов (ВГЧ-8, ЦМВ, ВЭБ и др.) в развитии ряда злокачественных новообразований: назофарингеальной карциномы, лимфомы Беркитта, В-клеточной лимфомы, рака груди, аденокарциномы кишечника и простаты, карциномы цервикального канала шейки матки, саркомы Капоши, нейробластомы и др.
Наибольшую угрозу для здоровья представляют герпетические нейроинфекции (летальность достигает 20%, а частота инвалидизации — 50%), офтальмогерпес (почти у половины больных приводит к развитию катаракты или глаукомы) и генитальный герпес.
Все методы индикации и идентификации вирусов основаны на следующих принципах:
- выявление вируса per se (электронная микроскопия);
- выявление и идентификация вирусов посредством взаимодействующих с ними клеток (накопление вирусов в чувствительных к ним клетках);
- выявление и идентификация вирусов с помощью антител (МФА, ИФА, РАЛ, ИБ, РН, РСК);
- выявление и идентификация нуклеиновых кислот (ПЦР, МГ).
Электронная микроскопия: быстрая диагностика позволяет обнаружить ГВ или их компоненты непосредственно в пробах, взятых от больного, и дать быстрый ответ через несколько часов. Возбудитель выявляют с помощью электронной микроскопии клинического материала при негативном контрастировании.
Серологические методы уступают по информативности и чувствительности другим способам лабораторной диагностики и не позволяют с достаточной степенью достоверности установить этиологию той или иной формы заболевания. Нарастание титров антител происходит
в поздние сроки (через несколько недель) после заражения или реактивации вируса, и в то же время оно может и не наблюдаться у иммунодефицитных лиц. Для установления 4-кратного нарастания титра антител к герпес-вирусной инфекции (показатель первичной инфекции) необходимо исследование парных сывороток. Серологические реакции (РСК, РН) обладают высокой специфичностью, но относительно низкой чувствительностью, а кроме того, сложны в постановке.
Широкое практическое применение получили иммунофлюоресцентный метод, ИФА, РАЛ, ИБ.
Наиболее точным методом диагностики герпес-вирусной инфекции является выделение вируса из различных клеточных культур.
Для обнаружения вируса герпеса используют молекулярно-биологические методы: полимеразную цепную реакцию и реакцию молекулярной гибридизации, которые позволяют выявить наличие вирусной нуклеиновой кислоты в исследуемом материале. ПЦР может считаться самой чувствительной и быстрой реакцией. Чувствительность метода дает возможность определить одну молекулу искомой ДНК в образцах, содержащих 10 клеток.
Лечение герпетической инфекции до настоящего времени остается сложной задачей. Хроническое течение процесса приводит к иммунной перестройке организма: развитию вторичной иммунной недостаточности, угнетению реакции клеточного иммунитета, снижению неспецифической защиты организма. Несмотря на разнообразие лекарственных препаратов, использующихся для лечения герпетической инфекции, лекарственных средств, обеспечивающих полное излечение от герпеса, не существует. Герпес-вирусная инфекция относится к трудно контролируемым заболеваниям. Это связано, в первую очередь, с разнообразием клинических поражений, развитием резистентности вируса к лекарственным средствам, наличием у герпес-вирусов молекулярной мимикрии. Поэтому для успешного лечения герпетической инфекции необходимо правильно подобрать противовирусный препарат, его дозу и длительность лечения, использовать комбинацию различных лекарств. В схемы терапии для повышения эффективности лечения необходимо также включать иммунобиологические препараты, способствующие коррекции иммунного статуса, а также патогенетические средства, облегчающие состояние пациента.
В настоящее время все антигерпетические средства подразделяются на 3 основные группы антивирусных препаратов (табл. 3).
Механизм действия химиопрепаратов (аномальных нуклеозидов: валтрекса, вектавира, фамвира, цимевена) связан с угнетением синтеза вирусной ДНК и репликации вирусов путем конкурентного ингибирования вирусной ДНК-полимеразы.
В препаратах-иммуномодуляторах (алпизарин, имунофан, ликопид, полиоксидоний) активно действующие вещества обладают иммуностимулирующими свойствами в отношении клеточного и гуморального иммунитетов, окислительно-восстановительных процессов, синтеза цитокинов.
Препараты-индукторы ИФН (амиксин, неовир, циклоферон) сочетают этиотропный и иммуномодулирующий эффекты действия. Препараты индуцируют образование эндогенных ИФН (α, β, γ) Т- и В-лимфоцитами, энтероцитами, гепатоцитами.
Особое место среди средств антигерпес-вирусной терапии занимает герпетическая вакцина для активации клеточного иммунитета, его иммунокоррекции в фазе ремиссии. Вакцинация преследует 2 цели: предупреждение первичной инфекции и возникновения состояния латентности, а также предупреждение или облегчение течения заболевания.
Однако, несмотря на наличие обширного списка антигерпетических препаратов, герпес остается до сих пор плохо контролируемой инфекцией. Это обусловлено и генотипическими особенностями возбудителя, и длительной персистенцией вируса в организме, и формированием штаммов, устойчивых к антивирусным препаратам. Максимальный клинический эффект может быть получен только при рациональной комплексной терапии лекарственных средств с различным механизмом действия.
Санкт-Петербургской группой ученых вирусологов и инфекционистов во главе с В. А. Исаковым предложена программа лечения и профилактики герпетической инфекции (табл. 4).
Преимущества комплексной терапии ГИ.
- Сочетанное применение противогерпетических химиопрепаратов и иммунобиологических средств обеспечивает синергидный эффект.
- Благодаря снижению дозы противовирусного ХПП уменьшается вероятность развития побочных эффектов, сокращается токсическое воздействие на организм больного.
- Снижается вероятность возникновения устойчивых штаммов герпес-вирусов к данному препарату.
- Достигается иммунокорригирующий эффект.
- Сокращается продолжительность острого периода болезни и сроков лечения.
Таким образом, терапия ГИ является сложной и многокомпонентной задачей.
По вопросам литературы обращайтесь в редакцию.
Т. К. Кускова, кандидат медицинских наук
Е. Г. Белова, кандидат медицинских наук
МГМСУ, Москва
Методические указания для студентов к практическому занятию № 6.
Тема: Лабораторная диагностика герпесвирусных инфекций.
Цель: Изучение лабораторной диагностики герпесвирусных инфекций.
Модуль 3. Общая и специальная вирусология.
Содержательный модуль 16. Специальная вирусология.
Тема 6:Лабораторная диагностика герпесвирусных инфекций.
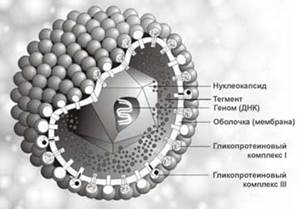
Актуальность темы:
Вирус простого герпеса – одна из самых распространенных вирусных инфекций человека, характеризующаяся лихорадочным состоянием и пузырьковыми высыпаниями, которые чаще всего локализуются на коже и слизистых оболочках. Важными особенностями герпетической инфекции являются пожизненное носительство вируса и частые рецидивы болезни.
Вирусная природа простого герпеса установлена в 1912 г. У. Грютером.
(Трёхмерное изображение вируса герпеса).
Герпесвирусы и вызываемые ими заболевания
| Типы вирусов герпеса | Вызываемые заболевания |
| ВПГ-1 (вирус простого герпеса типа 1) | Поражение: кожи, слизистой оболочки ротовой полости, конъюнктивы или роговицы глаза, энцефалиты |
| ВПГ-2 (вирус простого герпеса типа 2) | Поражение слизистых оболочек гениталий, у новорожденных - центральной нервной системы |
| ВЗВ (вирус ветрянки) | Ветряная оспа, опоясывающий лишай, постгерпетическая невралгия; язвенно-некротическая форма опоясывающего герпеса - СПИД-индикаторный признак заболевания |
| ЦМВ (цитомегаловирус) | Патологии новорожденных; осложнения после трансплантации органов и костного мозга: интерстициальная пневмония, гастроинтестинальные расстройства, гепатиты |
| ВЭБ (вирус Эпштейна-Барра) | Инфекционный мононуклеоз, лимфома Беркитта, рак носоглотки |
| ВГ-6 | Вирус, вызывающий фатальные интерстициальные пневмонии и инфекционные розеолы новорожденных |
| ВГ-7 | Вирус, выделенный от больных с синдромом хронической усталости |
| ВГ-8 | Вирус, выделенный из биоптата больного саркомой Капоши, ассоциированный с лимфопролиферативными заболеваниями |
| Примечание. ВГ - вирус герпеса. |
Таксономия, морфология, химический состав. Возбудитель простого герпеса - ДНК-содержащий вирус, относится к семейству Herpesviridae, роду Simplexvirus. По морфологии и химическому составу не отличается от вирусов ветряной оспы и опоясывающего герпеса.

Культивирование. Вирус простого герпеса (ВПГ) культивируют в куриных эмбрионах, культурах клеток и организме лабораторных животных. На хорионаллантоисной оболочке куриных эмбрионов вирус образует мелкие белые плотные узелки-бляшки; в зараженных культурах - вызывает цитопатический эффект: образование гигантских многоядерных клеток с внутриядерными включениями.
Антигенная структура. Вирус содержит ряд антигенов, связанных как с внутренними белками, так и с гликопротеидами наружной оболочки. Последние являются основными иммуногенами, индуцирующими выработку антител и клеточный иммунитет. Существует два серотипа вируса: ВПГ типа 1 и ВПГ типа 2.
Резистентность. Вирус может выживать на поверхности предметов при комнатной температуре в течение нескольких часов, чувствителен к УФ-лучам, обычным дезинфицирующим средствам, жирорастворителям, термолабилен.
Восприимчивость животных. Вирус простого герпеса патогенен для многих животных, у которых вызывает энцефалит при введении возбудителя в мозг или местный воспалительный процесс при заражении в глаз. В естественных условиях животные не болеют.
Эпидемиология. Простой герпес - одна из самых распространенных инфекций, которая поражает различные возрастные группы людей, чаще в осенне-зимний период. Отмечаются спорадические случаи заболевания, иногда небольшие вспышки в семьях, детских коллективах, больницах. Эпидемий не наблюдается.
Источником инфекции являются больные и носители. Основной механизм передачи - контактный, аэрогенный. Заражение происходит при попадании вирусов на поврежденные кожные покровы или слизистые оболочки.
Эпидемиология герпеса, вызванного вирусами типов 1 и 2, различна. ВПГ типа 1 передается через слюну, зараженные слюной руки и предметы быта, а ВПГ типа 2 - половым путем. Возможно заражение плода через плаценту.
Патогенез и клиническая картина. По клиническим проявлениям различают первичный и рецидивирующий герпес. Входными воротами возбудителя при первичной герпетической инфекции являются поврежденные участки кожи и слизистых оболочек рта, глаз, носа, мочеполового тракта, где вирусы репродуцируются. Затем по лимфатическим сосудам вирусы попадают в кровь и заносятся в различные органы и ткани.
Инкубационный период при первичном герпесе составляет в среднем 6-7 дней. Заболевание начинается с жжения, зуда, покраснения, отека на ограниченных участках кожи и слизистых оболочек, затем на этом месте появляются пузырьковые высыпания, наполненные жидкостью. Иногда заболевание сопровождается повышением температуры тела и нарушением общего состояния. При подсыхании пузырьков рубцов не образуется. Первичный герпес у новорожденных протекает тяжело и нередко заканчивается смертью. Однако у большинства людей первичная инфекция остается нераспознанной, так как протекает бессимптомно.
После первичной инфекции (явной и бессимптомной) 70-90 % людей остаются пожизненными носителями вируса, который сохраняется в латентном состоянии в нервных клетках чувствительных ганглиев. Нередко у носителей появляются рецидивы болезни в результате переохлаждения, перегревания, менструации, интоксикации, различных инфекционных заболеваний, стрессов, нервно-психических расстройств. Для рецидивирующего герпеса характерны повторные высыпания на коже и слизистых оболочках, нередко в тех же местах. Наиболее частой локализацией рецидивирующего герпеса, вызванного ВПГ типа 1, являются губы, крылья носа, полость рта, конъюнктива глаз. ВПГ типа 2 поражает мочеполовую систему и вызывает герпес новорожденных. Доказана роль ВПГ типа 2 в развитии рака шейки матки. Сравнительно редко встречаются генерализованные формы рецидивирующего герпеса, в частности поражения нервной системы и внутренних органов.
Иммунитет. В результате первичной герпетической инфекции в организме образуются сывороточные и секреторные антитела, которые обусловливают иммунитет к первичному герпесу, но не препятствуют сохранению вируса и возникновению рецидивов. Рецидивирующий герпес возникает при высоком уровне антител к вирусу герпеса. Основное значение в развитии рецидивирующего герпеса имеет состояние клеточного иммунитета.
Лабораторная диагностика. Материалом для исследования являются содержимое герпетических пузырьков, слюна, соскобы с роговой оболочки глаза, кровь, цереброспинальная жидкость, в летальных случаях . кусочки головного и спинного мозга.
Экспресс-диагностика заключается в обнаружении гигантских многоядерных клеток с внутриядерными включениями в мазках-отпечатках из высыпаний, окрашенных по Романовскому-Гимзе. Для дифференциации от других вирусов, принадлежащих к этому семейству, используют РИФ, ИФА, РИА, ПЦР. Выделение вируса проводят на куриных эмбрионах, культуре клеток и на лабораторных животных (мыши-сосунки), идентифицируют вирус с помощью РИФ или РН. В последние годы в диагностике простого герпеса начали применять моноклональные антитела, что дает возможность определить серотип вируса. Для серодиагностики заболевания используют РСК, РН, РИФ, ИФА.
Специфическая профилактика и лечение. Для профилактики тяжелых форм рецидивирующего герпеса в период ремиссии применяют многократное введение инактивированной, культуральной герпетической вакцины. Вакцинация, а также применение иммуномодуляторов, например реаферона, удлиняют межрецидивный период и облегчают течение последующих рецидивов. В остром периоде с лечебной целью используют химиотерапевтические препараты (виразол, ацикловир, оксолиновую, тебро-феновую, флореналовую мази, бонафтон), интерфероны и индукторы интерферона.
Вирус цитомегалии

Цитомегалия - инфекционное заболевание, возбудителем которого является цитомегаловирус (ЦМВ) Cytomegalovirus hominis (от греч. cytys - клетка, megas - большой). Вирус вызывает цитомегаловирусную инфекцию человека, характеризующуюся поражением почти всех органов (преимущественно слюнных желез) с образованием в них гигантских клеток с внутриядерными включениями, протекающую в различных формах - от бессимптомного носительства до тяжелой генерализованной формы, заканчивающейся летальным исходом.
Вирус впервые выделен К. Смитом в 1956 г.
Таксономия, морфология, антигенная структура. Возбудитель цитомегалии - ДНК-содержащий вирус, относится к семейству Herpesviridae, роду Cytomegalovirus.
Морфология, химический состав типичны для семейства герпесвирусов. Диаметр вирусной частицы (вириона) около 180 нм. В центре вириона находится двенадцатигранный нуклеокапсид, содержащий генетическую информацию - двухнитевую ДНК-вируса. Установлено 2 антигенных серотипа вируса.
Резистентность. Вирус термолабилен, чувствителен к дезинфицирующим средствам и жирорастворителям.
Эпидемиология. Цитомегаловирусная инфекция широко распространена на земном шаре. Источником вируса является больной человек или носитель. Вирус выделяется со слюной, мочой, секретами организма, реже фекалиями. Предполагается, что ведущий механизм передачи инфекции - контактно-бытовой, возможны аэрогенный и фекально-оральный механизмы передачи. Цитомегаловирус обладает высокой способностью проникать через плаценту (вертикальная передача), вызывая внутриутробную патологию плода.
Патогенез и клиническая картина. Патогенез не вполне выяснен. Инфекция связана с длительным носительством вируса, который в латентном состоянии сохраняется в слюнных железах, почках и других органах. Активация латентной инфекции происходит при иммунодефицитных состояниях, иммунодепрессивной терапии. Вирус поражает ЦНС, костный мозг, почки, печень, клетки крови. У беременных женщин цитомегалия может приводить к недоношенности, мертворождению, развитию аномалий у плода.
Иммунитет. У больных независимо от клинической формы инфекции, а также у носителей образуются антитела, которые, однако, не препятствуют сохранению вируса в организме и выделению его в окружающую среду. Интенсивность развития болезни находится под контролем клеточной иммунной системы хозяина.
Лабораторная диагностика. Обследованию на цитомегалию в первую очередь подлежат дети с поражением ЦНС и врожденными уродствами, а также женщины с неблагополучно протекающей беременностью. Исследуемый материал - слюна, моча, мокрота, цереброспинальная жидкость, кровь, пунктат печени.
Специфическая профилактика и лечение. Разработана живая аттенуированная вакцина. Для лечения применяют химиотерапевтические препараты (ганцикловир, фоскорнет натрия), иммуномодуляторы, интерферон.
Инфекционный процесс может протекать:
1. В острой форме - короткий инкубационный период с последующим развитием характерной клинической картины заболевания и обратной динамикой симптомов;
2. В хронической форме – клинико-лабораторная симптоматика заболевания проявляется в течение длительного времени (более 6 месяцев;
3. В инаппарантной (бессимптомной) форме, когда клинические симптомы болезни не выражены, а инфекция документируется лабораторно (вирусологическими и серологическими методами исследования);
4. В форме медленной вирусной инфекции – длительный инкубационный период (месяцы и годы) и с последующим медленным прогрессирующим течением, с развитием тяжелых клинических симптомов и, в итоге, - смертью больного.
Уникальным биологическим свойством всех ГВ человека является их способность к персистенции и латенции в организме инфицированного человека. Персистенция представляет собой непрерывное и цикличное размножение (репликацию) вируса в инфицированных клетках тропных тканей, что является причиной развития инфекционного процесса. Латенция герпесвирусов клинически себя не проявляет, а диагностируется только при наличии специфических Ig G против вируса (серопозитивность) в невысоких титрах, а сам вирус в этот период в периферической крови не определяется даже таким высокочувствительным методом, как ПЦР. В состоянии латенции нарушается полный цикл репродукции вируса, и он находится в клетках хозяина в виде субвирусных структур.
Широкий тканевый тропизм, способность к персистенции и латенции в организме инфицированного человека обуславливают различные клинические проявления герепесвирусных болезней.
Классификация
Клинических форм заболеваний, обусловленных герпесвирусами
| Вирус | Первичная инфекция | Реактивация после латенции |
| Вирус простого герпеса I типа – ВПГ-1–ВГЧ-1 – HSV-1 | Герпес кожи Лабиальный герпес Гингивостоматит Офтальмогерпес Генитальный герпес Неонатальный герпес Энцефалит (редко) Невропатии | Рецидивирующий орально-лобиальный герпес Рецидивирующий аногенитальный герпес Энцефалит Эзофагит, гастрит Гепатит Пневмониты Невропатии |
| Вирус простого герпеса II типа – ВПГ- 2 –ВГЧ- 2 – HSV-2 | Генитально-ректальный герпес Неонатальный герпес Менингоэнцефалит Крестцовый радикулит | Генетальный герпес Менингоэнцефалит Хроническая кожно-слизистая форма |
| Вирус варицелла-зостер- ВВЗ- вирус герпеса человека 3 типа – ВГЧ-3-VZV | Ветряная оспа | Опоясывающий герпес Постгерпетическая невралгия |
| Вирус герпеса человека 4 типа – ВГЧ-4- Эпштейна-Барр вирус – ЭБВ- EBV | Инфекционный мононуклеоз Саркома мышц Энцефалит у новорожденных Лимфоидная интерстициальная пневмония у детей | Инфекционный мононуклеоз Гепатит Лимфома Беркитта Назофарингиальная карцинома Волосатая лейкоплакия языка EBV-ассоциированный лимфопролиферативный синдром В-клеточная лимфома Синдром хронической усталости и иммунной депрессии Аутоиммунная патология |
| Вирус герпеса человека 5 типа – ВГЧ-5-цитомегаловирус- ЦМВ-СMV | Гетерофильно-негативный мононуклеоз Васкулит Неонатальная СMV -инфекция Субклиническая инфекция | Гетерофильно-негативный мононуклеоз СMV- ретинит СMV- гепатит СMV- пневмония СMV- энцефалит СMV- колит/холангит СMV- адреналовая недостаточность Реакция отторжения трансплантата Атеросклероз |
| Вирус герпеса обезьян В | Летальный энцефаломиелит при инфицировании людей | |
| Вирус герпеса человека 6 типа – ВГЧ-6- HHV-6 | Внезапная экзантема у детей Гетерофильно-негативный мононуклеоз Васкулит | Гетерофильно-негативный мононуклеоз Гепатит Лимфопролеферативные заболевания Интерстициальная пневмония у лиц с иммунодефицитом Энцефалит Злокачественные новообразования Синдром хронической усталости и иммунной депрессии Аутоиммунная патология Психозы |
| Вирус герпеса человека 7 типа – ВГЧ-7- HHV-7 | Возможна экзантема у детей | Синдром хронической усталости и иммунной депрессии Заболевания кожи и ЦНС аутоиммунной природы. Рак желудка |
| Вирус герпеса человека 8 типа – ВГЧ-8- HHV-8 | Не известно | Саркома Капоши Неходжкинская В –лимфома Лимфопролеферативное заболевание -болезнь Кастлемана |
Вирус простого герпеса (ВПГ)
(Herpes simplex virus –HSV)
Это широко распространенные в мире заболевания. Более чем 90% населения планеты являются носителями ВПГ.
Согласно данным ВОЗ, смертность от диссеминированных форм болезни, вызванной ВПГ, составляет 15,8 % и занимает второе место после показателя смертности от гриппа. Заболевания, связанные с ВПГ занимают 35,8 % среди заболеваний вирусной этиологии. Число госпитализированных больных с диагнозом ВПГ-инфекции ежегодно превышает 2,5 млн. человек. К офтальмологам ежегодно обращается свыше 500 тыс. больных с различными формами офтальмогерпеса; ВПГ обуславливает 60% от общего числа поражений роговицы. Больные хроническими герпетическими поражениями кожных покровов, а так же больные генитальным герпесом составляют 1 % от всего населения России. ВПГ- этиология прослеживается у 10 % всех энцефалитов и 20% менингоэнцефалитов на территории нашей страны. Летальность при менингоэнцефалитах ВПГ- этиологии составляет до 80 %.. ВПГ, персистируя в нервных клетках, неизбежно нарушают деятельность как вегетативной, так и ЦНС. При этом нарушается синоптическая передача медиаторов и увеличение свободных радикалов, что может приводить к старческому слабоумию (болезни Альцгеймера), когда развитие деменции наступает за очень короткий срок в 3-6 месяцев.
Биология ВПГ.
ВПГ ДНК-содержащий вирус размером 120-300 нм, вирион которого состоит из центрально расположенного плотного нуклеотида, белковой капсулы - капсида и наружной оболочки, содержащей белки, углеводы, липиды и другие вещества, а в антигенном отношении проявляет сродство с антигенами хозяина. Вирус обладает пантропизмом - он может поражать кожу, слизистые, центральную и периферическую нервную систему, печень, эндотелий сосудов, клетки крови (Т-лимфоциты, эритроциты, тромбоциты).
ВПГ, как ДНК-содержащий вирус, может интегрироваться в генетический аппарат клетки хозяина и вызывать злокачественную трансформацию клеток (в последние годы установлена этиологическая и патогенетическая роль ВПГ-2 в возникновении рака шейки матки)|.
Геном вируса может интегрироваться с генами некоторых других вирусов, вызывая их активацию. С другой стороны, развитие ряда вирусных и бактериальных инфекций сопровождается активацией латентного герпеса.
ВПГ термолабилен, при нагревании до 50-56°С он инактивируется через 30 минут. При комнатной температуре на кожных покровах и влажных поверхностях разных предметов выживает в течение 1-4 часов. Низкие температуры вирус переносит хорошо и при температуре от минус 20°С до минус 70°С сохраняется в жизнеспособном состоянии десятилетиями. Вирус устойчив также к повторному замораживанию и оттаиванию, действию ультразвука и годами может сохраняться в высушенном состоянии. Вирус погибает под воздействием ультрафиолетовых и рентгеновских лучей; он чувствителен к действию спирта и других органических растворителей, протеолитических ферментов, фосфатазы, желчи.
Эпидемиология ВПГ.
Источниками инфекции являются больные с различными формами болезней, в том числе и латентной, а так же вирусоносители. Вирус может находиться в крови, слюне, моче (в период вирусемии), везикулярном и вагинальном секрете, кале и т.д. Входные ворота инфекции - поврежденные слизистые глаз, рта, гениталий, кожа.
1. Ведущим путем передачи ВПГ-1 является контактно-бытовой - прямой контакт через слюну или через посуду, загрязненную слюной носителя вируса; источником заражения детей обычно является один из родителей с активной формой герпеса. Ведущим путем передачи ВПГ-2 у взрослых лиц является половой.
2. Воздушно-капельный путь, когда вирус из региональных лимфоузлов попадает гематогенно или лимфогенно в различные органы, в том числе и в слюнную железу.
3. Вертикальный путь (от инфицированной матери – плоду). Он наиболее опасен при бессимптомной инфекции у матери в предродовый период:
• восходящий путь - вирус проникает в полость матки через цервикальный канал и в 20-30% случаев может заразить плод;
• трансплацентарное инфицирование плода; встречается в 0,05-20% случаев;
• инфицирование во время родов (контакт с родовыми путями); встречается в 40% случаев.
4. Трансфузионный и трансплантационный пути (поскольку при генерализации процесса имеет место вирусемия,
наличие герпеса у донора может привести к инфицированию
реципиента, особенно на фоне применения цитостатиков).
Наибольшее количество заболеваний регистрируется в холодные месяцы, но эпидемий не бывает, хотя могут наблюдаться небольшие вспышки в дошкольных учреждениях, школах, больницах.
Герпес может быть госпитальной инфекцией, может наблюдаться внутрисемейное распространение инфекции. Источником инфекции в семье может быть не только мать, но и отец. ВПГ-инфекция в организме детей и родителей может протекать как в виде моноинфекции, вызванной ВПГ-1 или ВПГ-2, так и в сочетанной форме, что подтверждается наличием у человека противогерпетических антител одновременно к обоим вирусам.
Механизмы персистенции ВПГ.
Известны две альтернативные гипотезы для объяснения механизма персистенции ВПГ, которые допускают развитие рецидивов на основе статического или динамического состояния вируса.
Согласно первой, вирус находится в клетках паравертебрального сенсорного ганглия в интегрированном или свободном непродуктивном состоянии. Под влиянием "пускового фактора" вирус активируется и перемещается из ганглия по аксону периферического нерва в эпителиальные клетки, где реплицируется. Дефекты иммунной системы приводят к активации вируса и рецидиву болезни, которые могут возникать на фоне высоких титров антител.
В соответствии с другой (динамической) гипотезой, репродукция и выделение ВПГ из ганглиев происходит постоянно, но в небольшом количестве. Мигрируя центробежно из ганглия по аксону периферического нерва, вирус достигает эпителиальных клеток, но механизмы защиты организма (а также защитные свойства кожи) устраняют микроочаги инфекции, то есть предупреждают клинические проявления инфекции.
Патогенез ВПГ-инфекции.
Основными этапами развитиягерпетической инфекции являются:
1). первичная инфекция кожи и слизистых;
3). установление латентности в ганглиях, когда только вирусная ДНК, находящаяся в ядрах нейронов, свидетельствует о наличии инфекции. По окончании острой фазы инфекции свободный ВПГ более не обнаруживается в чувствительном ганглии. Механизмы, определяющие переход из острой фазы инфекции, когда вирус не удается обнаружить в гомогенатах ганглия, пока не выяснены. Этот переход параллелен развитию иммунных факторов: иммунная реакция хозяина уменьшает размножение вируса в коже, снимает сигнал и клетки ганглия становятся непермиссивными - устанавливается латентная инфекция.
Обнаружение вируса герпеса в ганглиях людей, перенесших в прошлом инфекцию ВПГ, говорит о реактивации инфекции, которая может протекать как бессимптомно, так и с развитием поражений слизистых и кожи.
Реактивация ВПГ часто встречается у лиц, получающих иммунодепрессанты после трансплантации органов, при УФ-облучении, стрессе. Активизирующий эффект перечисленных и ряда других факторов неразрывно связан с нарушением содержания в клетке циклоаденозин-монофосфата (цАМФ), роль которого велика в реализации разнообразных внутриклеточных процессов. В инфицированной ВПГ клетке резко снижается количество цАМФ. Нарушение равновесия между клеткой и ВПГ под влиянием провоцирующих факторов приводит к усилению репликации вируса, что клинически проявляется обострением.
Помимо нейрогенного пути распространения герпетической инфекции большое значение имеет гематогенный путь ее распространения в результате выраженного эритротропизма ВПГ, вследствие которого происходит заражение новых клеток. Кроме того, ВПГ тесно взаимодействует с лейкоцитами и даже тромбоцитами. При этом наблюдаются грубые повреждения хромосом и большие скопления антигена ВПГ в лейкоцитах.
Последнее изменение этой страницы: 2016-04-26; Нарушение авторского права страницы
Читайте также:


