Медицинские статьи о противовирусных препаратах
Н. М. Киселева, кандидат медицинских наук, доцент
Л. Г. Кузьменко, доктор медицинских наук, профессор
РГМУ, Москва
В настоящее время известно более 500 вирусов, возбудителей заболеваний человека. Вирусы содержат одно- или двухцепочечную рибонуклеиновую кислоту (РНК) или дезоксирибонуклеиновую кислоту (ДНК), заключенную в белковую оболочку — капсид. У некоторых из них есть и внешняя оболочка из липопротеидов. Многие вирусы содержат ферменты или гены, обеспечивающие репродукцию в клетке-хозяине. В отличие от бактерий у вирусов нет собственного обмена веществ: они используют метаболические пути клетки-хозяина.
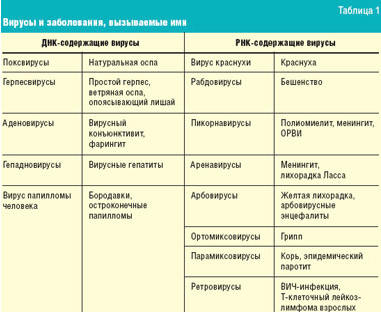
РНК-содержащие вирусы или синтезируют матричную РНК (мРНК), или сама РНК выполняет функцию мРНК. На ней синтезируются вирусные белки, в том числе РНК-полимераза, при участии которой образуется мРНК вируса. Транскрипция генома некоторых РНК-содержащих вирусов осуществляется в ядре клетки-хозяина. Под действием обратной транскриптазы ретровирусов на основе вирусной РНК синтезируется комплементарная ей ДНК (провирус), которая встраивается в геном клетки-хозяина. В дальнейшем при транскрипции образуется как клеточная РНК, так и мРНК вируса, на которой синтезируются вирусные белки для сборки новых вирусов. Вирусы и заболевания, которые ими вызываются, отражены в табл. 1.
На стадии заражения вирус адсорбируется на клеточной мембране и проникает в клетку. В этот период применяются препараты, нарушающие этот процесс: растворимые ложные рецепторы, антитела к мембранным рецепторам, ингибиторы слияния вируса с клеточной мембраной.
На следующем этапе начинается внутриклеточный синтез вирусных компонентов. На этом этапе эффективны ингибиторы вирусных ДНК-полимераз, РНК-полимераз, обратной транскриптазы, геликазы, праймазы, интегразы. На трансляцию вирусных белков действуют интерфероны (ИФН), антисмысловые олигонуклеотиды, рибозимы и ингибиторы регуляторных белков. На протеолитическое расщепление воздействуют ингибиторы протазы.
ИФН и ингибиторы структурных белков активно воздействует на сборку вируса.
Заключительный этап репликационного цикла включает выход дочерних вирионов из клетки и гибель инфицированной клетки-хозяина. На этом этапе эффективны ингибиторы нейраминидазы, противовирусные антитела и цитотоксические лимфоциты.
Существуют различные классификации противовирусных средств. В данной статье представлена классификация по воздействию на тот или иной вирус (табл. 2).

Рассмотрим противогриппозные и противогерпетические препараты.
Классификация противовирусных препаратов, разрешенных к применению на территории России.
- Группа противогриппозных препаратов:
– Амантадин;
– Арбидол;
– Осельтамивир;
— Римантадин. - Препараты, действующие на герпесвирусы:
– Алпизарин;
– Ацикловир;
– Бонафтон;
– Валацикловир;
– Ганцикловир;
– Глицирризиновая кислота;
– Идоксуридин;
– Пенцикловир;
– Риодоксол;
– Теброфен;
– Тромантадин;
– Фамцикловир;
– Флореналь. - Антиретровирусные препараты:
– Абакавир;
– Ампренавир;
– Атазанавир;
– Диданозин;
– Залцитабин;
– Зидовудин;
– Индинавира сульфат;
– Ламивудин;
– Нелфинавир;
– Ритонавир;
– Саквинавир;
– Ставудин;
– Фосфазид;
– Эфавиренз. - Другие противовирусные препараты:
– Инозин пранобекс;
– Интерферон альфа;
– Интерферон альфа-2;
– Интерферон альфа-2b;
– Интерферон бета-1а;
– Интерферон бета-1b;
– Йодантипирин;
– Рибавирин;
– Тетраоксо-тетрагидронафталин (Оксолин);
– Тилорон;
– Флакозид.
Арбидол — производное индолкарбоновой кислоты. Механизм действия препарата складывается из подавления репродукции вируса гриппа, влияния на синтез ИФН, повышения количества Т-лимфоцитов и функциональной активности макрофагов, а также антиоксидантного эффекта.
Препарат проникает в неизмененном виде как в незараженные, так и в зараженные клетки и определяется в ядерной и цитоплазматической фракциях. Арбидол ингибирует процесс слияния липидной вирусной оболочки с мембранами эндосом (при рН 7,4), приводящий к высвобождению вирусного генома и началу транскрипции. В отличие от амантадина и римантадина, Арбидол ингибирует освобождение самого нуклеокапсида от наружных белков, нейраминидазы и липидной оболочки. Таким образом, Арбидол действует на ранних стадиях вирусной репродукции.
У препарата отсутствует штаммовая специфичность (в культурах клеток он подавляет репродукцию вируса гриппа А на 80%, вируса гриппа В — на 60% и вируса гриппа С — на 20%, а также воздействует и на вирус птичьего гриппа, однако слабее, чем на репродукцию человеческих штаммов вируса гриппа).
Синтез ИФН нарастает, начиная с приема 1 таблетки до 3 таблеток. Однако дальнейшего увеличения уровня ИФН при приеме Арбидола не наблюдается. Быстрое нарастание синтеза ИФН может оказывать профилактическое действие при приеме препарата до начала заболевания гриппом.
Арбидол оказывает иммуномодулирующее действие, приводя к повышению общего количества Т-лимфоцитов и Т-хелперов. Причем нормализация данных показателей наблюдалась у пациентов с исходно сниженным числом CD3- и CD4-клеток, а у лиц с нормальным функционированием клеточного звена иммунитета практически отсутствовали изменения количества Т-лимфоцитов и Т-хелперов. При этом применение Арбидола не ведет к существенному снижению абсолютного числа Т-супрессорных лимфоцитов — таким образом, стимулирующая активность препарата не связана с угнетением функции супрессорных клеток. Арбидол увеличивает общее число макрофагов с поглощенными бактериями и фагоцитарное число. Предполагается, что активирующими стимулами для фагоцитарных клеток явились цитокины и, в частности, ИФН, продукция которого усиливается под воздействием препарата. Увеличивается также содержание натуральных киллеров — NK-клеток, что позволяет характеризовать препарат как индуктор активности естественных киллеров.
Препарат быстро всасывается из желудочно-кишечного тракта (ЖКТ). Т1/2 составляет 16–21 ч. Экскретируется в неизмененном виде с калом (38,9%) и мочой (0,12%). В течение первых суток выводится 90% введенной дозы.
Лекарственные взаимодействия Арбидола с другими лекарственными препаратами в литературе не описаны.
Практически единственными побочными эффектами препарата являются аллергические реакции. Препарат разрешен к применению с 2-летнего возраста.
Арбидол обладает достаточно широким спектром противовирусного действия и используется для профилактики и лечения гриппа типов А и В, в том числе осложненного бронхитом и пневмонией; острых респираторных заболеваний (ОРВИ); хронического бронхита, пневмонии, рецидивирующей герпетической инфекции; в послеоперационном периоде — для нормализации иммунного статуса и профилактики осложнений.
Амантадин и римантадин — производные адамантана. Оба препарата даже в малых дозах подавляют репродукцию вируса А. Их противовирусная активность обусловлена двумя механизмами.
Во-вторых, они могут действовать и на этапе сборки вируса, по-видимому, за счет изменения процессинга гемагглютинина. Этот механизм возможен у некоторых штаммов вирусов.
Среди диких штаммов устойчивость к препаратам возникает редко, однако от больных, принимающих их, получают устойчивые штаммы. Чувствительность и устойчивость вирусов к амантадину и римантадину перекрестная.
Оба препарата хорошо всасываются при приеме внутрь, имеют большой объем распределения. Большая часть амантадина выводится с мочой в неизмененном виде. Период полувыведения (Т1/2) у молодых людей составляет 12–18 ч, у пожилых возрастает почти вдвое, а при почечной недостаточности увеличивается еще больше. Поэтому дозу препарата необходимо уменьшать даже при незначительном изменении функции почек. Римантадин активно метаболизируется в печени, Т1/2 в среднем составляет 24–36 ч, 60–90% препарата выводится с мочой в виде метаболитов.
При приеме обоих препаратов наиболее часто отмечают незначительные дозозависимые нарушения со стороны ЖКТ (тошнота, снижение аппетита) и центральной нервной системы (ЦНС) (раздражительность, бессонница, нарушение концентрации внимания). При приеме высоких доз амантадина возможно значительное нейротоксическое действие: спутанность сознания, галлюцинации, эпилептические припадки, кома (эти эффекты могут усиливаться при одновременном приеме Н1-блокаторов, М-холиноблокаторов, психотропных средств и этанола). Безопасность применения во время беременности не установлена. Разрешено применение с 7-летнего возраста.
Препараты применяются для профилактики и лечения гриппа А. Их прием во время эпидемий гриппа позволяет избежать инфекции в 70–90% случаев. У лиц с неосложненным гриппом А лечение препаратами в течение 5 дней в возрастных дозировках, начатое на ранней стадии заболевания, на 1–2 сут уменьшает длительность лихорадки и общих симптомов, ускоряет выздоровление и иногда сокращает период выделения вируса.
Осельтамивир является неактивным предшественником, который в организме превращается в активный метаболит — осельтамивира карбоксилат. Он является переходным аналогом сиаловой кислоты и избирательным ингибитором нейраминидазы вирусов гриппа А и В. Кроме того, он подавляет штаммы вируса гриппа А, устойчивые к препаратам — производным адамантана.
Нейраминидаза вируса гриппа отщепляет концевые остатки сиаловых кислот и, таким образом, разрушает рецепторы, находящиеся на поверхности клеток и новых вирусов, т. е. способствует выходу вируса из клетки по окончании репродукции. Активный метаболит осельтамивира вызывает изменения в активном центре нейраминидазы и подавляет ее активность. Происходит агрегация вирусов на поверхности клетки и замедляется их распространение.
Устойчивые штаммы вируса гриппа А обнаруживают у 1–2% больных, принимающих препарат. Устойчивых штаммов вируса гриппа В на сегодняшний день не обнаружено.
При приеме внутрь препарат хорошо всасывается. Прием пищи не влияет на его биодоступность, но снижает риск побочного действия на ЖКТ. Препарат подвергается ферментативному гидролизу в ЖКТ и печени с образованием активного метаболита. Объем распределения препарата приближается к объему жидкости в организме. Т1/2 осельтамивира и его активного метаболита составляет 1–3 и 6–10 ч соответственно. Оба соединения выводятся главным образом почками в неизмененном виде.
При приеме внутрь возможны незначительные неприятные ощущения в животе и тошнота, которые уменьшаются при приеме препарата во время еды. Желудочно-кишечные расстройства обычно проходят через 1–2 сут, даже если больной продолжает прием препарата. Клинически значимых взаимодействий осельтамивира с другими препаратами не выявлено. Препарат применяют у детей старше 1 года.
Осельтамивир применяют для лечения и профилактики гриппа. Профилактический прием осельтамивира в период эпидемий снижает заболеваемость как среди вакцинированных противогриппозной вакциной, так и среди невакцинированных. При лечении гриппа этим препаратом выздоровление наступает на 1–2 сут раньше, а количество бактериальных осложнений снижается на 40–50%.
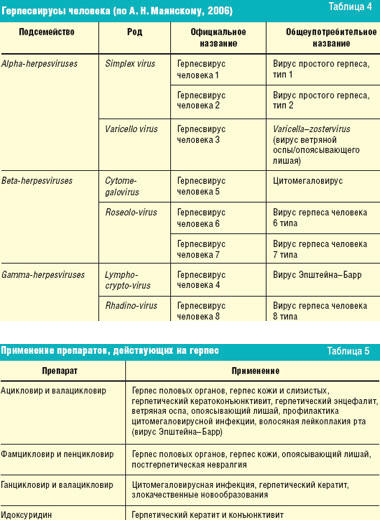
Прежде чем перейти к обсуждению противогерпетических средств, необходимо вспомнить различные вирусы герпеса и заболевания, вызываемые ими (табл. 4). К сожалению, в арсенале современных противовирусных средств нет препаратов, действующих на все вирусы герпеса одновременно (табл. 5).
Вирус простого герпеса типа 1 вызывает поражение кожи, рта, пищевода и головного мозга, вирус простого герпеса типа 2 — поражение наружных половых органов, прямой кишки, кожи и мозговых оболочек. Первым из допущенных к применению противогерпетических препаратов был видарабин (1977). Однако ввиду высокой токсичности его применяли для лечения заболеваний, вызванных вирусом простого герпеса и Varicella–zostervirus, лишь по жизненным показаниям. С 1982 г. для лечения больных с менее тяжелым течением заболевания стали применять ацикловир.
Ацикловир — ациклический аналог гуанозина, а валацикловир — L-валиновый эфир ацикловира. Ацикловир подавляет синтез вирусной ДНК после фосфорилирования вирусной тимидинкиназой внутри зараженных клеток. Образующийся в клетке ацикловиртрифосфат встраивается в синтезируемую в клетке-хозяине цепь ДНК, что приводит к прекращению роста вирусной цепи ДНК. Молекула ДНК, в состав которой входит ацикловир, связывается с ДНК-полимеразой, необратимо инактивируя ее.
Устойчивость вируса может возникнуть в результате снижения активности вирусной тимидинкиназы и изменения вирусной ДНК-полимеразы. Изменение активности ферментов возникает в результате мутаций.
Биодоступность ацикловира при приеме внутрь составляет всего 10–30% и уменьшается с увеличением дозы. В отличие от ацикловира, биодоступность валацикловира при приеме внутрь достигает 70%. Препарат быстро и почти полностью превращается в ацикловир. Ацикловир проникает во многие биологические жидкости, в том числе в содержимое везикул при ветряной оспе, спинно-мозговую жидкость, накапливается в молоке, околоплодных водах и плаценте. Концентрация его во влагалищном содержимом колеблется в широких пределах. Сывороточная концентрация препарата у матери и новорожденного примерно одинаковы. Через кожу препарат практически не всасывается. Т1/2 ацикловира составляет в среднем у взрослых 2,5 ч, у новорожденных — 4 ч, у больных с почечной недостаточностью может увеличиваться до 20 ч. Препарат практически полностью выводится почками в неизмененном виде. При беременности фармакокинетика препаратов не меняется.
Как правило, ацикловир переносится хорошо. При применении мази на основе полиэтиленгликоля возможно раздражение слизистой половых органов и чувство жжения. При приеме внутрь препарат изредка вызывает головную боль, головокружение, сыпь и диарею. Еще реже отмечаются почечная недостаточность и нейротоксическое действие. Побочные эффекты валацикловира сходны с таковыми у ацикловира — тошнота, диарея, головная боль; высокие дозы могут вызвать спутанность сознания, галлюцинации, поражения почек и — очень редко — тромбоцитопению. При внутривенном введении больших доз ацикловира могут развиться почечная недостаточность и поражения ЦНС.
Фамцикловир сам неактивный, но при первом прохождении через печень быстро превращается в пенцикловир. Пенцикловир — это ациклический аналог гуанозина. Механизм действия препарата сходен с механизмом действия ацикловира. Как и ацикловир, пенцикловир действует главным образом на вирусы простого герпеса и Varicella–zostervirus. Устойчивость к пенциклавиру в клинике встречается редко.
В отличие от пенцикловира, биодоступность которого при приме внутрь составляет лишь 5%, фамцикловир хорошо всасывается. При приеме фамцикловира биодоступность пенцикловира возрастает до 65–77%. Прием пищи совместно с препаратом замедляет всасывание последнего, но в целом биодоступность не снижается. Объем распределения пенцикловира в 2 раза превышает объем жидкости в организме, Т1/21/2 увеличивается до 9,9 ч. Препарат легко удаляется при гемодиализе.
Переносится ацикловир хорошо, но иногда возможно возникновение головной боли, тошноты, диареи, крапивницы, а у пожилых людей — галлюцинаций и спутанности сознания. Препараты для местного применения могут вызвать контактный дерматит и изъязвления.
Безопасность препарата во время беременности, а также взаимодействие его с другими лекарственными средствами не установлена.
Ганцикловир — это ациклический аналог гуанозина. Механизм действия препарата сходен с механизмом действия ацикловира. Активен в отношении всех герпесвирусов, но наиболее эффективен в отношении цитомегаловируса.
Биодоступность ганцикловира при приме внутрь во время еды составляет 6–9% и несколько меньше при приеме натощак. Валганцикловир хорошо всасывается и быстро гидролизуется до ганцикловира, биодоступность которого возрастает до 61%. При приеме валганцикловира во время еды биодоступность ганцикловира повышается еще на 25%. При нормальной функции почек Т1/2 составляет 2–4 ч. Более 90% препарата выводится почками в неизмененном виде. При почечной недостаточности Т1/2 увеличивается до 28–40 ч.
Основной дозалимитирующий побочный эффект ганцикловира — угнетение кроветворения (нейтропения, тромбоцитопения). У 5–15% больных отмечают поражения ЦНС разной степени тяжести (от головной боли до судорог и комы). При внутривенном введении возможны флебиты, азотемия, анемия, сыпи, лихорадка, изменение биохимических показателей печени, тошнота, рвота, эозинофилия.
У лабораторных животных препарат оказывал тератогенное и эмбриотоксическое действие, необратимо нарушал репродуктивную функцию. Цитостатические препараты усиливают побочное действие ганцикловира на костный мозг.
Идоксуридин — йодсодержащий аналог тимидина. Механизм противовирусного действия до конца не изучен. Известно, что фосфорилированные производные препарата встраиваются в вирусную и клеточную ДНК, но ингибируют репликацию только вирусной ДНК. При этом ДНК становится более хрупкой, легко разрушается, при ее транскрипции чаще возникают ошибки. Устойчивые штаммы выделяют от больных герпетическим кератитом, получавших идоксуридин. Препарат разрешен лишь для местного применения. При его использовании возможны боль, зуд, воспаление и отек в области глаз, аллергические реакции.
Успехи антимикробной терапии ХХ столетия привели к почти полному контролю над бактериальными инфекциями. Задачей инфекционистов и фармакологов ХХI века является обеспечение контроля над вирусной инфекцией. Помимо высокой эффективности новые противовирусные препараты должны обладать хорошей переносимостью. В настоящее время разрабатываются новые средства с принципиально новыми механизмами действия. Перспективными могут оказаться средства для подавления патологических иммунных реакций и иммунотерапия моноклональными антителами и вакцинами.
*Импакт фактор за 2018 г. по данным РИНЦ
Журнал входит в Перечень рецензируемых научных изданий ВАК.

Читайте в новом номере
Ежегодно вРоссии регистрируется 27,3–41,2млн случаев острых респираторных заболеваний (ОРЗ). Результаты мировых исследований демонстрируют, что доля вируса гриппа как возбудителя ОРЗ составляла впервом десятилетии XXIв. около 6,2–12,6%.
Расходы на лечение гриппа и его осложнений в мире ежегодно составляют около 14,6 млрд долларов. В России экономические потери от гриппа в год оцениваются в 10 млрд рублей [1].
В структуре смертности от гриппа ведущее место занимают больные старше 65 лет (80–90%), а среди пациентов 45–64 лет без сопутствующей патологии смертность составляет 2 случая на 100 тыс. человек. Среди больных с хроническими заболеваниями риск смертности распределяется следующим образом. Наибольший риск — при сочетании патологии сердца и легких, показатель смертности составляет 870 случаев на 100 тыс.; при сочетании сахарного диабета и болезней сердца — смертность 481 случай на 100 тыс.; при заболеваниях легких — 240 случаев на 100 тыс.; при заболеваниях сердца — 104 случая на 100 тыс. Смертность среди здоровых взрослых составляет всего 2 случая на 100 тыс. человек [2, 5].
Исследования 02.02– по выделению вирусов гриппа были проведены в 17 базовых лабораториях ФЦГ (ГУ НИИ гриппа РАМН, ) и 5 базовых лабораториях ЦЭЭГ (ГУ НИИ вирусологии им. , Москва). По результатам тестирования клинических материалов от 561 больного гриппом и ОРЗ было выделено 45 вирусов гриппа, 18 (3,2%) штаммов подтипа A(H1N1): в г. Москве — 1 штамм, г. — 1 штамм, в г. Хабаровске — 3 штамма и г. Владивостоке — 13 штаммов; 26 (4,6%) вирусов гриппа подтипа A(H3N2): в г. Калининграде — 8 штаммов, г. Москве — 15 штаммов, г. — 1 штамм и в г. Липецке — 2 штамма. В г. Калининграде был выделен 1 вирус гриппа типа В. В остальных случаях результаты исследований были отрицательными. Средняя частота выделения вирусов гриппа A(H1N1) в целом по всем городам составила 3,2%, вирусов гриппа A(H3N2) — 4,6%, вирусов гриппа В — 0,2%, суммарно всех типов — 8%. Результаты диагностики гриппа всеми методами (выделение вирусов, иммуноферментный анализ и метод полимеразной цепной реакции) поступили из 17 базовых лабораторий ФЦГ (ГУ НИИ гриппа РАМН, ) и 10 лабораторий ЦЭЭГ (ГУ НИИ вирусологии им. , Москва). В результате анализа клинических материалов от 1114 больных суммарная частота диагностирования гриппа составила 12,6%, гриппа A(H1N1), A(H3N2), гриппа, А и В — 2,9, 5,7, 1,4, 2,5% соответственно [3].
Коэффициент инфицирования вирусом сезонного гриппа колеблется в пределах 5–15%. Вспышки заболевания, вызванные вирусом парагриппа, могут охватывать до 20% населения. Удельный вес инфекции среди ОРВИ у взрослых может составлять до 10%, а у детей — до 12,5–25% [22].
Вакцинопрофилактика гриппа была введена в Национальный календарь прививок в России в 2006 г. По данным зарубежных исследований, показана экономическая эффективность вакцинации при гриппе, особенно для взрослых лиц трудоспособного возраста [4]. Профилактика и лечение гриппа — одна из актуальных проблем современной медицины. Проведение вакцинации не всегда возможно, особенно в группах риска: у детей, людей старше 60 лет, пациентов с сопутствующими заболеваниями, иммунодефицитами, аллергическими заболеваниями. Для групп риска характерны более тяжелое течение инфекции, развитие осложнений и смертельные исходы. У лиц преклонного возраста, пациентов с иммунодефицитом эффективность вакцинации снижается до 30–40%. Для развития пандемии необходимо появление нового вируса, против которого в организме нет иммунологической памяти, вирус должен обладать высокой контагиозностью и передаваться от человека к человеку [12]. Известно более 200 респираторных вирусов, формирование при острых респираторных вирусных инфекциях (ОРВИ). Перечисленные факты делают необходимой постановку ряда задач перед исследователями и клиницистами и стимулируют получение новых противовирусных препаратов и проведение неспецифической профилактики респираторных инфекций.
Одним из направлений лечения и профилактики ОРЗ является применение противовирусных препаратов, что определяется клиническими проявлениями, началом острого периода заболевания и известными данными, что 95% ОРЗ имеют вирусную этиологию.
Противовирусные препараты подразделяют на [22]:
1) блокаторы — римантадин, амантадин;
2) ингибиторы нейраминидазы — осельтамивир, занамивир;
3) другие препараты.
Белок М2 играет важную роль на ранних этапах вирусной инфекции, нарушает процесс сборки вирусных частиц и их репликацию. Римантадин обладает противовирусной активностью в отношении вируса гриппа, А, уменьшает токсическое влияние вируса гриппа В. К сожалению, штаммы вируса гриппа, А подтипов Н1N1 и H3N2 перестали быть чувствительными к римантадину, происходит развитие резистентности к препарату [7]. Назначение препарата в острый период снижает клинические проявления ОРЗ у детей, особенно при гриппе, А и В. Основные противопоказания к назначению римантадина: гепатит, нефрит, почечная недостаточность, тиреотоксикоз, беременность, кормление грудью. Побочные действия: аллергические реакции, боли в животе.
Осельтамивир, ингибитор нейраминидазы, активен по отношению ко всем вирусам гриппа. Показана его эффективность в отношении штаммов вируса гриппа птиц Н7 и Н9, а также H5N1. Препарат проникает во все органы и ткани, где происходит размножение вируса. Он подавляет синтез нейраминидазы — вирус не может покинуть и погибает. Осельтамивир назначают для профилактики и лечения гриппа [8, 10]. Препарат быстро абсорбируется из ЖКТ и метаболизируется в осельтамивира карбоксилат. В кровоток попадает 75% принятой дозы в виде осельтамивира карбоксилата, менее 5% — в неизмененном виде.
Применение препарата разрешено у взрослых и детей с 1 года жизни, у вакцинированных против гриппа людей, которые заболели, а также у представителей групп риска: пожилых лиц; пациентов, страдающих хроническими заболеваниями; людей, одновременно принимающих несколько лекарственных препаратов.
Лечение должно начинаться в первые 40 ч после появления симптомов. Прием препарата в первые 12 ч сокращает продолжительность заболевания более чем на 3 дня по сравнению с приемом через 48 ч. У детей прием осельтамивира в первые сутки заболевания сокращает длительность симптомов на 36 ч. Препарат взрослым и детям с 8 лет назначают по 75 мг 2 р./сут в течение 5 дней. Детям 1–3 лет осельтамивир назначают в виде суспензии. С целью профилактики достаточно приема препарата по 75 мг 1 р./сут [9, 10].
При использовании для профилактики осельтамивир эффективен в отношении вирусов гриппа, А и В. После контакта с больным назначение препарата снижает вероятность заболевания на 60–90%; предсезонная профилактика приводит к сходным результатам [10]. В профилактических целях прием осельтамивира следует начинать в первые 2 дня после контакта с инфицированным.
Назначение осельтамивира может приводить к развитию резистентности. Изоляты вируса гриппа типа, А при снижении чувствительности к осельтамивиру были исследованы в культуре in vitro с увеличением дозы осельтамивира карбоксилата. Генетический анализ показал, что снижение чувствительности к осельтамивиру связано с мутациями и изменением аминокислот нейраминидазы и гемагглютинина. В частности, наблюдались мутации I222T и H274Y нейраминидазы N1 вируса гриппа типа, А и I222T и R292K нейраминидазы N2 вируса гриппа типа А. Для нейраминидазы N9 вируса гриппа типа, А у птиц были типичны мутации E119V, R292K и R305Q; для гемагглютинина вируса гриппа, А H3N2 — мутации А28Т и R124 М, для гемагглютинина реассортантного вируса человека/птиц H1N9 (геном состоит из геномов вирусов человека и птиц) — мутация Н154Q [11].
Осельтамивир получали более 40 млн пациентов в 80 странах мира: в США, Японии, Канаде, Австралии, Швейцарии, странах Европы и Латинской Америки. Длительность симптомов гриппа, таких как кашель, миалгия, головные боли и лихорадка, после лечения осельтамивиром уменьшается по сравнению с их длительностью при применении плацебо на 40% [10]. Частота осложнений у больных гриппом при лечении данным препаратом снижается на 50% по сравнению с таковой при использовании плацебо.
Занамивир — противовирусный препарат, высокоселективный ингибитор нейраминидазы (поверхностного фермента вируса гриппа), действие которого направлено против вирусов, А и В. Вирусная нейраминидаза обеспечивает высвобождение вирусных частиц из инфицированной клетки, ускоряет проникновение вируса через слизистый барьер и инфицирование клеток дыхательных путей. Активность занамивира показана in vitro и in vivo и направлена против всех 9 подтипов нейраминидаз вирусов гриппа. Развития резистентности к занамивиру не зарегистрировано. Препарат выпускается в виде порошка для ингаляций через дискхалер, биодоступность низкая (в среднем 2%). Показания — лечение и профилактика гриппа, А и В у детей старше 5 лет и взрослых. При лечении гриппа, А и В взрослым и детям старше 5 лет рекомендуется назначать по 2 ингаляции (по 5 мг) 2 р./сут (суточная доза 20 мг) в течение 5 дней. Для профилактики — по 2 ингаляции (по 5 мг) 1 р./сут (суточная доза 10 мг) в течение 10 дней; курс может быть продлен до 1 мес. при опасности инфицирования.
Аллергические реакции, включая отек лица и гортани, бронхоспазм, затруднение дыхания, высыпания, крапивницу, при приеме занамивира отмечаются очень редко. В постмаркетинговых исследованиях (преимущественно дети в Японии) отмечались судорожные припадки, делирий, галлюцинации и девиантное поведение у пациентов, инфицированных вирусом гриппа и принимающих занамивир. Явления наблюдались на ранних стадиях заболевания, часто имели внезапное начало и быстрое наступление исхода. связь между приемом занамивира и вышеуказанными нежелательными явлениями не была доказана [11].
Благодаря химической структуре занамивира резистентность к нему развивается в меньшей степени, чем к осельтамивиру [11, 13].
Из других противовирусных препаратов следует отметить человеческий рекомбинантный интерферон (ИФН)-α2, обладающий противовирусным (в отношении вирусов гриппа, герпеса), иммуномодулирующим и антипролиферативным действием; выпускается в виде мази, геля, ректальных суппозиториев в дозах 150 000, 500 000, 1 000 000 и 3 000 000 МЕ.
Применение ИФН-α2 снижает частоту ОРЗ в 2–5 раз, сокращает длительность острого периода, уменьшает выраженность клинических симптомов и частоту осложнений. Его иммуномодулирующее действие связано с влиянием на Т- и , повышением уровня иммуноглобулина (Ig) класса A в крови, синтеза ИФН-γ клетками, фагоцитоза нейтрофильных лейкоцитов, восстановлением . Описан эффект ИФН-α2 при пневмонии, хламидийной этиологии, менингите [20, 21]. Отмечены профилактическая эффективность, иммуномодулирующее действие мази ИФН-α2, включая повышение синтеза ИФН-γ клетками, уменьшение циркуляции раннего ИФН, снижение частоты ОРВИ [21].
ИФН-α2 в виде геля может применяться для профилактики ОРВИ и стенозирующего ларинготрахеобронхита (миндалины смазываются в течение 3 нед., в острый период ОРВИ — в течение 5 дней, 2 курса в год).
ИФН-α2 хорошо переносится, совместим со всеми лекарственными средствами, разрешен к применению у беременных и кормящих женщин, новорожденных и доношенных детей, но возможна индивидуальная непереносимость [20].
Среди новых (появился в 2008 г.) препаратов можно отметить имидазолилэтанамид пентандиовой кислоты (ИПК) — аналог эндогенного пептидоамина, выделенного из тканей морского моллюска. Антивирусное действие ИПК связано с влиянием на конформационное созревание одного из основных белков вируса гриппа — NP, задерживает миграцию белка из цитоплазмы инфицированной клетки в ядро, что приводит к нарушению синтеза вируса гриппа. Противовоспалительное действие ИПК связано с подавлением синтеза провоспалительных цитокинов (фактор некроза опухоли-α, интерлейкин (ИЛ) -1β, -6), снижением активности миелопероксидазы. В исследованиях показано, что назначение ИПК в первые 40 ч инфицирования сокращает длительность острого периода при респираторной инфекции. Препарат снижает вирусную нагрузку, уменьшает время элиминации вируса, препятствует активации бактериальной инфекции, имеет хороший профиль безопасности [22, 23].
В исследовании участвовало 100 больных гриппом, получавших ИПК или арбидол, или плацебо. Оценивали время нормализации температуры тела, уменьшения или исчезновения симптомов интоксикации, обратного развития катаральных симптомов. Через 1–1,5 сут температура тела снижалась до нормальной у 5,6%, получавших плацебо, у 35,5%, получавших арбидол, и у 66,7% больных, получавших ИПК, разница была достоверной. В течение 3 сут у всех больных, получавших ИПК, температура тела стойко нормализовалась, среди получавших арбидол температура тела нормализовалась у всех больных на сут, среди получавших плацебо нормализацию наблюдали у 25% больных на сут наблюдения. Средняя продолжительность периода лихорадки у больных, получавших ИПК, составляла 34,5 ч, среди получавших арбидол — 48,4 ч и у больных, получавших плацебо, — 72 ч. Средняя продолжительность симптомов интоксикации (головная боль, головокружение, слабость) была короче у больных, получавших ИПК [25].
К новым противовирусным препаратам относится Амизон. Энисамиум йодид — действующее вещество является производным изоникотиновой кислоты (N- карбамидопиридиния йодид). Кроме противовирусного действия Амизон индуцирует синтез ИФН, лизоцима.
При гриппе и респираторных инфекциях (ОРВИ) Амизон принимают после еды, не разжевывая, по 0,5 г 3 р./сут в течение 5–7 дней, максимальная разовая доза — 1,0 г, суточная доза — 2,0 г. Стоит упомянуть о том, что профилактика по инструкции не предусмотрена, но уже более 10 лет Амизон с успехом применяется и по профилактической схеме. Для профилактики ОРЗ Амизон назначают по 0,25 г/сут в течение 3–5 дней, в дальнейшем по 0,25 г/сут 1 раз через 2–3 сут в течение 2–3 нед.
Среди побочных действий отмечают: ощущение горького вкуса во рту, возможно развитие отека слизистой оболочки ротовой полости, что не требует отмены препарата.
Противопоказания: беременность, возраст до 18 лет, период лактации, непереносимость компонентов препарата, йода, недостаточность лактазы, непереносимость лактозы, мальабсорбция.
Первые упоминания об Амизоне появились в 1998 г. Препарат выпускается [16]. Показаны анальгезирующий, жаропонижающий, антиоксидантный эффекты Амизона. По противоспалительной активности Амизон превосходит ибупрофен и не оказывает раздражающего действия на слизистую ЖКТ, что позволяет назначать препарат при сочетанной патологии желудка [17]. Амизон обладает антиэкссудативным действием, что позволяет уменьшить отек тканей и выраженность сосудистых воспалительных реакций за счет стабилизации мембран клеток и лизосом, торможения дегрануляции базофилов и тучных клеток и снижения выброса и регуляции медиаторов воспаления [18]. Препарат Амизон в последнее время активно используется для профилактики ОРВИ и гриппа. При его приеме максимальная концентрация в крови достигается через 2,5 ч, период полувыведения — 14 ч, 90–95% его метаболитов выводится с мочой [25, 26].
В различных исследованиях отмечена интерфероногенная активность Амизона, не уступающая таковой у тилорона. Уровень ИФН-α и -γ повышается в 2–3 раза после приема препарата [15]. Введение Амизона здоровым мышам приводило к активации экспрессии генов цитокинов β, -2, -12. У пациентов с ОРВИ при назначении Амизона на день приема отмечалось повышение продукции ИФН-α и -γ по сравнению с исходным уровнем и группой, получавшей плацебо [25–27]. В России зарегистрированы противовирусный и интерфероногенный эффекты Амизона.
В эксперименте на мышах, инфицированных вирусом А/Aichi 1/68 (H3N2), Амизон вводили животным за 24 ч до заражения вирусом, в момент заражения и через 24 ч после него. Контрольная группа мышей, зараженных вирусом гриппа, получала плацебо. Амизон при введении профилактически защищал 40% мышей от гибели. Введение препарата в момент заражения и после него сдерживало развитие пневмонии у 20% мышей. Увеличивалась продолжительность жизни животных [28].
D. Boltz et al. в США (Research Institute, Chicago, IL, USA; 2St. Jude Children Research Hospital, Memphis, TN) показали чувствительность вируса гриппа, А к Амизону, который в культуре in vitro в 100 раз угнетал синтез подтипов вируса (H1N1, H1N1pdm09 и H3N2). Добавление к терапии Амизона в течение первых 4–8 ч после инфицирования приводит к снижению титра вируса более чем в 100 раз, препарат действует на начальных этапах синтеза вирусных частиц. Амизон угнетает синтез вируса в культуре NHBE (normal human bronchial epithelial cells), снижая титр вируса более чем в 100 раз, что коррелирует со снижением уровня вирусной РНК. Получены результаты об активности Амизона против аденовирусов и коронавирусов. Поглощение Амизона бронхоэпителиальными клетками человека in vitro в культуре NHBE было довольно высоким. Клетки культуры были инкубированы с вирусом гриппа, А и осельтамивиром (контроль) или Амизоном. Амизон снижает синтез подтипов вирусов гриппа, А, включая H1N1, имевшего мутацию H275YNA ( вирус). Полной блокировки синтеза вирусных частиц не наблюдалось. Противовирусный эффект Амизона выражен при низких дозах, в первые 8 ч после инфицирования культуры. Увеличение дозы Амизона не приводит к усилению эффекта [14]. Таким образом, в клинике Амизон может быть эффективен при аденовирусной инфекции, инфекции вирусом, инфицировании вирусом гриппа, А, включая вирус, резистентный к осельтамивиру, но окончательные выводы будут получены после клинических исследований. Возможность снижения дозы препарата у больных должна быть подтверждена.
При респираторных инфекциях Амизон хорошо переносится, не вызывает аллергических реакций, снижает интоксикацию при ОРВИ, развитие бактериальных осложнений. Показана эффективность препарата при пневмококковой пневмонии, обострениях хронического бронхита, инфекциях [15, 25].
По данным и соавт., Амизон может быть использован для профилактики гриппа и ОРВИ в период сезонного подъема заболеваемости. Данный препарат получали 1869 взрослых и 625 детей и подростков в возрасте от 7 до 16 лет. Отмечено снижение заболеваемости ОРВИ в 3–6 раз по сравнению с таковой в контрольных группах. При возникновении ОРВИ инфекция протекала менее тяжело, отмечалось уменьшение числа осложнений (пневмонии, бронхиты, гаймориты). Для профилактики гриппа и ОРВИ 323 взрослых и 116 подростков (военнослужащие и учащиеся с военной подготовкой) получали Амизон и аскорбиновую кислоту. Группа контроля (384 взрослых и 105 подростков) получала бендазол и аскорбиновую кислоту. Уровень заболеваемости был достоверно ниже у получавших Амизон: у взрослых — в 3,6±0,2 раза, у подростков — в 4,2±0,15 раза (р Литература
Только для зарегистрированных пользователей
Читайте также:


