Лейкопения при вирусе герпеса
Герпес-вирусные инфекции (от греч. herpes — ползучий) — группа инфекционных заболеваний, вызываемых представителями семейства герпес-вирусов (Herpesviridae). Антигенных серотипов, выделенных от человека, восемь: вирус простого герпеса 1-го и 2-го типов, вирус ветряной оспы — опоясывающего герпеса или вирус герпеса человека 3-го типа, вирус герпеса человека 4-го типа — вирус Эпштейна–Барр (ВЭБ) — вызывает инфекционный мононуклеоз; вирус герпеса человека 5-го типа — цитомегаловирус (ЦМВ), вирус герпеса человека 6-го, 7-го типов — вызывают внезапную экзантему и синдром хронической усталости, вирус герпеса человека 8-го типа ассоциирован с саркомой Капоши [1]. Все герпес-вирусы являются ДНК-содержащими и сходны по морфологии, типу нуклеиновой кислоты, способу репродукции в ядрах инфицированных клеток.
В РФ сохраняется высокий уровень детской инфекционной заболеваемости [2]. Отмечается возрастание роли инфекций, вызванных вирусами цитомегалии, ВЭБ, герпеса 1-го, 2-го, герпеса 6-го и 8-го типов. Среди детской популяции герпетическая инфекция широко распространена. Так, 70–90% детей 3-летнего возраста имеют достаточно высокий титр вируснейтрализующих антител к вирусу простого герпеса 1-го типа [3]. Эти инфекции у детей часто принимают хроническое течение вследствие персистенции возбудителя и формирования необратимых изменений в органах и системах.
За последние пять лет увеличилось число детей в возрасте до одного года, умерших от генерализованных вирусных инфекций [4]. Велика роль герпес-вирусных инфекций, особенно цитомегаловирусной, в формировании перинатальной патологии и младенческой смертности. Риск развития внутриутробной инфекции зависит от характера взаимоотношений между организмом беременной женщины и микроорганизмом (первичное заражение во время беременности или реактивация ранее приобретенной инфекции).
Проблема врожденной инфекционной патологии является приоритетной для России [5].
Иммуногенез герпес-вирусной инфекции. Длительное нахождение герпес-вируса в организме человека становится возможным благодаря сложной стратегии противоборства и ускользания от иммунной системы хозяина. В достижении этого состояния можно выделить три пути стратегии возбудителя:
Вирус простого герпеса. В инфицированных клетках вирус простого герпеса образует внутриядерные включения и гигантские клетки, оказывает выраженное цитопатическое действие, проявляющееся округлением и образованием многоядерных клеток. Вирус является слабым индуктором интерферона, в связи с чем инактивация вирусной ДНК внутри клеток не наступает и он сохраняется внутри клеток длительное время, периодически вызывая рецидивы заболевания.
ЦМВ. Сущность проблемы ЦМВ-инфекции в том, что последняя относится к так называемым оппортунистическим инфекциям, клинические проявления которых возможно в условиях первичного или вторичного иммунодефицита.
ЦМВ поражает разнообразные клетки, чаще всего лейкоциты (лимфоциты, моноциты), эпителиальные клетки (дыхательных путей, слюнных желез, почек). С клеток крови ЦМВ с большим постоянством переходит на эндотелий, тропизм к которому у него весьма выражен. Поврежденные эндотелиальные клетки постоянно обнаруживаются в токе крови при активной/реактивированной ЦМВ-инфекции. Повреждение эндотелия сосудов имеет собственное патогенетическое значение в формировании органных поражений, так как вызывает ишемию или кровоизлияния в различные ткани [6].
В раннем неонатальном периоде (0–7 дней) у детей с ЦМВ-инфекцией наблюдались симптомы интоксикации, серый колорит кожи, выраженная мышечная гипотония, большая первоначальная потеря массы тела, синдром рвоты или срыгиваний, признаки угнетения ЦНС. В позднем неонатальном периоде (от 7 дней до одного мессяца) анализ клинических проявлений острой ЦМВ-инфекции выявляет поражение многих органов и систем. Так, у всех детей обнаруживаются гипоксически-ишемическая энцефалопатия с трансформацией синдрома угнетения в синдром гипервозбудимости, проявления анемии, патологическая гипербилирубинемия, увеличение печени и селезенки.
ВЭБ относится к подсемейству бета-герпес-вирусов. Вирусный геном заключен в нуклеокапсид, который покрыт гликопротеидным тегументом gp350, являющимся фактором рецепторного взаимодействия [7]. Проникновение вируса в В-лифоциты осуществляется через рецептор этих клеток CD21-рецептор к C3d-компоненту комплемента. ВЭБ-инфекция широко распространена среди людей, причем первичное инфицирование, как правило, происходит в антенатальном или детском возрасте, но манифестация ВЭБ-инфекции в виде отчетливых клинических проявлений инфекционного мононуклеоза в большинстве случаев происходит в школьном возрасте при различного рода иммунопатологических реакциях. Манифестация инфекции в виде инфекционного мононуклеоза может осложняться поражением печени, слизистой оболочки желудка, ткани почек, лимфоидного аппарата.
Особый характер взаимодействия микро- и макроорганизма при хронических персистирующих инфекциях обусловливают трудности лабораторной диагностики. Обнаружение возбудителя не может быть единственным критерием подтверждения диагноза. Необходима комплексная оценка клинических и лабораторных данных для постановки диагноза.
Цель исследования. Определить клинические особенности течения персистирующих герпес-вирусных инфекций у детей и оценить значимость комплекса лабораторных исследований, в том числе показателей общей иммунологической реактивности у больных при персистирующем у них инфекционном процессе.
Материал и методы исследований. Под наблюдением находилось 63 пациента в возрасте от одного месяца до 7 лет, из них детей до одного года было 25, от одного года до трех лет — 22 и старше трех лет — 15 больных. Среди обследованных детей преобладали пациенты первых двух лет жизни — 47 детей (74,6%) и старше двух лет было 15 больных (25,4%).
Результаты. В клинической диагностике персистирующих инфекций у детей следует отводить первостепенное значение неблагополучию акушерского анамнеза матерей больных детей.
Беременность и роды были осложненными у большинства матерей наблюдаемых детей, чаще всего у них отмечались гестозы и угроза выкидыша, рождение недоношенных, в родах гипоксия плода, преждевременная отслойка плаценты, кесарево сечение и др. У 32 женщин из 63 (50,7%) были различные соматические заболевания (хронический пиелонефрит, кольпит, анемия, аутоиммунный тиреоидит и др.). При обследовании беременных женщин было выявлено как моноинфицирование (у 30 из 63–47,6%), так и сочетания инфекций (у 16 из 63–25,4%). Наиболее часто обнаруживались герпес-вирусы и цитомегаловирусы (суммарно у 27 женщин из 63–43%) и реже другие возбудители — хламидии, микоплазмы (у 11 беременных — 17,4%). Высокая частота вышеуказанных осложнений свидетельствует о несомненной роли инфекции как отягощающего фактора в течение гестационного периода и родов.
Заподозрить внутриутробную или персистирующую инфекцию у детей можно было по высокой степени поражения у детей различных органов и систем: ЦНС (71,4%), органов дыхания (88,8%), желудочно-кишечного тракта (95,2%), поражению глаз (31,7%), лимфатического аппарата (15,9%).
В процессе наблюдения за детьми в недалеком прошлом все дети обследовались на состояние микробиоценоза кишечника.
У всех детей обнаруживались нарушения как в основных компонентах биоценоза, так и в составе условно-патогенной флоры. Следует отметить, что у всех пациентов проводилась коррекция микробиоценоза повторными курсами пре- и пробиотиков, однако восстановления микрофлоры до нормобиоценоза не наблюдалось ни у одного пациента. Следовательно, без выявления и адекватного лечения основного заболевания не удается курировать дисбиотические нарушения в организме ребенка.
Закономерен вопрос о правильности выбора комплекса диагностики внутриутробной и персистирующей инфекции у детей. В зависимости от возраста пользуются разными методами диагностики. Важное значение отводится сбору семейного анамнеза. Диагностика внутриутробных инфекций у детей должна опираться на клинические проявления как общего характера, так и на типоспецифические ее признаки, а также основываться на анализе комплекса лабораторных методов обследования [8].
При оценке клинических анализов крови у наблюдаемых детей обращали на себя внимание значительные отклонения в различных показателях гемограммы: выраженная анемизация (у 31,7% пациентов), нейтропения (у 19%), лимфоцитоз (у 27%), лейкопения с лимфоцитопенией (36,5%), ускорение СОЭ (у 27%), что в совокупности свидетельствовало о наличии воспалительного процесса в организме с выраженным снижением иммунореактивности у детей.
При скрининговом серологическом обследовании методом ИФА на внутриутробные инфекции у детей наиболее часто выявлялись положительные титры типоспецифических антител класса IgM и/или IgG к герпес-вирусам. Диагностические титры антител класса IgM и IgG определялись к ЦМВ (у 9 детей), к HV 1-го, 2-го типа (у 9 детей). Антитела к антигенам ВЭБ обнаруживались у 20 детей, из них у 10 детей были антитела класса IgG к раннему антигену ВЭБ и антитела класса IgM к капсидному антигену ВЭБ, что свидетельствовало об активной фазе ВЭБ-инфекции. Остальные 10 пациентов имели антитела класса IgG к нуклеарному (ядерному) антигену ВЭБ, что расценивалось как поздняя стадия инфекции.
У детей при персистирующем течении с реактивацией инфекции, которое чаще возникало после провоцирующих воздействий (ротавирусные диареи, ОРВИ, профилактические прививки) ПЦР-тесты при исследовании биосубстратов: кровь, осадок мочи, секрет из зева давали положительные результаты с последующим нарастанием титра типоспецифических антител по данным ИФА.
Совокупность проведенных исследований позволила выделить у обследованных больных следующие формы инфекций: моноинфекции были у 21 пациента — 31,8% (ЦМВ — у 5 детей, HV 1-го, 2-го типа — у 6 детей и ВЭБ — у 10), у 42 детей из 63 (68,2%) обнаруживались микст-инфекции. У 23 детей была ассоциация ЦМВ с герпес-вирусами (у 9 детей с HV 1-го, 2-го типа, у 3 детей — с HV 6-го типа и у 11 детей — с C. albicans и хламидиями). Микст-формы герпеса 1-го, 2-го типа были выявлены у 9 больных, у них были ассоциации с микоплазмами и хламидиями. Ассоциации ВЭБ были обнаружены у 10 детей (5 больных имели ассоциацию с ЦМВ, пациента — с HV 6-го типа и 2 больных — с Yersinia pseudotuberculosis).
Из 63 больных у 21 (33,3%) с моноинфекцией течение заболевания расценивалось как латентное (с ЦМВ-инфекцией у 5 и HV 1-го, 2-го типа у 6) и как персистирующее (у 10 детей с ВЭБ-инфекцией). У 14 детей из 42 с микст-инфицированием (у 1/3) было персистирующее течение инфекционного процесса (у 3 детей с ЦМВ-инфекцией в ассоциации с HV 6-го типа и у 11 детей с ЦМВ-инфекцией в ассоциации с C. albicans и хламидиями). У 28 детей из 43 (у 2/3) наблюдалось персистирующее течение с реактивацией инфекции (у 9 детей с ЦМВ-инфекцией в ассоциации с HV 1-го, 2-го типа; у 9 детей с HV 1-го, 2-го типа в ассоциации с хламидиями или микоплазмами и у 10 детей с ВЭБ инфекцией в ассоциации с ЦМВ, HV 6-го типа и ВЭБ в ассоциации с Y. pseudotuberculosis).
Коэффициент фагоцитарной защиты у детей с моноинфицированием и микст-формами герпесвирусной инфекции оказался достоверно сниженным по сравнению со средневозрастной нормой для здоровых детей (0,634 ± 0,05 усл. ед. и 0,540 ± 0,03 усл. ед. соответственно при норме 0,946 ± 0,03, Р1–2 и Р2–3 0,05). Недостаточность защиты клеточно-фагоцитарного звена иммунитета играет важную роль в патогенезе герпес-вирусных инфекций, что должно учитываться в лечении этих заболеваний.
Отклонение величины показателя ИЛМП имело противоположную направленность, она оказывалась достоверно повышенной как при моноинфекции, так и при микст-формах герпес-вирусных инфекций по сравнению с контролем (Р1–3 и Р2–3 0,05. Увеличение показателя ИЛМП у детей с герпес-вирусной инфекцией еще раз подтверждает лимфотропность вирусных антигенов.
ЛИИ оказался достоверно повышенным у больных с микст-формами герпес-вирусной инфекции по сравнению со средневозрастной нормой в контроле (Р2–3 0,05), они имели лишь тенденцию к повышению. Однако при оценке индивидуальных показателей ЛИИ у детей с моноинфицированием герпес-вирусами выявились существенные особенности. У 13 детей из 21 (61,9%) ЛИИ был ниже возрастной нормы, что отражало фазу положительной анергии к совершенно определенному антигену. Это свидетельствует, что организм защищен сейчас только от специфических антигенов, однако он остается уязвимым в отношении других патогенов, то есть низкий индекс интоксикации отнюдь не указывает на полное благополучие организма.
Полученные результаты исследований подтверждают выраженность иммунного дисбаланса как в клеточно-фагоцитарном звене иммунитета, так и в гуморальном, а также свидетельствуют о значимости эндогенной интоксикации у больных с микст-формами герпес-вирусной инфекции и уязвимости иммунной защиты у детей и при моноинфицировании.
Клинический пример. Андрей С., 2 года 5 мес., поступил в стационар с жалобами на высокую температуру — 39 °С, однократную рвоту, сниженный аппетит и жидкий стул 5 раз в сутки. Болен в течение двух недель ОРВИ, получил амбулаторно симптоматическое лечение. К концу второй недели ухудшилось состояние, рецидив лихорадки — 39 °C и дисфункция кишечника. Направлен на госпитализацию.
Анамнез жизни. От первой беременности, протекала с угрозой выкидыша, нефропатией, преэклампсией в родах. Во время беременности перенесла ОPВИ с лимфаденитом. Обследование на пренатальные инфекции, обнаруживались антитела класса IgG к антигенам ЦМВ и вирусу герпеса 1-го, 2-го типа. Лечение не проводилось. Роды в срок, масса при рождении 3500 г, длина 51 см. К груди приложен сразу, сосал активно, грудное вскармливание до года, прикормы вводились в 5 и 6 месяцев. Адаптация к пище нормальная. В массе прибавки достаточные, в 2 г. 5 мес — масса 14 кг 810 г, рост 93 см.
Состояние здоровья в течение первого года жизни неблагополучное. Длительно держалась желтуха, в возрасте 3 недель: общий билирубин — 315,1 мкмоль/л, непрямой — 297,3 мкмоль/л, прямой — 17,8 мкмоль/л. Одновременно с желтухой был неустойчивый стул. В 1-месячном возрасте неврологом установлен диагноз перинатального поражения ЦНС, гипоксическо-ишемического генеза, гипертензионный синдром.
К возрасту 6 мес были обнаружены изменения в гемограмме: гемоглобин — 112 г/л, эритроциты — 4,2 × 10 12 /л, лейкоциты — 7,8 × 10 9 /л, сегментоядерные нейтрофилы — 12%, лимфоциты — 67%, моноциты — 12%, эозинофилы — 8%, базофилы — 1%, СОЭ — 3 мм/час. В повторных анализах крови во 2-м полугодии продолжала выявляться нейтропения. Консультирован гематологом, установлен диагноз доброкачественной нейтропении детского возраста. В 10 мес в анализе крови выявлена анемия (гемоглобин — 107 г/л, эритроциты — 3,81 × 10 12 /л, цветовой показатель — 0,84, тромбоциты — 280 × 10 9 /л, сегментоядерные нейтрофилы — 11%, лимфоциты — 76%, моноциты — 90%, эозинофилы — 3%, базофилы — 1%). Гематологом назначено лечение Сорбифером дурулесом, курс 1 месяц.
Осмотрен ортопедом: отмечено ограниченное отведение бедер. В один год на УЗИ органов брюшной полости определялся перегиб в области шейки желчного пузыря, холестаз. Осмотр генетика: диагностирована недифференцированная дисплазия соединительной ткани с поражением костно-мышечной системы. В 1 г. 5 мес перенес острый энтероколит неуточненной этиологии, госпитализировался в стационар на 10 дней, получал лечение метронидазолом и Энтеролом. В течение 1,5 лет переносит частые ОРВИ с повышением температуры до 38,8 °С в течение 3–4 дней и катаральными явлениями.
Объективные данные. При последней госпитализации отмечались явления назофарингита в течение 5 дней, лихорадка до 39 °С 2 дня, кожные покровы без сыпи. При осмотре — гиперемия зева и увеличение подчелюстных, передних и заднешейных лимфоузлов, стул учащенный до 3 раз в сутки, с 5 дня лечения — оформленный. ЛОР-врачом диагностирован хронический тонзиллит и аденоидит, в фазе обострения.
Обследование. В мазке из зева — высев гемолитического стрептококка. Посевы на патогенную кишечную флору отрицательные. ИФА на ротавирус — отрицательный. Реакция непрямой гемагглютинации (РНГА) с кишечными диагностикумами — отрицательные.
Гемограмма при поступлении: гемоглобин 104 г/л, эритроциты — 3,7 × 10 12 /л, цветовой показатель — 0,85, лейкоциты — 6,4 × 10 9 /л, палочкоядерные нейтрофилы — 4%, сегментоядерные — 72%, лимфоциты — 18%, моноциты — 4%, эозинофилы — 2%, СОЭ — 4 мм/час.
Гемограмма в динамике: гемоглобин — 109 г/л, эритроциты — 3,4 × 10 12 /л, лейкоциты — 7,8 × 10 9 /л, палочкоядерные нейтрофилы — 19%, сегментоядерные — 42%, лимфоциты — 28% (широкоплазменные лимфоциты), моноциты — 8%, плазматические клетки — 1%, эозинофилы — 2%, СОЭ — 13 мм/час. В дальнейшем — красная кровь оставалась без динамики, число лейкоцитов не изменялось, нарастал лимфоцитоз до 43% (широкоплазменные формы), моноцитов до 12%, СОЭ повысилась до 20 мм/час.
Анализ мочи без отклонений от нормы (пятикратно). В биохимическом анализе крови — умеренная гипоальбуминемия, печеночные пробы — в норме. ИФА на специфические антитела к антигенам ЦМВ класса IgM — отрицательный, класса IgG — положительный. Маркеры ДНК-ЦМВ в осадке мочи и в секрете из зева методом ПЦР не найдены. ИФА на специфические антитела к хламидийному антигену (Chlamydia pneumoniae) — положительный в титре 1:80. Маркеры ДНК Ch. pneumoniae в мазке из носоглотки методом ПЦР — положительный. ИФА с микоплазменным антигеном — IgM и IgG — отрицательные, с герпес-вирусами 1-го, 2-го типа — IgM и IgG отрицательные. ИФА на специфические антитела к антигенам ВЭБ: IgM к капсидному антигену — отрицательный, IgG к раннему антигену — положительный и IgG к ядерному антигену (IgGNA) — положительный (> 0,5 ед.). Совокупность данного анализа была индикатором активной фазы мононуклеозной инфекции.
После проведенного обследования ребенку была назначена адекватная комплексная терапия (Cумамед, Ликопид с последующим переходом на Виферон, витамины А, Е, Пиридоксин, пробиотики — курс Примадофилуса). Наблюдение за ним продолжается.
Выводы
- В пользу диагностики персистирующих инфекций у детей свидетельствует отягощенный акушерско-гинекологический и соматический анамнез, а также инфекционный фактор беременных женщин.
- Заподозрить внутриутробное инфицирование у детей раннего возраста можно по высокой степени поражения различных органов и систем: ЦНС, органов дыхания, пищеварения, лимфатического аппарата.
- Диагностика внутриутробных инфекций должна базироваться на клинических проявлениях болезни и основываться на комплексе лабораторных и иммунологических методов исследования с их оценкой в динамике (в 1 мес, 3 мес, 6 мес и в 1 год жизни).
- Правильность выбора комплекса клинических и лабораторных тестов (ИФА в динамике, ПЦР-тесты с различными биосубстратами) приводит к своевременной диагностике внутриутробных инфекций и позволяет выявить моноинфицирование или микст-формы при их длительной персистенции.
- Для суждения о состоянии общей иммунологической реактивности детей с персистирующими герпесвирусными инфекциями может использоваться оценка интегральных показателей (КФЗ и ИЛМП): чем меньше величина КФЗ, тем больше выражен риск прорыва защитного барьера на пути инфекции.
- Наиболее неблагоприятное персистирующее течение имеют микст-формы герпесвирусной инфекции (ЦМВ, герпес, ВЭБ) или их сочетания с внутриклеточными возбудителями.
Литература
Ф. Н. Рябчук, кандидат медицинских наук, доцент
З. И. Пирогова, кандидат медицинских наук, доцент
СПбМАПО, Санкт-Петербург
Лейкопения, нейтропения, агранулоцитоз, гранулоцитопения – это тяжелый синдром, при котором наблюдается снижение количества белых телец в крови. Симптомы и лечение лейкопении разнятся в зависимости от причины, вызвавшей нарушение формулы крови.
Лейкоциты выполняют защитные функции
Лейкопения – что это такое?
Нейтропения – это общее снижение показателей лейкоцитов в крови ниже 1,5х109/л. Агрануцитоз является более тяжелой формой заболевания. Количество белых клеток в этом случае составляет не более 0,5х109/л, в тяжелых случаях диагностируют полное отсутствие лейкоцитов.
По МКБ 10 синдрому присвоены коды от D70 до D72.9 в зависимости от этиологии заболевания. Тяжелые формы патологии встречаются у 1 пациента из 100 тыс. человек, врожденные – 1 на 300 тыс.
Норма белых телец в крови человека
Функция белых клеток крови – это защита организма от воздействия патогенной флоры, контроль над ростом собственной микрофлоры, ограничение перемещения патогенов из очага воспаления в прочие ткани. Количество белых кровяных телец зависит от возраста пациента.
Физиологическая норма для различных групп пациентов в анализе крови:
- у взрослых, у детей от года и до 16 лет – более 1500;
- у новорожденного – первые-третьи сутки – более 1000;
- у грудничка первого года жизни – более 1000.
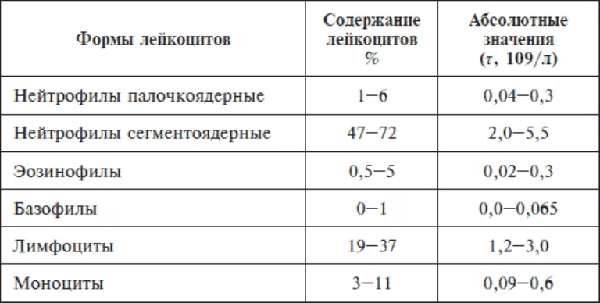
Форма лейкоцитов и их содержание в крови
Методика обработки биологического материала может варьироваться в зависимости от оснащенности лаборатории. Но на бланке указываются нормальные значения показателей. Поэтому сверить результаты достаточно просто.
Причины заболевания
Пониженные лейкоциты не всегда свидетельствуют о развитии нейтропении. У ребенка младшего возраста это может быть физиологической нормой и не требовать коррекции.
Причины низкого уровня лейкоцитов патологического генеза:
- Врождённые формы лейкопении – нарушения в генной структуре.
- При раке – использование агрессивных форм лечения – токсических препаратов для химиотерапии, облучения.
- Апластическая анемия – вторичное приобретенное нарушение кроветворения.
- Дефицит витамина В12, фолиевой кислоты, меди, метаболические расстройства, связанные с обменом и накоплением гликогена.
- Инфекционные заболевания, ОРВИ грибковые инвазии, аутоиммунные процессы, поражение простейшими микроорганизмами, протекающие в тяжелой форме. При бактериальной инфекции, вызванной вирусами Эпштейна-Барра, цитомегаловирусом, ВИЧ, гепатитом, парвовирусом В19, вирусом краснухи показатели лейкоцитов крови будут меньше нормы.
- Использование некоторых лекарственных препаратов при терапии воспалительных и инфекционных процессов, антидепрессантов, средств для лечения кардиопатологий.
- Отравление солями тяжелых металлов, соединениями мышьяка, ртути, золота.
- Туберкулез в острой стадии.
- Длительный контакт с пестицидами, инсектицидами, опасными химическими соединениями.
Вирус Эпштейна-Барра снижает уровень лейкоцитов в крови
Лейкопения развивается вследствие нарушения продукции, обмена или перераспределения белых клеток крови. Место разрушения белых телец зависит от причин, вызвавших заболевание.
Нейтрофилы образуются в костном мозге. Негативные воздействия на эту структуру приводят к гибели молодых активно делящихся клеток. При лейкопении, резвившейся на фоне апластической анемии, продукция белых телец не нарушена, но они неполноценны и неспособны к делению.
Лейкопения при паразитических инвазиях возникает из-за гибели лейкоцитов в селезёнке. При ВИЧ вирусе поражаются все клетки костного мозга, снижается их активность. Итогом является пониженное число продукции нейтрофилов.
Низкие лейкоциты на фоне медикаментозной терапии, не связанной с лечением раковых заболеваний обусловлены токсическими, иммунными, аллергическими механизмами развития.
Симптомы пониженных лейкоцитов
Нейтропения не обладает выраженной симптоматикой. О снижении уровня белых телец свидетельствует присоединение бактериальной, вирусной или грибковой инфекции как осложнение основного заболевания.
Скорость снижения количества лейкоцитов способствует увеличению риска развития инфекционных осложнений. При вялотекущей, хронической нейтропении вероятность присоединения бактериальных патогенов ниже, чем при остром, транзиторном падении уровня белых телец.
Повышение температуры тела часто является единственным диагностическим признаком лейкопении. Если пациент в составе комплексного лечения получает кортикостероидные препараты, то этот симптом может отсутствовать.

Повышенная температура основной признак лейкопении
У пациентов наблюдается лихорадочное состояние. При этом очаг инфекционного или бактериального поражения не обнаруживают. Микробиологическими способами в 25% случаев доказать наличие патогенной флоры не представляется возможным.
Нейтропению на фоне агрессивного лечения раковых заболеваний отличают от инфекционного процесса по специфической симптоматике.
Признаки лейкопении после химиотерапии, лечения цитостатиками:
- увеличение печени;
- стоматиты с образованием афт и изъязвлений;
- отечность слизистой ротовой полости;
- энтероколиты, в том числе и некроз участков кишечника;
- черный стул, боли в эпигастрии, повышенное газообразование при поражении системы ЖКТ;
- появление грибковой флоры;
- в тяжелых случаях – сепсис, септический шок;
- парапроктит;
- у женщин – нарушение менструального цикла, увеличение количества крови выделяющейся в течение менструации, нерегулярность месячных, склонность к маточным кровотечениям.
Виды лейкопении
В основу классификации нейтропении положены длительность синдрома относительно его начала, наличие и тяжесть возможных осложнений.
По времени появления первых симптомов различают:
- врождённая патология;
- приобретенная.
По длительности:
- острый процесс – длится не более 3 месяцев;
- хроническая форма – снижение уровня белых телец наблюдается более 2 месяцев.
По наличию осложнений – чем ниже показатели лейкоцитов в крови, тем выше вероятность развития тяжелых осложнений и летального исхода. 
Чем ниже уровень белых телец, тем выше шанс развития тяжелых заболеваний
Классификация лейкопении по этиологии патологического процесса и заболевания, провоцирующие это состояние:
- Нарушение продукции белых телец в косном мозге – происходит при генетических заболеваниях, опухолевых процессах, дефиците витаминов, применении некоторых лекарственных препаратов, при анапластической анемии.
- Высокая степень разрушения лейкоцитов в тканях – развивается при аутоиммунных и вирусных заболеваниях, при лечении цитостатиками и препаратами химиотерапии, прохождение гемодиализа или использование аппарата ИВЛ.
Степени заболевания
Степень патологического процесса определяется по результатам анализа крови.
| Количество нейтрофилов | Степень нейтропении | Вероятность развития бактериальных осложнений |
| 1–1,5*109/л | Легкая | Минимальная |
| 0,5–1109/л | Средняя | Средняя |
| Менее 0,5109/л | Тяжелая | Высокая |
Диагностика
Диагностические мероприятия начинают с исследования крови. При этом подсчитывают абсолютное количества нейтрофилов. Дополнительно определяют число эритроцитов и тромбоцитов. Изменение показателя нейтрофилов одновременно с изменением количества красных кровяных телец свидетельствует об онкопатологии крови.
Для определения механизма развития синдрома проводят забор костного мозга. Это позволяет выяснить, на каком этапе происходит гибель нейтрофилов – снижение выработки в костном мозгу, высокая скорость разрушения в крови.
Для определения механизмов заболевания может понадобиться забор костного мозга
При синдроме неясного генеза назначают следующие исследования:
- определение ревматоидного фактора;
- наличие антинуклеарных и антигранулоцитарных антител;
- проведение печёночных проб;
- определение дефицита цианокобаламина в крови.
Особое внимание врач должен обратить на лекарственные препараты, которые пациент принимает на постоянной основе.
Лечение лейкопении в домашних условиях
Быстро повысить содержание белых телец в домашних условиях не получится. Согласно протоколам ВОЗ пациент подлежит экстренной госпитализации в стерильный бокс. Персонал должен соблюдать правила асептики.
Специализированной терапии лейкопении не существует. Проводят лечение основного заболевания. Кроме этого, показана превентивная терапия бактериальных, грибковых и вирусных осложнений.
Что делать и какие лекарства принимать?
Дополнительно при низких лейкоцитах используют 2 группы препаратов:
- Стимуляторы иммунных и обменных процессов в клетке.
- Метилурацил – 4 раза в день по 500 мг в таблетированной форме, 2–3 раза в день для суппозиториев. Из побочных эффектов – только изжога, головная боль, частные позывы в туалет.
- Лейкоген – назначают при нетяжелой форме заболевания в составе комплексной терапии. Принимают по 1 таблетке 4 раза в день, дети – 3 раза в день. Курс составляет не менее 1 месяца. Из побочных эффектов – только аллергические реакции.
Метилурацил средство при пониженных лейкоцитах в крови
- Стимуляторы продукции белых телец в костном мозге:
- Нейпоген – препарат для лечения тяжелой формы заболевания. Применяется на фоне и по окончании химиотерапии, при ВИЧ-инфекции, врожденных формах, при неэффективности прочих методов лечения. Выпускается в виде раствора для внутривенных инфузий. Длительность терапии определяет врач, опираясь на результаты анализов крови. В течение 2 суток после последней инфузии уровень белых телец не должен снижаться.
- Лейкомакс – препарат стимулирует продукцию белых телец в костном мозге. Показан при тяжелых иммунных расстройствах, ВИЧ, герпесе на фоне СПИДа. При лейкопении назначают при неэффективности прочего лечения. Раствор вводится подкожно. Длительность курса терапии зависит от количества лейкоцитов в анализе крови.
Важно!Препараты 2 группы имеют обширный список противопоказаний и побочных эффектов. Поэтому самоназначение строго запрещено!
Рецепты из народных травников являются дополнительным способом лечения. Заменять ими средства официальной медицины опасно для здоровья.
Трава полыни, настойка прополиса на спирту являются препаратами официальной медицины.
Рецепт из расчета на 1 прием:
- Одну чайную ложку растительного сырья залить 1 стаканом кипящей воды.
- Закутать и оставить до полного остывания.
- В холодный отвар добавить 15 капель настойки прополиса.
- Принимать перед едой.

Отвар из полыни и прополиса помогает нормализовать уровень лейкоцитов в крови
Для изготовления лекарственного отвара требуется цельный неочищенный овес.
Рецепт:
- Две столовые ложки зерен овса залить 0,5 л воды. Томить на малом огне 15 минут.
- Закутать и остудить.
- Принимать по полстакана 3 раза в день.

Для отвара нужен цельный овес
Шиповник приобретайте в аптеках. Не собирайте у дорог или в черте города.
Рецепт:
- Истолочь сухие ягоды в мелкую крошку.
- Чайную ложку измельченного сырья залить 1 стаканом кипятка. Томить 15 минут на огне.
- Закутать и оставить настаиваться.
- Принимать по 2 столовые ложки отвара 3 раза вдень.

Перед приготовлением отвара шиповник нужно измельчить
Все травы имеют противопоказания и побочные эффекты. Поэтому любое средство из травника согласовывайте с врачом.
Специализированной диеты при низких показателях белых телец в крови не существует. Пациент должен придерживаться принципов здорового питания.
Не следует употреблять в пищу тяжелые, жирные продукты, злоупотреблять специями. Алкоголь, кроме небольшого количества красного вина – под категорическим запретом.
В рационе должны присутствовать овощи в любом виде, кроме жареных. Картофель придется ограничить. Прочие продукты растительного происхождения (бобовые, корнеплоды, капусту, ягоды, фрукты) без ограничений.

При лейкопении нужно употреблять больше овощей
Кисломолочные продукты, творог, нежирные сорта сыра – их потребление не ограничено. Жирное мясо следует заменить индейкой или курицей. Доказан хороший клинический эффект при употреблении морепродуктов, икры.
Чем опасна лейкопения?
Лейкопения – опасный синдром. Лейкоциты являются защитником, сторожевой клеткой организма. Низкий уровень белых телец делает организм беззащитным перед вирусами, патогенной флорой, грибковыми инфекциями и последствия не заставят себя ждать.
Без лечения синдрома дефицита нейтрофилов пациенту грозит почечная недостаточность, летальный исход от сепсиса и прочих бактериальных инфекций. Летальность зависит от формы патологии, наличия сопутствующих заболеваний, реакции организма на лечение, общее состояние пациента и варьируется от 4 до 40% случаев.
Профилактика недостатка лейкоцитов
Профилактику лейкопении, спровоцированной химиотерапией, не проводят. В остальных случаях общие рекомендации сводятся к качественному лечению инфекционных и вирусных заболеваний, соблюдению правил здорового питания.
Врачи, в том числе Комаровский настоятельно советуют вести активный образ жизни, гулять на свежем воздухе при любой погоде.
Читайте также:


