Клетки мишени для вируса гриппа
Инфекционный цикл вирусов гриппа начинается с контакта вирусной частицы с клеточной поверхностью. При этом рецепторсвязывающий карман НA связывает концевой остаток сиаловой кислоты в клеточном олигосахариде. В контакте участвует одновременно несколько тримеров НA. Затем участок клеточной поверхности (покрытая клатрином "ямка") углубляется, отшнуровывается от поверхности клетки и в цитоплазме сливается с эндосомой . Вирусная частица, находящаяся на стенке эндосомы, подвергается воздействию кислой реакции среды, что приводит к структурной перестройке НA. Участки длинной альфа-спирали в составе малой субъединицы НA перестраиваются таким образом, что гидрофобный N-концевой пептид ("пептид слияния") оказывается в непосредственном контакте с липидным слоем клеточной мембраны. Происходит слияние липидных слоев, и нуклеокапсид выходит в цитоплазму. За время пребывания в эндосоме внутренняя среда вириона делается все более и более кислой благодаря перекачке ионов Н+ из эндосомы в вирион, осуществляемой через канал тетрамера М2 . Закисление среды вызывает диссоциацию связи нуклеокапсида с белком М1 и позволяет нуклеокапсиду не только перейти в цитоплазму, но и транспортироваться в ядро клетки.
Каждый сегмент вирусной РНК оказывается в клеточном ядре в составе рибонуклеопротеидного тяжа, в котором вирусная РНК ассоциирована с белком NP . Каждый рибонуклеопротеидный тяж содержит, по меньшей мере, один тример РВ1 - РВ2 - РA , присоединенный к двум концам вирусной РНК. Прежде чем начать транскрипцию вирусной РНК, этот тримерный полимеразный комплекс связывает, а затем отщепляет 5'-концевой участок клеточной пре-мРНК длиной 10-13 н.о., содержащий на 5'-конце кэп, т.е. метилированный остаток гуанозина , присоединенный пирофосфатной связью. При этом распознавание и связывание кэпа осуществляет белок РВ2, а эндорибонуклеазное отщепление на расстоянии 10-13 н.о. от кэпа - белок РВ1. Отщепленные кэп-содержащие отрезки используются в качестве праймеров для вирусной транскрипции. При этом собственно функцию праймера выполняет только З'-концевой аденозиловый остаток праймера, который вступает в контакт с З'-концевым уридиловым остатком вирусного РНК-сегмента. Инициация транскрипции осуществляется посредством включения гуанозилового остатка, комплементарного предпоследнему цитозиловому остатку РНК-сегмента, в растущую цепь вирусной мРНК. Таким образом, в составе мРНК оказывается 10-13-нуклеотидный кэпированный праймер клеточного происхождения, за которым следует вирусспецифическая последовательность, комплементарная вирусному геномному сегменту (начиная с предпоследнего нуклеотида на его З'-конце).
Далее происходит элонгация цепи мРНК. Как инициацию транскрипции, так и элонгацию осуществляет белок РВ1 . Продвигаясь по нити геномной РНК от ее З'-конца к 5'-концу, полимеразный комплекс постоянно сохраняет связь с 5'-концом геномного РНК-сегмента, постепенно уменьшая петлю, образованную еще не транскрибированным участком. В каждом геномном РНК-сегменте имеется короткий (6-8 н.о.) олигоуридиловый участок на расстоянии 16 н.о. от 5'-конца. Полимераза, дойдя до этого места, не может продвинуться дальше, поскольку последний отрезок вРНК (5'-концевые 16 н.о.) находится в связи с самим полимеразным комплексом и для транскрипции механически недоступен. Поэтому полимераза останавливается и повторно транскрибирует несколько раз олигоуридиловый участок, синтезируя роlу(A)-последовательность на З'-конце мРНК. Таким образом, в составе любой молекулы вирусной мРНК присутствует на 5'-конце 10-13-нуклеотидный участок клеточного происхождения, но отсутствует на З'-конце участок, комплементарный 5'-концевому 16-нуклеотидному отрезку вРНК.
Вирусспецифические мРНК транспортируются из ядра в цитоплазму. Некоторые мРНК, транскрибированные с генов М и NS , предварительно подвергаются сплайсингу . В цитоплазме мРНК транслируются с образованием вирусных белков. Белок NP, белки полимеразного комплекса, белки NS1 и NS2 и, частично, белок M1 транспортируются в ядро. После достижения в ядре определенной концентрации белка NP вирусный полимеразный комплекс приобретает способность синтезировать полные комплементарные копии вирусных РНК-сегментов, не содержащие клеточных праймерных последовательностей, но содержащие участок, комплементарный последним 16 н.о. вирусного РНК-сегмента. Такие полные комплементарные транскрипты (кРНК) сразу после синтеза вступают в ассоциацию с белком NP. Они, в отличие от мРНК, не транспортируются в цитоплазму, а остаются в ядре и используются вирусной РНК-полимеразой в качестве матриц для синтеза новых геномных РНК, т.е. для репликации вирусного генома. Новые геномные РНК, в свою очередь, подвергаются транскрипции с образованием основной массы вирусных мРНК. На поздней стадии инфекции новые нуклеокапсиды, содержащие вРНК, выходят в цитоплазму. В этом процессе принимают участие белки M1 и NS2 в ассоциации с клеточными белками, осуществляющими экспорт клеточных макромолекул в цитоплазму через ядерные поры.
Белки НA и NA синтезируются рибосомами , которые связаны с грубым цитоплазматическим ретикулумом . Эти белки сразу после синтеза попадают в просвет внутриклеточных везикул и транспортируются к поверхности клетки, подвергаясь при этом гликозилированию и фолдингу . Белки M1 (те молекулы, которые не попадают в ядро) и М2 синтезируются на свободных рибосомах, но тоже после синтеза связываются с внутриклеточными мембранами и транспортируются к поверхности клетки. На поздней стадии инфекции значительная часть клеточной поверхности занята вирусспецифическими "пятнами", в которых наружный слой образован трансмембранными вирусными белками, а внутренний - белком М1. Клеточные белки из этих участков полностью вытеснены. Новосинтезированные вирусные рибонуклеопротеиды транспортируются к этим "пятнам", и здесь происходит почкование новых вирусных частиц.
Подбор вирусных РНК-сегментов в состав вириона является высокоупорядоченным процессом, в ходе которого в каждую вирусную частицу попадает по одной копии геномного сегмента. Взаимное распознавание геномных сегментов в ходе этого процесса осуществляется с участием длинных З'-концевых и 5'-концевых участков вРНК, захватывающих обширные области кодирующей последовательности РНК-сегментов.
Сегментированный характер генома позволяет вирусам гриппа при смешанном заражении разными вирусами одного и того же рода легко образовывать гибридные вирусы-реассортанты. Реассортанты определенного генного состава можно получить в лабораторных условиях. В природе тоже образуются реассортантные вирусы. Именно в результате реассортации вируса гриппа человека и вируса гриппа птиц возникли вирусы гриппа A , вызвавшие пандемии в 1957 и 1968 г. Возможен и прямой переход вируса от птиц к млекопитающим.
Вирус, вызвавший пандемию в 1918 г., не был реассортантом, возникшим при скрещивании вирусов гриппа человека и птиц. Все его гены сходны с генами вирусов гриппа птиц. В настоящее время во многих странах циркулирует высоковирулентный вирус гриппа птиц субтипа H5N1 , способный передаваться от птиц человеку и вызывать тяжелое заболевание с высокой смертностью, но не передающийся от человека к человеку. Вирус H5N1 возник в результате реассортации разных вирусов гриппа птиц. Ведется постоянное наблюдение за циркуляцией и эволюцией вируса субтипа H5N1.
Именно эта особенность вируса лежит в основе эффективного механизма, защищающего его от иммунной системы человека, поскольку приводит к появлению таких штаммов, с которыми не могут связываться антитела, ранее наработанные в организме в ответ на инфекцию или вакцинацию. Мутантный штамм поэтому активно размножается до тех пор, пока в организме не будут выработаны новые специфичные антитела.
Молекулярные механизмы, обеспечивающие проникновение вируса внутрь клетки-мишени, до сих пор остаются предметом многих научных исследований. Главная цель последних – помочь в разработке лекарственных препаратов, способных предотвратить инфицирование клетки вирусом. Остановить болезнь на начальной стадии крайне важно – это означает не дать вирусной частице создать армию своих клонов, готовых к заражению других здоровых клеток.
В настоящее время в связи с возможностью новой пандемии гриппа, причиной которой может стать мутированный штамм так называемого птичьего гриппа, исследования вируса гриппа типа А (к нему относится большинство штаммов гриппа млекопитающих и птиц) приобрели еще большую актуальность. Создание новых эффективных средств профилактики и лечения этого заболевания требует глубокого понимания сложных механизмов межмолекулярных взаимодействий, процессов регуляции работы генов как вируса, так и организма хозяина.
В лаборатории теоретической генетики ИЦиГ СО РАН компьютерные методы и подходы в эволюционной биологии и протеомики (науки о белках) активно развиваются в течение последних 15 лет. Одним из важнейших объектов исследований в настоящее время стал вирус гриппа А, точнее – гемагглютинин, один из его поверхностных белков.
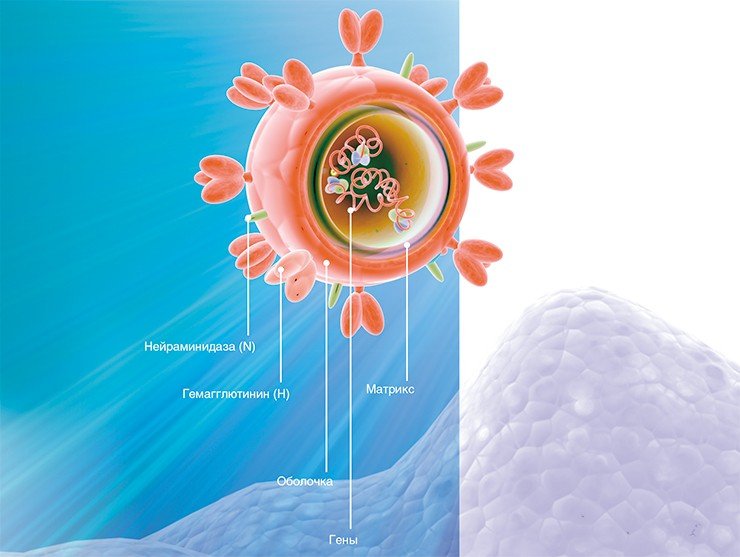
Генетический материал вируса защищен оболочкой из особого белка, вокруг которой располагается мембрана из липидов (жироподобных веществ). В ней удерживаются молекулы трех белков: гемагглютинина, нейраминидазы и белка М 2, формирующего особые ионные каналы. При помощи гемагглютинина вирус прикрепляется к клеточной мембране, а нейраминидаза ее разрушает, открывая вирусу путь внутрь клетки. Затем внутри вириона-захватчика благодаря ионным каналам изменяется кислотность среды (pH), чем создаются условия для освобождения генетического материала из вирусной капсулы.
Что увидел компьютер
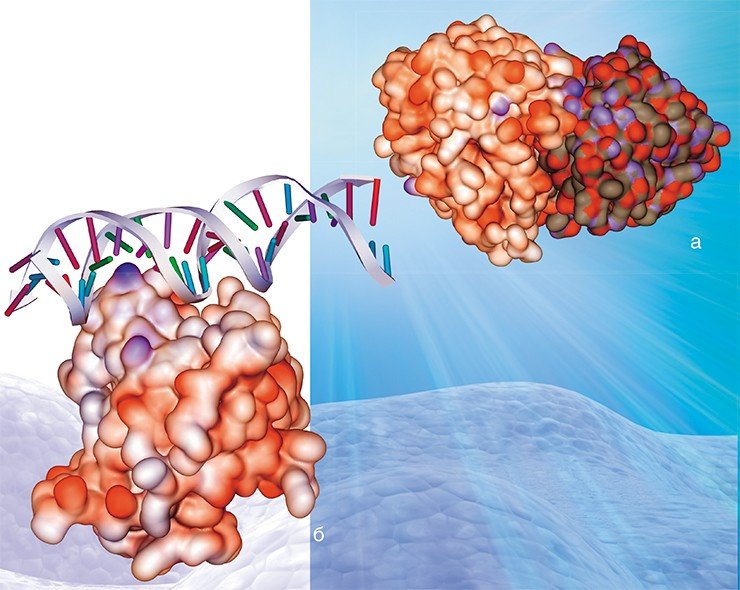
В принципе белковые молекулы могут взаимодействовать с другими молекулами самой разной природы: с макромолекулами, в числе которых могут быть белки или нуклеиновые кислоты, носители генетической информации; с низкомолекулярными соединениями; а также с различными ионами. И в этом смысле белки вирусов ничем не отличаются от белков других живых организмов, в том числе человека.

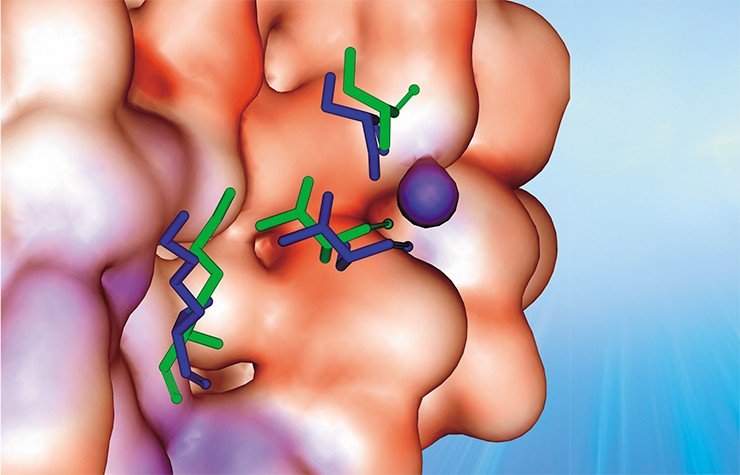
Возможно, именно эти свойства гемагглютинина позволяют вирусу гриппа с легкостью ускользать от нашей иммунной системы, обеспечивая его высокую эпидемичность. Аргументом в пользу этого соображения является тот факт, что выявленные участки связывания ионов практически перекрываются с участками расположения антигенных детерминант.
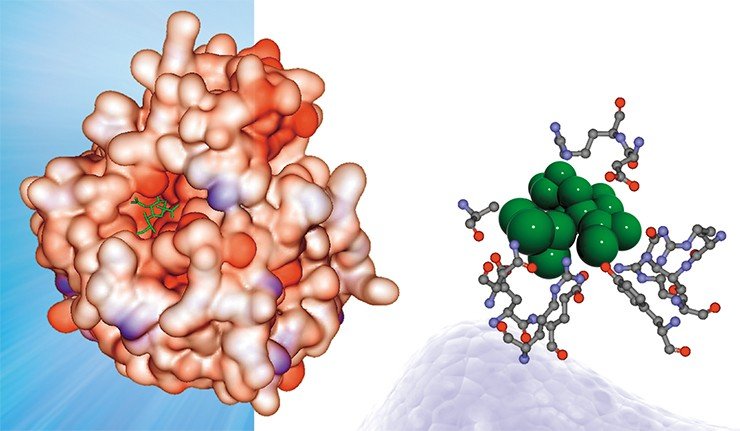
В лаборатории теоретической генетики ИЦиГ СО РАН создана база данных (PDBSite), содержащая информацию о пространственных структурах более чем 30 тыс. различных функциональных участков (сайтов) белков, включая каталитические центры ферментов, сайты взаимодействий белок–белок, белок–ДНК/РНК, белок–лекарственные препараты и т. д. В базе в удобном для поиска и использования виде хранятся данные о физико-химических, структурных и эволюционных характеристиках этих сайтов, полученные с помощью компьютерного анализа экспериментально расшифрованных комплексов. Эти сведения успешно используются для распознавания функциональных сайтов в пространственных структурах малоизученных белков путем определения их структурного сходства с известными. Например, в результате анализа структуры гемагглютинина – поверхностного белка вируса гриппа – выяснилось, что один из его участков схож с сайтом связывания сульфат-иона (SO4), что свидетельствует о потенциальной способности этого белка связываться в этом участке с сульфат-ионом
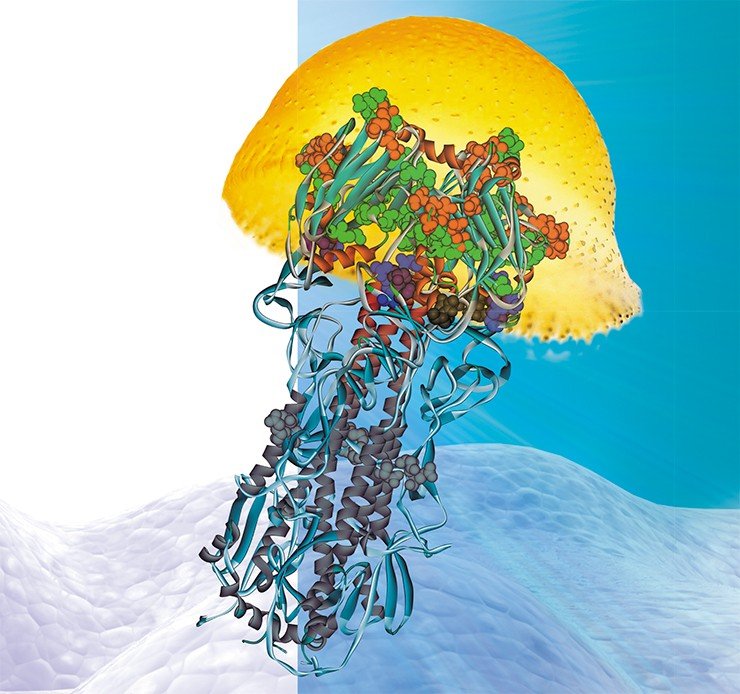
В пространственной структуре поверхностного белка вируса гриппа обнаружено множество сайтов связывания различных ионов (а также потенциальных мест такой посадки), благодаря чему вокруг вируса может формироваться своеобразный ионный щит, защищающий его от атак иммунной системы
Высказанные нами предположения, позволившие сформировать новый взгляд на проблему механизмов защиты вирусов от атаки иммунной системы организма-хозяина, а также обнаружить новых молекулярных участников, задействованных в процессе проникновения вируса внутрь клетки, безусловно, требуют дальнейшего анализа и экспериментальной проверки.
Однако то, что ионы могут быть важными факторами, регулирующими жизненный цикл вируса гриппа, уже не вызывает сомнения. Как и то, что исследования подобных молекулярных механизмов будут содействовать открытию новых фармакологических мишеней и созданию эффективных вакцин и лекарственных препаратов.
Вопреки распространенному заблуждению коронавирус не появился из ниоткуда, как черт из табакерки. Сьюзен Вайс, профессор кафедры микробиологии из Пенсильванского университета, изучает коронавирусы уже около 40 лет.
- Когда я начинала ими заниматься на меня смотрели с сожалением, как смотрят на чудаков, которые делают ставку на заведомого аутсайдера, - рассказала Сьюзен Вайс изданию The Atlantic. - Считалось, что коронавирусы не оказывают заметного влияния на здоровье людей. Семейство коронавирусов, которые передаются человеку, состояло из 6 штаммов. Четыре из них— OC43, HKU1, NL63 и 229E открыты достаточно давно и вызывают треть общих простудных заболеваний (среди них банальный насморк), они переносятся достаточно легко. Два других члена семейства MERS-CoV (коронавирус, вызывающий ближневосточный респираторный синдром) и SARS-CoV (стал причиной вспышки атипичной пневмонии в Китае в 2002 году) вызывают гораздо более тяжелые заболевания. Но когда появился SARS-CoV-2 (так называется сам вирус), спровоцировавший пандемию Covid-19 (название болезни, которую вирус вызывает), уже никто не будет относиться к коронавирусам свысока.
Какая мутация сделала вирус убийцей
Однако почему именно седьмой коронавирус оказался таким опасным и агрессивным?
Ключ к ответу таится в структуре вируса. По форме он представляет колючий шар. Его шипы цепляются к белку под названием ACE2, который находится на поверхности наших клеток, выстилающих оболочку органов дыхания. В отличие от своего предшественника SARS-classic, (он причина вспышки атипичной пневмонии 2002 года), SARS-CoV-2 образно говоря обзавелся шипами новой конструкции. Их можно грубо сравнить с раздвоенным наконечником стрелы. Такие стрелы в старину делали, чтобы нанести максимальный урон противнику: тормозя на огромной скорости в теле жертвы, лепестки наконечника стрелы раскрывались, разрывая плоть и застревая в теле жертвы. В SARS-classic эти шипы раскрывались плохо (а только так вирус мог проникнуть в клетку жертвы) поэтому число заболевших было невелико - 8096 случаев заболевания в 29 странах, умерли 774 человека.
Однако в SARS-CoV-2 скрепляющее соединение, которое держало раздвоенные наконечники шипа вместе, легко растворялось ферментом под названием фурин, он вырабатывается в организме человека. “Колючки” вируса, как репей, впивались в свою мишень - белок ACE2, и проникали в клетку.

Модель вируса SARS-CoV-2. Фото: ru.wikipedia.org
- Такая конструкция имеет решающее значение для передачи от человека к человеку, - считает Ангела Расмуссен из Колумбийского университета. - Она позволяет SARS-CoV-2 сильнее прилипать к клеткам, которые он атакует. В общих чертах это означает, что ему необходима значительно меньшая концентрация вирусов, чтобы инфицировать организм.
Почему 80 процентов людей болеют бессимптомно, а в группе риска высокая смертность
Другая особенность седьмого коронавируса заключается в его “всеядности”. Большинство респираторных вирусов имеют специализацию: они атакуют либо верхние, либо нижние дыхательные пути. Заболеваниями верхних дыхательных путей люди страдают чаще, но переносят легче. В то же время инфекции нижних дыхательных путей (бронхи, трахея и легкие) труднее передается, но приводят к более тяжелым последствиям. Новый коронавирус вероятнее всего не так избирателен: он поражает и верхние и нижние дыхательные пути. Эта особенность объясняет, почему 80 процентов людей переносят коронавирус бессимптомно и сами того не подозревая являются “тайными агентами” по его распространению. А в случаях, когда вирус сумел пустить корни глубоко, течение болезни очень тяжелое и нередко приводит к воспалению легких.
Как COVID-19 убивает организм
Попав в организм коронавирус атакует клетки обладающие белком АСЕ2, которые выстилают наши дыхательные пути. По мере развития инфекции отмирающие клетки опускаются все ниже и попадают в легкие, перенося туда и вирус.
Когда легкие наполняются мертвыми клетками и жидкостью, затрудняется дыхание и начинается одышка - человек пытается частотой дыхания компенсировать недостаток кислорода.
Иммунная система в свою очередь предпринимает атаку на вирус, используя традиционные испытанные средства: чтобы доставить иммунные клетки к очагу заражения кровеносные сосуды расширяются, а проницаемость сосудов увеличивается. Эта борьба организма с инфекцией внешне проявляется в виде повышения температуры, воспаления, покраснения и отека тканей. Но проницаемость сосудов и приток крови приводят к тому, что легкие еще больше заполняются жидкостью. Защитная реакция иммунной системы переходит в неконтролируемую форму и несет угрозу самому организму.
Финальным аккордом саморазрушения организма является так называемый “ цитокинов ый шторм”. Цитокины - это молекулы, которые обеспечивают мобилизацию воспалительного ответа и активируют иммунные клетки. Но когда уровень цитокинов в крови становится запредельным, иммунная система идет вразнос принося организму больше вреда, чем сам вирус. Иммунные клетки уничтожают очаг воспаления вместе с тканями, но процесс воспаления распространяется на соседние участки. Постепенно этот иммунный шторм охватывает весь организм и может убить своего хозяина.
Такие самоубийственные неконтролируемые реакции иммунной системы провоцировала “испанка” - вирус гриппа, который в 1918 году унес жизни более 50 миллионов человек в мире. Этим же инструментом пользуются вирус Эболы, птичий грипп H5N1 и тяжелый острый респираторный синдром, который вызывал предшественник Covid-19. Но чем больше ученые узнают о SARS-CoV-2, тем больше шансов, что его удастся остановить.
ЧИТАЙТЕ ТАКЖЕ
Распространение коронавируса в мире: Хроника.
Крути педали, пока коронавирусы не догнали
Езда на велосипеде и другие физические упражнения помогут защититься от инфекции, а то и пережить её в случае чего (подробности)
На пороге сезона гриппа многие задумываются о прививках. Основной компонент противогриппозных вакцин – гемагглютинин. Специалисты Ростеха, главного поставщика таких препаратов в России, рассказали, что это за вещество, откуда оно берется и как помогает нашему иммунитету справиться с возбудителем.
В результате ежегодных эпидемий по всему миру гриппом заражаются 5 миллионов человек, из них до 500 тысяч погибают. В первую очередь в опасности дети и пожилые люди.
Орудие преступления и главная мишень для иммунной системы
Вирус гриппа – шар диаметром 100 нанометров (хотя встречаются и похожие на нити длиной 300 нанометров и больше). Внутри него спрятан генетический материал в виде РНК – рибонуклеиновой кислоты. Именно она, проникая в клетку, превращает ее в фабрику по производству новых вирусных частиц.
Если для вируса гемагглютинин и нейраминидаза – важные инструменты, то для организма человека это чужеродные частицы, антигены. Иммунитет умеет их распознавать с помощью антител, в результате чего развивается реакция, направленная на борьбу с инфекцией. Антитела против гемагглютинина не дают вирусу инфицировать клетки, а против нейраминидазы – выходить из клеток новым вирусным частицам. Причем, самым сильным антигеном является гемагглютинин. Именно он привлекает наиболее пристальное внимание иммунной системы. И это его свойство лежит в основе работы противогриппозных вакцин.
В 2009 году весь мир паниковал из-за эпидемии свиного гриппа, вызванной новым штаммом H1N1. Эти буквы как раз обозначают гемагглютинин (H) и нейраминидазу (N). Цифры рядом с ними указывают на подтипы этих веществ. Ученым известно 16 антигенных подтипов гемагглютинина (H1–16) и 9 подтипов нейраминидазы (N1–9). Они характерны для вируса гриппа A – он является самым распространенным и может инфицировать не только людей, но и животных.
Довольно часто встречается инфекция, вызванная вирусом гриппа B – она протекает немного легче и распространяется только среди людей. Однако, как и вирус гриппа A, он может вызывать серьезные осложнения. Все современные вакцины направлены против этих двух возбудителей. Есть еще вирус гриппа C – им тоже заражаются только люди, он встречается редко и вызывает легкие симптомы. Если говорить о вирусе A, то у людей чаще всего встречаются антигенные подтипы H1–3 и N1–2.
Как гемагглютинин применяют в вакцинах?
В зависимости от того, насколько сильно разрушен вирус, противогриппозные вакцины делятся на три вида. Цельновирионные – содержат целые инактивированные вирусы; расщепленные (сплит-вакцины) – содержат отдельные фрагменты вирусов, а субъединичные – поверхностные и внутренние антигены вируса.
Побочные эффекты после введения вакцины возможны, но они бывают очень редко. У некоторых людей повышается температура, возникает легкое недомогание и боли в мышцах. Иногда болит место укола. Это происходит из-за того, что иммунная система реагирует на антигены и вызывает воспалительный процесс. Обычно симптомы сохраняются один день, потом проходят.
Историческая справка
В XIX веке ученые активно пытались понять причину гриппа. Основными подозреваемыми были бактерии, но иногда высказывались и более экзотические теории о том, что болезнь вызывает пороховой дым, загрязнение воздуха, курение некачественных сигар. Только во время эпидемии 1918–1919 годов появились подозрения, что виновниками являются некие вирусы. Впервые они были выделены из носовой слизи больных людей (вирус гриппа A) в 1932 году английскими учеными Уилсоном Смитом, Кристофером Эндрюсом и Патриком Лейдлоу.
В 1936 году удалось получить нейтрализованные антитела, и начались испытания вакцины. Поначалу она защищала только от вируса A. Во время испытаний в 1942–1945 годах ученые обнаружили вирус B, и была создана двухвалентная вакцина (против двух возбудителей).
Большой вклад в развитие противогриппозных вакцин внесли советские ученые. Выдающийся русский вирусолог Анатолий Александрович Смородинцев, основавший Научно-исследовательский институт, который сейчас носит его имя, впервые в мире создал живую аттенуированную (ослабленную, — NS) вакцину против гриппа. Результаты его работы с соавторами были опубликованы в 1937 году в журнале American Journal of the Medical Sciences. Анатолий Александрович активно занимался вопросами комплексной профилактики гриппа, разработки живых ассоциированных вакцин, коллективного иммунитета к гриппу.
Во время очередной пандемии в 1978 году была создана трехвалентная вакцина против двух штаммов A и одного B. Наконец, в 2012 году появились четырехвалентные вакцины, которые и рекомендуется использовать сегодня.
Как производят вакцины против гриппа?
Есть разные технологии. Чаще всего, для того чтобы получить гемагглютинин, вирусы выращивают на куриных эмбрионах. В первую очередь важно понимать, от каких штаммов вируса нужна защита в текущем сезоне. Эксперты из Всемирной организации здравоохранения (ВОЗ) дважды в год проводят обзор мировой эпидемиологической ситуации и выпускают соответствующие рекомендации. Производители вакцин получают нужные штаммы из лабораторий ВОЗ.
Готовую вакцину нельзя сразу отправлять в больницы. Ее нужно протестировать с помощью реагентов, полученных из лаборатории ВОЗ. Обычно процесс занимает две недели. Сотрудники лаборатории проверяют, содержится ли в вакцине нужное количество антигена, нет ли посторонних примесей, насколько она безопасна, стерильна и так далее. Когда проверка окончена, препарат можно разливать по одноразовым шприцам. Каждый шприц повторно проверяют, чтобы убедиться, что он не поврежден, и в нем находится необходимая доза.
Опасны ли вакцины против гриппа для людей, у которых аллергия на яйца?
Даже после очень тщательной очистки в противогриппозной вакцине остается минимальное количество яичного белка. Теоретически это опасно для аллергиков, но на практике все не так однозначно. Еще в 1976 году в Америке было проведено крупное исследование, которое показало, что на 48 миллионов введенных доз вакцины описано 11 случаев тяжелой аллергической реакции – анафилаксии. Но ни один пациент не погиб. При этом, до прививки ни один из этих 11 людей не сказал, что у него есть аллергия на яйца.
По последним данным, анафилактические реакции на противогриппозные вакцины встречаются в одном случае на миллион. Если в препарате содержится не более 0,12 мкг/мл яичного белка, это считается безопасным даже для аллергиков. И все же людей, у которых были анафилактические реакции на куриные яйца, рекомендуется прививать в стационаре, где за их состоянием может наблюдать врач.
Производство гемагглютинина для противогриппозных вакцин – процесс сложный. Для него требуется высокотехнологичное оборудование. Производитель должен соблюсти массу требований и обеспечить тщательный контроль. Ситуация осложняется еще и тем, что во время пандемии может потребоваться очень много доз в короткие сроки.
Зачем прививаться каждый год?
— Вирусная или бактериальная инфекция — чем они различаются? Как понять, какую подхватил?
— Как отличить вирусную инфекцию от бактериальной? Прежде всего обратите внимание на то, есть ли у вас болезненные ощущения в носоглотке, как изменяется температура тела. Если горло сильно болит, першит, резкого повышения температуры нет — значит, вы имеете дело с бактериальным заражением. А вот высокая температура тела (выше 39 градусов) без признаков чёткой локализации боли — факт встречи с вирусами. Это два основных признака, по которым можно отличить природу возбудителей.
Следует сказать, что при вирусной инфекции дебют заболевания скоротечен и не имеет видимой причины, отмечается выраженная общая интоксикация. Это и боль позади глазных яблок, и боль в мышцах при движении. Если говорить об отделяемом из верхних дыхательных путей, то при вирусной инфекции они (выделения. — RT) прозрачны, при бактериальной — жёлто-зелёные. Обратите внимание на сухой кашель! Но даже если вы считаете, что самостоятельно распознали причину недуга, вызовите врача на дом!
— Чем так опасен новый коронавирус в сравнении с теми вирусами, о которых мы уже наслышаны?
— Новая коронавирусная инфекция относится к острым респираторным вирусным инфекциям (ОРВИ), и осложнения у неё могут быть такие же, как и у других ОРВИ: пневмония, бронхит, синусит и другие. Опасность этого вируса в том, что он легко передаётся от человека к человеку. Особому риску подвержены пожилые люди.
— Какой у него принцип действия? Как влияет на организм?
Это усложняет распознавание вируса системой иммунитета. Так начинается разрушительная работа вируса в организме. Самой опасной точкой повреждения является система органов дыхания.
— Пара вопросов о профилактике. Кто-то говорит пить витамин С, кто-то — парацетамол. Кого слушать и слушать ли вообще?
— Ответ очень простой: слушать только вашего лечащего врача! Отдельно — о парацетамоле. Известен целый ряд случаев его бесконтрольного применения. А непреднамеренная передозировка парацетамола ведёт к отравлению, сопровождающемуся тяжёлым поражением печени. Крайне не рекомендуется принимать этот препарат с алкоголем! Итак, главный помощник — ваш лечащий доктор!
— Первое — чистота рук и окружающих поверхностей. Часто мойте руки водой с мылом и используйте дезинфицирующие средства.
Потрудитесь не касаться рта, носа и глаз руками (такие прикосновения неосознанно свершаются человеком более 15 раз в час).
Носите с собой дезинфицирующее средство для рук, чтобы в любой обстановке вы могли им воспользоваться.
Обязательно мойте руки перед едой.
Будьте особенно осторожны, когда находитесь в людных местах. Максимально сократите прикосновения к находящимся в таких местах поверхностям и предметам и не касайтесь лица.
Носите с собой одноразовые салфетки и всегда прикрывайте нос и рот, когда вы кашляете или чихаете, обязательно утилизируйте их после использования.
Не ешьте еду (орешки, чипсы, печенье и другие снеки) из общих упаковок или посуды, если другие люди погружали в них свои пальцы.
Избегайте приветственных рукопожатий и поцелуев.
Регулярно очищайте поверхности и устройства, к которым вы прикасаетесь: клавиатуру компьютера, панели оргтехники для общего использования, экран смартфона, пульты, дверные ручки и поручни.
Помните, почему предметы личной гигиены так называются!
— Рассмотрим пример: человек приехал из-за границы с кашлем и решил самоизолироваться. Врача не вызывает, думает, что это обычный ОРВИ или грипп, сейчас полечится — и пройдёт. Это рабочая схема, как думаете?
— Стоит ли вообще заниматься самолечением без диагноза? Какой порядок действий порекомендуете для тех, кто заболел?
— При подозрении на коронавирусную инфекцию самолечение абсолютно противопоказано. Не выходите из дома. Вызовите врача.
— Мыть руки — казалось бы, суперпросто, но об этом так часто сейчас говорят, как будто до этого вообще не мыли. Какие ещё полезные привычки посоветуете ввести в обиход?
— Мыть руки нужно правильно! То есть часто мыть руки с мылом (не менее минуты), причём не только ладони, но и тыльную их сторону, между пальцами, под ногтями. При этом очень важно их хорошо высушивать одноразовыми полотенцами, так как вирус на влажных руках также может сохраняться.
Обрабатывайте доступные поверхности общепринятыми дезинфицирующими средствами.
Используйте домашние ультрафиолетовые облучатели-рециркуляторы и кварцевые лампы.
Часто проветривайте помещение, где вы находитесь.
И самое главное: не паниковать! Инфекция не любит паники. Страх — первый помощник врага, и на всякую беду страха не напасёшься.
Читайте также:


