Клетки которые убивают опухолевые и зараженные вирусом клетки

NK-клетки (натуральные, или естественные, нулевые или киллеры, NK-лимфоциты - от англ. Natural Killer cells) составляют основную часть нулевых лимфоцитов. На них приходится 5-10% (по некоторым источникам - до 15 процентов) лимфоцитов в периферической крови и 1-2% лимфоцитов в селезенке. В лимфатических узлах они единичны.
Морфологически это большие лимфоциты с бобовидным смещенным ядром и азурофильными гранулами, которые по виду и составу близки гранулам Т-киллеров. Нулевые лимфоциы также называют большие гранулярные лимфоциты.
Клетками-мишенями для NK - лимфоцитов являются опухолевые клетки, клетки, зараженные вирусами, бактериями или простейшими, а также стареющие и поврежденные клетки.
Механизм уничтожения сходный с Т-киллерами, но более активный, поскольку не требует распознавания молекул МНС. NK-клетки не обладают антигенной специфичностью и не приобретают иммунологическую память.
Нулевые лимфоциты обеспечивают неспецифический противоинфекционный иммунитет, а также являются главным звеном противоопухолевой защиты.
Повышение активности 0 (нулевых) лимфоцитов – перспективное направление онкологии.
Лимфоциты можно смело назвать главным звеном в защитной цепочке нашего организма и нашей иммунной системы. Они зорко следят за то чтобы, в организм не проникали чужеродные клетки, это своего рода клеточная цензура нашего тела.
- Основная обязанность нулевых лимфицитов (NK-клеток), киллерных клеток - выявлять и уничтожать собственные клетки организма, в которых что-то нарушилось: они убивают опухолевые клетки и клетки, зараженные вирусами (а также, возможно, и другими чужеродными агентами).
Нормальные киллеры (НК-клетки) у человека составляют примерно 5% лимфоцитов периферической крови.
Функция нулевых лимфоцитов (NK-клеток) являются:
- защита то раковых клеток
- Реагирование на внедрившуюся инфекцию
- Участие в регуляции гемопоэза
Норма лимфоциты, в 1 мкл (5) 19-37 (1,200-3,000)
0- нулевые лимфоциты - это не "просвещенные" лимфоциты. Можно сказать что нулевые (0)- это молоды лимфоциты, не сформерованые, так сказать "пластилин для лепки".
Интерферон: активация NK клеток
Натуральные киллеры являются важным фактором неспецифической защиты от вирусной инфекции . Они участвуют в так называемой естественной или спонтанной цитотоксичности в отношении клеток-мишеней. НК-лимфоциты не имеют маркеров Т- и В-клеток.
Свое цитотоксическое действие на клетки-мишени они оказывают без участия антител. В отличие от НК другая популяция лимфоцитов, так называемые К-лимфоциты , отвечают за зависимую от антител цитотоксичность и обеспечивают лизис инфицированных вирусом клеток, на поверхности которых экспонированы вирусные антигены, связанные с антителами, специфичными к данным антигенам. НК- и К- лимфоциты обладают более высокоавидными Fc-рецепторами по сравнению с Fc-рецепторами Т- и В-клеток, и относятся к популяции нуль-лимфоцитов.
Активность НК- и К-лимфоцитов может в значительной степени контролироваться (увеличиваться) интерфероном ( Lang et al., 1982 ; Biron, Welsh, 1982 ). Показано, что любой интерферон (альфа, бета и гамма) вызывает активацию НК как in vitro, так и in vivo ( Biron, Welsh, 1982 ). При этом имеется выраженная корреляция между уровнем интерферона и активностью НК.
Важным моментом регуляции активности интерферона при вирусной инфекции является то, что in vivo активация НК интерфероном происходит вблизи инфицированных вирусом клеток, т.е. интерферон действует локально, так как его продуцируют либо инфицированные вирусом клетки-мишени, либо цитотоксические Т-лимфоциты при их контакте с такими клетками.
При этом НК сами могут быть важными продуцентами интерферона в течение вирусной инфекции. В частности, показано, что при взаимодействии НК с вирусами гриппа или герпеса параллельно с продукцией IFN-б наблюдалось повышение активности НК, предполагая существование позитивной саморегуляции их функции интерфероном.
Увеличение активности натуральных киллеров при действии интерферона может осуществляться двумя путями. Интерферон может либо увеличивать активность существующих НК, либо стимулировать генерацию новой популяции НК путем активации дифференцировки предшественников НК в эффекторные клетки.
Существующие данные позволяют предположить, что в действительности оба механизма могут иметь место (см., например, Bloom, 1980 ; Berman, Franfort, 1982 ). Известно, что цитотоксичность, индуцируемая НК, не является антиген-специфичной и не ограничена по антигенам МНС.
Поэтому повышение активности НК при действии интерферона не связано с повышением экспрессии на их поверхности антигенов гистосовместимости, как это имеет место при стимуляции макрофагов или цитотоксических Т-лимфоцитов.
По всей вероятности молекулярные механизмы регуляции цитотоксической активности Нк и К-лимфоцитов, опосредованные интерфероном, связаны с повышением экспрессии рецепторов к Fc фрагменту иммуноглобулинов G (в случае К-лимфоцитов) и рецепторов к IL2 (в случае НК-клеток).
Во всяком случае для НК мыши и человека показано, что IFN- альфа/бета вызывал увеличение на их поверхности рецепторов к IL2. Эти данные показывают, что кроме интерферона в регуляции активности НК (и, возможно, К-лимфоцитов) могут принимать участие другие лимфокины, например, IL2. При этом процессы активации цитотоксичности могут быть связаны также с изменением внутриклеточного метаболизма этих макрофагов.
Таким образом, в течение вирусной инфекции активность НК и К-лимфоцитов может регулироваться индуцированным вирусом интерфероном.
При этом секретируемый интерферон действует локально, вызывая активацию цитотоксических клеток, которые обеспечивают лизис инфицированных вирусом клеток, ограничивая распространение вируса в организме. НК активируются в ранний период инфекции после того, как начинает синтезироваться интерферон, а активированные К-лимфоциты вызывают избирательный лизис вирус-инфицированных клеток в поздний период после того, как появляются специфичные к вирусу антитела.
NK - лимфоциты, норма и расшифровка
Нормальные показатели NK - лимфоцитов - от 3 до 8%
Клетки, одновременно несущие CD3 и CD16/CD56, рассматриваются как разновидность Т-лимфоцитов с активностью неспецифических киллеров (NKT-клетки).
На их поверхности представлена мембранная молекула CD56 – изоформа адгезивной молекулы из семейства молекул адгезии клеток нервной системы (NCAM - neural cell adhesion molecule) из суперсемейства иммуноглобулинов.
Они способны лизировать определенные клетки-мишени без предварительного контакта и развития реакции типа иммунного ответа.
7-14лет: 13,21±2,71%; 0,34±0,03*109/л
Интервал колебаний: 5-25%
Число клеток в 1 мкл: 380±33
Интервал колебаний: 100±650
Повышение показателя:
- Фаза восстановления после вирусных инфекций (гепатит B, C)
- Ряд аутоиммунных заболеваний
- Онкологические заболевания
- Беременность
- Алкогольный цирроз печени
Снижение показателя:
- Первичных иммунодефицитах: агаммаглобулинемия без В-лимфоцитов (сцепленная с полом), гипер-IgM-синдром.
- Облучении.
- Лечении кортикостероидами.
- Лечении цитостатиками.
- СПИДе.
- Паразитарных заболеваниях.
- Системных заболеваниях.
- Стрессе.
- Дефиците цинка.

Согласно вирусной теории рака, опухолеродный вирус, в отличие от инфекционных, необходим только на самых ранних этапах процесса зарождения и развития опухоли. После возникновения опухолевой клетки, как считают сторонники вирусной теории, присутствие вируса не обязательно. При озлокачествлении вирус вызывает в клетке наследственные изменения, и образовавшаяся опухолевая клетка уже не нуждается в вирусе для своего дальнейшего размножения.
Кроме известных злокачественных новообразований: саркомы кур, вызываемой вирусом Рауса, папилломы Шоупа у кроликов, вызываемой фильтрующимся агентом, рака молочной железы мышей, возникающего под влиянием вируса — так называемого фактора молока,- в настоящее время имеется свыше 30 опухолевых заболеваний позвоночных животных и человека, роль вирусов в возникновении которых доказана. Среди них — папилломы и кондиломы человека, папилломатоз крупного рогатого скота, ротовая папиллома кроликов, собак. Сейчас известно 7 типов вирусов, вызывающих лейкозы у мышей. Вирусы Гросса, Молони вызывают лимфоидную лейкемию, вирус Графи — миелоидную, вирус Френд — ретикулез, вирус Мазуренко — .
В последнее время вирусная теория рака обогатилась важным фактом — обнаружен вирус . Этот вирус открыт Стюарт и Эдди, которые засевали бесклеточные фильтраты опухолей околоушных желез и лейкозных тканей мышей в однослойные культуры почечной ткани обезьяних эмбрионов. После нескольких пассажей вирус полиомы, содержащийся в надосадочной жидкости, способен был вызывать развитие опухоли не только у мышей различных линий, но и у крыс, кроликов, хомяков и морских свинок; при этом возникали опухоли ни одного органа, а различных локализаций.
Интересным фактом вирусной теории рака является установление возможности вызвать злокачественное превращение нормальных клеток нуклеиновыми кислотами, выделенными из опухолеродных вирусов, в частности полиомы. Нуклеиновые кислоты опухолеродных вирусов вносят в клетку дополнительную генетическую информацию, обусловливающую ее озлокачествление. Высказывают предположение, что при проникновении в клетку нуклеиновая кислота опухолеродного вируса входит в геном ее клетки, связываясь с нуклеиновыми кислотами и вызывая наследственные изменения клетки.
Вирусная природа некоторых злокачественных и доброкачественных новообразований несомненна, однако для объяснения происхождения всех злокачественных новообразований под влиянием вирусов нет оснований.
Установление факта, что в механизме действия вируса лежит действие нуклеиновой кислоты, то есть химического вещества, сближает эту вирусную теорию рака с полиэтиологической теорией генеза рака и открывает перспективы создания единой теории происхождения опухолей.
Вирусы, вызывающие рак
Всемирной организацией здравоохранения вирусы, вызывающие рак, были разделены на три группы: мелкие вирусы (вирусы группы папова, аденовирусы); величиной 70–100 ммк — вирус саркомы Рауса, вирус лейкоза млекопитающих и птиц, вирусы рака молочной железы у мышей; крупные . К ним относятся вирусы фибромы кроликов, контагинозного моллюска и .
Как правило, вирусы, вызывающие рак, вызывают опухолевую трансформацию, сопровождающуюся включением генома вируса в геном клетки. Часть вирусного генома в опухолевых клетках активна и определяет синтез нескольких специфических антигенов, локализующихся на поверхности клеток (специфический трансплантационный антиген) и в ядре (так называемый ). В клетках опухолей, индуцированных. вирусами (аденовирусы и вирусы группы папова), синтеза полных вирусных частиц обычно не происходит, но такой синтез может быть индуцирован специальными экспериментальными приемами. В клетках лейкозов и опухолей, индуцированных вирусами, может иметь место синтез полных вирусных частиц.
Мелкие вирусы, вызывающие рак. Аденовирусы человека и животных представляют собой вирусы с частицами размером 70–75 ммк. Некоторые типы аденовирусов (типы 12 и 18), выделенные от человека, а также некоторые аденовирусы, выделенные от птиц и обезьян, вызывают опухоли через 1–2 месяца после введения новорожденным сирийским хомячкам и (реже) крысам и мышам. В культуре клеток хомячка эти вирусы вызывают опухолевую трансформацию. Данных об опухолеродной активности этих вирусов для их природных хозяев нет.
Вирусы группы папова — вирусы размером около 45 ммк. К ним относятся вирус полиомы, вирус и вирусы папиллом человека, кролика, рогатого скота и других животных.
При заражении вирусом полиомы эмбриональных культур мыши наблюдается продуктивная вирусная инфекция, завершающаяся формированием в ядре клеток большого числа вирусных частиц и разрушением большинства клеток (цитопатогенный эффект); небольшая доля выживших клеток претерпевает опухолевую трансформацию. При заражении эмбриональных клеток сирийского хомячка продуктивная инфекция не наблюдается, в большинстве клеток отмечается абортивная вирусная инфекция, при которой свойства клеток временно меняются, но через некоторое время возвращаются к норме. У небольшой части клеток через несколько месяцев происходят включение генома в геном клетки и стойкая трансформация.
опухолеродные вирусы, вызывающие рак (онкорнавирусы, лейковирусы) образуют частицы диаметром 60–80 ммк: внешняя оболочка этих вирусов содержит липиды. Вирусная частица содержит ряд ферментов (так называемые обратные транскриптазы), которые после попадания вируса в клетку могут вызывать синтез ДНК на цепи вирусной РНК.
Эффективность трансформации клеток, вызываемой в культуре некоторыми вирусами, очень высока: вирус куриной саркомы или вирус мышиной саркомы могут вызывать трансформацию 80–100% клеток культур за короткий срок (3–4 дня). Во многих случаях вирусы, вызывающие рак существуют в латентном состоянии и передаются следующему поколению через половые клетки или через молоко при вскармливании (вертикальная передача). Различают несколько групп вирусов.
Для каждой группы характерны общий группоспецифический антиген и антигены, специфичные для каждого варианта вируса.
а) Группа вирусов лейкозов — саркомы птиц. Сюда входят вирус саркомы мышей и вирусы лейкозов кур, разные штаммы. Вирус саркомы кур Рауса вызывает в короткий срок (от 1 до 3–8 недель) опухоли на месте введения у кур. Некоторые варианты вируса Рауса вызывают саркомы также при введении новорожденным и взрослым млекопитающим (обезьяны, мыши, крысы, морские свинки, хомячки), а также при введении некоторым пресмыкающимся. Лейкозные вирусы вызывают у кур разные варианты лейкоза (миелобластоз, эритробластоз).
б) Группа вирусов лейкозов — саркомы мышей. Вирус саркомы (варианты Молони и Харвея) выделен из опухолей мышей и уже через несколько дней вызывает разрастание саркоматозных клеток у мышей, крыс, хомячков. Вирусы лейкозов мышей существуют во многих вариантах, различающихся по своей патогенности: вирус Гросса вызывает лимфатический лейкоз, патогенен лишь для новорожденных мышей. Вирус Молони вызывает также лимфатический лейкоз у новорожденных мышей, но патогенен и для взрослых мышей. У мышей, зараженных вирусом осповакцины, удалось выделить вариант лейкозного вируса, вызывающий ретикулез и гематоцитобластоз (вирус Мазуренко). Некоторые варианты лейкозных вирусов вызывают лейкоз при заражении и мышей, и крыс.
г) Вирус рака молочных желез мышей (вирус Биттнера, фактор молока) Крупные вирусы, вызывающие рак, принадлежат к особой группе. Они близки по структуре к вирусам группы оспы. Эти вирусы вызывают преимущественно доброкачественные опухоли или опухолевидные разрастания клеток, которые могут регрессировать. В клетках этих разрастаний обнаруживаются вирусные частицы. К этой группе относятся вирусы фибромы и миксомы кроликов, а также обезьян.

Введение. Естественные киллеры, натуральные киллеры, NK - клетки – большие гранулярные лимфоциты периферической крови и лимфоидных органов [3].
В цитоплазме этих клеток содержатся гранулы с белком перфорином, вызывающим образование в мембранах клеток-мишеней пор (каналов), и гранзимами (семейство сериновых протеаз, нарушающих ДНК, прохождение клеточного цикла и растворяющих ядро при входе в клетку [4]). Эти гранулы высвобождаются из цитоплазмы клеток в процессе взаимодействия последних с клетками-мишенями (инфицированными вирусом или опухолевыми). Противовирусный эффект этих клеток неспецифичен.
NK-клетки атакуют клетки-мишени двумя путями: а) с помощью активационного рецептора распознают клетки-мишени, не экспрессирующие молекулы гистосовместимости I класса и лизируют их; б) распознают и лизируют клетки с помощью механизма антителозависимой цитотоксичности, взаимодействуя с фиксированными на их мембране вирусспецифическими антителами посредством Fc-рецепторов.
Рецепторы NK-клеток
На поверхности мембраны NK-клеток имеется два типа рецепторов – активационный и ингибиторный [3].
Для контроля несоответствующих активирующих сигналов существует набор ингибиторных рецепторов, которые подавляют активацию NK-клеток. К ним относятся лектиноподобные гетеродимеры, такие как CD94-NKG2A, KIRs, обнаруженные у людей, или лектинподобные гомодимеры Ly49, обнаруженные у мышей. Эти ингибирующие рецепторы "исследуют" молекулы МНС класса I и защищают здоровые клетки от неадекватного опосредованного NK-клетками киллинга [4].
При взаимодействии MHC1 и ингибиторного рецептора, на мембране NK-клеток возникает ингибиторный сигнал, который и предупреждает лизис клеток-мишеней. Так нормальные соматические клетки защищаются от повреждающего действия естественных киллеров, т.е. они могут активировать ингибиторный рецептор. Инфицированные же вирусом клетки-мишени, как правило, характеризуются сниженной экспрессией молекул I класса на своей поверхности. Естественно, что такие клетки-мишени эффективнее распознаются активационным рецептором этих клеток. А так как ингибиторный сигнал при этом недостаточен или вовсе отсутствует, то, естественно, формирование активационного сигнала превалирует. В результате происходит быстрое прикрепление NK-клеток к поверхности клетки-мишени, из гранул высвобождаются молекулы перфорина, которые достигают мембраны инфицированной вирусом клетки и вызывают ее повреждение путем образования трансмембранного канала. Через это отверстие в цитоплазму клетки-мишени проникают белки-гранзимы, запускающие механизм апоптоза. Клетки-мишени при этом погибают [3]. В дополнение к рецепторам, активирующим NK-клетки, стимуляция Toll-подобного рецептора (TLR) на NK-клетках играет важную роль в их активации. Было показано, что TLR3, TLR7, TLR8 и TLR9 экспрессируются на человеческих NK-клетках, и что лиганды для этих TLR могут активировать NK-клетки человека in vitro. Аналогично, прямая активация TLR4 бактериальным компонентом фимбриального белка FimH, по-видимому, важна для активации NK-клеток.
Цитокины, участвующие в активации NK-клеток
Помимо прямой стимуляции через активирующие рецепторы NK-клетки на начальных стадиях вирусной инфекции могут активироваться цитокинами.
Четыре основных цитокина, участвующих в активации NK-клеток, представляют собой интерфероны I типа (IFN), IL-12, IL-15 и IL-18. Эти цитокины могут продуцироваться непосредственно инфицированными клетками, а также активированными дендритными клетками или макрофагами.
IFN I типа непосредственно активируют NK-клетки для усиления цитотоксичности. Эта роль IFN типа I была хорошо установлена в условиях инфицирования MCMV (мышиный цитомегаловирус), LCMV (вирус лимфоцитарного хориоменингита) и несколькими другими вирусами. Они также могут индуцировать секрецию IL-15, цитокина, способного индуцировать пролиферацию NK-клеток.
В отличие от IFN типа I, IL-12 активирует NK-клетки для увеличения продукции IFN-γ. Секреция IFN-γ повышает функциональную активность NK-клеток, что создает условия ранней защиты от некоторых инфекций до тех пор, пока в реакцию не вступят Т-клетки , продуцирующие тот же цитокин. Вирус простого герпеса (HSV) вызывает более выраженную секрецию IL-12 и IFN типа I как у мышей, так и у людей, тогда как у пациентов с ВИЧ наблюдается снижение выработки ИЛ-12, который коррелирует со степенью активации NK-клеток, соответственно. Другой цитокин, IL-18, также может индуцировать продукцию IFN-γ NK-клетками. И IL-12, и IL-18 необходимы для первичных NK-клеток в ответе на вирусную инфекцию [4].
Влияние T-рег на NK-клетки
Помимо влияния цитокинов доказано влияние на NK-клетки Т-регуляторных клеток. Естественные CD4+/CD25+ Т-регуляторные клетки (Трег) составляют у человека около 5% периферических CD4+ Т-лимфоцитов и поддерживают гомеостаз периферической аутотолерантности посредством супрессии аутореактивных Т-клеток. На мышиных опухолевых моделях показан возможный механизм, с помощью которого Трег вызывают угнетение литической и секреторной функций натуральных киллеров (НК) in vitro и контролируют их пролиферацию. Под действием растворимого фактора роста опухоли β (TGF-β), продуцируемого опухолевыми клетками и связанного с мембраной Т-регуляторных лимфоцитов, у НК-клеток снижается экспрессия системы молекул, ассоциированных с цепью MHC I класса (NKG2D). Это приводит к угнетению функциональной активности натуральных киллеров и позволяет Трег контролировать НК в норме и при опухолевом росте. Удаление CD4+/CD25+ Т-регуляторных клеток вызывает резкое увеличение темпов пролиферации натуральных киллеров, равно как и их цитотоксической активности. При этом НК-клеточный гомеостаз зависит не только от функционирования Т-регуляторных лимфоцитов. Однако активность НК обратно пропорциональна частоте встречаемости Трег у онкологических пациентов, а удаление Трег может стимулировать НК-опосредованный лизис опухолевых клеток ex vivo [2].
Рекрутирование NK-клеток в место заражения
Контроль за вирусными инфекциями требует не только соответствующей активации NK-клеток, но и эффективного рекрутирования активированных NK-клеток к месту инфекции. В нормальном состоянии NK-клетки могут быть найдены в селезенке, легких, костном мозге, лимфатических узлах, мононуклеарных клетках периферической крови и печени. Сфингозин-1-фосфат играет важную роль в миграции лимфоцитов, а S1P5R, рецептор, связанный с G-белком (GPCR), дифференциально экспрессируется на NK-клетках для контроля их развития и нормального состояния.
При попадании в организм инфекции NK-клетки мигрируют в направлении заражения и накапливаются там. В целом, в транспорт NK-клеток в места воспаления вовлечены четыре типа рецепторов хемокинов: CCR2, CCR5, CXCR3 и CX3CR1. Все, кроме CX3CR1, как было показано, играют роль в хемотаксисе к местам вирусного заражения. В частности, CCR2 и CCR5 имеют решающее значение для транспортировки в печень при инфицировании MCMV. CCR5 индуцирует попадание NK-клеток в центральную нервную систему при инфекции HSV-2. CXCR3 помогает движению NK-клеток в печень при заражении вирусом денге и, наряду с CD62L, как правило, облегчает миграцию в лимфатические узлы при воспалении. Однако до конца механизмы миграции NK-клеток в область воспаления до конца не известны.Natural killer (NK) cells, as part of the innate immune system, play a key role in host defense against viral infections. Recent advances have indicated that NK cell activation and function are regulated by the interplay between inhibitory and activating signals. Thus, a better understanding of mechanisms responsible for NK cell activation and function in the control of viral infections will help develop NK cell-based therapies. In this review, we will first discuss how NK cells are activated in response to viral infections. We will then focus on the recruitment of activated NK cells to the site of infection as well as on NK cell effector mechanisms against virally infected cells.
Key Words: Natural killer cells, Viral infection, Innate immunity
Реакция NK-клеток на инфицированные вирусом клетки
После активации и рекрутирования в место заражения NK-клетки используют три основные стратегии для уничтожения инфицированных вирусом клеток: производство цитокинов, секрецию цитолитических гранул и цитолиз. Выработка IFN-γ является важной эффекторной функцией активированных NK-клеток. IFN-γ оказывает непосредственное влияние на то, чтобы клетки хозяина были менее восприимчивы к вирусу и могли действовать дистантно, чтобы предотвратить инфицирование других клеток. Он также рекрутирует и активирует другие эффекторные лейкоциты, включая цитотоксические Т-лимфоциты и CD4 + Т-хелперы 1 типа [4].
Нарушения, связанные с NK-клетками
Важность NK-клеток для здоровья человека была подчеркнута растущим числом лиц, у которых отсутствуют NK-клетки и / или их функции. В настоящее время известно более 40 случаев поражения NK-клеток. Аномалии NK-клеток, однако, в некоторых случаях представляют собой основной иммунологический дефект. В совокупности эти условия называются дефицитом NK-клеток. Недавние достижения добавили ясности в этот диагноз и выявили дефекты в трех разных генах, которые могут вызывать дефицит NK-клеток (NKD): GATA2, MCM4 и FCGR3A. У больных могут отсутствуют либо сами NK-клетки (CNKD), либо их функции (FNKD). Хотя сообщается о различных методах лечения пациентов с CNKD и FNKD, но никогда не проводилось организованного клинического испытания какой-либо терапии у этих пациентов. Большинство терапевтических подходов сосредоточено на восприимчивости к герпесвирусам и применении профилактических противовирусных препаратов [5].
Влияние на NK-клетки
Как говорилось ранее, NK-клетки играют важную роль в контроле за вирусными инфекциями организма, поэтому закономерно встает вопрос о стимуляции активности этих клеток, а также и других клеток врожденного иммунитета для защиты организма. Возможность такого влияния была найдена воздействием на клетки-эффекторы врожденного иммунитета некоторых препаратов иммуномодулирующего действия.
При проведении эксперимента на мышах для изучения действия иммуномодулирующих препаратов, таких как: поликомпонентная вакцина Иммуновак, состоящая из антигенных компонентов St. aureus, K. pneumoniae, P. vulgaris и E. Coli; стафило-протейно-синегнойная жидкая вакцина (СПСА); стимфорте (водная вытяжка из органов и тканей ужей); фукоидан (сульфатированный гетерополисахарид из бурых водорослей) и нуклеинат натрия (низкомолекулярная NaРНК, полученная при гидролизе кормовых дрожжей), было выявлено, что они оказывают стимулирующее действие на клетки-эффекторы врожденного иммунитета и вызывают пролиферативные процессы в лимфоидной ткани различных зон иммунокомпетентных органов. При этом наибольшей активностью обладали иммуномодуляторы бактериального происхождения, поскольку в их составе имелись патоген-ассоциированные молекулярные структуры микроорганизмов, являющиеся лигандами для рецепторов клеток врожденного иммунитета и приводящие к их активации [1].

p, blockquote 1,0,0,0,0 -->
Эти клетки становятся активными спустя примерно 3 дня после поступления инфекции в организм и сразу реагируют на раковые клетки в организме. Можно сказать, что NK-клетки постоянно ищут опухолевые клетки и непосредственно воздействуют на них, вызывая гибель.
p, blockquote 2,0,1,0,0 -->
Известно, что, если организм не сможет вырабатывать NK-клетки, то под воздействием бактерий и вирусов может достаточно быстро умереть. Был выявлен дефицит натуральных киллеров у людей в начальной стадии герпес-вирусной инфекции. При достаточной активности и здоровом количестве этих клеток, они способны помогать в борьбе с ВИЧ. Есть и прямая зависимость, показанная в опытах на мышах, между снижением количества Nk-клеток и развитием рака .
p, blockquote 3,0,0,0,0 -->
Повышение иммунитета через активацию натуральных киллеров
p, blockquote 4,0,0,0,0 --> 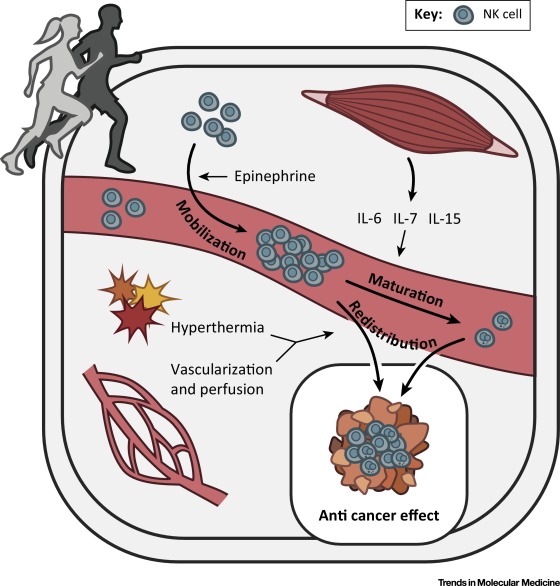
УВЕЛИЧЕНИЕ КОЛИЧЕСТВА И АКТИВНОСТИ НАТУРАЛЬНЫХ КИЛЛЕРОВ ПРИ ФИЗИЧЕСКОЙ НАГРУЗКЕ (http://www.cell.com/trends/molecular-medicine/fulltext/S1471-4914(16)30041-7)
Когда повышается уровень NK-клеток – усиливается иммунитет
Не всегда повышенное количество и активность натуральных киллеров может быть полезна. Например, ожирение повышает экспрессию воспалительных генов в брюшном жире (но не в других частях тела). Это увеличивает количество и активность NK-клеток в жировой прослойке живота. Но, когда натуральные киллеры уменьшают своё количество, то воспаление в брюшном жире снижается и улучшается резистентность к инсулину. Дело в том, что NK-клетки управляют инсулинорезистентностью через выработку некоторых белков, которые затем воздействуют на макрофаги.
p, blockquote 5,1,0,0,0 --> 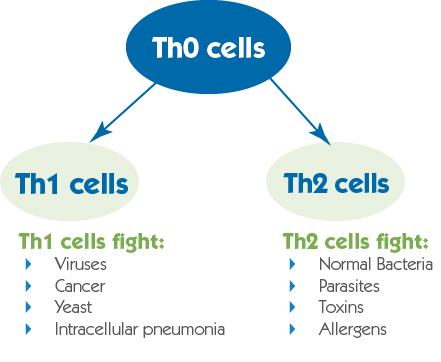
ЧТО СТИМУЛИРУЕТ АКТИВАЦИЮ ИММУННОГО ОТВЕТА ПО TH1 И TH2 ТИПУ
При астме NK-клетки способствуют усиления иммунного ответа через выработку IgE, что может ухудшить состояние больного с астмой. А при диабете 1-го типа натуральные киллеры усиливают разрушение поджелудочной железы, что еще больше усиливает проявления диабета. Известно, что при увеличенной активности NK-клеток у женщин могут быть повторные выкидыши.
p, blockquote 6,0,0,0,0 -->
Существует два типа доминирования иммунного ответа – Th1 и Th2. Считается, что доминирование по Th1 типу является воспалительным ответом организма и такая реакция иимунитета стимулирует выработку цитокинов IL-12, IL-2 и увеличивает активность NK-клеток. Но существует обратная реакция, когда активированные NK-клетки подавляют клетки Th1 иммунного ответа.
p, blockquote 7,0,0,0,0 --> 
ПРИ ДИСБАЛАНСЕ ИММУННОГО ОТВЕТА (TH1/TH2) ПОВЫШАЕТСЯ РИСК РАЗЛИЧНЫХ ЗАБОЛЕВАНИЙ
В целом, можно сказать, что повышение иммунитета не должно быть слишком сильным, особенно, если касаться натуральных киллеров. Хотя, при некоторых заболеваниях, например, таких, как рак, усиление иммунного ответа через активацию и увеличение числа NK-клеток может быть одним из способов лечения.
p, blockquote 8,0,0,1,0 -->
Когда количество NK-клеток понижается
Как естественно увеличить количество NK-клеток и тем самым повысить иммунитет
Как естественно увеличить активность NK-клеток и тем самым повысить иммунитет
Стоит осторожно относится к этому перечню, если у вас присутствует доминирование ответа иммунитета по Th1 пути.
p, blockquote 9,0,0,0,0 -->
- Белый шампиньон
- Куркумин
- Ресвератрол
- Андрографис
- Ашвагандха
- Кардамон
- Пробиотики : S Boulardii, L casei, L bulgaricus
- Витамин В12
- Чеснок
- Пептиды тимуса
- Астрагал
- Ягоды годжи
- Бета-глюканы
- Гриб Рейши
- Гиностемма
- Женьшень
- Растение львиная грива
- Эхинацея
- Хлорелла
- Коэнзим Q10
- Витамин Е
- Низкие дозы Налтрексона
- Арабиногалактан
- Cocoacalm
- Гормон роста
- IGF-1
- Гормон щитовидной железы Т3
- Гормон пролактин
ПОТЕНЦИАЛЬНЫЙ ВРЕД, НАНОСИМЫЙ ЛЕКТИНАМИ (https://livingwellnessblog.wordpress.com/2014/04/27/the-lectin-fodmap-diet-connection/)
Что может уменьшить уровень и активность NK-клеток и понизить иммунитет
Уменьшение активности и цитотоксичности NK-клеток может привести к ухудшению способности организма защищаться от инфекций и раковых клеток. К веществам, уменьшающим цитотоксичность натуральных киллеров, относятся:
p, blockquote 10,0,0,0,0 -->
- Ацетилхолин
- Эстрадиол
- Опиоиды
- Фолиевая кислота (у женщин в постменопаузе)
- Рыбий жир
- Тестостерон + интенсивные силовые нагрузки
Читайте также:


