Как размножается вируса спида
Новое, неизвестное человечеству заболевание было открыто учеными в 1981 году. Первооткрывателями неизвестного вируса стали американские ученые. В 1983 году особенности нового микроорганизма были изучены американскими и французскими учеными-медиками. Болезнь, которую вызывает этот вирус, называют СПИД, то есть синдром приобретенного иммунодефицита. На самом деле более правильное название вируса – ВИЧ. Пока от него не найдены лекарства. Когда инфекция попадает в человека, она начинает свое разрушительное действие до того момента, пока не уничтожит своего хозяина. Из этой статьи можно узнать, сколько живет вирус ВИЧ во внешней среде и как его уничтожить.
Как вирус поражает организм
Попадая в человека, вирус может жить только в определенных клетках, у которых снаружи находится молекула белка CD4. Такая молекула находится в составе лимфоцитов, главных клеток иммунитета человека. Лимфоциты несут множество функций в организме человека. Они уничтожают инфекции, которые могут нанести вред организму. Тем самым способствуя высокой резистентности организма. ВИЧ внедряется в лимфоциты и размножается в них. Новые вирусы выходят из клеток и поражают все новые лимфоциты.
В организме человека находится больше количество лимфоцитов, поскольку тело должно реагировать на различные инфекции. Однако вирус постепенно уничтожает иммунные клетки, и организм теряет возможность сопротивляться болезням. Так происходит, пока человек не умрет от поражения сопутствующими СПИДу болезнями.
Поскольку в человеческом теле лимфоцитов очень много – от 500 до 1500 в микролитре крови, при поражении ВИЧ еще несколько лет организм может сопротивляться инфекциям и смертельному вирусу. И только когда большая часть лимфоцитов оказываются пораженными, тело человека заболевает СПИДом и другими тяжелыми заболеваниями. Именно количество живых здоровых лимфоцитов в крови является показателем дальнейшего прогноза для человека при заражении вирусом.
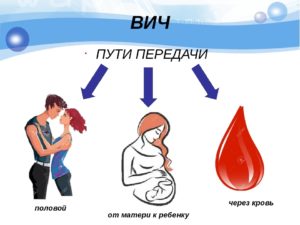
Как нельзя заразиться

Если ВИЧ попадает на кожу человека, он не может проникнуть внутрь. Поэтому первым правилом защиты является личная гигиена. Уже доказано врачами, что больные СПИДом безопасны в быту, если кожа не имеет ран, и нет контакта с зараженной кровью.
От них не передается вирус при рукопожатии, воздушно-капельным путем, через расчески и одежду, через посуду. Невозможно заразится, если пользоваться одной ванной, туалетом, душем, бассейном и сауной с больным. Поэтому посещение этих мест безопасно при соблюдении стандартных правил уборки и личной гигиены посетителей.
Симптомы и методы диагностики
Диагностика инфекции достаточно сложная, поскольку симптомы от ВИЧ проявляются через несколько недель и схожи с другими заболеваниями.
Одними из первых признаков инфицирования, которые появляются впервые 2-4 недели, является:
- высокая температура (37,5 ◦ С – 38,0 ◦ С);
- головная боль;
- усталость;
- сыпь на коже;
- увеличение шейных лимфоузлов;
- боль в мышцах или суставах.
После поражения вирусом большого количества клеток, отвечающих за иммунитет, наступает крайняя стадия заболевания – СПИД. На этой стадии иммунитет человека очень низкий и любая инфекция может привести к осложнению или даже к летальному исходу.
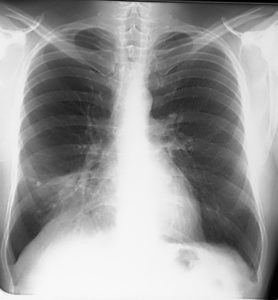
Для данной стадии характерно:
- длительно незаживающие царапины и раны;
- продолжительная диарея (жидкий стул);
- резкая потеря веса;
- пневмония;
- появление язв на слизистых;
- появление пятен на коже и во рту;
- ухудшение памяти;
- эпилептические припадки.
ВИЧ инфекцию достаточно сложно диагностировать, опираясь лишь на симптомы. Для установления точного диагноза необходимо провести лабораторные исследования, суть которых заключается в выявлении антител к ВИЧ в крови или же при непосредственном обнаружении вируса.
Диагностика заболевания осуществляется с помощью следующих тестов:
- Иммуноферментный анализ (ИФА). Самый популярный метод обнаружения ВИЧ. С помощью него можно установить наличие возбудителя инфекции и его количество в плазме крови. Точный результат этот тест может показать спустя 3-6 недель с момента предполагаемого заражения.
- Иммунный блотинг (ИБ). Только после проведения этого теста можно устанавливать инфицирование ВИЧ. Результат этого теста может быть положительным, отрицательным или сомнительным. В случае последнего рекомендуется повторное прохождение теста. Если же дополнительный результат снова выдает сомнительный результат, пациента ставят на учет и наблюдают за ним в течение 6 месяцев.
![]()
Полимеразная цепная реакция (ПЦР). Этот способ выявления инфекции является очень чувствительным, что способствует выявлению ВИЧ-инфекции спустя 14 дней с момента заражения и может определить конкретную стадию заболевания. Также с помощью данного теста можно внести точность при сомнительных результатах по иммуноблоттинговому исследованию. Однако при использовании данного метода существует вероятность получения ложноположительного результата именно из-за высокой чувствительности, так как наличие даже нескольких вирусных частиц достаточно для идентификации возбудителя.- Экспресс-тесты. Благодаря этим тестам, результаты о наличии ВИЧ инфекции можно получить через 10-15 минут.
Следует помнить, что наличие антител, с большей достоверностью можно выявить спустя три месяца после заражения. Своевременное выявление ВИЧ инфекции, до перехода ее в стадию СПИД – гарантия эффективности лечения и продления жизни инфицированного.
Сколько живет ВИЧ вне организма
Меры предосторожности от заражения зависят от продолжительности жизни ВИЧ вне организма. Сколько же живет ВИЧ вне организма больного?
В качестве эксперимента ученые высушили физиологическую жидкость с вирусом. Инфекция сохранила активность в ней на 15 дней. Однако надо учесть, что условия для него создали со стабильным температурным режимом и влажностью. В реальной жизни такие условия не существуют. Кроме температуры и влажности на выживаемость вируса на открытом воздухе влияет еще и его количество жидкости.
Независимо от условий вирус во внешней среде живет от получаса до часа. Из этого можно сделать вывод, что ВИЧ погибает быстро вне организма человека, если для него не создано хороших условий для существования.
Шприцы являются самыми распространенными переносчиками инфекции. Кровь больного человека, содержащаяся в игле после укола, является благоприятной средой для вируса, в которой он будет жить долго. В игле создаются такие условия, что кровь не высыхает несколько дней. Поэтому вирус продолжает сохранять устойчивость в использованном шприце, если до этого им пользовался больной. Именно поэтому было принято решение по всему миру ввести в обиход одноразовые шприцы. В любом случае использовать шприц после кого-то нельзя. Поскольку нет никакой гарантии, что человек, воспользовавшийся шприцем, не находится в стадии заражении вирусом, который еще не проявил себя.
Когда про СПИД еще не было известно, именно через многоразовые шприцы и медицинские инструменты большими группами заражали самых обычных людей в медучреждениях и детских садах – детей, пенсионеров, мамочек. Срок жизни ВИЧ в этом случае от нескольких минут до нескольких часов.
Именно из-за многократного использования одного шприца на всех наркоманы являются группой риска для заражения ВИЧ. Поэтому шприцы должны быть только одноразовыми, а инструменты для медицинских манипуляций должны проходить дезинфекцию. Это самая лучшая защита от инфицирования.
Особенностью вируса является то, что он на протяжении большого времени может сохранять активность в крови, взятой у больного. В ней он выдерживает даже низкие температуры, сохраняя возможность поражать нового хозяина. Сколько сохраняется ВИЧ при высоких температурах в крови, изучить не получилось, потому что при 90 градусах белок сворачивается. Поэтому определить в нем живой вирус и ответить на вопрос в какой среде вирус СПИДа как правило погибнет становиться невозможно.
В связи с возникновением в мире нового заболевания ВИЧ, стал очень строгим контроль доноров, потому что среди них может случайно попасть человек – носитель вируса, еще не проявившего себя. Именно через кровь происходит заражение пострадавшего, которому ее переливают. Также бывают изредка случаи заражения, если инфицированная кровь попадает на рану другого человека. Поэтому обработка ран, использование медицинских перчаток, гигиена – один из способов защиты от заражения.
Сперма также является одной из прекрасных сред для проживания вируса. В сперме он сохраняет жизнеспособность до двух суток. При этом прежде, чем погибнет вирус он успевает размножится миллиардами плохих клеток. Именно поэтому в мире ввели в массовое использование презервативы – контрацептивны, защищающие не только от нежелательной беременности, но и от контакта со спермой партнера.
Что убивает ВИЧ-инфекцию
На данный момент инфекцию можно уничтожить лишь за пределами организма человека. Ученые, выяснив при каких условиях, он быстро погибает, разработали профилактические методы, которые способствуют замедлению распространения инфекции и помогают стерилизации мединструментов.
- Важно чтобы температура раствора для обработки различных поверхностей была 50 ◦ С и выше, тогда возможность уничтожить инфекцию повышается до 90%.
- Ультрафиолетовые лучи не оказывают негативного влияния на жизнедеятельность вируса.
- Инфекция уничтожается при взаимодействии с кислородом буквально за несколько минут. Данный факт подтверждается тем, что СПИД не передается по воздуху. Вирус может погибнуть, если его отправить в окисленную среду.
При какой температуре погибает ВИЧ?
Один из главный вопросов, которым часто задаются как обычные граждане, так и работники медицины – при какой температуре погибает ВИЧ? Изучения в области вирусологии подтвердили, что ретровирус умирает если на него воздействует температура 50 ◦ С-70 ◦ С в течении 30-40 минут. Мгновенно вирус погибает лишь при температуре выше 100 ◦ С. Поэтому, стоит знать, что ВИЧ теряет вирулентность при кипячении вещей в течение 2-3 минут.
Однако не все можно прокипятить, поэтому следует помнить, что возбудитель ВИЧ гибнет и при низких температурах. Так при 10 ◦ С-15 ◦ С замедляется жизнеспособность вируса и он медленно погибает, а при температуре 50 ◦ С-60 ◦ С он умирает почти мгновенно.
Так как слишком высокая или низкая температуры не предусмотрены для человека, то подавить вирус в организме можно лишь при употреблении противовирусных лекарств. Но следует помнить, что при наступлении обстоятельств непригодных для жизни вируса, он входит внутрь клетки и задерживается в ней на несколько лет, а при возобновлении необходимых условий он снова развивает свою жизнедеятельность.
Теперь, когда Вы знаете о симптомах, методах диагностики данного заболевания и при какой температуре погибает СПИД, Вы сможете избежать этой страшной инфекции и уберечь Ваших близких от заражения.
Одни вирусы способны интегрироваться в геном клетки-мишени и таким образом оставаться во всех дочерних клетках, которые будут в будущем получены после ее деления. К таким вирусам относятся гаммаретровирусы и лентивирусы. Другие делать этого не умеют (например, адено- и аденоассоциированные вирусы). Но для производства белков и репликации (размножения) все они используют клетку и ее синтетический аппарат.
Как это работает?
Для того чтобы вирус мог проникнуть в клетку, белки его оболочки должны связаться с мембранными белками клетки-мишени. Важно отметить, что проникает вирус только в те клетки, которые могут в дальнейшем помочь его репликации. Вирус ВИЧ живет в клетках иммунной системы, вирус гепатита С — в клетках печени. Есть особые вирусы, которые поражают только растения или даже только бактерии.
Содержащие неактивный вирус и оставшиеся в живых клетки иногда сохраняют возможность нормального функционирования. В этом случае клетки могут быть заражены, но вирус проявит себя спустя длительный период времени. Так устроен герпес.
В зависимости от того, каким типом нуклеиновой кислоты представлен генетический материал, выделяют ДНК-содержащие вирусы и РНК-содержащие вирусы. И тут стоит остановиться на классификации.
Типы вирусов. Коротко о главном
Современная типология вирусов содержит 7 классов и была предложена Дэвидом Балтимором еще в 1971 году. С тех пор, впрочем, она была уточнена и расширена, в том числе советскими учеными. И выглядит в настоящее время таким образом:
- Класс I
Вирусы, содержащие двухцепочечную ДНК
Описание
Для репликации вирусу необходимо попасть в ядро клетки-мишени и воспользоваться ее ДНК-полимеразой. Иногда вирус вызывает незапланированное деление самое клетки, то есть становится онкогенным. Эти вирусы хорошо изучены.
Пример: Вирус герпеса, адено- и папилломавирусы
Вирусы, содержащие одноцепочечную ДНК
Описание
Попадая в ядро клетки, вирусы образуют двухцепочечную ДНК, после чего реплицируются так же, как вирусы класса I.
Пример: Парво- и цирковирусы
Вирусы, в которых РНК способна к репликации (редупликации)
Описание
Вирусы этого класса могут размножаться в цитоплазме клетки, им не нужна молекула ДНК. Каждый ген, находящийся в РНК вируса, кодирует только один вирусный белок.
Пример: Бирна- и реовирусы
Вирусы, содержащие одноцепочечную (+) РНК
Описание
Из геномной (+) РНК на рибосомах хозяина создаются вирусные белки. В одном фрагменте РНК могут быть закодированы разные белки, что увеличивает сложность вируса без удлинения генов.
Пример: Пикорнавирусы (полиомиелит, гепатит А) и коронавирусы
Вирусы, содержащие одноцепочечную (–) РНК
Описание
(–) РНК этих вирусов предварительно должна быть транскрибирована в (+) РНК вирусными РНК-полимеразами, после чего может начаться синтез вирусных белков. Вирусы этого класса делятся еще на две группы, в зависимости от их генома и места его репликации (цитоплазма или ядро).
Пример: Филовирусы, аренавирусы (геморрагическая лихорадка Ласса), ортомиксовирусы (вирусы гриппа) и так далее.
Вирусы, содержащие одноцепочечную (+) РНК, реплицирующиеся через стадию ДНК
Описание
Такие вирусы используют фермент обратную транскриптазу для превращения (+) РНК в ДНК, которая встраивается в геном хозяина ферментом интегразой. Дальнейшая репликация происходит при помощи полимераз клетки хозяина.
Пример: Ретровирусы (в том числе ВИЧ)
Вирусы, содержащие двухцепочечную ДНК, реплицирующиеся через стадию одноцепочечной РНК
Описание
Молекула ДНК замкнута в кольцо и является матрицей для синтеза мРНК и дополнительных молекул РНК, которые используются при репликации вирусного генома обратными транскриптазами.
Пример: Колимовирусы (вызывают инфекции растений) и гепаднавирусы (например, гепатит В)
Вакцинация и лечение
Как правило, организмы умеют бороться с паразитирующими на них вирусами. На примере млекопитающих и человека мы обычно говорим о главном инструменте — врожденном иммунитете.
Впрочем, наиболее эффективен этот вид защиты в отношении бактериальных инфекций и не может обеспечить продолжительную и надежную защиту, особенно от инфекций вирусных.
Именно поэтому огромное значение имеет приобретенный иммунитет, в результате которого клетки иммунной системы обучаются вырабатывать специфические к вирусу антитела, способные уничтожать как саму вирусную частицу, так и зараженные ею клетки.
Еще одна врожденная система борьбы с вирусными инфекциями — внутриклеточная. Как правило, клетка способна распознать чужеродную РНК в своей цитоплазме, куда ее сперва и доставляют многие вирусы, и имеет специальные комплексы для ее деградации. Но часть вирусов научились обходить и эту ловушку. К примеру, ротавирусы, которые даже внутри клетки сохраняют капсид с геномной РНК.
Миссия: уничтожить
Основная сложность в лечении вирусных заболеваний заключается в том, что они используют естественные функции клеток-мишеней для своего размножения, поэтому ученым зачастую оказывается не так-то просто придумать препарат, который будет токсичен для вируса и безопасен для самой клетки. Если такой безопасности достичь не удастся, лекарство будет иметь слишком много побочных эффектов, повреждающих сам организм, что окажется нецелесообразно для использования.
По принципу действия противовирусные препараты подразделяются на две группы: стимулирующие иммунную систему атаковать вирусы (например, за счет индукции синтеза белков-интерферонов) и атакующие вирусы напрямую. Препараты второй группы различаются по этапу жизненного цикла вируса, на котором они активны: это препараты, препятствующие проникновению вируса в клетку, препятствующие размножению вируса внутри клетки и препятствующие выходу копий вируса из клетки.
Чтобы помешать проникновению вируса, препарат должен заблокировать рецептор на клетке, с которым связывается вирусная частица. Так работает, например, ибализумаб — зарегистрированный в США новый препарат против ВИЧ, о котором мы недавно писали.
Еще один класс противовирусных препаратов блокирует ферменты, необходимые для создания и модификаций белков вируса. Такие лекарства называют протеазными ингибиторами.
Вместо заключения: а могут ли вирусы приносить пользу?
Безусловно, да. Несмотря на то, что вирусы ассоциируются у большинства людей с однозначным вредом, они могут приносить и пользу — если речь идет о так называемых вирусных векторах и терапевтических подходах на их основе.
Исследователи давно научились помещать в белковую оболочку вируса интересующие их нуклеиновые кислоты, чтобы доставлять нужный ген в клетки, а также убирать те гены, которые делают вирус опасным для организма.
Это позволило сделать возможной генную терапию, помогающую бороться с заболеваниями, вызванными известными генетическими мутациями. Создание вирусных векторов — достаточно непростая задача, к тому же ограниченная свойствами самих вирусных частиц: количеством помещающейся генетической информации, местом ее вставки, стабильностью. Кроме того, вирусный вектор, используемый в медицине, не должен вызывать иммунного ответа или критично влиять на жизнедеятельность клетки. Тем не менее эти сложности решаются, поэтому уже одобрен ряд вполне успешных и безопасных генных терапий. А в качестве основы для вирусных векторов чаще всего используются ретро-, ленти-, адено- и аденоассоциированные вирусы.
Просто о сложном


-->СТАТЬИ -->
| [07.07.2014] | [Вирусы] |
| Натуральная оспа (0) | |
| [18.07.2014] | [Вирусы] |
| Вирусы. Краткий обзор (0) | |
| [21.07.2014] | [Общие понятия] |
| Вирусология (0) | |
| [03.07.2014] | [Общие понятия] |
| Немного истории (0) | |
| [04.07.2014] | [Инфекции] |
| Цитомегаловирусная инфекция (0) | |
| [21.08.2014] | [Вирусы] |
| Вирус иммунодефицита человека (ВИЧ) (0) | |
| [22.08.2014] | [Вирусы] |
| Строение и жизненный цикл вируса иммунодефицита человека (ВИЧ) (1) | |
| [09.02.2016] | [Вирусы] |
| Лихорадка Зика (0) | |
Строение вируса иммунодефицита человека
 |
| Строение вируса иммунодефицита человека |
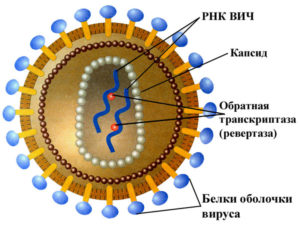
Вирионы ВИЧ имеют вид сферических частиц, диаметр которых составляет около 100—120 нанометров (это приблизительно в 60 раз меньше диаметра эритроцита).
В состав зрелых вирионов входит несколько тысяч белковых молекул различных типов.
Капсид зрелого вириона, состоящий из примерно 2000 молекул белка р24, имеет форму усечённого конуса.
Внутри капсида находится белково-нуклеиновый комплекс: две нити вирусной РНК, прочно связанные с белком нуклеокапсида p7, ферменты (обратная транскриптаза, протеаза, интеграза).
С капсидом также ассоциированы белки Nef и Vif (7—20 молекул Vif на вирион).
Внутри вириона (и, вероятнее всего, за пределами капсида) обнаружен белок Vpr8-11. Кроме того, с капсидом ВИЧ-1 (но не ВИЧ-2) связазны около 200 копий клеточного фермента пептидилпролилизомеразы, необходимого для сборки вириона.
Капсид окружён оболочкой, образованной примерно 2000 молекул матриксного белка p17. Матриксная оболочка в свою очередь окружена двуслойной липидной мембраной, являющейся наружной оболочкой вируса. Она образована молекулами фосфолипидов, захваченными вирусом во время его отпочковывания от клетки, в которой он сформировался.
С помощью белка gp120 вирус присоединяется к рецептору CD4 и корецептору, находящимся на поверхности Т-лимфоцитов человека. Стехиометрическое соотношение p24:gp120 в вирионе составляет 60—100:1.
Белки gp41 и в особенности gp120 интенсивно изучаются в качестве возможных мишеней для разработки лекарств и вакцины против ВИЧ .
При формировании наружной оболочки вируса также происходит захват некоторого количества мембранных белков клетки, в том числе человеческих лейкоцитарных антигенов (HLA) классов I и II и молекул адгезии.
Функции важных структурных белков ВИЧ-1
Сокращение
Описание
Функции
gp41 (TM, transmembrane)
Трансмембранный гликопротеин массой 41 кДа
gp120 (SU, surface)
Гликопротеин массой 120 кДа
Наружный белок вириона. Нековалентно связан с трансмембранным белком gp41. С одной молекулой gp41 связаны 3—5 молекул gp120. Способен связывать рецептор CD4. Играет важную роль в процессе проникновения вируса в клетку.
Белок массой 24 кДа
Образует капсид вируса
Матриксный белок массой 17 кДа
Около двух тысяч молекул этого белка образуют слой толщиной 5—7 нм, располагающийся между внешней оболочкой и капсидом вируса.
p7 (NC, nucleocapsid)
Нуклеокапсидный белок массой 7 кДа
Входит в состав ка псида вируса. Образует комплекс с вирусной РНК.
Геном и кодируемые белки
 |
| Геном ВИЧ-1 |
Геном ВИЧ-1
Генетический материал ВИЧ представлен двумя копиями положительно-смысловой (+)РНК. Геном ВИЧ-1 имеет длину 9000 нуклеотидов. Концы генома представлены длинными концевыми повторами (англ. long terminal repeat, LTR), которые управляют продукцией новых вирусов и могут активироваться и белками вируса, и белками инфицированной клетки. 9 генов ВИЧ-1 кодируют, по крайней мере, 15 белков.
Ген pol кодирует ферменты: обратную транскриптазу (RT), интегразу (IN) и протеазу (PR).
Ген gag кодирует полипротеин Gag/p55, расщепляемый вирусной протеазой до структурных белков p6, p7, p17,p24.
Ген env кодирует белок gp160, расщепляемый клеточной эндопротеазой фурином на структурные белки gp41 и gp120.
Другие шесть генов — tat, rev, nef, vif, vpr, vpu (vpx у ВИЧ-2) — кодируют белки, отвечающие за способность ВИЧ-1 инфицировать клетки и производить новые копии вируса. Репликация ВИЧ-1 in vitro возможна без генов nef, vif, vpr, vpu, однако их продукты необходимы для полноценной инфекции in vivo.
Gag: Полипротеин-предшественник Gag/p55 синтезируется с полноразмерной геномной РНК (которая в данном случае служит в качестве мРНК) в процессе стандартной кэп-зависимой трансляции, но возможна и IRES-зависимая трансляция. Предшественники функциональных белков располагаются в составе полипротеина Gag/p55 в следующем порядке: p17…p24…p2…p7…p1…p6 (р1 и р2 — соединительные пептиды; другие продукты расщепления Gag/p55 описаны выше).
Домен М, расположенный внутри области p17/МА, миристилируется (присоединяются остатки миристиновой кислоты) и направляет Gag/p55 к плазматической мембране. Домен I, находящийся внутри области p7/NC, отвечает за межмолекулярные взаимодействия отдельных мономеров Gag/p55. Домен L, также локализованный в области p7/NC, опосредует отпочковывание вирионов от плазматической мембраны; в этом процессе участвует также р6 область полипротеина Gag/p55.
Vpu: Двумя важными функциями белка Vpu являются:
1) разрушение клеточного рецептора CD4 в эндоплазматическом ретикулуме путём привлечения убиквитинлигазных комплексов и
Vpr: Белок Vpr необходим для репликации вируса в неделящихся клетках, в том числе макрофагах. Этот белок, наряду с другими клеточными и вирусными белками, активирует длинные концевые повторы генома ВИЧ. Белок Vpr играет важную роль в переносе провируса в ядро и вызывает задержку деления клетки в периоде G2.
Nef: Белок Nef выполняет несколько функций. Он подавляет экспрессию молекул CD4 и HLA классов I и II на поверхности инфицированных клеток, и тем самым позволяет вирусу ускользать от атаки цитотоксических T-лимфоцитов и от распознавания CD4+-лимфоцитами. Белок Nef может также угнетать активацию T-лимфоцитов, связывая различные белки-компоненты систем внутриклеточной передачи сигнала.
У инфицированных вирусом иммунодефицита макак-резусов активная репликация вируса и прогрессирование болезни возможны только при интактном гене nef. Делеции гена nef были обнаружены в штаммах ВИЧ, выделенных у группы австралийцев с длительным непрогрессирующим течением инфекции.
Однако у части из них со временем появились признаки прогрессирования инфекции, в том числе снижение числа CD4+-лимфоцитов. Таким образом, хотя делеции гена nef и могут замедлять репликацию вируса, это не гарантирует полной невозможности прогрессирования заболевания.
Tat и Rev: Регуляторные белки Tat (транс-активатор) и Rev накапливаются в ядре клетки и связывают определённые участки вирусной РНК. Белок Tat имеет молекулярную массу около 14-15 кДа, связывает вторичную структуру геномной РНК вблизи 5'-нетранслируемой области активирует обратную транскрипцию геномной РНК ВИЧ, синтез вирусных мРНК, необходим для репликации вируса почти во всех культурах клеток, регулирует выход вирионов из зараженных клеток, нуждается в клеточном кофакторе — циклине T1. Белок Rev регулирует экспрессию белков вириона, связывает мРНК гена env в области RRE (англ. Rev response element) интрона, разделающего экзоны генов Tat и Rev.
Белки Tat и Rev стимулируют транскрипцию провирусной ДНК и транспорт РНК из ядра в цитоплазму, а также необходимы для трансляции. Белок Rev обеспечивает также транспорт компонентов вируса из ядра и переключение синтеза регуляторных белков вируса на синтез структурных.
Жизненный цикл
На схеме показано слияние вирриона ВИЧ и плазматической мембраны Т-лимфоцита человека

Этап 1. Взаимодействие вирусного белка gp120 с клеточным рецептором CD4 (указано красной стрелкой)

Этап 2. Конформационные изменения вирусного белка gp120 обеспечивают связывание с клеточным рецептором CCR5 (указано красной стрелкой)

Этап 3. Концевые участки вирусного белка gp41 проникают в плазматическую мембрану клетки (указано красной стрелкой)

Этап 4. Вирусный белок gp41 подвергается значительным конформационным изменениям, складывается пополам (указано красной стрелкой) и образует спираль, что приводит к сближению и слиянию мембран вириона и клетки. Таким образом ВИЧ захватывает Т-лимфоцит с целью дальнейшей репродукции.
Проникновение в клетку и интеграция
Вирусная инфекция начинается, когда вирион ВИЧ сталкивается с человеческой клеткой, имеющей на своей мембране рецептор CD4. Вирусный гликопротеин gp120 прочно связывает рецептор CD4. В результате такого взаимодействия gp120 претерпевает конформационные изменения, которые позволяют ему также связать молекулу корецептора CXCR4 или CCR5 (экспрессируемых на поверхности Т-лимфоцитов, макрофагов, дендритных клеток и микроглии).
В зависимости от способности связывать эти корецепторы, ВИЧ классифицируют на R5-тропные (связывают только CCR5), X4-тропные (связывают только CXCR4) и R5X4-тропные (могут взаимодействовать с обоими корецепторами). Препараты, блокирующие корецепторы могут быть эффективны против ВИЧ.
После описанных событий мембрана клетки и мембрана вириона ВИЧ сливаются, и содержимое вириона проникает внутрь клетки. Белок gp41 очень важен для слияния мембран, поэтому его рассматривают в качестве мишени для разработки противовирусных препаратов. Внутри клетки вирусная РНК высвобождается из капсида, и происходит обратная транскрипция — синтез ДНК на основе матрицы одноцепочечной геномной РНК вируса, катализируемая обратной транскриптазой.
Большая часть лекарственных препаратов, одобренных для применения при ВИЧ-инфекции, направлена на нарушение работы обратной траскриптазы. Синтезированная ДНК транспортируется внутрь ядра клетки и встраивается в хромосому хозяина под действием интегразы. Несколько препаратов, ингибирующих интегразу, проходят ранние стадии клинических испытаний. Вирусная ДНК, встроившаяся в хромосому клетки, называется провирусом.
Человеческая РНК-полимераза в ядре клетки синтезирует информационную РНК (мРНК), а позднее и геномную РНК вируса. Синтезированные РНК транспортируются обратно в цитоплазму, где на матрице мРНК на рибосомах синтезируются вирусные ферменты, структурные и регуляторные белки.
Сборка и отпочковывание вирионов
Геномная РНК вируса, а также вирусные белки транспортируются к местам сборки вирионов. Сборка вирионов происходит на мембране, куда направляется миристилированный полипротеин Gag/p55. Вирионы первоначально формируются из полипротеинов-предшественников структурных белков и ферментов и на этой стадии не являются инфекционными.
В ходе созревания вирусной частицы вирусная протеаза расщепляет белки-предшественники до функциональных компонентов. Несколько одобренных противовирусных препаратов ингибируют работу протеазы и препятствуют формированию зрелых вирионов.
Новые вирусные частицы отпочковываются от поверхности клетки, захватывая часть её мембраны, и выходят в кровяное русло, а клетка хозяина, несущая рецептор CD4, погибает. Недавние исследования показали, что процесс отпочковывания вирионов может быть более сложным, чем считалось ранее. Так было обнаружено, что благодаря взаимодействию белка Gag с компонентами клетки вирионы накапливаются в особых внутриклеточных мультивезикулярных тельцах, которые обычно служат для экспорта белков. Таким образом вирусные частицы высвобождаются из клетки, эксплуатируя её собственную систему транспорта макромолекул.
Распространение по организму
В период острой фазы ВИЧ-инфекции отсутствие специфического иммунного ответа позволяет вирусу активно реплицироваться и достигать высоких концентраций в крови.
Вирус заселяет органы лимфатической системы, CD4 + -лимфоциты, CD8 + -лимфоциты и макрофаги, а также другие клетки: альвеолярные макрофаги лёгких,клетки Лангерганса, фолликулярные дендритные клетки лимфатических узлов, клетки олигодендроглии и астроциты мозга и эпителиальные клетки кишки.
В лимфоидной ткани ВИЧ размножается на протяжении всего заболевания, поражая макрофаги, активированные и покоящиеся CD4 + -лимфоциты и фолликулярные дендритные клетки. Количество клеток, содержащих провирусную ДНК, в лимфоидной ткани в 5—10 раз выше, чем среди клеток крови, а репликация ВИЧ в лимфоидной ткани на 1—2 порядка выше, чем в крови.
Резервуаром ВИЧ служат лимфатические узлы и конкретно дендритныe клетки, в которых вирус сохраняется длительное время после периода острой виремии.
Для активации CD8 + -лимфоцитов и образования антиген-специфических цитотоксических T-лимфоцитов необходима презентация пептидного антигена в комплексе с человеческим лейкоцитарным антигеном класса I.
Дендритные клетки, необходимыe для начала первичных антиген-специфичных реакций, захватывают антигены, перерабатывают и переносят их на свою поверхность, где эти антигены в комплексе с дополнительными стимулирующими молекулами активируют T-лимфоциты.
Заражённые клетки часто не выделяют дополнительных стимулирующих молекул и поэтому не способны вызвать активацию достаточного числа B и T-лимфоцитов, функция которых зависит от дендритных клеток.
После завершения обратной транскрипции в CD4 + -лимфоците вирусный геном представлен провирусной невстроенной ДНК. Для встраивания провирусной ДНК в геном клетки-хозяина и для образования новых вирусов необходима активация T-лимфоцитов.
Контакт CD4 + -лимфоцитов и антигенпредставляющих клеток в лимфоидной ткани, наличие вирусов на поверхности фолликулярных дендритных клеток и присутствие провоспалительных цитокинов (ИЛ-1, ИЛ-6 и ФНОα) способствуют размножению ВИЧ в инфицированных клетках. Именно поэтому лимфоидная ткань служит самой благоприятной средой для репликации ВИЧ.
На 2014 год ВИЧ-инфекция остаётся неизлечимым заболеванием, так как геном вируса интегрируется в хромосомы клеток и может реактивироваться даже после курса антиретровирусной терапии.
В настоящее время идёт поиск безопасных способов редактирования генома человека и исключения из него провирусной ДНК. В 2014 году был предложен метод удаления генома ВИЧ-1 из заражённых клеток при помощи системы CRISPR/Cas9. С помощью этого метода исследователям удалось вырезать фрагмент провирусной ДНК, заключённый между 5'- и 3'-концевыми LTR-областями из хромосом зарежённых клеток в культуре.
Кроме того, этот метод оказался также эффективным для профилактики заражения неинфицированных клеток. Описанный подход может привести к разработке способа полного избавления от ВИЧ-инфекции.
Читайте также:
- Чем отпаивать ребенка при ротавирусе
- Какие анализы надо сдать на гепатиты перед прививкой на гепатит в
- Большая вирусная нагрузка при беременности
- Вирусный круп у детей комаровский 1993
- Вирусная этиология о лейкозах
 Пожалуйста, не занимайтесь самолечением!При симпотмах заболевания - обратитесь к врачу.
Пожалуйста, не занимайтесь самолечением!При симпотмах заболевания - обратитесь к врачу.