Как производят вакцины от вирусов
Вакцина от гриппа действует в течение сезона простуд, а на следующий год необходимо повторить курс вакцинации. Это продукт научных трудов ученых. Вакцины разрабатываются годами, и этот процесс требует тщательных шагов от разработчиков. Самое интересное о вакцине от гриппа: из чего производится и как действует - пойдет речь ниже.
Немного о вакцинах

Появлению вакцин послужило возникновение эпидемий заболеваний, которые вызывали массовые человеческие потери. В борьбе с ними люди испробовали многое - колдовство, народная и традиционная медицина, карантин, санитарно-гигиенические средства, но большого прорыва удалось добиться только при изобретении вакцинации.
В 1768 году Екатерина Вторая решилась сделать прививку у немецкого доктора от оспы для себя и юного наследника престола. В этот период от оспы погибли немало людей, как при дворе Царской России, так и в Европе. О своем поступке императрица ни разу не пожалела, а врача, сделавшего прививку, наградила пожизненно.
С открытиями Луи Пастера в конце 19-го века вакцинация начала набирать обороты. В нескольких странах мира появились лаборатории по созданию вакцин, а к середине 20-го века они распространились повсеместно и получили высокий уровень развития. В 50-х годах 30-го века в СССР, да и в других странах, началась эпидемия полиомиелита, которая являлась страшной угрозой для населения и калечила многие жизни. Благодаря разработкам американских ученых, исследователи из СССР смогли создать аналогичную вакцину, которая применялась во многих странах и остановила такую болезнь, как полиомиелит.
Вакцинация позволила сохранить миллионы жизней и защитить нас от таких заболеваний, как дифтерия, туберкулез, столбняк, гепатит, полиомиелит. В конце прошлого века разработали вакцину от гриппа, ведь осложнения, которые может оставить это заболевание, очень серьезные, а иногда грипп оканчивается летальным исходом.
Как идет разработка вакцины от гриппа
Над изучением гриппа, штаммы которого постоянно меняются, трудятся центры по исследованию гриппа. Их в мире насчитывается около 100. Каждый год пять ведущих центров исследования гриппа, которые входят во Всемирную организацию здравоохранения, отбирают вирусы, которые будут входить в вакцину этого года. Обычно отбирают не менее 3-4 вирусов. Так как эпидемии гриппа в Северном и Южном полушариях Земного шара происходят в разное время, то в феврале ведут разработку для Северного полушария, а в сентябре - для Южного.
Как выращивают вирусы для вакцины
После отбора вирусов, которые будут входить в вакцину, их культивируют в оплодотворенных куриных яйцах или в других живых клетках. Самые распространенные вирусы гриппа - это A и B. Они каждый год входят в состав вакцины. В этом году (сезон 2019/2020) в состав вакцины от гриппа вошли следующие вирусы:
- H1N1 (A);
- H3N2 (A);
- Victoria (B);
- Yamagata (B).
Задача ученых - создать условия, чтобы эти вирусы могли сосуществовать в одной среде (вакцине). Перед этим каждый вирус вводят в яйцеклетку, затем дают ему время на размножение. После этого культуры объединяют в единую субстанцию.
Во время роста вирусов клетки (яйца или культура клеток) содержат в стерильных условиях под воздействием ультрафиолетовых(УФ) лучей. Затем вирусы уничтожают или ослабляют для введения их в организм человека. Введение стабилизаторов и консервантов позволяет сохранить вакцину пригодной для хранения и употребления. Затем качество вакцины проверяется, и после одобрения она поступает в медицинские учреждения.
Главные факты о вакцине от гриппа
- Итак, можно выделить главное, в производстве вакцины от гриппа:
- Вакцина от гриппа состоит из 3-4 штаммов вирусов A и B.
- Выбранные вирусы вводят в куриные яйца или культуры клеток, где они растут и размножаются.
- После их размножения вирусы убивают или ослабляют - так получают вакцину.
Вакцина вакцине рознь
Вакцины от гриппа могут отличаться качеством и составом в зависимости от производителя. В сезоне 2019/2020 львиная доля вакцин от гриппа была произведена американскими компаниями Sanofi Pasteur (Пенсильвания (завод в Свифтуотере)) и Seqirus (Северная Каролина (завод в Холли-Спрингс)).
Большинство вакцин производится из куриных яиц, тем не менее, сообщество здравоохранения медленно, но верно продвигает вакцины, которые не содержат яиц, латекса и ртути. Именно поэтому клеточные культуры и другой метод, называемый рекомбинантным, стали более популярными в последние годы в качестве альтернативного способа изготовления вакцин против гриппа для людей с аллергией на яйца.

Ростех к 2022 году планирует войти в пятерку крупнейших в мире производителей основного компонента вакцин от гриппа – гемагглютинина.
Красивый и с шипами: как устроен вирус гриппа
Когда мы видим названия штаммов гриппа, вроде A(H1N1) или A(H3N2), то H и N – это обозначения гемагглютинина и нейраминидазы. Именно эти два белка обусловливают такие свойства вируса гриппа, как иммуногенность и изменчивость.
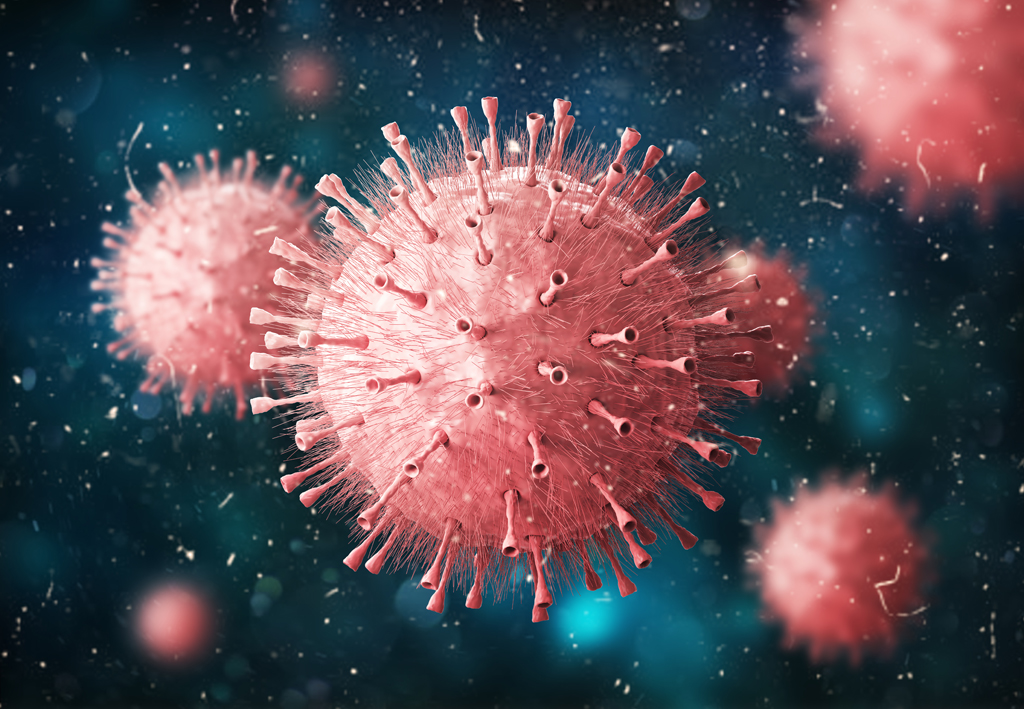
Простыми словами описать работу этих белков можно так – гемагглютинин обеспечивает прикрепление вируса к клетке, а нейраминидаза отвечает за способность вирусной частицы проникать в клетку хозяина и выходить из нее после размножения. Некоторые противовирусные препараты как раз подавляют работу нейраминидазы, чтобы вирусные частицы не могли мигрировать в новые клетки.
Гемагглютинин является основным компонентом гриппозных вакцин, так как именно он индуцирует в организме человека образование защитных антител. На сложной трехмерной структуре этого белка располагаются такие участки, которые очень важны с точки зрения профилактики гриппа, – это так называемые антигенные домены. Когда антитела образуются, они блокируются именно с этими участками и лишают вирус возможности входить в клетку. Но вирус гриппа пытается любыми путями обмануть иммунную систему человека. В структуре его поверхностных белков происходят различного рода мутации, которые приводят к изменению свойств вируса, или его дрейфу.
Нейраминидаза также меняется. Возможно изменение одного или двух антигенов одновременно. В настоящее время известны 18 подтипов гемагглютининов (Н1 – Н18) и 11 подтипов нейраминидаз (N1 – N11).
Вариантов вируса гриппа очень много, они подразделяются на типы: А, B, С. Вирусы гриппа А являются самыми опасными,так как именно они ответственны за пандемии и тяжелые эпидемии. Эти возбудители более патогенны и заразны, чем вирусы гриппа В и С. Дело в том, что вирус А содержит два типа нейраминидазы (N1, N2) и четыре типа гемагглютинина (Н0, H1, H2, НЗ), благодаря чему он более изменчив, а вирусы В не подразделяются на подтипы (только на две линии). Вирус гриппа С содержит только гемагглютинин и не содержит нейраминидазу. Вирусы гриппа С, в отличие от вирусов А и В, не вызывают эпидемий, только лишь приводят к заболеваниям в легкой и бессимптомной форме у детей и пожилых пациентов.
В эпидемическом 2019-2020 гг. в Северном полушарии, по данным ВОЗ, будут доминировать следующие штаммы: A/Brisbane/02/2018 (H1N1)pdm09; A/Kansas/14/2017 (H3N2); B/Colorado/06/2017 (линия B/Victoria-подобных); B/Phuket/3073/2013 (линия B/Yamagata-подобных). Первые три предназначены для трехвалентных вакцин от гриппа, четвертый – дополнительный штамм для включения в четырехвалентные вакцины.
О том, какие виды гриппа будут угрожать в текущем году, ВОЗ объявляет заранее, до начала эпидсезона. Для этой цели Организация имеет сеть лабораторий – 149 Национальных лабораторий по гриппу в 121 стране, которые во время эпидемий выделяют от больных штаммы, изучают антигенные и генетические свойства, определяют наиболее актуальные из них. Специалисты ВОЗ анализируют также многие другие факторы – перемещение людей, миграция птиц. На основе всей этой информации и прогнозируется перечень опасных штаммов. В этом году ВОЗ предоставила производителям вакцин актуальные штаммы в конце марта, на месяц позже обычного, – эксперты долго не могли определить, какой штамм вируса A/H3N2 нужно включать в вакцины.
Во многих развитых странах сегодня переходят на четырехвалентную вакцину от гриппа, то есть содержащую два актуальных штамма А и два актуальных штамма гриппа B. Отечественная четырехвалентная вакцина прошла регистрацию в Минздраве в июле 2019 года. В этом сезоне ею будут прививать тех, кто в группе риска – работников социальной сферы, транспорта и здравоохранения. Полностью на прививки с четырьмя штаммами Россия перейдет к 2023 году. Кстати, наша страна является седьмой в мире, где по полному циклу производится четырехвалентная вакцина.
Новая защита: белок вместо целого вируса
Позже ученые поняли, что целый вирус для вакцины не нужен, можно использовать только белок, на который, собственно, и формируется иммунный ответ. То есть теперь для защиты от гриппа человек получает лишь порцию белка гемагглютинина – 15 мкг на каждый штамм гриппа.

Завершающая стадия производства выполняется в стерильных асептических зонах, в которых гемагглютинин от четырех вирусов объединяется в одном реакторе. После чего следует автоматический розлив вакцины в шприцы. Готовые шприцы с вакциной попадают в зону инспектирования и этикетирования препарата. Там они проверяются на отсутствие повреждений и соответствие дозе с помощью автоматических оптических камер, а затем на них наклеивается этикетка.
Сейчас вакцинация от гриппа в самом разгаре. Традиционно пик распространения гриппа приходится на конец января – начало февраля, но начаться волна может уже в ноябре. Организму требуется 2–4 недели, чтобы выработать иммунитет после прививки. Поэтому сейчас самое время задуматься о прививке. Напоминаем, что у вакцинации есть противопоказания, поэтому не забудьте проконсультироваться с врачом.
И напоследок немного статистики:
– около 35 млн больных гриппом каждый год фиксируется в России;
– грипп ежегодно становится причиной 250-500 тыс. смертей и 3-5 млн случаев серьезных заболеваний;
– своевременная вакцинация на 60-80% предотвращает заболеваемость гриппом и осложнений после болезни у людей среднего возраста.
Кардиостимулятор: сердце в правильном ритме

«Немногим известно, что вакцины выращивают на обезьяньих почках, мышиных мозгах и зародышах цыплят.
Немногим известно о страшных последствиях введения чужеродных животных тканей (их ДНК и РНК) и об аутоиммунных реакциях, которые они могут вызвать.
Немногим известно о том, что вакцины подавляют иммунитет и могут стать причиной рака, лейкемий и даже быть связанными со СПИДом.
Многим вообще неизвестно (поскольку им не говорили), что вакцины выращиваются на органах животных, и они содержат ДНК и РНК этих животных.
Прививки являются продуктами крови и они опасны для нашей иммунной системы. Медицинская литература полна сообщениями, связывающими прививки со многими болезнями — и причинно (причинная связь) и по времени (временная связь).
Однако, люди ошибочно полагают, что раз прививки назначаются по закону, то правительство удостоверилось в их безопасности и эффективности.
Ежедневно выстраивают миллионы детей и вводят им гнилые токсические вещества, взращенные на органах животных, раковых клетках, абортированных плодах и других отравляющих субстанциях.
Лишь немногие интересуются, откуда достают вирусы и как их выращивают в лабораториях. Если бы кто-либо задал эти весьма чувствительные вопросы, то он бы многое узнал о производстве вакцин.
Если внутри организма существуют нормальные условия, вызывающие заражение вирусы и микробы просто не будут там расти. Например, вирус гепатита не растёт ни на асфальте, ни в организме здорового человека.
Для того, чтобы сделать вакцину, производители должны получить откуда-то этот вирус, поэтому они берут его от больных гепатитом. Разумно. (Первые гепатитные вакцины 1970-х гг. выращивали на крови гомосексуалистов, т. к. последние имели высокий уровень заболеваемости гепатитом).
Как только вирус выделен, он должен выращиваться в ядовитой среде… вы ведь помните, что патогены не растут в здоровых тканях?
Как только вирусы вырастают, их инактивируют формальдегидом (сильным канцерогеном) или другим агентом. К вакцинам добавляют и иные вещества, увеличивающие их эффективность: ртуть (тиомерзал), фенол, алюминий, антибиотики.
Все эти вещества синтетические, противоестественные, иммуносупрессивные, а некоторые даже канцерогенные.
Вирусы плохо растут в здоровых организмах, а потому используются больные. Например, отобранные для раковых опытов мыши не могут заболеть раком до тех пор, пока их не переведут на специальную диету. Это означает, что мы не можем заболеть раком до тех пор, пока мы правильно питаемся.
Итак, первые вирусы выращиваются на токсичных средах, поддерживающих их активность, их метаболизм и рост. Многие патогены живут в анаэробных (бескислородных) условиях, и погибают в присутствии кислорода.
Вакцины являются биологическими агентами, созданными из грязи, больных органов, больных людей и животных. Эти токсины вводятся человеку для того, чтобы увеличить количество антител против специфической болезни и выработать иммунитет.
Но учёные имеют очень слабое представление о том, что такое иммунитет и что именно делает иммунную систему сильной.
Питание — вот ключ к любой программе улучшения иммунитета, но они ведь игнорируют питание (травы, витамины, пищевые продукты) в угоду прибыльным прививкам.
Вакцины делают много больше для сенсибилизации организма, чем для его иммунизации, т. к. они содержат многие токсические вещества, вызывающие такие реакции сенсибилизации, как аллергии и анафилаксия.
Когда вы читаете эти строки, подумайте об этом аспекте прививок. Ртуть известна в качестве вещества, вызывающего аутоиммунные состояния и увеличивающего титр антиядерных антител (используемых в диагностике волчанки).
Аллергия и/или анафилаксия просто являются тяжёлыми реакциями гиперчувствительности на материал, присутствующий в вакцинах.
Все вакцины подавляют нервную систему и содержат вредные и токсичные компоненты, вызывающие реакции такого типа.
Но как же может ослабленная иммунная система выработать иммунитет к болезни?
Отрывок статьи американского доктора Джозефа М. Меркола.

В условиях пандемии многие государства приступили к созданию лекарств и вакцин от нового коронавируса. Сообщается, что в России разработка прошла первую фазу — так ли это? Значит ли, что скоро можно ждать появления препарата? Чтобы разработать новое лекарство от неизвестного заболевания по всем правилам научного поиска нужно от 5 до 15 лет. Разобрали весь процесс на примере COVID-19 вместе с Равилем Ниязовым, специалистом по регуляторным вопросам и разработке лекарств Центра научного консультирования.
COVID-19 — инфекционное заболевание, вызываемое коронавирусом SARS-CoV-2. В тяжелых формах оно поражает легкие, иногда — сердце и другие органы. Особенно тяжело заболевание протекает, если у больного есть другие нарушения со стороны дыхательной или сердечно-сосудистой систем. Молниеносно возникшая пандемия COVID-19 поставила вопрос разработки лекарств и вакцин от новой инфекции. Это долгий процесс с множеством стадий, на каждой из которых исключают вещества-кандидатов. Только одно или небольшая группа таких веществ в итоге сможет стать безопасным и эффективным лекарством.
Шаг 1: понять, как развивается новое заболевание
Любая болезнь нарушает естественные физиологические и биохимические процессы в организме. Причины заболеваний могут быть разными, в том числе — инфекционными. Инфекционный агент (в случае COVID-19 это коронавирус SARS-CoV-2) заимствует и эксплуатирует биохимический аппарат клеток, перехватывая управление им, в результате чего клетки перестают выполнять свою физиологическую функцию. Для вируса SARS-CoV-2 основной мишенью являются клетки дыхательного эпителия, отвечающие за газообмен, то есть за дыхание.
Лекарством для лечения COVID-19 будет считаться любое вещество или комбинация веществ, которое будет способно (1) инактивировать вирус еще до того, как он успеет поразить клетку, или (2) нарушать жизненный цикл вируса внутри зараженной клетки, или (3) защищать новые непораженные здоровые клетки от инфицирования.
Чтобы создать лекарство от SARS-CoV-2, нужно хорошо знать, каков жизненный цикл вируса в организме человека:
- с какими клетками человека и через какие рецепторы на поверхности клеток он связывается, какой собственный вирусный аппарат для этого он использует;
- как вирус проникает в клетку;
- как вирус эксплуатирует биохимический аппарат клетки, чтобы воспроизводить собственный генетический материал и белки, нужные для сборки новых вирусных частиц;
- как вирус покидает инфицированную клетку, чтобы инфицировать новые клетки;
- как формируется иммунитет против вируса и какой вклад иммунитет вносит в тяжесть заболевания (чрезмерная иммунная реакция может вызывать тяжелое поражение внутренних органов).

Всё перечисленное — это совокупность фундаментальных знаний, необходимых для перехода к следующему этапу разработки лекарства — синтезу или биосинтезу веществ, которые могут нарушать свойства вирусных частиц, убивая вирус и при этом не вредя человеку. Например, так работают лекарства от ВИЧ-инфекции или гепатита C. Но при этих заболеваниях важно применять сразу несколько веществ из разных классов, чтобы вирус не становился устойчивым к терапии. Об этом нужно будет помнить и при разработке лекарств против SARS-CoV-2.
Для лечения вирусных заболеваний также могут использоваться иммуносыворотки, содержащие антитела, способные инактивировать вирус. Такие сыворотки можно получать от животных, например, лошадей или кроликов, но также и от человека, уже переболевшего заболеванием.
Однако самый эффективный подход — профилактика заболевания. Для этого используют вакцины — естественные или генетически модифицированные белки вируса, а иногда и живой, но ослабленный вирус. Вакцина имитирует инфекционное заболевание и стимулирует организм к формированию иммунитета. В последнее время также разрабатываются РНК- и ДНК-вакцины, но пока одобренных препаратов нет.
В отличие от традиционных вакцин, РНК-/ДНК-вакцины содержат не вирусные белки, а гены, кодирующие основные вирусные белки. Введение такой вакцины приводит к синтезу клетками белков вируса, на которые должна реагировать иммунная система и вырабатывать иммунитет против этих белков вируса. Гипотетически это должно препятствовать началу инфекционного процесса при заражении настоящим патогенным вирусом. Важно отметить, такие РНК- и ДНК-вакцины не должны кодировать те белки вируса, которые способны были бы привести к настоящей вирусной инфекции.
Шаг 2: поиск хитов
На ранней стадии разработки синтезируют и тестируют множество веществ — библиотеку. Основная цель этого этапа — найти группу хитов (hit — попадание в цель), которые бы связывались с нужной вирусной мишенью. Обычно это один из белков вируса. Иногда отбор идет из библиотек, состоящих из миллиардов низкомолекулярных веществ. Сейчас активно используют компьютерные алгоритмы — машинное и глубокое обучение — чтобы искать новые потенциально активные молекулы. Одна из компаний, успешно работающая в этом направлении, — InSilico Medicine, создана российскими математиками.
Другой источник потенциальных лекарств — выздоровевшие люди: в их крови содержатся антитела, часть из которых способны связываться с вирусом и, возможно, нейтрализовать его.
Шаг 3: поиск и тестирование лидов
Когда находят группу хитов, способную связываться с вирусным белком, переходят к следующему этапу скрининга. На этом шаге исключаются вещества, которые:
- нестабильны и быстро разлагаются;
- тяжелы/затратны в синтезе;
- токсичны для различных клеток человека в условиях лабораторных экспериментов на культуре клеток. Вещества не должны быть токсичны сами, токсичностью также не должны обладать продукты их метаболизма в организме, продукты их разложения и примеси, возникающие в процессе производства; вместе с тем если процесс производства способен с помощью очистки удалять продукты разложения или примеси, то такой хит может и не будет выведен из разработки;
- плохо растворимы в воде — лекарство должно в достаточном количестве растворяться в биологических жидкостях, чтобы распределиться по организму;
- быстро разлагаются в живом организме;
- плохо проникают через слизистые оболочки, клеточные мембраны или внутрь клетки, в зависимости от пути введения лекарства и расположения вирусной мишени.
Хиты, которые выдерживают эти испытания и проходят все фильтры, переводят в категорию лидов (lead — ведущий).
Лиды тестируют в еще более широкой серии экспериментов для принятия так называемых решений Go/No-Go о продолжении или остановке разработки. На этой стадии инициируются испытания на животных. Такая схема отбора нужна чтобы как можно раньше вывести из разработки бесперспективные молекулы, потратив на них минимальные время и ресурсы, поскольку каждый последующий этап является еще более затратным.
Те несколько лидов, которые успешно проходят очередные испытания, становятся кандидатами. К этому моменту разработка может длиться уже от трех до семи лет.
Шаг 4: испытания кандидатов и клинические исследования

Прежде чем перейти к испытаниям на людях, нужно выполнить исследования на животных и подтвердить отсутствие неприемлемой для человека токсичности, подобрать первоначальную безопасную дозу. На этом этапе кандидаты тоже могут отсеиваться — например, из-за генотоксичности (токсичности для генетического аппарата клетки) или канцерогенности (способности вызывать рак). Еще они могут оказаться небезопасными для беременных женщин или женщин детородного возраста, вызывать поражение головного мозга, печени, почек, сердца или легких. В зависимости от природы молекулы исследования проводят на грызунах, собаках, обезьянах, минипигах, кроликах и т.д.
В зависимости от природы заболевания, особенностей его терапии и свойств лекарства, какие-то исследования могут не проводиться или быть не значимы. Например, оценка канцерогенности лекарства не потребуется, если оно будет применяться в лечении краткосрочных заболеваний, как в случае COVID-19. Генотоксичность не оценивают для биопрепаратов или если лекарство предназначено для лечения метастатического рака и т. д. Суммарно доклинические исследования могут занимать 3–5 лет. Часть из них проводится параллельно с клиническими исследованиями.
Если доклинические исследования успешны, начинается клиническая разработка, которая условно делится на фазы. Это нужно, чтобы постепенно и контролируемо тестировать лекарство на все большем количестве людей. И снова стадийность процесса позволяет прекратить разработку на любом этапе, не подвергая риску многих людей.
- Первая фаза: здесь подтверждают первичную безопасность для людей в принципе, изучают поведение лекарства в организме человека, его биодоступность (способность достигать места действия в достаточных концентрациях), его взаимодействие с другими лекарствами, влияние пищи, половых и возрастных различий на свойства лекарства, а также безопасность для людей с сопутствующими заболеваниями (особенно важны заболевания печени и почек — эти органы отвечают за метаболизм и выведение лекарств), проверяют, не вызывает ли лекарство нарушение ритма сердца. Кроме того, на I фазе оценивают безопасный диапазон доз: эффективные дозы не должны быть неприемлемо токсичными.
- Вторая фаза: здесь начинают проверять эффективность лекарства на пациентах с заболеванием. На ранней II фазе оценивают, работает ли кандидатная молекула на людях с изучаемым заболеванием в принципе, а на поздней II фазе подбирают режим дозирования, если кандидатное лекарство было эффективным. При этом вещество, эффективное в лабораторных экспериментах, на животных моделях заболевания и даже в ранних клинических исследованиях на людях, вполне может не быть таким же рабочим в реальной медицинской практике. Поэтому и нужен длительный процесс поэтапной исключающей разработки, чтобы на выходе получить эффективное и безопасное лекарство.
- Третья фаза: здесь подтверждают эффективность и безопасность лекарства, а также доказывают, что его польза компенсирует те нежелательные реакции, которые неминуемо будет вызывать лекарство. Иными словами, в исследованиях третьей фазы надо понять, что баланс пользы и рисков положителен. Это всегда индивидуально. Например, у людей с ВИЧ в целом допустимо, если противовирусные лекарства вызывают некоторые нежелательные реакции, а в случае онкологических заболеваний приемлемы и более выраженные токсические реакции.
В случае вакцин, которые рассчитаны на здоровых людей, и особенно детей, приемлемы лишь легкие нежелательные реакции. Поэтому найти баланс трудно: вакцина должна быть высоко эффективной, и при этом вызывать минимальное число тяжелых реакций, например реже, чем 1 случай на 1000, 10 000 или даже 100 000 вакцинированных людей. Клиническая разработка может длиться до 5–7 лет, однако низкомолекулярные противовирусные лекарства для краткосрочного применения, как в случае COVID-19, можно протестировать быстрее — за 1–2 года.
Разработка многих отечественных противовирусных и иммуномодулирующих препаратов не соответствует такому научно выверенному процессу разработки.
Шаг 5: производство
Важный этап — наладить производство лекарства. Разработка процессов синтеза начинается в самом начале отбора лидов и постепенно дорабатывается, оптимизируется и доводится до промышленного масштаба.
В настоящее время против SARS-CoV-2 разрабатывается много разных методов лечения:
- низкомолекулярные соединения, которые нарушают жизненный цикл вируса. Трудность в том, что может быть нужно применять сразу несколько противовирусных лекарств. Сейчас надежды возлагают на ремдесивир. Есть данные, что может быть эффективен давно известный гидроксихлорохин, действующий не на сам вирус, а влияющий на иммунитет. Информацию, что комбинация лопинавира и ритонавира оказалась неэффективной у тяжелобольных пациентов, стоит интерпретировать с осторожностью: она может быть эффективна при более легких формах, или для профилактики, или у каких-то определенных подгрупп;
- противовирусные, в том числе моноклональные, антитела, которые связываются с ним на поверхности и блокируют его проникновение в клетку, а также помечают вирус для клеток иммунной системы. Антитела можно получать как биотехнологически, так и выделять из крови переболевших людей. Сейчас тестируются препараты, получаемые с помощью обоих методов;
- вакцины. Они могут представлять собой естественные или модифицированные белки вируса (модификации вводят для усиления выработки иммунитета), живой ослабленный вирус, вирусоподобные наночастицы, синтетический генетический материал вируса (РНК-вакцины) для того, чтобы сам организм человека синтезировал некоторые белки вируса и смог выработать антитела к нему. Одна из проблем в случае вакцин — простое введение белков вируса, пусть и модифицированных, не всегда позволяет сформировать иммунитет, способный защитить от реального заболевания — так называемый стерильный иммунитет. Даже образование антител в ответ на введение вакцины не гарантирует защиты: хорошим примером являются те же ВИЧ и гепатит C, хотя вакцина против гепатита B достаточно проста и при этом высокоэффективна. Хочется надеяться, что отечественные разработчики следуют рекомендациям Всемирной организации здравоохранения по проведению доклинических и клинических исследований вакцин, включая исследования провокации и изучение адъювантов;
- препараты для РНК-интерференции. Так называемые малые интерферирующие рибонуклеиновые кислоты (РНК) — это небольшие отрезки синтетически получаемой РНК, которые способны связываться с генетическим аппаратом вируса и блокировать его считывание, мешая синтезу вирусных белков или воспроизведению генетического материала вируса.
Процесс разработки лекарства — это научный поиск с неизвестным исходом. Он занимает много времени и требует участия большой команды профессионалов разных специальностей. Однако только реальный клинический опыт позволит оценить, удалось ли получить не только эффективное, но и безопасное лекарство, поэтому любое точное определение сроков получения лекарства — спекуляция. Получить эффективную и безопасную вакцину к концу года, если следовать всем правилам научного поиска, вряд ли удастся.
Детальные обсуждения процессов разработки новых лекарств и возникающих в связи с этим проблем — на YouTube-канале PhED.
Пандемический грипп (H1N1) - 2009 Краткое сообщение № 7
6 АВГУСТА 2009 г. | ЖЕНЕВА - После выявления и изоляции нового штамма вируса гриппа с пандемическим потенциалом требуется примерно 5-6 месяцев для получения первых партий одобренной вакцины. Такие сроки необходимы в связи с тем, что процесс производства новой вакцины включает множество последовательных этапов, каждый из которых требует определенного времени. Ниже приводится краткое описание процесса разработки вакцины - от самого начала (получение образца вируса) до конца (наличие вакцины для использования).
1. Выявление нового вируса: В рамках сети, созданной для проведения эпиднадзора, лаборатории во всем мире осуществляют плановый сбор образцов циркулирующих вирусов гриппа и направляют их в Сотрудничающие центры ВОЗ по справочным материалам и научным исследованиям в области гриппа для проведения анализа. Первый этап в процессе производства пандемической вакцины начинается, когда какой-либо из центров выявляет ранее неизвестный вирус гриппа, который значительно отличается от циркулирующих штаммов, и информирует об этом факте ВОЗ.
Вакцинный вирус выращивается в яйцах, так как вирус гриппа хорошо в них размножается и яйца легкодоступны.
2. Подготовка вакцинного штамма (называемого вакцинным вирусом): Данный вирус должен быть сначала адаптирован к использованию для производства вакцины. Чтобы сделать вакцинный вирус менее опасным и более способным к выращиванию в куриных яйцах (технология, используемая большинством производителей), он смешивается со стандартным лабораторным штаммом вируса, и создаются условия для их совместного роста. Через некоторое время образуется гибридный вирус, содержащий внутренние компоненты лабораторного штамма и внешние компоненты пандемического штамма. Для получения гибридного вируса требуется примерно три недели.
3. Верификация вакцинного штамма: После получения гибридного вируса следует провести его тестирование, чтобы убедиться в том, что он действительно производит внешние белки пандемического штамма, является безопасным и может выращиваться в яйцах. По завершении этого процесса, который занимает примерно три недели, вакцинный штамм передается производителям вакцины.
4. Приготовление реагентов для тестирования вакцины (с референс-реагентами): Одновременно с этим Сотрудничающие центры ВОЗ изготавливают стандартизированные вещества (называемые реагентами), которые предоставляются всем производителям вакцины. Они позволяют измерять, какое количество вируса они производят, и обеспечивают наличие надлежащей дозы вакцины во всех упаковках. Этот этап требует, как минимум, три месяца и часто создает серьезные трудности для производителей.
1. Оптимизация условий для роста вируса: Производители вакцины берут гибридный вакцинный вирус, который они получают из лабораторий ВОЗ, и исследуют различные условия его роста в яйцах для нахождения оптимальных условий. Этот процесс занимает примерно три недели.
2. Производство нефасованной вакцины: Для производства большинства противогриппозных вакцин используются 9-12-дневные оплодотворенные куриные яйца. Вакцинный вирус вводится в тысячи яиц, которые затем инкубируются в течение 2-3 дней для размножения вируса. После этого собирается яичный белок, который к этому времени уже содержит миллионы вакцинных вирусов, и из яичного белка выделяется вирус. Частично очищенный вирус убивают с помощью химических веществ. Затем внешние белки вируса очищаются, в результате чего получают несколько сотен или тысяч литров очищенных вирусных белков, которые называются антигенами и являются активными ингредиентами вакцины. Для производства каждой партии антигенов требуется примерно две недели, при этом приготовление новой партии можно начинать через каждые несколько дней. Размер партии зависит от того, сколько яиц производитель может получить, инокулировать и инкубировать. Другим фактором является урожай вируса с каждого яйца. После получения одной партии процесс повторяется так часто, как это необходимо для производства требуемого количества вакцины.
3. Контроль качества: Его можно начинать только после поставки лабораториями ВОЗ реагентов для тестирования вакцины, как описано выше. Каждая партия тестируется и проверяется на стерильность антигена в нефасованной форме. Этот процесс занимает две недели.
4. Расфасовка и выпуск вакцины: Партия вакцины разводится до желаемой концентрации антигена, расфасовывается в ампулы или шприцы и снабжается этикетками. Некоторые из них тестируются на предмет:
- стерильности
- подтверждения концентрации белков
- безопасности путем тестирования на животных.
Этот процесс занимает две недели.
5. Клинические испытания: В некоторых странах каждая новая противогриппозная вакцина должна апробироваться на нескольких испытуемых для подтверждения того, что она действует желаемым образом. Это требует, как минимум, четыре недели. В некоторых странах такое требование может отсутствовать, поскольку проводилось множество клинических испытаний с использованием аналогичной ежегодной вакцины, и это позволяет допустить, что новая пандемическая вакцина будет действовать аналогичным образом.
Прежде чем вакцина может поступить в продажу или вводиться людям, необходимо получить соответствующее разрешение регулирующих ведомств. Каждая страна имеет собственный регулирующий орган и свои правила. Если вакцина производится с использованием тех же процессов, что и вакцина против сезонного гриппа, и изготавливается на том же производственном предприятии, разрешение может быть получено очень быстро (в течение 1-2 дней). Регулирующие ведомства в ряде стран могут требовать проведения клинических испытаний, прежде чем разрешить выпуск вакцины, что требует дополнительного времени.
Весь процесс, при самом оптимистичном сценарии, может быть завершен через 5-6 месяцев. После этого первая партия пандемической вакцины может быть окончательно готова к распределению и использованию.
Обозначения: Пунктирные стрелки с предшествующими сплошными стрелками показывают, сколько времени требуется в первый раз для завершения каждого этапа работы (сплошные стрелки), который затем повторяется (пунктирные стрелки). Сплошные линии показывают, что данный этап работы занимает ограниченный период времени.
Читайте также:


