Как определить цпд вируса
1. Равномерная мелкозернистая деструкция клеток (вирусы Коксаки, ЕСНО, полиовирусы).
2. Очаговая мелкозернистая дегенерация (вирусы гриппа, клещевого энцефалита и др.).
3. Гроздевидная дегенерация (аденовирусы).
4. Крупнозернистая равномерная деструкция (вирус герпеса).
5. Симпластообразование (обезьяньи вирусы, вирусы кори, осповакцины, RS-вирус).
Методы обнаружения вируса в культуре ткани
1. Цитопатический эффект.
2. Реакция гемадсорбции.
3. Метод цветных проб.
5. Иммунофлуоресцентный метод.
6. Реакция связывания комплемента.
7. Реакция гемагглютинации.
8. Заражение животных, восприимчивых к данному вирусу.
9. Реакция преципитации в агаре.
Методы определения типа вирусов (идентификация, типирование вирусов)
Определение типа вирусов в вируссодержащем материале основано на реакции нейтрализации биологического действия вируса (РНБД) типоспецифическими сыворотками. Конечный результат реакции может быть установлен на основании следующих признаков:
1) нейтрализация ЦПД;
2) нейтрализация реакции гемадсорбции;
3) цветная проба;
4) задержка (торможение) гемагглютинации;
5) свечение клеток, содержащих вирус, под влиянием типоспецифических флуоресци-рующих сывороток;
6) нейтрализация в опыте на животных.
1. Чем вирусы отличаются от всех остальных живых организмов?
2. Что такое вирион, капсид, нуклеокапсид, тип симметрии, суперкапсид?
3. Критерии классификации вирусов.
4. Типы вирусных геномов.
5. Методы культивирования вирусов.
6. Заражение лабораторных животных. Правила, способы.
7. Заражение куриных эмбрионов. Правила, способы.
8. Культуры клеток (тканей). Определение, классификация, получение.
9. Признаки размножения вирусов в курином эмбрионе.
10. Методы обнаружения вируса в культуре клеток.
11. Цитопатический эффект, определение, классификация.
12. Методы типирования вирусов.
13. Сущность реакции гемадсорбции.
14. Сущность метода цветных проб.
15. Сущность метода бляшек.
16. Сущность реакции гемагглютинации для обнаружения вирусов.
17. Методы микробиологической диагностики вирусных инфекций.
18. Что такое вирусоскопический метод диагностики?
19. Что такое вирусологический метод диагностики?
20. Типы вирусных инфекций.
21. Особенности и механизмы противовирусного иммунитета.
22. Механизмы персистирования вирусов в организме.
23. Механизмы проникновения вируса в клетку.
24. Где в хозяйской клетке размножаются ДНК- и где РНК-содержащие вирусы?
25. Стадии взаимодействия вируса с клеткой.
26. Что такое вирогения?
27. Механизмы противовирусного действия интерферона.
28. Что такое протоонкоген и онкоген?
29. Формы обмена генетическим материалом у бактерий.
30. Что такое конъюгация, ее механизм.
31. Что такое трансдукция, ее механизмы?
32. Что такое плазмиды, их биологические особенности.
33. Основные классы плазмид.
34. Бактериофаги. Их химический состав и морфология.
35. Типы инфекций, вызываемых бактериофагом. Их особенности.
36. Какая разница между вирулентным и умеренным бактериофагом?
37. Что такое лизогения? Лизогенная конверсия?
38. Стадии взаимодействия Т-чётного фага с бактериальной клеткой.
39. Для чего используются фаги в медицинской практике?
40. Что такое фаготипирование?
З А Н Я Т И Е10
Тема: Микрофлора окружающей среды и организма человека. Санитарно-показательные микроорганизмы (СПМО). Санитарно-бактериологическое исследование воды, воздуха, почвы (1 день).
План занятия:
1. Знакомство с микрофлорой человеческого тела: посев отпечатков пальцев, посев слизи из зева.
3. Санитарно-бактериологическое исследование воды питьевой:
а) определение ОМЧ (разбор схемы);
б) титрационный метод (разбор схемы);
в) метод мембранной фильтрации (разбор схемы).
4. Санитарно-бактериологическое исследование воздуха:
а) посев воздуха седиментационным методом Р. Коха;
б) аспирационный метод (разбор).
5. Санитарно-бактериологическое исследование почвы (разбор).
а) определение общего количества бактерий в почве;
б) определение бактерий группы кишечных палочек (бродильный (титрационный) метод, метод мембранных фильтров, прямой поверхностный посев на плотные питательные среды);
в) определение перфрингенс-титра (посев почвенных разведений в среду Вильсона-Блера, использование сред накопления для определения клостридий в почве);
г) определение нитрифицирующих бактерий.
Методические указания
1. Сделать посев отпечатков пальцев руки на пластинки МПА и среды Эндо.
При помощи стерильного ватного тампона взять материал со слизистой оболочки зева и произвести посев на простой и кровяной МПА.
2. Критерии для СПМО (разбор). Три группы СПМО.
3. Разбор нормируемых микробиологических показателей качества воды: общее микробное число (ОМЧ), общие колиформные бактерии (ОКБ), термотолерантные колиформные бактерии (ТКБ), коли-фаги.
а) Определение ОМЧ (разбор схемы).
Для определения ОМЧ воды чаще всего используют метод 10-кратных разведений, когда концентрация микроорганизмов каждого последующего разведения в 10 раз меньше предыдущего, затем разведения высевают на питательные среды. В пустые стерильные чашки Петри, соблюдая правила асептики, стерильной пипеткой вносят 1 см 3 из заранее приготовленного разведения. Чашки предварительно маркируют (со стороны донышка, а не крышки!), чтобы исключить случайную замену их при падении, сдвиге и др.
Разведения выбирают с таким расчётом, чтобы на чашке выросло от 30 до 300 колоний. Из каждой пробы засевают два разведения. Не позднее чем через 15 мин после внесения материала (разведения) в чашку наливают расплавленного и остуженного до 45 + 5°С 10-12 см 3 питательного агара (питательную среду), толщина слоя которого должна быть 4-5 мм. Расплавленную среду и посевной материал незамедлительно тщательно перемешивают круговыми движениями, чтобы микроорганизмы равномерно распределились в массе среды. Чашки Петри оставляют на холодной горизонтальной поверхности на 10-15 мин для охлаждения и застывания среды, после чего посевы помещают в термостат и инкубируют при заданной температуре и экспозиции.
Для дальнейшей работы выбирают чашки, на которых выросло от 30 до 300 колоний, а при посеве нативного материала - от 1 до 300 колоний. Количество колоний на поверхности и в глубине агара подсчитывают визуально или при помощи лупы с 2-5-кратным увеличением.
б) Определение ОКБ и ТКБ титрационным методом.
Метод основан на накоплении бактерий после посева определенных объемов воды в жидкие питательные среды, с последующим пересевом на дифференциальную плотную среду с лактозой и идентификации колоний по культуральным и биохимическим тестам. При исследовании питьевой воды качественным методом (текущий санэпиднадзор) засевают три объема по 100 см 3 . При исследовании воды с целью количественного определения ОКБ и ТКБ (повторный анализ) засевают соответственно 100, 10 и 1 см 3 — по три объема каждой серии.
в) Определение ОКБ и ТКБ методом мембранных фильтров.
4. Для санитарно-бактериологической оценки состояния воздуха используют седиментационный и аспирационный методы.
а) Седиментационный метод Коха прост, не требует специальной аппаратуры. Суть метода: чашка с питательной средой ставится на рабочем столе, открывается на 10 мин, закрывается и ставится в термостат, где выдерживается двое суток при температуре 37°С, а затем двое суток при комнатной температуре. После этого проводится подсчет выросших колоний по формуле Омелянского.
Для выявления грибов в воздухе посев проводится на среду Сабуро, и чашка выдерживается при 22-25°С до 5 суток. Для выявления патогенных бактерий посевы проводят на дифференциально-диагностические среды: для золотистого стафилококка — на желточно-солевой агар, для энтеробактерий — на среду Эндо с добавлением генцианвиолетта (для торможения роста сапрофитов), для псевдомонад — на среду № 9 (ГФ XI, т. 2). Чашки выдерживают в открытом виде 1 час, после чего ставят в термостат для культивирования при 37°С на двое суток с последующим выдерживанием при комнатной температуре в течение 2 суток.
Расчет по модифицированной формуле Омелянского ведется на 1 м 2 поверхности:
X = n . 10 4 / p . r 2. t ,
где X - ОМЧ воздуха обследуемого помещения (КОЕ); п - количество колоний на чашке (КОЕ); t - время экспозиции чашки (мин); p . r 2 - площадь чашки Петри (см 2 ); 10 4 - пересчет м 2 в см 2 .
Формула Омелянского, даже модифицированная, имеет ряд существенных недостатков: 1) нельзя определить точный объем воздуха, из которого микробы оседают на чашку; 2) мелкодисперсная фаза аэрозоля (а с ним и микробы) практически не оседает и токами воздуха постоянно поддерживается во взвешенном состоянии.
Результаты, получаемые с помощью этого метода, позволяют сравнить, сопоставить степень микробной обсемененности разных помещений и ориентироваться при разработке мероприятий по очищению воздушной среды.
б) Аспирационный метод изучения микрофлоры воздуха основан на использовании ударной струи воздуха, получаемый с помощью аппарата Кротова или других подобных ему аппаратов (импактеры (ПУ-1Б), импинджеры (ПОВ-1), система HiAir Petri TM . Последняя позволяет пропускать до 1000 л воздуха за 200 сек.). Достоинства этого метода:
- точно учитывается объем воздуха, пропускаемого через чашку с питательной средой, установленную в аппарате;
- принцип ударной струи воздуха способствует фиксации на влажной поверхности питательной среде всех взвешенных частиц аэрозоля.
Таким образом, удается фиксировать на поверхности плотной питательной среды максимальное количество микроорганизмов, обитающих в воздухе. Используя различные виды элективных и дифференциально-диагностических питательных сред, можно выявлять в воздухе все основные группы патогенных и условно-патогенных микроорганизмов.
5. Для санитарно-бактериологической оценки состояния почвы используют определение общего количества бактерий, бактерий группы кишечной палочки, а также определение перфрингенс-титра и нитрифицирующих бактерий.
а) При определении общего количества бактерий в почве посев проводят в 1,5% МПА – не менее двух различных разведений пробы в зависимости от степени предполагаемого загрязнения исследуемой почвы. Перед посевом каждое разведение тщательно перемешивают стерильной пипеткой, забирают 1 см 3 суспензии и переносят на дно стерильной чашки Петри. Из каждого разведения посев проводят минимум в две параллельные чашки. После этого в чашки вливают 15-20 см 3 предварительно расплавленного и остуженного до температуры 45 °С питательного агара, тщательно перемешивают с почвенной суспензией и оставляют до застывания в строго горизонтальном положении. После застывания агара чашки с посевами помещают в термостат в перевёрнутом виде (крышкой вниз) при температуре 37 °С на 24 ч. После инкубации подсчитывают выросшие колонии и проводят пересчёт на 1 г почвы.
б) Определение бактерий группы кишечных палочек проводят несколькими методами: бродильным (титрационным), методом мембранных фильтров и прямым поверхностным посевом в плотные питательные среды.
Бродильный (титрационный) метод. При анализе почвы с невысокой степенью фекального загрязнения рекомендуют проводить определение БГКП титрационным методом с использованием среды Кесслер или лактозного бульона с трифенилтетразолием хлорида (ТТХ). 10 см 3 почвенной суспензии первого разведения (1:10) засевают во флакон с 50 см 3 среды, что соответствует посеву 1 г почвы. Последующие разведения высевают по 1 см 3 в пробирки с 9 см 3 той же среды. Перед посевом в каждую пробирку с лактозным бульоном добавляют 0,3 см 3 2% водного раствора ТТХ, а в каждый флакон – по 1,5 мл. Методика посева с использованием ТТХ основана на способности кишечной палочки восстанавливать бесцветное соединение ТТХ в трифенилформазан, выпадающий в осадок, придающий среде коричнево-красный цвет. Кишечная палочка устойчива к действию формазана, в то время как развитие другой микрофлоры подавляется. Посевы на среде Кесслер-Свенертона инкубируют 48 ч при температуре 43 или 37 °С. Отсутствие через 48 ч газообразования и помутнения в бродильных сосудах позволяет дать отрицательное заключение о наличии БГКП. Отрицательное заключение при использовании лактозного бульона с ТТХ дают через 24 ч в том случае, если в пробирках и флаконах цвет среды не изменился. При наличии признаков бактериального роста проводят высев на среду Эндо или розоловый агар. Чашки с посевами инкубируют при температуре 37 °С 24 ч. В случае отсутствия признаков роста на чашках дают отрицательное заключение. Красные, розовые с металлическим блеском, жёлтые и оранжевые колонии на розоловой среде типичны для кишечных палочек. На заключительном этапе исследования проводят идентификацию выросших на агаризованных средах характерных колоний (аналогично анализу БГКП в воде). Результаты анализа выражают коли-титром.
Метод мембранных фильтров используют в качестве ускоренного метода анализа слабозагрязнённых почв. Через стерильные мембранные фильтры № 3 с помощью фильтровального аппарата Зейтца пропускают 5–10 см 3 почвенной суспензии первого разведения, которую предварительно центрифугируют при 2000 об./мин в течение 5 мин. Дальнейшее исследование проводят аналогично анализу БГКП в воде методом мембранных фильтров.
Прямой поверхностный посев на плотные питательные среды применяют для исследования почвы из мест интенсивного фекального загрязнения. Проводят прямой поверхностный посев почвенной суспензии в количестве 0,1 или 0,05 см 3 на среды Эндо. При анализе сравнительно чистых почв посев проводят из разведений 1:10-1:100, для загрязнённых почв используют разведение 1:10 6 . Посевы инкубируют в термостате при температуре 37 °С в течение 24 ч. На следующем этапе исследования идентифицируют выделенные бактерии (аналогично определению БГКП в воде).
Результаты двух последних методов исследований выражают коли-титром или коли-индексом.
в) Определение перфрингенс-титра проводят по двум общепринятым методикам.
Посев почвенных разведений в среду Вильсона-Блера. Из всех почвенных разведений (до 1:10 6 ) образцы по 1 см 3 переносят в 2 параллельных ряда пробирок. Один ряд пробирок прогревают при температуре 80 °С в течение 15 мин и/или при 90 °С – 10 мин. Затем во все пробирки добавляют по 9-10 см 3 свежеприготовленной среды Вильсона-Блера. Инкубацию посевов проводят при температуре 37 или 43 °С в течение 24 ч. Учёт можно проводить и несколько раньше, так как санитарно-показательные клостридии, преимущественно С. perfringens, через несколько часов образуют колонии чёрного цвета. Обнаружение в мазках колоний характерных грамположительных палочек указывает на наличие С. perfringens. Общепринятая методика определения С. perfringens на среде Вильсона-Блера имеет существенный недостаток – питательная среда в определённой степени ингибирует рост микроорганизма. Для устранения этого явления предложена модификация методики.
Использование сред накопления для определения клостридий в почве. По 1 см 3 прогретых и нативных почвенных разведений засевают в пробирки с полужидкими и жидкими питательными средами, предварительно регенерированными кипячением (Клодницкого, Китт-Тароцци, бульона Мартена с ватой и др.). После инкубации посевов в течение 18-20 ч при температуре 37 °С проводят высев 0,5-1 см 3 материала из помутневших пробирок в среду Вильсона-Блера или сульфит-полимиксин-неомициновую среду. Посев, инкубацию и учёт при этом проводят аналогично первому способу.
г) Для определения нитрифицирующих бактерий сеют почвенные разведения во флаконы с минеральной средой Виноградского, разлитой тонким слоем. В ходе эксперимента два флакона со средой оставляют незасеянными в качестве контроля чистоты среды. Посевы инкубируют при температуре 28 °С в течение 14-15 сут. При развитии нитрифицирующих бактерий в среде образуются азотистая и азотная кислоты, которые определяют на 5-7 сутки после посева и вторично – на 14-15. Титр нитрифицирующих бактерий определяют качественной реакцией с дифениламином, который в присутствии азотистой и азотной кислот даёт синее окрашивание. Пастеровской пипеткой несколько капель среды из каждого флакона, не взмучивая осадок, переносят на стеклянную или фарфоровую пластинку, добавляют несколько капель дефениламина, разведённого концентрированной серной кислоте. Синее окрашивание указывает на присутствие в среде продуктов метаболизма нитрифицирующих бактерий. Среда контрольных флаконов должна оставаться без изменения окраски.
Контрольные вопросы
Какие микроорганизмы называют санитарно-показательными?
В чем сущность прямого метода санитарной оценки объектов внешней среды?
Какие существуют показатели-критерии косвенного метода индикации микроорганизмов внешней среды?
Что такое общее микробное число, и какие методы его определения вы знаете?
Какие микроорганизмы относятся к первой группе СПМО?
Какие бактерии называют колиформными?
Какие колонии образуют на среде Эндо типичные лактозоположительные бактерии?
Какие микроорганизмы относятся ко второй группе СПМО?
Что такое титр СПМО?
Что такое индекс СПМО?
Какие микробиологические показатели определяют при оценке качества питьевой воды централизованного водоснабжения?
Как определяют ОМЧ воды?
Что такое ОКБ и ТКБ?
В чем сущность метода мембранных фильтров при определении ОКБ и ТКБ воды?
Какие фильтры используют при исследовании воды?
Какие методы обнаружения микроорганизмов в воде вы знаете?
Как определяется ОКБ в почве?
Какие методы используются для определения БГКП в почве?
В чем сущность бродильного метода определения БГКП?
В каких случаях используется прямой поверхностный посев почвы на плотные питательные среды?
Что такое перфрингенс-титр, и какими методами он определяется?
Какие питательные среды используют для определения перфрингенс-титра?
Какие СПМО почвы вы знаете?
Какие показатели определяют при санитарном анализе почвы?
Какую роль в почве выполняют аммонификаторы и нитрификаторы?
Какие микробиологические показатели определяются при исследовании воздуха?
Что такое резидентная микрофлора воздуха?
Что такое транзиторная микрофлора воздуха?
Какие санитарно-показательные микроорганизмами при исследовании воздуха в закрытых помещениях вы знаете?
На каком принципе основан метод Коха при санитарно-микробиологическом исследовании воздуха?
Какие недостатки имеет метод Коха?
Как можно использовать результаты, полученные при исследовании воздуха методом Коха?
В чем сущность аспирационного метода изучения микрофлоры воздуха?
Какие приборы для отбора проб воздуха вы знаете?
Какие достоинства имеет аспирационный метод исследования воздуха?
Что такое общая бактериальная обсемененность воздуха?
Сайт СТУДОПЕДИЯ проводит ОПРОС! Прими участие :) - нам важно ваше мнение.
В большинстве случаев перед обнаружением вируса в живой системе его следует освободить от компонентов клеток хозяина. Для этого предусмотрены следующие процедуры:
1) для разрушения клеток в материале используют трехкратное замораживание с последующим оттаиванием или растирание материала в гомогенизаторе со стерильным песком или стеклянными бусами;
2) для очистки от клеточного детрита и посторонних примесей полученный таким образом материал подвергают центрифугированию с последующим исследованием надосадочной жидкости или пропускают через бактериальные фильтры. При этом вирус ввиду малых размеров не осаждается при центрифугировании и не задерживается бактериальными фильтрами, оставаясь в жидкости;
3) полученный материал обрабатывают антибиотиками для деконтаминации и предотвращения бактериального загрязнения.
Полученный таким образом материал принято называть вируссодержащим материалом.
Для выявления вирусов в зараженном объекте в настоящее время применяют различные способы (рисунок 1).
Выявление по цитопатическому действию (ЦПД)
Обнаружение ЦПД вирусов в культуре клеток микроскопическим способом.ЦПД представляет собой дегенеративные изменения в клетках, которые появляются в результате репродукции в них вирусов. Одни вирусы проявляют ЦПД в первые дни после заражения культур клеток (вирус оспы, полиомиелита и др.), другие – значительно позже, иногда спустя 2 недели после заражения (аденовирусы, вирусы парагриппа и др.). Характер ЦПД зависит в основном от вида вируса (рисунок 2).
Рисунок 1 – Методы выявления вирусов в зараженном объекте

А – незараженный монослой; Б – зараженный монослой: видно разрушение монослоя и признаки клеточной дегенерации (а – сморщивание и образование звездчатых клеток; b – округление клеток; с – вздутие клеток; d – лизис и образование гранулярного детрита).
Рисунок 2 – Цитопатическое действие вируса полиомиелита на культуре клеток почки обезьяны в неокрашенных препаратах
Различают полную и частичную дегенерацию клеток монослоя. При полной дегенерации, вызываемой, например, вирусами полиомиелита, Коксаки и ECHO, клетки монослоя подвергаются значительным изменениям, большее их количество слущивается со стекла. Остающиеся единичные клетки сморщены (пикноз ядра и цитоплазмы), для них характерно двойное лучепреломление – сильное свечение при микроскопии. Частичная дегенерация культур клеток имеет несколько разновидностей:
а) по типу гроздеобразования – клетки округляются, увеличиваются, частично сливаются между собой с образованием особых гроздевидных скоплений (характерна для аденовирусов);
б) по типу очаговой деструкции – на фоне в целом сохранившегося монослоя появляются очаги пораженных клеток – микробляшки (характерна для некоторых штаммов вирусов оспы, гриппа);
в) по типу симпластообразования – под действием вирусов клетки сливаются между собой с образованием гигантских многоядерных клеток – симпластов, синцитиев (характерна для вирусов кори, паротита, парагриппа, респираторно-синцитиального, герпеса, иммунодефицита человека).
Пролиферативный тип изменений характерен для некоторых онкогенных вирусов, трансформирующих клетки в злокачественные, что проявляется в приобретении ими способности к неограниченному делению.
Выявление по цветной пробе. Принцип данного теста заключается в следующем. В результате жизнедеятельности клеток в питательной среде накапливаются кислые продукты. В результате цвет входящего в состав среды индикатора (фенолового красного) становится оранжевым. При заражении культуры клеток такими цитопатогенными вирусами, как энтеровирусы или реовирусы, метаболизм клеток подавляется, рН среды и ее цвет не изменяются (она остается красной).
Бляшки вирусов представляют собой очаги разрушенных вирусом клеток монослоя под агаровым покрытием. Вирусные бляшки подсчитывают для количественного анализа инфекционной активности вирусов.
Для получения бляшек разные разведения вирусной суспензии наносят на однослойные культуры ткани в плоских флаконах или чашках Петри и покрывают их слоем агарового покрытия. При этом репродукция вируса и ЦПД ограничиваются только первоначально инфицированными и соседними с ними клетками. Очаги клеточной дегенерации (бляшки) выявляют путем окрашивания культуры нейтральным красным, который либо включают в состав агарового покрытия, либо добавляют непосредственно перед учетом результатов. Бляшки состоят из погибших клеток, не окрашиваются нейтральным красным и поэтому выглядят в виде светлых пятен на фоне розово-красного монослоя.
Известны и другие способы выявления вирусных бляшек в культурах клеток. Так, например, используется определение бляшек под бентонитовым покрытием. Мелкодисперсный очищенный бентонит добавляют к жидкой питательной среде, и этой смесью заливают инфицированный монослой клеток. В результате адсорбции частиц бентонита на поверхности клеток монослой приобретает молочный цвет. В месте размножения вируса, где клетки частично или полностью слущены со стекла, бентонитовое покрытие нарушено (бляшки).
Для выявления вирусных бляшек под бентонитовым питательным покрытием применяют многослойные культуры перевиваемых клеток человека или животных, чувствительные к исследуемому вирусу, пригодны 2-суточные негустые монослои клеток. Готовят 10-кратные разведения из исследуемого материала, каждым разведением инфицируют не менее двух матрацев (колб Эрленмейера или пенициллиновых флаконов) с культурой клеток. После адсорбции вируса (от 30 до 40 мин) монослои от 3 до 4 раз отмывают стерильным ИХН и заливают бентонитовым питательным покрытием: бидистиллированная вода – 415 мл, 6 %-й гель бентонита – 5 мл, раствор Эрла (десятикратный концентрат) – 50 мл, нативная бычья сыворотка – 15 мл, 7,5 %-й раствор гидрокарбоната натрия – 15 мл, пенициллин – 200 ЕД/мл, стрептомицин или линкомицин – 100 ЕД/мл. Монослой зараженных клеток в колбах Эрленмейера емкостью 50 мл заливают от 20 мл до 30 мл бентонитового покрытия, а монослой клеток на дне пенициллинового флакона – от 5 мл до 6 мл.
Гель бентонита получают из сухого минерала. Чтобы улучшить сорбционные свойства бентонита, его насыщают катионами натрия. Затем его стерилизуют 40 мин при 111 °С. Сорбционные свойства геля бентонита не изменяются в процессе хранения при комнатной температуре в течение ряда лет.
Время бляшкообразования под бентонитовым покрытием для различных вирусов неодинаково. Результаты образования бляшек для энтеровирусов, например, учитывают через промежуток времени от 36 до 48 ч. Культуральные сосуды переворачивают монослоем вверх, смывая средой дегенерировавшие клетки. Бляшки, образуемые различными типами энтеровирусов, отличаются по величине, интенсивности развития и характеру краев. Поскольку одна вирусная инфекционная частица (вирион) образует одну бляшку, метод бляшкообразования позволяет точно определить количество инфекционных единиц в материале, а также измерить нейтрализующую активность вирусных антител.
Выявление по реакции гемадсорбции (РГАд)
Реакцию гемадсорбции (РГАд) применяют для индикации в зараженных культурах клеток вируса, обладающего гемагглютинирующей активностью. Сущность реакции заключается в том, что на поверхности клеток, зараженных вирусами, адсорбируются эритроциты, чувствительные к гемагглютинирующему действию вирусов. Так, например, на клетках, зараженных вирусом натуральной оспы, адсорбируются эритроциты кур; вирусом кори – эритроциты обезьян; аденовирусами – обезьян и крыс и др. (рисунок 3).

1 – островковый тип адсорбции эритроцитов на зараженных клетках; 2– незаряженные клетки.
Рисунок 3 –Реакция гемадсорбции
Методика РГадс следующая. Из пробирок с зараженными и незараженными культурами клеток удаляют питательную среду и вносят по 0,2 мл 0,4 % взвеси в изотоническом растворе хлорида натрия трижды отмытых эритроцитов. Пробирки оставляют в наклонном положении на промежуток времени от 20 до 30 мин при температуре 37 °С, 22 °С или 4 °С. Затем пробирки осторожно встряхивают и исследуют под малым увеличением микроскопа. На клетках монослоя, зараженных вирусом, наблюдается диффузная или локальная адсорбция эритроцитов в виде скоплений, гроздей и розеток. При отрицательном результате на монослое адсорбируются лишь единичные эритроциты. Гемадсорбция предотвращается обработкой зараженного вирусами монослоя специфической сывороткой.
Эта реакция позволяет выявить вирусы до развития ЦПД благодаря адсорбции эритроцитов на поверхности клеток, инфицированных гемадсорбирующими вирусами. Эти сложные вирусы имеют в составе супер-капсида специфические гликопротеиды – гемагглютинины (например, орто- и парамиксовирусы). Для воспроизведения РГАд в культуру клеток (контрольную и зараженную вирусом) после определенного для каждого вируса срока инкубации добавляют 0,2 мл 0,5 %-й взвеси эритроцитов так, чтобы был покрыт монослой и оставляют ее на время от 15 до 20 мин при 4 °С, 20 °С или 37 °С (в зависимости от свойств вируса). Затем пробирки встряхивают для удаления неадсорбированных эритроцитов и учитывают под малым увеличением микроскопа скопление их на отдельных клетках или на всем монослое. На незараженных клетках эритроцитов не должно быть. Следует отметить, что не все вирусы, агглютинирующие эритроциты in vitro, способны вызывать гемадсорбцию в культуре клеток. Гемадсорбция наблюдается лишь в том случае, если в процессе взаимодействия вируса с клеткой вирусный гемагглютинин встраивается в структуру наружной клеточной мембраны и тем самым изменяет ее свойства.
Нам важно ваше мнение! Был ли полезен опубликованный материал? Да | Нет
Для выявления (индикации) вирусов применяются следующие методы.
Индикация вирусов в культуре клеток осуществляется, прежде всего, по цитопатическому действию (ЦПД) вирусов, сроки и характер которого зависят от свойств вируса, проявляясь дегенеративными изменениями клеток с последующей их гибелью и отслаиванием от стекла (рис. 29).
Полная дегенерация клеток сопровождается значительными изменениями в виде пикноза ядра и цитоплазмы, отслаиванием клеточного монослоя от стекла.
Частичная дегенерация культур клеток может протекать по следующим типам:
- гроздеобразования (округление, увеличение и слияние клеток с образованием гроздевидных скоплений, типично для аденовирусов),
- очаговой деструкции (очаги пораженных клеток на фоне в целом сохранившегося монослоя), характерной для вирусов гриппа;
- симпластообразования (слияние клеток с образованием гигантских многоядерных клеток в виде симпластов или синцитиев, характерных для вирусов кори, паротита, парагриппа, респираторно-синцитиального, герпеса, иммунодефицита человека).
Пролиферативный тип ЦПД с трансформацией клеток в злокачественные, обладающие неограниченными потенциями к росту, способны вызывать онкогенные вирусы.
Сроки, в течение которых наступает ЦПД, вариабельны (например, 1-2 дня у полиовирусов, 7-14 суток у аденовирусов).


А б
Рис. 29. Культура клеток почек обезьян (а – незараженная, б – цитопатическое действие вируса) х 200
Индикация вирусов с помощью реакции гемадсорбции (РГад).
Сущность этой реакции заключается в способности эритроцитов человека или животных адсорбироваться на поверхности клеток, инфицированных рядом вирусов (например, орто и парамиксовирусов и др.) в ранние сроки их репродукции (до развития ЦПД) в результате действия гемагглютининов – гликопротеидов, входящих в состав суперкапсида вируса. Для постановки РГад в культуру клеток добавляют 0,2 мл 0,5%-й взвеси эритроцитов, выдерживают 15-20 мин при температуре 4 0 , 20 0 или 37 0 С в зависимости от свойств вируса, после чего взвесь эритроцитов удаляют и производят учет реакции под малым увеличением микроскопа по скоплению эритроцитов на отдельных клетках или на всем монослое.
Индикация вирусов по цветной пробе.
Принцип метода основан на определении кислых продуктов метаболизма, накаливающихся в клетке в процессе ее жизнедеятельности с помощью индикатора фенолового красного, меняющего свой цвет с красного в щелочной среде на оранжево-желтый в кислой среде. При заражении культуры клеток вирусами, вызывающими ЦПД (например, аденовирусы, энтеровирусы и др.), метаболизм клеток подавляется, рН среды не меняется и она остается окрашенной в красный цвет.
Индикация вирусов по внутриклеточным включениям.
Репродукция некоторых вирусов (оспы, герпеса, бешенства) приводит к образованию внутриклеточных включений, локализующихся в цитоплазме или в ядре клеток и представляющих собой скопления вируса (или его антигенов). Включения выявляют путем световой микроскопии культур клеток, окрашенных по Романовскому - Гимзе или другими методами, а также с помощью прямого флюорохромирования (например акридиновым оранжевым) с последующей микроскопией препаратов в люминесцентном микроскопе.
Индикация вирусов с помощью прямой РИФ – выявлениевирусных антигенов, находящихся в инфицированной клетке культуры ткани, с помощью антител диагностической иммунной сыворотки, специфических иммуноглобулинов или моноклональных антител, меченых флюорохромом, обычно флюоресцеином (рис. 30).
Индикация вирусов с помощью электронно-микроскопического метода (ЭММ) применяется, в основном, в научных исследованиях. Материал для ЭММ концентрируют различными методами (ультрацентрифугирование, хроматография на колонках, адсорбцией с помощью специальных сорбентов или антител – для метода иммунной электронной микроскопии). ЭММ позволяет обнаружить в ядре или цитоплазме клеток отдельные вирионы, а также их скопления. В практических целях ЭММ может быть полезен для индикации и идентификации вирусов с типичной морфологией (оспенные вирусы, ротавирусы, коронавирусы, ВИЧ и т.д.).
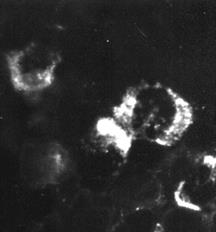
Рис. 30. Реакция иммунофлюоресценции (РИФ) – выявление вирус-специфических антигенов. х 900
Индикация вирусов по образованию бляшек - очагов разрушенных вирусом монослоя культуры клеток под агаровым покрытием. Количество бляшек отражает инфекционную активность вируса.
Для постановки этой пробы вирусную суспензию в разных разведениях вносят в культуры ткани, находящиеся в плоских сосудах, после чего монослой клеток заливают гелем (слой агара или бентонита с индикатором нейтральным красным). Время бляшкообразования для большинства вирусов, обладающих ЦПД, варьирует от 36 до 48 ч. Бляшки выглядят в виде неокрашенных светлых пятен на розово-красном фоне окрашенного монослоя. В бентонитовом методе монослой клеток молочного цвета, бляшки прозрачные.
Зараженные РКЭ инкубируют в термостате при 35- 37 0 С в течение 48 -72 ч., после чего производят их вскрытие, амниотическую и аллантоисную жидкость отсасывают шприцем, а оболочки и эмбрион извлекают и помещают в стерильные чашки Петри. При репродукции некоторых вирусов (натуральной оспы, осповакцины, простого герпеса) на ХАО куриных эмбрионах появляются характерные бляшки - беловатые пятна диаметром 1-2 мм, количество которых соответствует числу инфекционных частиц.
В аллантоисной и амниотической жидкости зараженных эмбрионов ряд вирусов (например, ортомиксовирусы, парамиксовирусы, аденовирусы и т.д.) может быть выявлен с помощью реакция гемагглютинации (РГА). Принцип реакции состоит в способности гемагглютининов - поверхностных вирусных структур гликопротеидной природы этих вирусов склеивать (агглютинировать) эритроциты определенных видов животных, птиц или человека. РГА не относится к иммунологическим реакциям, поскольку в ее основе отсутствует взаимодействие АГ и AT.
Гемагглютинационный титр (максимальное разведение вирусосодержащей жидкости, вызывающее агглютинацию эритроцитов - одна гемагглютинирующая единица вируса,1 ГЕ) соответствует концентрации вируса. Агглютинацию эритроцитов могут вызывать также некоторые бактерии (стафилококки, эшерихии, сальмонеллы, шигеллы, холерный вибрион Эль-Тор), что необходимо учитывать при трактовке результатов РГА при исследовании вирус-содержащего материала, загрязненного бактериальной микрофлорой.
Определение титра вирусов можно проводить также на хорионаллантоисной оболочке.Для этого в лунки стерильных полистироловых пластин помещают кусочки скорлупы 11-12-дневного куриного эмбриона с неповрежденной ХАО, добавляют вирусосодержащую жидкость в десятикратных разведениях на буфере, накрывают пластины фольгой и инкубируют при 35-37 0 С в течение 24-72 часов. После этого скорлупу удаляют, добавляют 0,5% взвесь куриных эритроцитов и производят учет реакции по эффекту гемагглютинации, который свидетельствует о репродукции вируса.
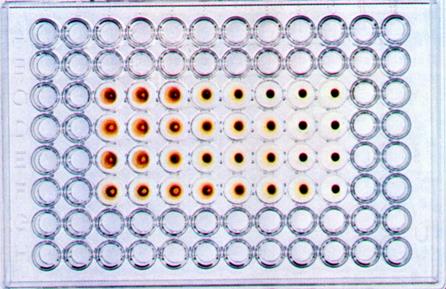
Рис. 31. Реакция гемагглютинации для выявления вируса гриппа в хорион-аллантоисной жидкости куриного эмбриона.
Индикация вирусов в организме лабораторных животных находится в зависимости от вируса и вида чувствительного лабораторного животного, будет описана в лабораторной диагностике конкретных вирусных инфекций.
Идентификация вирусов проводится с помощью следующих методов .
Учет вирусиндуцированных патологических изменений в чувствительных живых системах.
Изучение антигенных свойств вирусов в серологических реакциях с противовирусными сыворотками является основным методом идентификации вирусов. Для этого используют ряд иммунологических реакций.
Реакция нейтрализации основана на способности антител нейтрализовать инфекционную активность вирусов в культурах ткани, РКЭ, чувствительных лабораторных животных. Из вирус-содержащего материала готовят десятикратные разведения и добавляют к ним специфическую сыворотку в разведении в соответствии с титром, указанным на этикетке ампулы. Смеси вирус-сыворотка инкубируют 30 — 60 мин при 37 °С для обеспечения связывания антигенов с антителами, после чего смесью заражают культуру ткани, куриные эмбрионы или лабораторных животных. Контролем является чувствительная биосистема, зараженная вирусом без сыворотки.
Реакция считается положительной в случае нейтрализации ЦПД в культуре клеток, а также при отсутствии патологических изменений в куриных эмбрионах или в организме животных. По результатам РН высчитывается индекс нейтрализации (ИН - отношение титра вируса в контроле к титру вируса в опыте). При ИН менее 10 реакция расценивается как отрицательная, от 11 до 49 — сомнительная, от 50 и выше — положительная.
РН может быть поставлена в наиболее чувствительном варианте - подавления вирусного бляшкообразования под действием вирусспецифической антисыворотки. Для этого к вирус-содержащему материалу добавляют соответствующую искомому вирусу антисыворотку и после инкубации в термостате при 37 0 С течение 30-60 мин смесь вносят в культуру чувствительных клеток. Бляшкообразование выявляют в слое агара или бентонита. Идентичность вируса антителам сыворотки проявляется подавлением бляшкообразования.
Другим вариантом РН является цветная проба. Положительный результат пробы в случае соответствия вируса противовирусным антителам проявляется блокадой репродукции вируса, клетка при этом остается жизнеспособной, вырабатывая кислые продукты метаболизма, под влиянием которых цвет индикатора (фенолового красного) меняется с красного на желтый. Для постановки пробы в пробирки вносят по 0,25 мл рабочего разведения вируса и соответствующую антисыворотку.
Смесь выдерживают при комнатной температуре 30-60 мин, добавляют в каждую пробирку по 0,25 мл клеточной суспензии и закрывают их резиновыми пробками. Пробирки инкубируют в термостате при 37 0 С 6-8 дней, результаты реакции учитывают по изменению цвета индикатора (красный цвет индикатора соответствует щелочному характеру рН - 7,4 указывая на репродукцию вируса и подавление метаболизма клеток; желтый цвет свидетельствует о кислом рН - ниже 7,2 в результате нейтрализации вируса антителами и активном метаболизме клеток с выработкой кислых продуктов обмена).
Перед постановкой РТГА сыворотки обрабатывают периодатом калия, каолином, бентонитом, ацетоном или другими веществами для удаления неспецифических ингибиторов гемагглютинации. После этого к двукратным разведениям сыворотки добавляют равное количество вируссодержащей жидкости с активностью 4 ГЕ, смесь инкубируют 30-60 мин при оптимальной для данного вируса температуре (4 0 , 20 0 , 37 0 С), а затем добавляют равный объем 0,5-1,0% взвеси эритроцитов. Смесь снова инкубируют 30-45 мин и производят учет результатов реакции. Титром сыворотки считают ее наибольшее разведение, которое вызывает торможение гемагглютинации.
Реакция торможения гемадсорбции (РТГадс) основана на нейтрализации эффекта адсорбции эритроцитов на поверхности клеток, инфицированных вирусами, способными вызывать гемадсорбцию. Для постановки реакции по 0,2 мл специфической сыворотки, разведенной 1:5, вносят в пробирки, инкубируют 30-60 мин в термостате при оптимальной для данного вируса температуре, затем добавляют по 0,2 мл 0,5% взвеси эритроцитов. Контрольные пробы содержат неиммунную сыворотку и эритроциты. Пробирки снова инкубируют 20-30 мин, после чего производят учет реакции. Идентификация вируса основывается на признаке отсутствия адсорбции эритроцитов на клетках в присутствии иммунной сыворотки при наличии гемадсорбции в контрольных пробирках.
Для антигенной идентификации вирусов в клетках культур тканей используются также РПГ, РСК, РИФ, РОПГА ИФА, РИА со специфическими иммунными противовирусными сыворотками или моноклональными AT.
- выявление вирусной НК методами генодиагностики с помощью метода молекулярной гибридизации и ПЦР;
- электронно-микроскопическое изучение вирусов (см. выше).
Читайте также:


