Изолят вируса что это
Вирус болезни Ньюкасла (БН) широко распространенное заболевание, регистрируемое во многих странах и поражающее многие виды диких и домашних птиц.
Несмотря на значительные успехи в диагностике, эпизоотологии, изучении патогенности вируса БН на молекулярном уровне, проблема борьбы с этим особо опасным заболеванием птиц остается актуальной [1, 2]. В основе профилактики болезни Ньюкасла лежат неспецифические и специфические средства защиты и методы их осуществления [3, 4].
Возбудитель БН – РНК-содержащий вирус (парамиксовирус птиц типа 1) являющийся таксоном рода Avulavirus, подсемейства Paramyxovirinae, семейства Paramyxoviridae, порядка Mononegavirales и характеризующийся минус-нитевым РНК-геномом. Его вирионная РНК представлена шестью генами, кодирующими гемагглютинин-нейраминидазу (HN), нуклеопротеин (NP), фосфопротеин (P), матриксный белок (М), РНК-зависимую РНК-полимеразу (L) и белок слияния (F), и двумя неструктурными белками V и W [5].
Для идентификации изолятов вируса болезни Ньюкасла были использованы полимеразная цепная реакция в реальном времени (РВПЦР) и антигенный анализ с помощью моноклональных антител. Реагенты для реакции были предоставлены Шведским ветеринарным университетом (SVA) города Упсала.
Для выделения вируса использовали клоакальные смывы и кусочки органов от домашних и диких птиц. До начала исследований пробы хранили в низкотемпературном морозильнике (±70 ºС).
РНК вируса БН выделяли с помощью коммерческого набора RNeasy Mini Kit (QIAGEN, Германия) согласно инструкции. Реакционный объем составил 20 мкл, а концентрация праймеров 10 мкмоль на реакцию. Постановка реакции была проведена согласно протоколу к диагностическому набору. Был проведен 1 цикл в режиме 50 °С – 15 мин, 95 °С – 5 мин и 45 циклов амплификации в режиме 90 °С – 30 сек, 60 °С – 60 сек. РВПЦР проводили в приборе Rotor Gene 6 000 (Software). Результаты проведенной РВ-ПЦР приведены в таблице.
Таблица. Результаты исследованных образцов БН в РВ-ПЦР
| Область | Вид птиц | Количество исследованны х птиц | Трахеальный смыв | Клоакальный смыв | ||
| количество образцов | результат | количество образцов | результат | |||
| Джамоат Мирзо Ризо, г. Гиссар | утка | 2 | 2 | отрицательный | 2 | отрицательны й |
| цыпленок | 2 | 2 | положительный | 2 | отрицательны й | |
| голубь | 2 | 2 | отрицательный | 2 | отрицательны й | |
| куропатка | 1 | 1 | положительный | 1 | отрицательны й | |
| индюк | 1 | 1 | положительный | 1 | отрицательны й | |
| Джамоат Чимтепп а | дикий голубь | 3 | 3 | положительный | 3 | отрицательны й |
Как видно из таблицы, из 22 исследованных проб в 2-х выявлены РНК вируса болезни Ньюкасла. При этом положительный результат отмечен только у кур. Все пробы уток, голубей, куропаток, индюков из Гиссарского района и диких голубей из джамоата Чимтеппа района Рудаки дали отрицательный результат в РВ-ПЦР. Результаты ПЦР в реальном времени приведены на рис. 1.
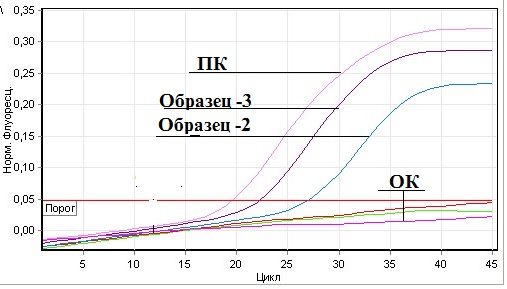
Рис.1. Результаты РВ-ПЦР на вирус БН
Премечание: ПК – положительный контроль; ОК — отрицательный контроль; Образец-2 – трахеальный смыв цепленка 1.1; Образец-3 – трахеальный смыв цепленка 2.1.
Совместно со специалистами Шведского национального ветеринарного университета (SVA, Упсала) изучено филогенетическое дерево изолята вируса болезни Ньюкасла, выделенного в Таджикистане.
При скрининге материалов Гиссарского района в ПЦР получены положительные результаты с обнаружением специфических продуктов 300 пар оснований, что свидетельствует о наличии РНК вируса БН в исследованных образцах.
После выделения вируса проведено секвенирование фрагмента гена, кодирующего белок слияния (F-протеин). В результате секвенирования расшифрована последовательность нуклеотидов, которая включает сайт расщепления белка слияния, что важно для выявления его патогенности.
Для определения филогенетических взаимоотношений секвенированного вируса осуществлен анализ имеющихся в международной базе данных полных нуклеотидных последовательностей F-гена (GGRRQKRFIGAV) ПМВ-1.
Результаты молекулярно-биологического исследования в полимеразной цепной реакции с обратной транскрипцией (ОТ-ПЦР) и методом нуклеинового секвенирования генома позволили идентифицировать изолят от домашних птиц, относящийся к авулавирусу птиц 1- серотипа,7i — генотипа (VIIi), т.е. вирус БН (Avian Avulavirus type 1) (рис. 2).
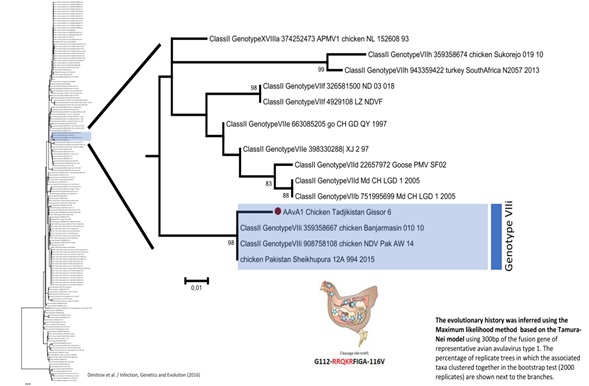
Рис. 2. Дендрограмма Гиссарского изолята вируса болезни Ньюкасла по антигенному родству выполненная в Шведском национальном ветеринарном университете (SVA), Упсала.
Как видно из рис. 2, Гиссарский изолят вируса болезни Ньюкасла (на рисунке текст выделен) по антигенному варианту совпадает на 98 % с штаммами стран южной Азии, такими как Шри Ланка и Пакистан.
Заключение
Таким образом, с помощью ОТ-ПЦР и моноклинальных антител показана степень антигенного родства вируса болезни Ньюкасла, циркулирующего в Таджикистане, с вирусами из других стран.
Авторы
Д. М. Шоназар, кандидат ветеринарных наук, заведующий лабраторией диагностики вирусных болезней животных и птиц Института проблем биологической безопасности ТАСХН (ИПББ), Душанбе
Г. Н. Мамадатохонова, старший научный сотрудник Института проблем биологической безопасности ТАСХН (ИПББ), Душанбе
С. Зохари, микробиолог, Шведский национальный ветеринарный университет (SVA), Упсала
Библиографические ссылки
1. Безбородова Н. А., Ким Н. А.Сравнение лабораторных методов диагностики инфекций, вызываемых патогенными и условно-патогенными микроорганизмами // Эффективное животноводство. 2018. № 2 (141). С. 46–47.
2. Методы клинико-лабораторной диагностики острых респираторных вирусных инфекций у крупного рогатого скота / Порываева А. П., Печура Е. В., Вялых И. В., Томских О. Г., Бусыгина Н. С. // Вопросы нормативно-правового регулирования в ветеринарии. 2017. № 3. С. 55–58.
3. Alexander D. J. Newcastle disease and other avian paramyxoviruses Rev Sci Tech, 2000. № 19 (2). Р. 443–462.
4. Kaverin N. V., L’vov D. K. Paramiksovirusy (Paramyxoviridae) [Paramyxoviruses]. V kn.: Medicinskaja virusologija, 2008. Р. 183–189.
Аннотация научной статьи по ветеринарным наукам, автор научной работы — Лоивская О.Ю., Люлькова Л.С., Маркова Е.В., Матвеева И.Н., Преображенская А.С.
Статья посвящена выделению и идентификации изолята вируса болезни Ауески . Изолят вируса был выделен от кота, павшего на территории г. Москвы, от болезни Ауески в перевиваемой культуре клеток почки телёнка MDBK. В результате установлено, что изолят вируса высоко патогенен для лабораторных животных: кроликов, морских свинок и крыс. К изоляту вируса были чувствительны другие перевиваемые клеточные линии: Taurus-1 и ВНК-21. Характер ЦПД в разных культурах клеток был одинаковым. Способность к репродукции в культуре клеток изучаемого изолята вируса достигала максимума к 4-6 пассажу и составляла 6,81-7,61 lgТЦД50/см3. Наличие вируса болезни Ауески подтверждено биопробой и другими лабораторными методами, в том числе ПЦР . Метод ПЦР позволил выявлять геном вируса в вирусосодержащем культуральном и в органно-тканном материале. Неспецифических реакций не наблюдалось. ПЦР-продукты обнаруживали ожидаемого размера. Вирусосодержащий материал изолята вируса болезни Ауески используется при изучении биологических и молекулярно-биологических свойств.
Похожие темы научных работ по ветеринарным наукам , автор научной работы — Лоивская О.Ю., Люлькова Л.С., Маркова Е.В., Матвеева И.Н., Преображенская А.С.
ISOLATION AND IDENTIFICATION OF ISOLATED AUESCI'S DISEASE VIRUS
The article is dedicated to isolation and identification of the Aujeszky's disease virus isolate . The virus isolate was isolated from a cat who died in Moscow from Aujeszky’s disease in an inoculated culture of MDBK calf kidney cells. As a result, it was found that the virus isolate is highly pathogenic for laboratory animals: rabbits, guinea pigs and rats. Other transplantable cell lines were sensitive to the virus isolate : Taurus-1 and BHK-21. The nature of the CPP in different cell cultures was the same. The ability to reproduce in the cell culture of the studied virus isolate reached a maximum at passage 4-6 and amounted to 6.81-7.61 lg TCD50 / cm3. The presence of Aujeszky's disease virus is confirmed by bioassay and other laboratory methods, including PCR . The PCR method made it possible to identify the virus genome in virus-containing culture and in organ-tissue material. Nonspecific reactions were not observed. PCR products showed the expected size. The virus-containing material of the Aujeszky's disease virus isolate is used in the study of biological and molecular biological properties.
УДК 619:616.98:578.824.11 DOI 10.33632/1998-698Х.2020-2-21-26
ВЫДЕЛЕНИЕ И ИДЕНТИФИКАЦИЯ ИЗОЛЯТА ВИРУСА БОЛЕЗНИ АУЕСКИ
1'2 Лоивская О.Ю. - аспирант, хЛюлькова Л.С. - доктор биологических наук, хМаркова Е.В. - кандидат сельскохозяйственных наук, 1Матвеева И.Н. - доктор биологических наук, профессор, 1Преображенская А.С. - соискатель
:ФГБНУ Всероссийский научно-исследовательский и технологический институт биологической промышленности (141142, Московская область, пос. Биокомбината, ВНИТИБП, е-mail: biolog1967@mail.ru)
Статья посвящена выделению и идентификации изолята вируса болезни Ауески. Изолят вируса был выделен от кота, павшего на территории г. Москвы, от болезни Ауески в перевиваемой культуре клеток почки телёнка MDBK. В результате установлено, что изолят вируса высоко патогенен для лабораторных животных: кроликов, морских свинок и крыс. К изоляту вируса были чувствительны другие перевиваемые клеточные линии: Таыгш-1 и ВНК-21. Характер ЦПД в разных культурах клеток был одинаковым. Способность к репродукции в культуре клеток изучаемого изолята вируса достигала максимума к 4-6 пассажу и составляла 6,81-7,61 ¡^ТЦД5С/см3. Наличие вируса болезни Ауески подтверждено биопробой и другими лабораторными методами, в том числе ПЦР. Метод ПЦР позволил выявлять геном вируса в вирусосодержащем культуральном и в органно-тканном материале. Неспецифических реакций не наблюдалось. ПЦР-продукты обнаруживали ожидаемого размера. Вирусосодержащий материал изолята вируса болезни Ауески используется при изучении биологических и молекулярно-биологических свойств.
Ключевые слова: изолят вируса, культура клеток, репродукция, болезнь Ауески, цитопатическое действие, инфекционная активность, ПЦР.
Болезнь Ауески — острая вирусная болезнь домашних и некоторых диких животных, в том числе пушных зверей и грызунов, характеризуется лихорадкой, воспалением легких, признаками поражения головного и спинного мозга, что проявляется различными нервными расстройствами (сильное возбуждение, судороги, параличи), сильными зудом и расчесами у всех животных кроме свиней, норок и соболей. Болезнь Ауески распространена практически по всему миру и наносит большой экономический ущерб животноводству развитых стран. Возбудителем болезни является вирус, относящийся к семейству Herpesviridae, подсемейству Alphaherpesvirinae. Свиньи являются естественным хозяином вируса, остаются пожизненными его носителями, причем в любой момент возможна реактивация латентного возбудителя (Mu'ller et al.,2011).
Для культивирования вирусов перспективны перевиваемые линии клеток, так как обеспечивают получение больших объёмов вирусосодержащего материала, который при-
меняется при исследовании биологических, молекулярно-генетических свойств вируса, а также используется в качестве лабораторной модели для изучения эволюции вируса, разработки средств диагностики и специфической профилактики (Fonseca et al., 2010; Steinrigl A. et al.,2012).
Целью настоящей работы было выделение и идентификация изолята вируса болезни Ауески.
Результаты исследований. Характер ЦПД выделенного изолята вируса в культуре клеток MDBK представлен на рисунке 1.
В процессе наработки вирусного материала изолята вируса болезни Ауески в моно-слойной перевиваемой культуре клеток МББК установили, что к 4-6 пассажам вирус достигал максимальных титров. Оценивали величину накопления инфекционности вируса по наступлению 70-90% цитопатического эффекта. Репродуктивная способность изучаемого изолята вируса достигала максимума к 46 пассажу и составляла 6,81-7,61 ^ТЦД50/см3. И дальнейшее пассирование не повышало исходной активности. Полученные результаты
свидетельствуют, что динамика адаптации изолята вируса не имела существенных различий, и после адаптации изолят вируса стабильно сохраняли свойственный ему уровень репродуктивной активности в течение всего периода исследований.
Исследования по определению оптимальной заражающей дозы проводились в трех повторностях, с последующим определением биологической активности вируссодержащих суспензий. Результаты проведённых исследований представлены в таблице 1.
Таблица 1 - Накопление изолята вируса болезни Ауески в культуре клеток MDBK, в
зависимости от инфицирующей дозы и сроков культивирования, (п=3)
Множествен ность заражения ТЦД50/см3 Биологическая активность в ^ ТЦД50/см3 в различные сроки культивирования, час
12 24 36 48 60 72
0,0001 2,30±0,06 3,30±0,21 4,4±0,07 4,7±0,19 4,1±0,08 3,56±0,12
0,001 3,20±0,21 3,6±0,12 4,00±0,09 4,83±0,14 4,5±0,08 4,2±0,15
0,01 4,10±0,07 5,7±0,09 6,75±0,19 7,00±0,13 6,83±0,03 6,55±0,20
0,1 5,20±0,14 5,76,20 6,5±0,18 6,84±0,02 7,05±0,09 6,84±0,15
1,0 5,6±0,03 6,30,15 7,00±0,12 6,75±0,14 6,5±0,12 6,20±0,14
Как следует из данных таблицы 1, уровень накопления вируса в культуре клеток, инфицированной в дозах 0,0001 и 0,001 ТЦД50/мл, достигал максимума через 48 ч и затем снижался. Активность вирусного материала из проб, инфицированных в дозе 1,0 ТЦД50/см3, достигала максимума через 36 ч и затем также отмечалась тенденция к снижению. При инфицировании клеток вирусом в дозе 0,01 -0,1 ТЦД50/см3 максимальный уровень накопления вируса отмечали через 48-60 ч.
Оценку эффективности концентрации сыворотки крови в составе поддерживающей
среды проводили по результатам накопления вируса и состоянию культуры клеток. Результаты исследований представлены в таблице 2. Как следует из данных, представленных в таблице 2, использование в поддерживающей среде 2 и 5% сыворотки крупного рогатого скота существенно не оказывает заметного влияния на активности получаемых вируссодержащих материалов штамма. Титры вируса были в пределах 7,5 ^ ТЦД50/см3. При 1% содержании сыворотки титр вируса был сравнительно ниже и составлял 6,23^ ТЦД50/см3.
Таблица 2 - Накопление изолята вируса в культуре клеток с использованием поддерживающей
среды с различным содержанием нативной сыворотки крупного рогатого скота (п=3)
Концентрация Срок появления ЦПД Период Титр инфекционной
сыворотки крови вируса в культуре культивирования активности вируса, ^ ТЦД50/ см3
крупного рогатого клеток, час вируса, час
1,0 24 48-72 6,23±0,13
2,0 24 48-60 7,6±0,19
5,0 24 48-60 7,5±0,21
Максимальное накопление вируса в вируссодержащем материале происходило на 48-60 час. Очевидно, что этот период культивирования являлся оптимальным. При этом ЦПД составляло более 90% площади инфицированного монослоя. Сравнительная оценка вирулентности вируса, проведённая на лабораторных животных, показала, что изучаемый изолят вируса высокопатогенен для лабораторных животных: кроликов, морских свинок и крыс. Видовую принадлежность вируса, накапливаемого в культурах клеток, подтверждали выявлением генома методом ПЦР (рис. 2). Подобранные праймеры гибризизовались с нуклеиновыми кислотами ЖУРНАЛ ДЛЯ ПРОФЕССИ
всех исследуемых препаратов, в которых содержался вирус болезни Ауески, и ограничивали продукты амплификации размером 194 п.о., что соответствовало рассчитанному значению. ПЦР позволял выявлять нуклеиновую кислоту вируса болезни Ауески в вирусосодержащем культу-ральном и органно-тканном материале павших домашних животных в количестве не менее 22 пг.
Из результатов, приведённых на рисунке 2, следует, что ПЦР позволяет амплифициро-вать фрагмент целевого гена размером 194 пар нуклеотидов (п.о.) в образцах, содержащих ДНК вируса болезни Ауески. 1В ОТ ПРОФЕССИОНАЛОВ
Рисунок 2 - Обнаружение ДНК вируса болезни Ауески методом ПЦР: дорожки 1, 7 - маркер - фрагмент ДНК известной молекулярной массы; 2- ткань мозга ягнёнка,
3 - вируссодержащей культуральной материал
4 - ткань мозга кота;
5,6 - ткань мозга кролика, инфицированного изолятом вируса (биопроба)
Заключение. Изолят вируса был выделен из проб органов погибшего от болезни Ау-ески кота. К изоляту вируса была чувствительна перевиваемая клеточная линия: MDBK. Способность к репродукции в культуре перевиваемых линиях клеток изучаемого изолята вируса достигала максимума к 4-6 пассажу и составляла 6,81-7,61 ^ТЦД50/см3. Видовую принадлежность вируса, накапливаемого в культурах клеток, подтверждали выявлением генома методом ПЦР и биопробой на кроли-
ках. Полученные экспериментальные данные показали, что только в пробах, (содержащих ДНК вируса болезни Ауески выявляли специфические продукты реакции ПЦР размером 194 п.н.
Вирусосодержащий материал изолята вируса болезни Ауески, полученный в различных культурах клеток, планируется использовать в дальнейших исследованиях для изучения его молекулярно-биологических свойств.
1. Богомолова, О.А. Чувствительность перевиваемых линий культур клеток Магс-145 и МА-104 к изоляту вируса цирковирусной инфекции свиней / О.А. Богомолова, И.Н. Матвеева, В.М. Попова // Научный альманах. - 2018. - № 5-2(43). - С. 166-169.
2. Маркова, Е.В. Изучение инфекционной активности нецитопатогенного цирковируса свиней 2 типа в реакции непрямой иммунофлуоресценции / Е.В. Маркова, И.Н. Матвеева, О.А. Богомолова, О.А. Гаджимурадов, И.В. Иванов, В.М. Попова, Л.А. Скороходова // Научный альманах. - 2018. - №7-1(45) - С.201-205
3. Матвеева, И.Н. Исследование новой питательной среды для культивирования клеток млекопитающих / И.Н. Матвеева, В.М. Попова, А.Я. Самуйленко, А.С. Дяченко, А.С. Преображенская // Технологии живых систем. - 2016. - № 1.- С. 83-86.
4. Преображенская, А.С. Использование ПЦР для выявления генома возбудителя болезни Ауески в биологическом материале / АС. Преображенская, И.Н. Матвеева, А.С. Дяченко, В.М. Попова // Ветеринария и кормление. - 2014. - № 6. - С. 32.
5. Самуйленко, А.Я. Избранные труды. М.-2013.- 541 с.
6. Fonseca Jr. Molecular epidemiology of Brazilian pseudorabies viral isolates / Jr. Fonseca, A.A. Camargos et al. // Vet. Microbiol. - 2010a. - 141 (3-4). - P. 238-245.
7. Goldberg, T.L. Comparative utility of restriction fragment length polymorphism analysis and gene sequencing to the molecular epidemiological investigation of a viraloutbreak / T.L. Goldberg, R.M. Weigel, E C. Hahn, G. Scherba // Epidemiol. Infect. - 2001. - 126 (3). - P.415-424.
8. Mu'ller, T. Characterization of pseudorabies virus of wild boar origin from Europe / T. Mu'ller, B.G. Klupp, C. Freuling, B. Hoffmann, M. Mojcicz, I. Capua, V. Palfi, B. Toma, W. Lutz, F. Ruiz-Fon, C. Gortarzar, A. Hlinak, U. Schaarschmidt, K. Zimmer, F.J. Conraths, E.C. Hahn, T.C. Mettenleiter // Epidemiol. Infect. - 2010. - 138 (11). - Р.1590-1600.
9. Mu'ller, T. Pseudorabies virus in wild swine: a global perspective / T. Mu'ller, E.C. Hahn, F. Tottewitz, M. Kramer, B.G. Klupp, T.C. Mettenleiter, C. Freuling // Arch.Virol. - 2011. - 156. - Р.1691-1705.
10. Steinrigl, A. Detection and molecular characterization of Suid herpesvirus type 1 in Austrian wild boar and hunting dogs / A. Steinrigl, S. Revilla-Ferna'ndez, J. Kolodziejek, E. Wodak, Z. Bago, N. Nowotny, F. Schmoll, J. Ko'fer // Vet. Microbiol. - 2012. - 157 (3-4). - Р.276-284.
ISOLATION AND IDENTIFICATION OF ISOLATED AUESCI'S DISEASE VIRUS
12 Loivskaya O.Yu. - Graduate student, :Lyulkova L.S. - Doctor of Biological Sciences, :Markova E.V. - Candidate of Agricultural Sciences, :Matveeva I.N. - Doctor of Biological Sciences,
Professor, :Preobrazhenskaya A.S. - job seeker
'Federal State Budgetary Scientific Institution All-Russian Research
and Institute of Biological Industry (141142, Moscow region, village of Biocombinat, VNITIBP, e-mail: biolog1967@mail.ru)
2FKP "Schelkovo Biocombine" (141142, Moscow region, village of Biocombinat, e-mail: LoivskayaOY@biocombinat.ru)
The article is dedicated to isolation and identification of the Aujeszky's disease virus isolate. The virus isolate was isolated from a cat who died in Moscow from Aujeszky 's disease in an inoculated culture of MDBK calf kidney cells. As a result, it was ^ found that the virus isolate is highly pathogenic ^ for laboratory animals: rabbits, guinea pigs and rats. Other transplantable cell lines were sensitive to the virus isolate: Taurus-1 and BHK-21. The nature of the CPP in different cell cultures was the same. The ability to reproduce in the cell culture of the studied virus isolate reached a maximum at passage 4-6 and amounted to 6.81-7.61 lg TCD50 / cm3. The presence of Aujeszky's disease virus is confirmed by bioassay and other laboratory methods, including PCR. The PCR method made it possible to identify the virus genome in virus-containing culture and in organ-tissue material. Nonspecific reactions were not observed. PCR products showed the expected size. The virus-containing material of the Aujeszky's disease virus isolate is used in the study of biological and molecular biological properties.
Keywords: virus isolate, cell culture, reproduction, Aujeszky's disease, cytopathic effect, infectious activity, PCR.

Особенно актуальной проблема ИББ стала в 90-х годах ХХ столетия в связи с появлением в Европе и Азии высоковирулентных штаммов вируса ИББ, инфицирование которыми приводит к высокой смертности птицы. В странах Америки превалируют вариантные штаммы, которые самостоятельно не способны вызывать клиническое проявление заболевания, при этом приводят к выраженному иммуносупрессивному состоянию организма. 1
Благодаря наличию молекулярных диагностических инструментов сегодня существует возможность анализировать последовательности геномов разных полевых штаммов вируса ИББ, что позволяет выбирать наиболее подобные вакцинные штаммы для профилактики заболевания у птицы.
С 2000-х годов мы проводим скрининговые исследования для изучения молекулярно-эпизоотической ситуации с вирусом ИББ на территории Украины и стран СНГ.
Изоляты, выделенные в разное время и в разных регионах Украины, Российской Федерации, Республики Беларусь, были охарактеризованы и проанализированы. Характеристику изолятов проводили по двум основным критериям:
- Оценка генетического родства выделенных изолятов путем определения последовательности вариабельной области гена VP2.
- Оценка вирулентности каждого изолята путем заражения SPF-цыплят.
Основой антигенной изменчивости вируса ИББ являются мутации вариабельного участка гена VP2, который кодирует основной белок капсида. Изменения последовательностей этого участка гена VP2 приводят к антигенному шифту штаммов, а отдельные, так называемые, точечные мутации приводят к антигенному дрейфу с образованием новых субтипов вируса. 2
Белок VP2 является основным протективным антигеном, индуцирующим вирус-нейтрализующие антитела, которые и обеспечивают иммунитет против болезни Гамборо. 3 Следовательно, знание кода аминокислотной последовательности в вариабельной области участка VP2 украинских изолятов является ключом к оценке их генетического родства как между собой, так и с вирусными штаммами вакцинных препаратов, применяемых в Украине.
Данные рестрикционного анализа изолятов, выделенных на территории Украины, позволяют классифицировать украинские изоляты ИББ, патогенные для цыплят, на две основные группы – высоковирулентные (vv IBDV) и классические вирулентные (cv IBDV) группы штаммов вируса ИББ.
Необходимо отметить, что зафиксированные вспышки заболевания Гамборо на птицеводческих предприятиях с выраженной клинической картиной и высоким процентом смертности всегда были связаны с инфицированием птицы высоковирулентными штаммами вируса ИББ. При этом инфицирование поголовья проходило на фоне проведенных профилактических обработок птицы против ИББ, что указывает на неспособность отдельных используемых вакцинных препаратов обеспечить полноценную защиту птицы против давления высоковирулентных вирусов ИББ (vv IBDV).
Cеквенирование выделенных изолятов (определение последовательности нуклеотидов в вариабельной области гена VP2) позволило провести оценку гомологии участков VP2 между различными вирусами ИББ и установить высокую степень генетического родства среди выделенных изолятов вируса ИББ.
Полученные таким образом данные оценки молекулярно-эпизоотической ситуации по ИББ в Украине были положены в концепцию создания линейки вакцинных препаратов против болезни Гамборо на основе выделенных украинских изолятов. Так, начальный вирус для получения штамма МВ/5 (вакцинный препарат POLIMUN IBD) был выделен из фабрициевых сумок больных бройлеров птицефабрики в Донецкой области. Эффективность данных вакцин достигнута за счет максимальной степени гомологии участков гена VP2 полевых украинских изолятов по отношению к антигенному профилю вакцинных штаммов POLIMUN. За счет чего и формируется специфический поствакцинальный иммунный ответ к циркулирующим штаммам вируса ИББ.
По мнению ведущего исследователя вируса ИББ в мире D.J. Jackwood, установление степени гомологии гена VP2 полевых изолятов вируса, выделенных из бурс зараженных птиц, к различным вакцинным штаммам является необходимым, поскольку лишь максимально подобные штаммы могут защитить птицу от вируса, который циркулирует в хозяйстве. 4
В качестве примера могут служить данные филогенетического родства отдельно взятых изолятов вируса ИББ к вакцинным препаратам POLIMUN Гамборо. Топология ветвей филогенетического дерева отображает степень сходства штаммов, которые анализировались, и указывает на аминокислотные различия в вариабельном антигенно важном участке капсидного белка различных вакцинных штаммов вируса.
Пример 1.Филогенетический анализ полевого изолята, выделенного на одном из предприятий Украины (Isolate1517, 2015 г.)

Уровень гомологии разных штаммов вируса ИББ к выявленному изоляту (Isolate 1517) по результатам секвенирования.
В качестве причин брачной изолированности у человека могут выступать как физико-географические, так и социально-религиозные факторы, традиции и пр. Однако несомненно, что в создании и поддержании И. на протяжении всей истории человечества и в их распаде первичными являются социально-экономические факторы, особенности хозяйственного уклада, общественный строй, религиозные и национальные традиции.
Бесконечно большие популяции, в которых родительские гаметы, формирующие зиготы следующего поколения, встречаются статистически случайно, называются панмиксными; соответственно случайное скрещивание носит название панмиксии. Однако бесконечно большие популяции всего лишь математическая абстракция, поэтому противопоставление изолированности и панмиксии относительно.
Основным количественным критерием для отнесения популяции к категории И. является коэффициент инбридинга (см.), т. е. величина, отражающая степень родственности людей, составляющих популяцию (если он велик — 0,03—0,001), или к категории панмиксий (если он мал — 0,0001—0,00001).
Коэффициент инбридинга нек-рого лица, определенный из его родословной, и средний коэффициент инбридинга всех членов популяции используются большинством исследователей как мера инбредности лица или популяции. Однако надежность этой оценки зависит от полноты сбора генеалогического материала (числа охваченных поколений).
По происхождению И. можно условно разделить на три группы: реликтовые И., оставшиеся со времен неолита, когда все человечество представляло собой ряд небольших изолированных популяций (система изолятов Сибири, Южной Америки, Австралии); И., возникшие в период от античности до раннего средневековья,— популяции, образовавшиеся в местностях с небольшой плотностью населения (север Скандинавии, Европейский север РСФСР, горные местности — Дагестан, Памир, горы Японии); так наз. религиозные И. (хаттериты и дункеры в США, самаритяне Израиля, хаббаниты Южной Аравии, караимы Литвы). Часть этих И. возникла всего 300—500 лет тому назад, однако строгих различий между этими тремя категориями изолированных популяций провести нельзя, примером чему могут служить сельские кастовые изоляты Индии.
Основной причиной внимания генетиков и медиков к изучению изолированных популяций является протекание в них генетико-автоматических процессов, т. е. дрейф генов. Под дрейфом генов понимают случайное изменение генетической конституции популяции, причиной к-рого может быть, напр., малочисленность этой популяции, поэтому дрейф генов не ведет к генотипическому приспособлению к среде. Чем меньше размер популяции, тем интенсивнее протекает в ней процесс дрейфа генов. Этот процесс приводит к снижению частоты встречаемости или даже к полной утрате одного из аллелей нек-рого локуса и увеличению частоты встречаемости другого аллеля этого же локуса. В результате дрейфа генов каждый И. характеризуется своими генными частотами, в ряде случаев резко отличаясь от соседних И., связанных с ним общностью происхождения. Эти отличия могут достигать уровня межнациональных или межрасовых.
И. представляют широкие возможности для изучения фенотипического полиморфизма отдельных наследственных болезней (см.) на обширном клин, материале, а также для анализа генетической гетерогенности внешне единых форм. Изучение серии И. позволяет описать широкий спектр наследственных болезней, зарегистрировать значительное число ранее не известных патологических генов, т. к. каждый И. обладает собственным нозол, профилем. В качестве примера можно привести многолетние исследования В. Мак-Кьюзиком группы И. амишей в США, в к-рой удалось идентифицировать ранее не описанные рецессивные болезни, получить новые данные по мультифакторным заболеваниям. Исследование изолированных сельских популяций Финляндии [Неванлинна (H. R. Nevanlinna)] позволило обнаружить в некоторых из них большое число случаев врожденного нефроза, ведущего к гибели детей в первые недели жизни. Более того, в этих популяциях было найдено увеличение (в результате дрейфа генов) даже доминантных болезней, часть из которых (напр., генерализованный амилоидоз) вне исследованных популяций не описана.
В СССР исследование Изолятов имеет давние традиции. Внимание медиков-генетиков привлекают изолированные сельские популяции Центральной России, Кавказа, Средней Азии (В. В. Сахаров, Н. П. Бочков), реликтовые изоляты Сибири и Алтая (Ю. Г. Рычков).
Чрезвычайно важным является то обстоятельство, что наряду с И., значительно отягощенными наследственными болезнями, с большим количеством больных, встречаются и такие, в которых медико-генетическая обстановка достаточно благоприятна. Сравнение между собой И., сходных или различающихся по происхождению, степени изолированности, срокам существования, воздействию средовых факторов, генетической отягощенности, позволяет оценить роль этих факторов в формировании генофонда популяций, а полученные выводы могут иметь значительную прогностическую ценность. Поэтому изучение И. является одной из насущных задач мед. генетики.
Как правило, медико-генетическому исследованию подвергается не индивидуальный И., а группа популяций, связанных общностью происхождения. В первую очередь перед исследователем встает проблема оценки размера каждой единичной популяции из группы родственных и обменивающихся мигрантами, т. е. определение эффективного размера популяции. Эффективный размер популяции можно считать приблизительно равным 1/3 ее цензового размера. Для анализа взаимной изолированности изучаемых популяций используются данные о распределении фено- и генотипических частот менделирующих маркеров (группы крови, сывороточные и эритроцитарные ферменты и т. д.), данные этнографического изучения (фамилии, родовая принадлежность), демографические данные (длительность смены поколений, размер семьи, миграции), наконец, история и экология рассматриваемых популяций.
Особый интерес представляет медико-генетическое исследование индивидуальных И. Генетику-врачу целесообразно получить материал, характеризующий полные семьи. Для выполнения этого требования необходимо либо тотальное мед. исследование И., либо, если он слишком велик, тщательное предварительное выявление всех наследственно отягощенных семей. Генеалогический материал следует собирать тотально и на максимально доступное число поколений. Квалифицированное медико-генетическое исследование не может быть выполнено без привлечения клиницистов различного профиля.
Оценка генофонда человечества и его особенностей в изолированных популяциях необходима для перспективного планирования мероприятий по здравоохранению, т. к. именно в Изолятах имеет место концентрация патологических генов.
Библиография: Дубинин Н. П. Общая генетика, М., 1976, библиогр.; Маккьюсик В. А. Наследственные признаки человека, пер. с англ., М., 1976, библиогр.; Рычков Ю. Г. Система древних изолятов человека в Северной Азии в свете проблем стабильности и эволюции популяций, поиски и решения на путях популяционной генетики, Вопр, антропол., в. 44, с. 3, М., 1973; Эфроимсон В. П. Введение в медицинскую генетику, М., 1968; Gavаlli-Sfоrzа L. L. a. Bodme г W. F. The genetics of human populations, San Francisco, 1971, bibliogr.
Читайте также:


