Исследование сточной воды на энтеровирусы

Вода является неотъемлемой составляющей всех живых систем. В среднем, человек потребляет 2,5 литра воды в день. Наряду с полезным кальцием, магнием и калием вода несет в себе и вредные для здоровья человека элементы, такие как нитраты, нитриты, кадмий и тому подобное. Характеристики употребляемой нами жидкости определяют качество и продолжительность жизни. Согласно докладу Всемирной организации здравоохранения (WHO, 2007), около 1,1 миллиарда человек не имеют доступа к безопасным источникам водоснабжения, а около 2 миллиона человек ежегодно умирают от заболеваний, передающихся через питьевую воду. Тошнота и диарея – не самое опасное, что вызывают микроорганизмы. Бактерии и вирусы в прямом смысле могут отравлять нашу жизнь, вызывая болезни с летальным исходом (например, Clostridium botulinum – возбудитель ботулизма) или опосредовано приводя к смертельным случаям (Helicobacter pylori – возможная причина рака ЖКТ). В Российской Федерации состояние воды регламентируются несколькими нормативами в зависимости от предназначения (смотреть таблицу).
Требования к микробиологическим показателям качества воды в Российской Федерации в зависимости от хозяйственной деятельности человека
| Показатель | Природная вода 1 | Вода бассейнов 2 | Нецентр. водоснаб. 3 | Центр. водоснаб. 4 | Бутилированная вода 5 |
|---|---|---|---|---|---|
| Общая микробная численность (ОМЧ), КОЕ / 1 мл | – | – | не более 100 | не более 50 | не более 20 |
| Общие колиформные бактерии (ОКБ), КОЕ / 100 мл | не более 1000 (питьевая вода) не более 500 (рекреационное назначение) | не более 1 | отсутствие в 100 мл | отсутствие в 100 мл | отсутствие в 300 мл |
| Термо-толерантные колиформные бактерии (ТКБ), КОЕ / 100 мл | не более 100 | отсутствие в 100 мл | отсутствие в 100 мл | отсутствие в 100 мл | отсутствие в 300 мл |
| Колифаги, БОЕ / 100 мл | не более 10 | отсутствие в 100 мл | отсутствие в 100 мл | отсутствие в 100 мл | отсутствие в 1000 мл |
| Споры сульфит-редукторов | – | – | – | отсутствие в 20 мл | отсутствие в 20 мл |
| Возбудители кишечных инфекций | отсутствие в 1000 мл | отсутствие в 1000 мл | отсутствие в 1000 мл | отсутствие в 1000 мл | отсутствие в 1000 мл |
| Синегнойная палочка (Pseudomonas aeruginosa) | – | отсутствие в 100 мл | – | – | отсутствие в 1000 мл |
| Золотистый стафилококк (Staphylococcus aureus) | – | отсутствие в 100 мл | – | – | – |

Оценка качества по микробиологическим показателям сводится к определению в объекте доли микроорганизмов, связанных с человеком и его продуктами жизнедеятельности.
Прежде всего, определим единицы измерения количества микробов. КОЕ/мл (колониеобразующие единицы) – количество жизнеспособных микробных клеток в миллилитре. Если производится оценка вирусных частиц в среде, то указывается БОЕ/мл (бляшкообразующие единицы) – количество вирусных частиц в миллилитре.
Общие показатели
Выявляет бактерии, потенциально способные причинить вред здоровью. Этот показатель достаточно информативен, так как высокая ОМЧ является индикатором загрязнения органическими соединениями (например, содержащихся в фекалиях) и различными формами азота. С другой стороны, в ОМЧ входят как опасные бактерии (например, высокопатогенный штамм кишечной палочки Escherіchіa colі), так и практически безвредные и повсеместно встречаемые сенные палочки (Bacillus subtillis).
Группу ОКБ формируют бактерии семейства Enterobacteriacea (Citrobacter, Enterobacter, Klebsiella). Многие представители этой группы относятся к нормальной микрофлоре желудка, поэтому превышение ОКБ может говорить о возможном фекальном загрязнении, связанном с деятельностью человека. Однако в данной группе могут встречаться и свободноживущие микробы, которые не представляют опасности для здоровья.
ТКБ – более достоверный индикатор загрязнения продуктами жизнедеятельности. Этот показатель свидетельствует о свежем фекальном загрязнении. В большинстве случаев в этой группе обнаруживается кишечная палочка Escherіchіa colі.
Колифаги являются вирусами палочки Escherichia coli и рассматриваются эпидемиологами как более чувствительный метод определения загрязнения жидкости микроорганизмами группы кишечной палочки. Вирусные частицы более устойчивы к окружающей среде, чем бактерии, в которых они обитают, поэтому этот показатель качества служит достоверной меткой давнего фекального загрязнения. Содержание колифагов свидетельствует о наличии опасных для человека энтеровирусов в воде.
Рекомендуется проводить исследование этой характеристики в случае, если ранее источник не был проверен, а также для оценки эффективности методов дезинфекции источников и систем подачи-распределения воды.
Спорообразующие клостридии (Clostridium botulinum, Clostridium perfringens, Clostridium tetani) являются дополнительным микробиологическим показателем фекального загрязнения. Клостридии встречаются в кишечнике, однако при попадании в организм в большом количестве могут вызывать пищевые отравления и смертельные заболевания, в том числе, ботулизм. В отличие от относительно неустойчивых ОКБ и ТКБ, споры клостридий могут сохраняться долгое время, поэтому этот микробиологический показатель, как и колифаги, свидетельствует о наличии давнего загрязнения. Относительно высокая устойчивость позволяет использовать споры в качестве индикатора эффективности проведения водоподготовки (хлорирования, озонирования и т.п.).
Определение этого микробиологического показателя качества воды рекомендуется проводить при наличии посторонних запахов и образовании чёрного налёта на трубах, а также для оценки эффективности методов дезинфекции источников и систем подачи-распределения жидкости.
Pseudomonas aeruginosa – распространённый организм, который встречается практически во всех средах, в т. ч. входит в состав микрофлоры кожи. Однако при снижении иммунитета человека и высоком содержании в воде синегнойная палочка может вызывать серьёзные заболевания, поражая лёгкие и почки и приводя к сепсису. Присутствие Pseudomonas aeruginosa в бассейне или ванне является основанием для полной замены содержимого резервуара. Особенность синегнойной палочки – её чрезвычайная устойчивость к нагреванию, дезинфицирующим средствам и антибиотикам.
Staphylococcus aureus – тесно связанная с человеком бактерия, которая в основном образует колонии на коже, половых органах, респираторном и желудочно-кишечном трактах. Как и синегнойная палочка, золотистый стафилококк встречается у здоровых людей, однако может вызвать развитие болезни при ослаблении иммунитета.
В действующих нормативных документах не прописаны конкретные возбудители кишечных инфекций. В эту группу входят микроорганизмы, заражение которыми происходит через жидкие среды (Escherichia, Shigella, Vibrio, Salmonella). Процесс определения этого параметра трудоёмок и требует специальной квалификации микробиолога.
Микробиологические показатели качества воды, не регулируемые СанПиН
Развитие и удешевление технологий и новых методов приводит, с одной стороны, к расширению контролируемых параметров, с другой, к выбору более конкретных микроорганизмов-показателей. Например, руководство ВОЗ рекомендует использовать в качестве индикатора фекального загрязнения наличие кишечной палочки (Escherіchіa colі), а не ОКБ и ТКБ. В странах ЕС помимо палочки определяют наличие энтерококков – специфичной группы микроорганизмов обитателей кишечника человека. Ниже приведены группы микроорганизмов, которые имеют индикаторное значение при оценке микробиологического качества воды.
Enterococcus spp. – широкая группа микроорганизмов, проживающая в кишечнике человека. Наряду с золотистым стафилококком энтерококки являются причиной внутрибольничных инфекций, вызывают у человека (менингит, эндокардит). Ввиду более высокой устойчивости этих микроорганизмов к засолению и температуре, по сравнению с ТКБ, энтерококки – более надежный индикатор фекального загрязнения морей и солёных озёр. Согласно нормативу ЕС, эта группа не должна обнаруживаться в 250 мл. Согласно законодательству США, при превышении содержания Enterococcus spp. 35 КОЕ / 100 мл вводится запрет на купание людей.
К условно-патогенным дрожжам и микромицетам (плесени) относят большую неоднородную группу грибных организмов. В неё входят Candida albicans и Cryptococcus neoformans, которые вызывают оппортунистические заболевания, в т. ч. грибковые заболевания кожи и молочницу. Другие организмы-микромицеты (Cladosporium cladosporioides, Aspergillus niger) усиливают аллергические реакции, а иногда вызывают их. Особенно опасны плесневые грибы (Penicillium spp., Aspergillus spp., Fusariam spp., Alternaria spp. and Claviceps spp), образующие канцерогенные микотоксины (патулин, афлотоксин). Исследователи из Европейского союза пришли к выводу, что водопроводная вода не является распространителем микотоксинов, однако в стоячих источниках (например, накопительных резервуарах) могут создаться условия для благоприятного развития грибов. В некоторых странах ЕС содержание грибов строго регламентируется, например, в Швеции в питьевой воде их не может быть более 100 КОЕ / 100 мл.
Микроорганизмы, содержащие зелёный пигмент хлорофилл – обитатели богатых питательными элементами стоячих водоемов. Сами микроорганизмы не заражают человека, но синтезируют и выделяют в среду цианотоксины, вызывающие поражение внутренних органов млекопитающих: гепатотоксины (Microcystis, Anabaena, Oscillatoria, Nodularia, Nostoc, Cylindrospermopsis и Umezakia), нейротоксины (Aphanizomenon и Oscilatoria), почечные токсины (Cylindroapermopsis raciborski).
Таким образом, микробиологические показатели качества воды отражают несколько важных показателей:
- Общее загрязнение микроорганизмами источника воды (ОМЧ).
- Наличие фекального загрязнения и продуктов жизнедеятельности (ОКБ, ТКБ, колифаги, сульфитредукторы, энтерококки).
- Возможное наличие энтеровирусов (колифаги).
- Наличие потенциально опасных микроорганизмов (золотистый стафилококк, синегнойная палочка, условно-патогенные дрожжи, энтерококки, сульфитредукторы).
- Наличие потенциальных продуцентов микотоксинов и цианотоксинов (грибы и цианобактерии).
- Наличие патогенных микроорганизмов (Shigella, Vibrio, Salmonella).
Если при гепатите А мы имеем значительный чисто эпидемиологический материал о распространении этой инфекции через воду, при почти полном отсутствии экспериментальных данных о присутствии и сохранении вируса в воде, то при энтеровирусных инфекциях положение прямо противоположно. Нам хорошо известна частота присутствия энтеровирусов в сточных водах, доказана возможность проникновения этих агентов в различного рода водоемы, установлена длительная сохраняемость вируса в воде, а эпидемиологический материал о передаче полиомиелита, заболеваний вызываемых вирусами Коксаки и ЕСНО крайне ограничен. В конце раздела мы постараемся дать объяснение этому несоответствию, а сейчас рассмотрим фактический материал возможности распространения энтеровирусных инфекций с питьевой водой.
Основной причиной инфицирования водоемов энтеровирусами является попадание в них сточных вод, которые как указывалось в главе II часто заражены этими агентами.
В дополнение к приведенным выше данным о присутствии энтеровирусов в различного рода водах, сошлемся на ряд работ. Так, Z.Sekla et al, (1980) в Манитобе /Канада/ обнаружили энтеровирусы в 61,8% проб сточных вод, в 20,5% проб сточных вод после естественной фильтрации, в 3% проб речной воды и в 6,7% образцов питьевой воды из городского водопровода.
В таблице 1 приведены данные исследования, проведенного В.Л.Бондаренко с соавт. (1990) на Украине.
Таблица №1 Энтеровирусы в различных водах.
Содержащие вирус полиомиелита
Содержащие другие энтеровирусы
Вод детских бассейнов
Опасность заражения воды от стоков усугубляется тем, что применяемые методы очистки и обеззараживания стоков, не гарантируют их освобождения от энтеровирусов /Г.А.Багдасарьян, 1961; А.М.Ошерович и Г.С.Часовникова, относится в частности и к хлорированию сточных вод /S.Kelly a.W.Sanderson, 19547/. В водоемы энтеровирусы могут попадать также от купающихся в них людей. В частности А.М.Ошерович и Г.С.Часовникова /1969/ обнаружили вирус Коксаки В в воде бассейнов, где купались дети.
Сохраняемости энтеровирусов в воде посвящено много работ, некоторые и из них мы приведем. По L.Cioglia и B.Loddo /1962/ энтеровирусы в морской воде при температуре 25°С сохранялись 8-15 дней, при более низкой температуре и при добавлении сточных вод - дольше. По Рlisser et al. (1963) в лабораторных условиях ЕСНО-6 в морской воде сохранялся 33 дня, в естественных условиях - 11 дней. Л.В.Григорьева /1975/ установила, что вирусы Коксаки в сырой морской воде сохранялись 10-13 дней, в автоклавированной - 50-74 дня. В пресной, речной, сырой воде по данным того же автора при низкой температуре вирус Коксаки А 5 сохранялся 113 дней, а стерильной -776 дней. Чем выше была исходная концентрация вируса, тем дольше он сохранялся. Находящийся в воде вирус Коксаки постепенно снижает свою вирулентность /Л.В.Григорьева, Н.Е.Боуман, 1963/. По О.В.Бычковской с соавт. /1964/ вирус полиомиелита в речной воде при 37°С сохранялся 1 день, при 20° - 11 дней, при 4° - 130 дней. Сходные данные получили А.Ф.Киселева (1968), Е.А.Багдасарьян с соавт. (1972). В другой работе Г.А.Багдасарьян /1970/ вирус полиомиелита I типа в водопроводной воде сохранялся 18 дней, в речной - 33 дня, в сточной - 65 дней, в осадке сточных вод - 160 дней. Присутствие бактериальной флоры способствовало сохранению энтеровирусов. Имелась разница в выживаемости в воде отдельных вирусов: например, ЕСНО-7 сохранялся лучше полиовируса I.
О лучшей сохраняемости энтеровируса в загрязненных водах говорят и данные Vark, Berg et al. (1970). Они же подтверждают данные о лучшей сохраняемости энтеровирусов при низкой температуре: в автоклавированной воде при температуре 25°С энтеровирусы сохранялись 15-30 дней, а при температуре 8-10°С - 160-188 дней. Наоборот по L.Girier et al. (1965) в речной воде энтеровирусы выживали значительно меньший срок, чем в воде дистиллированной. По данным этих авторов вирус полиомиелита I типа можно было обнаружить в стерилизованной воде при температуре 4°С на 63-й день при температуре 20° при малой концентрации вирус исчезал к 14 дню, при большой концентрации - к 92 дню; при температуре 37° вирус выживал не более 7-14 дней. По данным Hermann /цит. по G.Berg, 1975/ вирус полиомиелита I типа и вирус Коксаки А 9 отмирали в нативной озерной воде быстрее, чем в той же воде прошедшей через фильтр. Жизнеспособность полиовируса была выше, чем вируса Коксаки. Большую выживаемость вирусов отмечали в холодной воде.
Наконец, имеются данные о том, что на сохраняемость энтеровирусов в воде оказывает влияние химический состав воды. Так по G.Vioyse, H.Weiser /1967/ поливирусы, вирусы Коксаки и ЕСНО в обычной воде прудов при температуре 4° и 20°С выживали 9 недель, при добавлении хлорида магния - 12, при добавлении солей марганца 5, в присутствии солей железа - 3 недели. В речной воде вирусы адсорбировались на частичках глины.
Л.В.Григорьева и Н.Е.Боцман (1963) суммируя многочисленные сообщения о сохраняемости энтеровирусов в воде, отмечают следующие закономерности характеризующие это явление:
- - энтеровирусы лучше сохраняются при низкой температуре воды;
- - в морской воде вирусы сохраняются хуже, чем в пресной /может быть это зависит от присутствия в морской воде йода/;
- - чем массивнее было первоначальное заражение, тем дольше сохраняется вирус в воде;
- - в нативной воде вирусы сохраняются в 3-5 раз меньше, чем в стерильной воде /по поводу этого положения имеются противоречивые данные/;
- - вирулентность вируса, находящегося в воде, постепенно снижается.
К этому остается добавить, что в некоторых случаях энтеровирусы в водоемах сохраняются очень долго - недели, месяцы.
Переходя к анализу собственно эпидемиологических данных, отметим, прежде всего, что они относятся почти исключительно к полиомиелиту, причем в значительной своей части носят предположительный характер. Больше всего наблюдений о возможности распространения полиомиелита с питьевой водой опубликовано в литературе США. Впервые на возможность такой передачи полиомиелита указал Kling (1929). J.R.Paul, J.D.Treck (1941) описали вспышку полиомиелита среди лиц проживающих по реке Нью-Гатук (США) ниже места спуска сточных вод. Отмечены заболевания среди лиц контактировавших со стоками, из которых был выделен вирус, и речной водой. Сходную ситуацию наблюдали в штате Огайо (США) Toomey et al. (1945). В 1953 г. в г.Эдмонд (США) отмечен резкий подъем заболеваемости полиомиелитом. Город снабжался водой из р.Саскатчеван, куда выше водозабора поступали сточные воды г. Девон. Вспышке предшествовала авария на установке, хлорировавшей сточные воды (Zittle, 1954). Сходная эпидемия наблюдалась в США (Bancroft, 1957). Наконец, в 1962 г. в штате Небраска (США) также наблюдалась водная вспышка полиомиелита (R.Mitcnell, 1976). На крайнем севере США в штате Аляска, предположения о водной передаче полиомиелита высказывались C.A.Evans et al. (1957). Из зарубежных стран, помимо США, материалы о возможности водной передачи полиомиелита представлены Y.Faahzaeu et al. (1950) из Швеции, P.V.Gharpure (1957) из Индии. Болгарии. Ц.Веселиновой - Стояновой (1986). В последние из перечисленных работ указывается на существование прямой зависимости между циркуляцией вирусных возбудителей в воде водоемов и водоисточников и заболеваемостью населения /в исследовании проведенном в г.Манитотоба /Канада/ указывается на отсутствие корреляции между наличием вируса полиомиелита в питьевой воде и регистрируемой заболеваемостью - Sек1а Z/ еt аl., 1980/.
Небогата данными о возможности распространения полиомиелита с питьевой водой и отечественная литература. А.Ф.Ястребов (1958) сообщает, что в одном случае были основания предположить водную /колодезную/ вспышку полиомиелита. Подробностей автор не приводит. Наиболее интересный материал о водном распространении полиомиелита в доступной нам отечественной литературе опубликован Н.А.Зейтленок и К.А.Ванаг (1959). Дело идет о вспышке полиомиелита в 1953 г. охватившей 69 человек, из которых 29 проживали в городе, 15 в ближайшей к нему сельской местности, 25 в других районах.
Рис.1. Поселок тракторного завода

Первые заболевания полиомиелита /11 больных/ возникли в конце мая в районе поселка тракторного завода /см.рис. 1/. В июне-августе заболевания появились в других районах города. В июле 11 заболеваний были выявлены в селе Боголюбове, расположенном ниже города по течению р.Клязьмы. В Клязьму выше Боголюбова впадает р. Рпень, в которую в свою очередь впадает овраг, на склонах которого расположены дома поселка тракторного завода, где больные появились раньше всего. В Боголюбове имеется технический водопровод из р. Клязьмы, причем некоторые жители села употребляли воду технического водопровода. Авторы полагают, что вспышка полиомиелита в с.Боголюбово имела водный характер. Предполагаются также, что заражение детей в других районах города было связано с посещением детьми оврагов, по которым текли сточные воды.
Высказываются предположения о том, что заражение людей полиомиелитом может происходить при купании. Так Z.Jotakis (1959) отмечает, что во время вспышки полиомиелита в Стамбуле, наиболее высокая заболеваемость наблюдалась в районе с наиболее загрязненным пляжем. К противоположным выводам пришли работники Комитета службы санитарных лабораторий Великобритании /J.Нyg, 1959, 57, 4, 435-472/. Эпидемиологическое обследование показало, что из 150 заболевших полиомиелитом детей - 45 купались на пляжах последние 3 недели до заболевания, однако из 150 контрольной группы /т.е. не заболевших полиомиелитом/ 44 тоже пользовались пляжами. Делается вывод, что купание на пляже без явных признаков загрязнения сточными водам не представляет опасности.
Данные о распространении водным путем заболеваний вызываемых вирусами Коксаки и ЕСНО очень скудны Girier et al. (1965) считают, что прямых доказательств такого распространения этих вирусных агентов не имеется. Однако, МсLean (1964) указывает на возможность купальных заражений. Позже Н.В.Наwley et al. (1973), наблюдали вспышку заболеваний вызванных вирусами Коксаки В среди мальчиков, находившихся в лагере на оз. Чамлейн на северо-востоке США. Возможным фактором заражения могло быть купание в упомянутом озере, в одной пробе воды, которой найден вирус Коксаки /однако не исключено, что вирус попадал в озеро с выделениями заболевших, заразившихся каким-либо другим путем, например воздушно-капельным, и присутствие вируса в воде не имело эпидемиологического значения/.
В заключение - некоторые соображения о причинах несоответствия между частотой обнаружения энтеровирусов в водоемах и экспериментально доказанной возможностью их длительного сохранения в воде, с одной стороны, и скудностью эпидемиологических данных о распространении соответствующих заболеваний водным путем, с другой, - незначительная концентрация энтеровирусов в воде, не достигающая патогенной дозы в тех объемах воды, которые человек использует для питья. Это предположение подтверждается тем, что действительно концентрация вирусов в воде естественных водоемов, как правило, невелика. Как известно, скопление энтеровирусов в воде не происходит. Вместе с тем следует обратить внимание на трудность эпидемиологической диагностики возможных водных вспышек энтеровирусных заболеваний, связанную с редкостью клинически выраженных заболеваний при заражении этими вирусами. Действительно, известно, что клинически выраженные заболевания /а выявляются и регистрируются имению они/ составляют несколько человек на 1 тысячу заразившихся. Если предположить, что инфицированную воду использовали 200-300-400 человек /примерное число лиц пользующихся водой одной колонки, одного колодца/, то заболевших может быть 1-2-3-5-6 человек. Столь небольшое число заболевших не соответствует привычному представлению о водных вспышках, и это препятствует их выявлению. Технические трудности, связанные с выявлением носителей, также препятствуют проведению полноценного эпидемиологического обследования в практических условиях.
Санитарно-бактериологическое исследование воды - Ф. К. Черкес
Исследованию подлежит вода:
1) централизованного водоснабжения;
2) из колодцев различного типа;
3) открытых водоемов (рек, озер, морей);
4) плавательных бассейнов;
Примечание. Пробы хлорированной воды берут во флаконы с дехлоратором (гипосульфитом).
Отбор проб воды. Из открытых водоемов воду берут с помощью специальных бутылей или батометров, снабженных грузилами. Пробу воды рекомендуют брать на глубине 10-15 см от поверхности (так как поверхность подвергается воздействию атмосферных факторов) и на расстоянии 1,5 м от берега (вода у самого берега может быть загрязнена микрофлорой почвы).
Для отбора проб водопроводной воды используют стерильные флаконы вместимостью 500 мл, закрытые ватно-марлевыми пробками и покрытые бумажными колпачками.
Кран предварительно обжигают тампоном, смоченным спиртом, после чего воду спускают в течение 10-15 мин и набирают во флаконы. Заполненные флаконы закрывают стерильными пробками.
Примечание. Исследуют 333 мл воды (табл. 54).

Таблица 54. Эмпирическая таблица ГОСТ 16963-73
В распределительной сети водопровода отбор проб воды осуществляют в зависимости от количества населения, проживающего в зоне обслуживания.
Стандартные методы исследования регламентированы для воды центрального водоснабжения (ГОСТ 18963-73) и предусматривают:
1. Определение общего числа микроорганизмов (в 1 мл исследуемой воды должно быть не более 100).
2. Определение коли-индекса и коли-титра (коли-индекс 3, коли-титр 333 и выше; для Москвы и Ленинграда коли-индекс не более 2, а коли-титр более 500).
3. Исследование по эпидемиологическим показаниям на патогенную микрофлору (патогенных микроорганизмов не должно быть обнаружено).
Согласно ГОСТу 18963-73 общее число бактерий - это то количество микроорганизмов, которое содержится в 1 мл исследуемой воды, способных в течение суток при температуре 37° С образовывать колонии, видимые невооруженным глазом (или при увеличении с помощью лупы).
При исследовании водопроводной воды засевают 2 чашки. В одну из них вносят 1 мл неразведенной воды, в другую 1 мл воды, разведенной в 10 раз (т. е. 0,1 мл исходной пробы).
При исследовании более загрязненной воды засевают 1 мл воды, разведенной в 100 раз. Это соответствует 0,01 и 1 мл .воды, разведенной в 1000 раз (0,001 мл) и т. д. Для получения таких объемов готовят последовательно десятикратные разведения, по 1 мл каждого разведения вносят в чашку и заливают тонким слоем (12-15 мл) растопленного и остуженного до 45° С питательного агара. Для равномерного распределения исследуемой воды залитые агаром чашки перемешивают путем вращения их. После застывания агара посевы ставят в термостат и инкубируют при температуре 37° С 24 ч.
Чашки с посевами вынимают из термостата и подсчитывают число выросших колоний. Учитывают только те чашки, где число колоний находится в пределах 30-300. Если колоний немного, их подсчитывают невооруженным глазом или при помощи лупы.
Если колоний много, то подсчет можно вести с помощью специального прибора для счета микробных колоний (рис. 54).
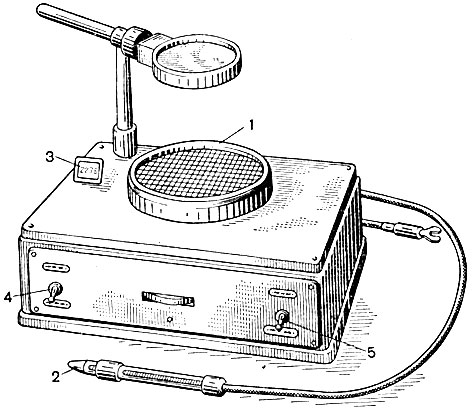
Рис. 54. Прибор для счета колоний микроорганизмов. 1 - столик для чашки Петри; 2 - игла с пружинным устройством; 3 - показатель счетчика; 4 - тумблер для включения импульсного счетчика; 5 - тумблер для включения лампы освещения счетчика
Подсчитанное количество колоний умножают на разведение и узнают число микробов в 1 мл исследуемой воды.
Наличие БГКП (бактерий группы кишечной палочки) является показателем фекального загрязнения, интенсивность которого характеризуют:
Коли-индекс - количество кишечных палочек, обнаруженных в 1 л воды.
Коли-титр - наименьшее количество воды, в котором обнаруживают присутствие кишечной палочки * .
* ( Коли-титр и коли-индекс - это один показатель, различно выраженный.)
Для выявления в воде БГКП можно пользоваться двумя методами: титрационным (бродильным) и методом мембранных фильтров.
Для исследования воды используют среду накопления глюкозопептонную (ГПС) среду Эйкмана с индикатором и бродильными трубками. Среда готовится концентрированной (в 10 раз) и нормальной концентрации - для посева 1 мл воды.
Исследуемую воду засевают по 100 мл в 3 колбы, по 10 мл в 3 пробирки (с концентрированной средой) и по 1 мл в 3 пробирки (со средой нормальной концентрации) - всего 333 мл. Посевы инкубируют в термостате при 37° С 24 ч.
Вынимают посевы из термостата и просматривают их.
При наличии помутнения в колбах или пробирках из них производят посев петлей на сектора среды Эндо в чашках Петри. Посевы инкубируют в термостате при 37° С.
Вынимают чашки из термостата. Из подозрительных колоний делают мазки. При наличии грамотрицательных палочек ставят пробу на оксидазную активность. Положительная проба на оксидазу дает право дать отрицательный ответ.
Проба на оксидазу. 1-й способ: со среды Эндо снимают петлей 2-3 колонии каждого типа и наносят на поверхность фильтровальной бумаги, смоченной диметилпарафенилендиамином. Положительная реакция характеризуется посинением штрихов, сделанных из колоний.
2-й способ: реактив можно нанести на изолированную колонию на среде Эндо (красная колония - синеет) (рис. 55).
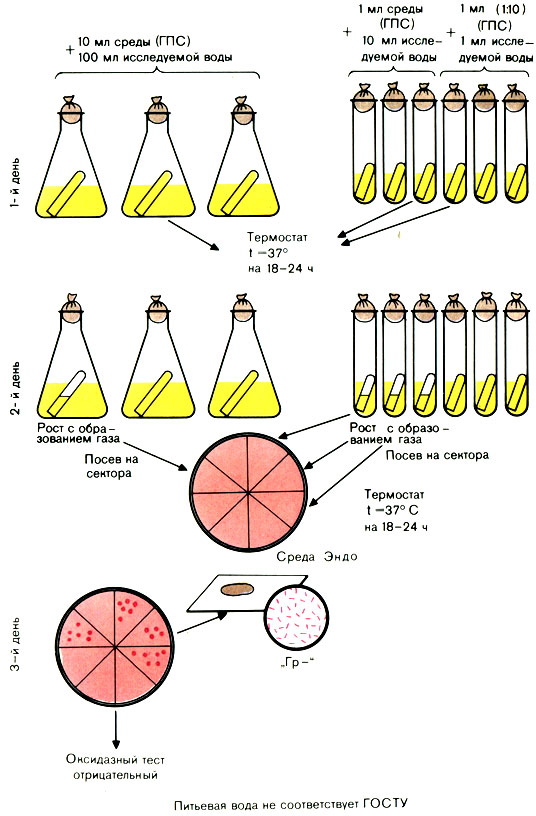
Рис. 55. Определение коли-индекса воды титрационным методом
Отрицательная проба на оксидазу свидетельствует о наличии в воде БГКП. В этом случае вычисляют коли-индекс и коли-титр с помощью стандартных (эмпирических) таблиц ГОСТа 16963-73 (см. табл. 54).
Эти таблицы предусматривают любую возможную комбинацию объемов посева, из которых выделена кишечная палочка.
Для фильтрации воды можно использовать воронку Гольдмана вместимостью 700-800 мл.
В воронку смонтированного и простерилизованного фильтровального прибора Зейтца наливают отмеренный объем исследуемой воды. С помощью насоса создают вакуум в приемном сосуде (обычно воду фильтруют через фильтры № 2 и 3). По окончании фильтрации стерильным или обожженным в огне пинцетом снимают фильтр и накладывают его на среду Эндо в чашке Петри так, чтобы поверхность с осевшими на ней микробами была обращена вверх (на одну чашку можно помещать 3-4 мембранных фильтра).
Посевы инкубируют в термостате при температуре 37° С 18-24 ч.
Чашки с посевами (фильтрами) вынимают из термостата. Отсутствие подозрительных колоний дает право дать отрицательный ответ.
Учету подлежат все красные и розовые колонии с металлическим блеском или без него. Из выросших колоний делают мазки, окрашивают по Граму (рис. 56).
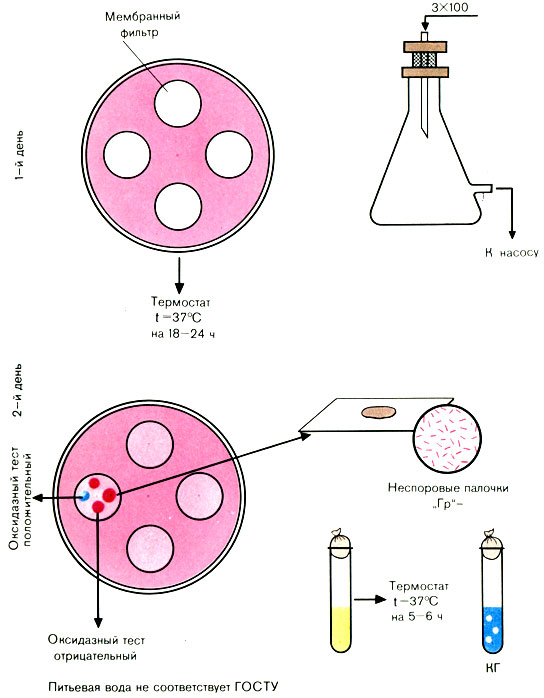
Рис. 56. Определение коли-индекса воды методом мембранных фильтров
При наличии грамотрицательных палочек ставят пробу на оксидазу. Положительная оксидазная проба дает право дать отрицательный ответ. При отрицательной оксидазной пробе производят посев на полужидкую среду с глюкозой и индикатором или на среду ГПС с бродильными трубками - для выявления ферментации углевода до кислоты и газа. При наличии кислоты и газа вычисляют коли-индекс. Например, на всех фильтрах, находящихся на среде Эндо, выросло 3 колонии, пропущено через фильтр было 300 мл воды.
Примечание. Титрационный метод более точный и может быть использован при наличии в воде примесей. Метод мембранных фильтров экономичнее и дает возможность дать ответ на 2-й день.
Для определения наличия в воде свежих фекальных кишечных палочек производят посев воды (3-х объемов) на лактозопептонную среду с борной кислотой. Инкубируют при 43° С 24 ч. Наличие кислоты и газа свидетельствует о свежем фекальном загрязнении.
По эпидемиологическим показаниям в воде определяют сальмонеллы, шигеллы, энтеровирусы.
Примечание. Общепринятым дополнительным показателем фекального загрязнения питьевой воды являются энтерококки. При проведении бактериологического исследования определяют все группы энтерококков, хотя санитарное значение имеют преимущественно фекальные стрептококки, обнаружение которых является показателем свежего фекального загрязнения.
1. Какова основная задача санитарной микробиологии?
2. Что такое санитарно-показательные микроорганизмы?
3. Что такое коли-индекс и коли-титр?
4. Какие Вы знаете методы определения БГКП?
Определите общее число микробов в исследуемой пробе воды. Среда ГПС (Эйкмана).
ГПС (Эйкмана) концентрированная. В 1 л воды растворяют 100 г пептона, 50 г хлорида натрия. Нагревают смесь до кипения, фильтруют, прибавляют 100 г глюкозы, устанавливают рН 7,4-7,6 и разливают по 10 мл в колбы вместимостью 250 мл, по 1 мл в 3 пробирки (концентрированной среды) и по 1 мл в 3 пробирки со средой нормальной концентрации (во всех емкостях среду до нужной концентрации доводят стерильной водой).
Примечание. При исследовании особенно загрязненных вод делают большие разведения (например, 10 -6 , 10 -7 и т. д.).
Читайте также:


