Интерлейкин 1 и хронический гепатит с

Определение генетического полиморфизма этого маркера имеет наибольшее значение для пациентов с генотипом 1 HCV, учитывая более низкую частоту ответа на стандартную противовирусную терапию. В некоторых исследованиях не было выявлено четкой связи между полиморфизмом IL28В и частотой устойчивого вирусологического ответа у таких пациентов [7]. Определение генотипа IL28В имеет большое значение для оценки потенциального ответа на противовирусную терапию и отбора пациентов, у которых возможны более короткие курсы лечения. В целом полиморфизм IL28В – это один из факторов, позволяющих индивидуализировать лечение хронического гепатита С [10]. В литературе есть данные о том, что полиморфизм гена IL28В ассоциирован развитием с гепатоцеллюлярной карциномы, индуцированной HCV [5]. Таким образом, представляется интересным изучение взаимосвязи полиморфизма этого гена с тяжестью поражения печени, в частности, с нарушениями функциональных печеночных проб, лабораторными тестами фиброза и регенерации печени, что поможет уточнить роль полиморфизма IL28В в патогенезе и прогрессировании ХГС.
Цель исследования – изучить взаимосвязь лабораторных маркеров цитолиза, холестаза, гиалуроновой кислоты (ГК), альфа-фетопротеина (АФП), уровня вирусной нагрузки (ВН) и генетического полиморфизма IL28B в участке rs12979860 у больных ХГC.
Материалы и методы исследования
Обследовано 100 пациентов с ХГС в фазе реактивации, госпитализированных в Пермскую краевую инфекционную клиническую больницу для начала проведения комбинированной противовирусной терапии. Средний возраст больных составил 38,3 ± 10,4 года, из них 48 мужчин и 52 женщины. Этиологическая верификация диагноза проводилась качественным и количественным определением в крови у пациентов РНК HCV с помощью полимеразной цепной реакции (ПЦР), а также серологических маркеров HCV. По генотипу HCV пациенты с ХГС разделились следующим образом: генотип 1 определен у 56 % больных, генотип 2 и 3 – у 44 %. Сопоставимая по полу контрольная группа включала 90 практически здоровых (доноров) лиц со средним возрастом 36,3 ± 7,9 лет, не имеющих заболеваний печени.
В настоящем исследовании мы проанализировали однонуклеотидную замену (SNP) в гене IL-28В (rs12979860) у 190 человек (90 доноров без хронических заболеваний печени и 100 пациентов с ХГС).
Распространенности гомозигот по аллелю С (СС) в группе здоровых и больных ХГС достоверно не отличались (χ2 = 0,61; р = 0,44) и составили соответственно 42 и 36 % (рисунок). Встречаемость патологических гомозигот ТТ в группе здоровых и больных ХГС составила соответственно 6 и 8 % (χ2 = 0,35; р = 0,55). В обеих группах преобладали гетерозиготы СТ (χ2 = 0,79; р = 0,67). Соотношение частот аллелей изучаемого маркера в исследуемых группах также не характеризовалось различием. Встречаемость патологического минорного аллеля Т в группе с ХГС составила 36 %, в группе контроля 32 % (χ2 = 0,64; р = 0,42). Полученные результаты по встречаемости генотипов и аллелей IL-28В (rs12979860) как для здоровых лиц, так и в группе ХГС среди популяции Пермского края практически не отличаются от данных других авторов. В частности, в России распространенность протективного аллеля С в популяции составляет 61–64 %, в наших исследованиях – 64 % у больных ХГС и 61 % в группе контроля [5, 10]. Таким образом, в ходе исследования не было установлено статистически значимого отличия частот генотипов и аллелей маркера IL-28В (rs12979860) между группами здоровых индивидуумов и лиц с ХГС. В группе больных ХГС частота аллеля риска Т составила 0,359, что достоверно не отличалось от его частоты 0,319 среди здоровых. Из 56 больных, инфицированных HCV-1, у 40 человек было выявлено неблагоприятное сочетание генотипов rs12979860 СТ и ТТ (35 и 5 соответственно), что значимо отличалось от группы контроля (χ2 = 4,55; р = 0,03). Таким образом, потенциальный риск развития неустойчивого вирусологического ответа при 1 генотипе HCV составил 71,4 %.
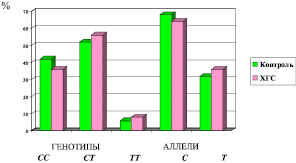
Распространенность генотипов и аллелей полиморфизма гена IL-28В (rs12979860) у больных ХГС и в группе контроля
При корреляционном анализе минорный аллель Т гена IL-28В (rs12979860) продемонстрировал достоверные взаимосвязи с функциональными печеночными тестами: АЛТ, АСТ, общим и прямым билирубином, что указывает на взаимосвязь полиморфизма гена и тяжести поражения печени. Эти данные также свидетельствуют о неблагоприятном влиянии выраженности цитолиза и холестаза на прогноз противовирусной терапии (табл. 2). Полученные результаты согласуются с данными исследования Agundez J.A. и соавт. (2009), которые выявили взаимосвязь генного полиморфизма с АЛТ, гамма-глютамилтранспептидазой, соотношением АСТ/АЛТ [3].
Взаимосвязи минорного аллеля Т гена IL-28В (rs12979860) с функциональными печеночными пробами, гиалуроновой кислотой и альфа-фетопротеином при ХГС
В настоящее время проблемой хронической HCV-инфекции интересуются как врачи-специалисты, так и люди, никак не связанные с медициной. От гепатита С во всем мире страдают по меньшей мере 200 млн человек.
В настоящее время проблемой хронической HCV-инфекции интересуются как врачи-специалисты, так и люди, никак не связанные с медициной.
От гепатита С во всем мире страдают по меньшей мере 200 млн человек. Последствиями перенесенного заболевания могут быть хронический гепатит, цирроз и первичный рак печени.
Распространенность хронической HCV-инфекции на земном шаре варьирует от 0,5 до 2%. Существуют регионы, для которых характерна более высокая распространенность этого заболевания: 6% в Заире и Саудовской Аравии, 16% в изолированных поселениях в Японии. В России наблюдается рост заболеваемости гепатитом С (3,2 на 100 тыс. населения в 1994 году и 19,3 в 1999 году). Источниками заражения вирусным гепатитом C служат больные острыми и хроническими формами HCV-инфекции, причем в основном это люди, у которых отсутствует желтуха и наблюдается бессимптомное или малосимптомное течение заболевания.
В настоящее время HCV чаще всего инфицируются молодые люди, преимущественно мужчины в возрасте около 20 лет, примерно 40% из них заражаются при внутривенном введении наркотиков. Основным путем инфицирования HCV является парентеральный. Так, у 6,1% больных, которым производилось переливание крови и ее компонентов во время кардиохирургических операций, развивался острый вирусный гепатит C, у 60% из них гепатит принимал хроническую форму.
Существует и риск заражения гепатитом C половым путем, однако он невелик (5-8%). Возможна передача HCV от матерей с острой или хронической формой инфекции; это также редкое явление, встречается не чаще чем в 5-6% случаев. Риск заражения вышеуказанными путями уступает таковому при гепатите В.
Приблизительно у половины больных путь инфицирования HCV установить не удается.
Вирус гепатита С относится к семейству флавивирусов. Геном вируса представлен однонитевой РНК протяженностью около 10 000 нуклеотидов. Вирус гепатита С вызывает заболевание только у человека. В экспериментальных условиях воспроизвести инфекцию можно у высших обезьян.
Определение генотипов вируса гепатита С имеет большое значение для практической медицины. Хотя до сих пор не установлено четкой корреляции между генотипами и уровнем виремии, характеристиками пациента, тяжестью течения заболевания, большинство исследователей соглашаются с выводами о значении генотипов вируса как важного фактора, влияющего на эффективность противовирусной терапии.
Вакцину против гепатита С создать пока не удалось из-за высокой изменчивости вируса гепатита С (ВГС).
Считают, что вирус оказывает прямое цитопатическое действие и вызывает иммуноопосредованное повреждение гепатоцитов. Высокая степень хронизации вирусного гепатита С обусловлена некоторыми особенностями действия вируса:
- возможностью внепеченочной репликации вируса, включая иммунокомпетентные клетки (клетки, предшественники гемопоэза, лимфоциты и моноциты периферической крови, миофибробласты);
- гетерогенностью генотипов и частыми мутациями генома вируса;
- индукцией каскада иммунопатологических реакций;
- активизацией процессов перекисного окисления липидов в печени.
В течении хронической HCV-инфекции может происходить нейтрализация мажорного варианта вируса, но тогда генерируются минорные варианты. Квазивиды HCV представляют собой движущуюся мишень, которую ограничивает иммунная система хозяина. Появление нового мажорного квазивида сопровождается повышением виремии и увеличением титра Ig M антител к вирусным белкам. Постепенно и этот новый мажорный вариант заменяется. Такой процесс приводит к периодической волнообразной виремии, сопровождающейся обострением хронического гепатита С (ХГС) и повышением уровня антител.
Возможно, антивирусному Т-клеточному ответу отведена центральная роль в элиминации ВГC, так как нейтрализующие антитела, по-видимому, очень часто оказываются неэффективными. Т-хелперные (Th) лимфоциты распознают вирусные антигенные пептиды, представленные HLA-комплексом II класса на поверхностной мембране антиген-презентирующих клеток. В зависимости от типа цитокинового профиля Th-клетки делятся на две группы: Th1 и Th2. Первые продуцируют IFNg и IL2, стимулируя Т-клеточный ответ и цитотоксическую Т-лимфоцитную активность, а вторые продуцируют IL4 и IL10, стимулируя В-клеточный ответ. Таким образом, Тh-лимфоциты играют существенную роль в регуляции иммунного ответа. У пациентов, у которых болезнь перешла в хроническую стадию, в острой фазе вирус-специфический Th ответ был ниже и преобладали цитокины типа Th2.
У хронически ВГC-инфицированных пациентов значительно увеличено содержание вирусоспецифических Th2-клеток и их цитокинов. Нарушение баланса Th1/Th2 цитокиновой продукции может играть важную роль в иммунопатогенезе хронической ВГC-инфекции. Показано снижение уровня IFNg и IL12 при ХГС. Этот дефицит является следствием повышенного уровня IL10, предполагаемого отрицательного регулятора для IFNg. Повышенное содержание Th2-клеток при ХГС может снижаться при комбинированной терапии рибавирином и IFNa. Обнаружено, что у пациентов с клинико-биохимическим улучшением после лечения IFNa произошло увеличение уровня Th1-цитокинов.
Цитотоксические лимфоциты (CTL) играют, по-видимому, некоторую роль в ограничении репликации ВГС. Этот ответ недостаточен для полной элиминации вируса при хронической инфекции и, кроме того, может вызывать повреждение печени. Известно, что CTL способны быстро опознавать и направленно лизировать клетки, несущие ВГC-антигены, не провоцируя значительного воспаления, с помощью перфоринового, FasL- и TNFα-базируемых механизмов.
ТNF, как предполагается, индуцируют апоптоз клеток, опосредуя высвобождение свободных радикалов из митохондриальных электронно-транспортных путей и модуляцию синтеза некоторых белков. Взаимодействие нуклеокапсидного белка ВГC с внутрицитоплазматической частью рецептора TNFb, вероятно, представляет собой эволюционно-отобранный механизм, с помощью которого вирус препятствует преждевременному апоптозу клетки-хозяина. В отсутствие доступных модельных клеточных культур прямая цитопатичность вируса гепатита С не может быть исследована в полном объеме.
В подавляющем большинстве случаев острого гепатита С иммунной системе не удается элиминировать вирус. До сих пор нет ясного представления о том, почему это происходит. Очевидно, ВГС обладает эволюционно-закрепленными способностями, обеспечивающими ему персистенцию.
Однако иммунная система может оказывать существенное влияние на ВГC-инфекцию. В 15% случаев острого гепатита С она эффективно уничтожает вирус, а у хронически ВГC-инфицированных обеспечивает умеренное ограничение инфекции в течение почти 20 лет. Возможно, ослабление какого-либо звена антивирусных иммунных механизмов позволяет вирусу активно воздействовать на иммунную систему. Длительная ВГC-персистенция может привести к развитию В-клеточных лимфопролиферативных нарушений, таких, как смешанная криоглобулинемия, злокачественная не-Ходжкинская лимфома и появление органоспецифических и неспецифических аутоантител. Таким образом, хроническую ВГC-инфекцию следует рассматривать как мультисистемное заболевание.
Лабораторная диагностика гепатита С основана на выявлении специфических маркеров инфицирования ВГС (анти-ВГС-IgM/G, РНК ВГС) и должна проводиться разрешенными МЗ РФ к применению диагностическими препаратами отечественного или зарубежного производства в лабораториях, имеющих лицензию на проведение данного вида лабораторных исследований.
HCV RNA — самый ранний маркер репликации вируса, определяемый с помощью полимеразной цепной реакции (ПЦР) спустя несколько недель после заражения. Для выявления анти-ВГС применяют иммуноферментный анализ (ИФА). В настоящее время используют тест-системы третьего поколения ELISA-3. Подтверждающим методом является рекомбинантный иммуноблотинг (RIBA). У 60% больных анти-ВГС определяются в острой фазе, у 35% они появляются спустя 3-6 месяцев после инфицирования, у 5% инфицированных лиц анти-ВГС не определяются.
Болезнь может протекать бессимптомно. Наиболее распространенным симптомом является слабость. Целенаправленный опрос больных часто помогает выявить такие факторы риска, как переливание крови, внутривенное введение наркотиков, хронический гемодиализ и др. Кроме слабости больной может жаловаться на быструю утомляемость, тяжесть в правом подреберье, боли в правом верхнем квадранте живота, диспепсические явления.
Критериями постановки диагноза являются увеличение печени и селезенки, гиперферментемия и анти-ВГС в крови в течение не менее 6 месяцев.
Гепатоспленомегалия выявляется не более чем у 50% обратившихся за помощью больных, активность сывороточных трансаминаз редко превышает верхнюю границу нормы в 6 раз. Следует обратить внимание на то, что активность сывороточных трасаминаз не отражает степени изменений в печени: она может быть нормальной, несмотря на значительные морфологические изменения. Концентрация РНК ВГС в сыворотке имеет существенное значение для определения контагиозности и для мониторинга результатов лечения. При наличии в крови HCV-РНК биопсия печени, как правило, выявляет ряд изменений. Концентрация HCV-РНК в сыворотке, превышающая 105 молекулярных эквивалентов (копий) в 1 мл, наблюдается в активной фазе заболевания и совпадает с пиками активности трансаминаз.
Наличие или отсутствие РНК ВГС, как правило, не является диагностическим критерием хронического гепатита С и определяет фазу процесса (активный, неактивный).
Для раннего выявления ГЦК у больных циррозом печени, особенно у мужчин старше 40 лет, каждые 6 месяцев определяют уровень сывороточного α-фетопротеина и выполняют УЗИ печени.
Инфицирование ВГС приводит к развитию острого гепатита С, протекающего в манифестной (желтушной) или чаще в латентной (безжелтушной) формах, которые развиваются в соотношении 1:6. Около 17-25% больных острым гепатитом С выздоравливают спонтанно, у остальных 75-83% развивается хронический гепатит С. Большинство больных с биохимическими и иммунологическими признаками хронического гепатита имеют слабовыраженную или умеренную степень воспалительно-некротического поражения печени и минимально выраженный фиброз. Примерно у 26-35% больных хроническим гепатитом С в течение 10-40 лет развивается фиброз печени и может наступить смерть от цирроза печени и его осложнений. У 30-40% больных с циррозом печени высок риск заболевания раком печени.
Считается, что не более чем у 30% больных ВГС с минимальной морфологической активностью через 20 лет возможно развитие цирроза печени. Таким образом, больные, у которых при гистологическом исследовании биоптата печени выявляется наличие минимального воспаления и минимального фиброза, нуждаются в динамическом наблюдении.
Если персистенция РНК ВГС сохраняется более 6 месяцев, то спонтанное разрешение хронической HCV-инфекции маловероятно.
У большинства больных с хроническим гепатитом С заболевание протекает бессимптомно. Если жалобы существуют, то это чаще всего слабость, тупые боли в правом подреберье, тошнота, снижение аппетита, кожный зуд, артралгии и миалгии. Физикальный осмотр пациента помогает установить диагноз зачастую только на стадии цирроза печени.
Ассоциация хронического гепатита С с различными внепеченочными проявлениями — хорошо известный врачам факт. Наиболее вероятным для большинства заболеваний и синдромов, наблюдаемых при HCV-инфекции, представляется иммунный патогенез, хотя конкретные механизмы во многом еще не выяснены. Доказанные и предполагаемые иммунные механизмы включают:
- моно- или поликлональную пролиферацию лимфоцитов;
- образование аутоантител;
- отложение иммунных комплексов;
- секрецию цитокинов.
Частота иммуноопосредованных заболеваний и синдромов у больных хроническим гепатитом С достигает 23%. Наиболее характерны аутоиммунные проявления для больных с гаплотипом HLA DR4, который ассоциируется с внепеченочными проявлениями при аутоиммунном гепатите. Этот факт подтверждает гипотезу о триггерной роли вируса в инициации аутоиммунных процессов у генетически предрасположенного индивидуума.
Ассоциированные с продукцией или отложением иммуноглобулинов:
- Криоглобулинемия
- Лейкоцитокластерный васкулит
- Мембранозно-пролиферативный гломерулонефрит
- В-клеточная лимфома
- Плазмоцитома
- MALTома
- Тиреоидит
- Синдром Шегрена
- Гемолитическая анемия
- Тромбоцитопения
- Красный плоский лишай
Ассоциированные с неизвестным механизмом:
- Поздняя кожная порфирия
Выявление сывороточных аутоантител отражает наиболее частый феномен аутоиммунизации при HCV-инфекции, который диагностируют у 40-65% больных. Спектр аутоантител достаточно широк и включает ANA (до 28%), SMA (до 11%), анти-LKM-1 (до 7%), антифосфолипидные (до 25%), антитиреоидные (до 12,5%), ревматоидный фактор, анти-ASGP-R и др. Чаще всего титры этих антител не достигают диагностических значений, показательных для той или иной аутоиммунной патологии.
Анти-GOR являются антителами, специфичными для HCV-инфекции, и их выявляют не менее чем у 80% больных. Эпитоп, распознаваемый анти-GOR, локализуется на пока неидентифицированном ядерном белке, гиперэкспрессию которого наблюдают при гепатоцеллюлярной карциноме. Выработка анти-GOR ассоциирована только с HCV-инфекцией, но не с АИГ.
Аутоиммунные расстройства наблюдаются в среднем у 23% больных хроническим гепатитом С. Наиболее часто встречаются патология щитовидной железы.
Гистологическая картина не является патогномоничной, при этом достаточно часто выявляются характерные изменения. Отличительная особенность ее — лимфоидные агрегаты или фолликулы в портальных трактах, которые могут быть как изолированными, так и частью воспалительных изменений портальных трактов. По клеточному составу эти агрегаты напоминают первичные лимфоидные фолликулы в лимфатических узлах. Жировая дистрофия обнаруживается в 75% случаев. Кроме того, выявляются следующие характерные изменения: негнойный холангит с лимфоидной и плазмоклеточной инфильтрацией стенок протоков; лимфогистиоцитарная инфильтрация перипортальной зоны; слабовыраженные ступенчатые некрозы; мостовидные некрозы (обнаруживаются редко), пролиферация и активация сателлитных клеток печени, пролиферация эпителия желчных канальцев.
Отмечено, что индекс гистологической активности (ИГА) и индекс фиброза (ИФ) у больных хроническим гепатитом С с наличием жировой дистрофии достоверно выше, чем у пациентов без сопутствующей жировой дистрофии. У 93% больных с жировой дистрофией в гепатоцитах обнаруживался Core-протеин ВГС, при отсутствии жировой дистрофии — лишь у 39%. Этим фактом подчеркивается роль Core-протеина в развитии жировой дистрофии гепатоцитов.
Биопсия печени играет существенную роль в уточнении диагноза и оценке активности и стадии заболевания.
РНК ВГС можно определить в ткани печени методом ПЦР.
Основная цель лечения — предотвратить прогрессирование заболевания.
Режим отдыха, диета и прием витаминов не оказывают лечебного действия.
Отбор пациентов для лечения. Показанием к назначению терапии интерфероном служит умеренное (но не минимальное) либо тяжелое воспаление и/или фиброз. Решение о лечении пациентов с циррозом печени принимают индивидуально в каждом конкретном случае. Больные, у которых гистологическая активность минимальна, должны находиться под динамическим наблюдением, так как они имеют хороший жизненный прогноз без лечения и очень низкий риск развития цирроза печени через 10-20 лет.
Факторы, связанные с благоприятным эффектом противовирусной терапии при хронической HCV-инфекции:
- Возраст моложе 45 лет
- Женский пол
- Отсутствие ожирения
- Срок инфицирования менее 5 лет
- Отсутствие коинфекции HBV
- Отсутствие иммунодепрессии
- Отсутствие алкоголизма
- Умеренное повышение АЛТ
- Отсутствие цирроза
- Низкое содержание железа в печени
- Низкий уровень HCV RNA в сыворотке
- Генотип 2 или 3
- Однородность популяции вируса
Больным с нормальным уровнем АЛТ и положительным тестом на HCV RNA без результатов гистологического исследования противовирусное лечение проводить не рекомендуется.
Основной препарат, эффективность которого в лечении гепатита С доказана, — это интерферон альфа (ИФα).
В настоящее время принята оптимальная схема монотерапии ИФ: разовая доза составляет 3 млн МЕ, ее вводят подкожно или внутримышечно 3 раза в неделю в течение 3 месяцев. Через 3 месяца необходимо исследовать РНК ВГС. Если результаты ПЦР положительные схему лечения меняют. Если же РНК не выявляется, лечение продолжают до 12 месяцев. Стойкий положительный ответ в этом случае регистрируется у 15-20% больных.
Оптимальная схема лечения хронического гепатита С в настоящее время — это комбинация ИФa и рибавирина.
- в течение 6 месяцев - при генотипах 2 и 3;
- в течение 6 месяцев - при генотипе 1 и низком уровне виремии;
- в течение 12 месяцев - при генотипе 1 и высоком уровне виремии.
Стойкий положительный ответ при комбинированном лечении ИФa с рибавирином наблюдается в 40-60% случаев.
Суточная масса рибавирина составляет 1000-1200 мг в зависимости от массы тела.
В последние годы для повышения эффективности интерферона применяют пегилирование, которое заключается в присоединении к молекуле интерферона полиэтиленгликоля. В итоге образуется ПЭГ-интерферон, имеющий более длительный период полураспада. Предварительные данные свидетельствуют о большей эффективности такого лечения по сравнению с терапией интерфероном альфа.
Имеются данные, свидетельствующие о положительном действии таких препаратов, как ремантадин, урсодеоксихолевая кислота, пегилированные интерфероны, препараты глициризиновой кислоты, однако эта информация нуждается в дальнейшей проверке.
По вопросам литературы обращаться в редакцию
Аннотация научной статьи по клинической медицине, автор научной работы — Фазылов В. Х., Ткачева С. В., Манапова Э. Р.
Поиск рациональных методов лечения ХГС у пациентов, неответивших на первичную противовирусную терапию (ПВТ), преимущественно при неблагоприятных генотипах по интерлейкину-28B (ИЛ-28В), остается актуальным. Цель исследования: оценить эффективность и безопасность применения рекомбинантного ИЛ-1β (Беталейкин®) в комбинированной ПВТ у пациентов с ХГС, неответивших на предыдущее лечение. Материалы и методы: в исследование было включено 26 пациентов с HCV-1. Пациенты были разделены на 2 группы в зависимости от схемы повторной комбинированной терапии: 1 группа (n=10) получала рекомбинантный ИФН-α2в (препарат Интераль®-П) по 5 млн. МЕ ежедневно, подкожно (п / к) в течение 12 недель, затем через день до окончания лечения; рибавирин в зависимости от массы тела (800-1200 мг / сут) и Беталейкин®) п / к по 0,005 мкг / кг через день в течение 12 недель (45 инъекций); 2 группа (n=16) - рекомбинантный ИФН-α2в (препарат Интераль®-П) по 3 млн. МЕ через день, п / к в течение 48 недель; рибавирин по 1000 мг / сут (для массы тела 75 кг) и Беталейкин®) п / к по 0,005 мкг / кг через день, всего 5 курсов по 3 недели (50 инъекций). Результаты: комбинированная ПВТ (α-ИФН2в и рибавирин ) ХГС с включением цитокинового препарата Беталейкин® у пациентов, неответивших на предыдущую терапию, с преобладанием неблагоприятного генетического фона по ИЛ-28В типированию способствовало повышению УВО (44 %) с большей эффективностью 45-дневного введения препарата в первые 12 недель ПВТ в сочетании с индукционным методом α-ИФН-терапии и достижению биохимического ответа к 24 неделе лечения. Нежелательные явления препарата Беталейкин® ограничивались преимущественно лихорадочной и умеренной местной болевой реакциями, не требовавшие отмены терапии.
Похожие темы научных работ по клинической медицине , автор научной работы — Фазылов В. Х., Ткачева С. В., Манапова Э. Р.
APPLYING OF RECOMBINANT INTERLEUKIN-1Β TO TREAT CHRONIC HEPATITIS C FOR PATIENTS, NON-RESPONSE TO THE PREVIOUS ANTIVIRAL THERAPY
ПРИМЕНЕНИЕ РЕКОМБИНАНТНОГО ИНТЕРЛЕЙКИНА-ф В ЛЕЧЕНИИ ХРОНИЧЕСКОГО ГЕПАТИТА С У ПАЦИЕНТОВ, НЕ ОТВЕТИВШИХ НА ПЕРВИЧНУЮ ПРОТИВОВИРУСНУЮ ТЕРАПИЮ
Фазылов В. Х., Ткачева С. В., Манапова Э. Р.
Казанский государственный медицинский университет, Россия, 420012, Казань, ул. Бутлерова 49
APPLYING OF RECOMBINANT INTERLEUKIN-1|3 TO TREAT CHRONIC HEPATITIS C FOR PATIENTS, NON-RESPONSE TO THE PREVIOUS ANTIVIRAL THERAPY
Fazylov V. H., Tkacheva S. V., Manapova E. R.
Kazan state medical university, Russia, Butlerova str., 49, Kazan, Tatarstan, 420055
Вильдан Хайруллаевич Fazylov Vildan Н. E-mail:
Фазылов Вильдан Хайруллаевич Доктор медицинских наук, профессор, заведующий кафедрой инфекционных болезней КГМУ Ткачева Светлана Васильевна Кандидат медицинских наук, доцент кафедры инфекционных болезней КГМУ Манапова Эльвира Равилевна Кандидат медицинских наук, ассистент кафедры инфекционных болезней КГМУ Fazylov Vildan 4airullaevich, Doctor of Medical Science/Professor, Kazan state medical university Tkacheva Svetlana Vasilevna, MD Ph.D, department of infectious diseases, Kazan state medical university Manapova Elvira Ravilevna MD Ph.D, department of infectious diseases, Kazan state medical university
Поиск рациональных методов лечения ХГС у пациентов, неответивших на первичную противовирусную терапию (ПВТ), преимущественно при неблагоприятных генотипах по интерлейкину-28В (ИЛ-28В), остается актуальным. Цель исследования: оценить эффективность и безопасность применения рекомбинантного ИЛ-1р (Беталейкин®) в комбинированной ПВТ у пациентов с ХГС, неответивших на предыдущее лечение. Материалы и методы: в исследование было включено 26 пациентов с НСУ-1. Пациенты были разделены на 2 группы в зависимости от схемы повторной комбинированной терапии: 1 группа (п=10) получала рекомбинантный ИФН-а2в (препарат Интераль®-П) по 5 млн. МЕ ежедневно, подкожно (п/к) в течение 12 недель, затем через день до окончания лечения; рибавирин в зависимости от массы тела (800-1200 мг/сут) и Беталейкин®) п/к по 0,005 мкг/кг через день в течение 12 недель (45 инъекций); 2 группа (п=16) — рекомбинантный ИФН-а2в (препарат Инте-раль®-П) по 3 млн. МЕ через день, п/к в течение 48 недель; рибавирин по 1000 мг/сут (для массы тела 75 кг) и Беталейкин®) п/к по 0,005 мкг/кг через день, всего 5 курсов по 3 недели (50 инъекций). Результаты: комбинированная ПВТ (а-ИФН2в и рибавирин) ХГС с включением цитокинового препарата Беталейкин® у пациентов, неответивших на предыдущую терапию, с преобладанием неблагоприятного генетического фона по ИЛ-28В типированию способствовало повышению УВО (44%) с большей эффективностью 45-дневного введения препарата в первые 12 недель ПВТ в сочетании с индукционным методом а-ИФН-терапии и достижению биохимического ответа к 24 неделе лечения. Нежелательные явления препарата Беталейкин® ограничивались преимущественно лихорадочной и умеренной местной болевой реакциями, не требовавшие отмены терапии.
Ключевые слова: хронический гепатит С; противовирусная терапия; интерферон-альфа; рибавирин; интерлей-кин-1р; интерлейкин-28В.
Экспериментальная и клиническая гастроэнтерология 2014; 110 (10):64-69
Keywords: chronic hepatitis C; antiviral therapy; interferon alpha; ribavirin; interleukin -1p; interleukin -28B.
Eksperimental'naya i Klinicheskaya Gastroenterologiya 2014; 110 (10):64-69
Сочетание пегилированного интерферона-альфа (ПегИФН-а) и рибавирина (РИБ) в этиотропной терапии хронического гепатита С (ХГС) у наивных пациентов применяется с 2001 года [1], с достижением устойчивого вирусологического ответа (УВО) при генотипе 1 ЫСУ (ЫСУ-1) у 40-50% пациентов. Определение генотипов пациента по интерлей-кину — 28В (ИЛ-28В) позволяет прогнозировать при благоприятном генотипе СС полиморфизма ге12979860 ИЛ-28В получение УВО у 70-80% больных, получающих в течение 48 недель ПегИФН-а и РИБ [2]. Ежедневное введение стандартных ин-терферонов-альфа (ИФН-а) в высоких дозах часто и не без успеха используется в практической медицине, поскольку авторы во многом ориентируются на аналогичные исследования за рубежом, где в качестве основного аргумента подобного терапевтического режима рассматривается их максимальное приближение к профилю ПегИФН-а 3. Остается актуальным поиск рациональных методов терапии ХГС у "неответчиков", так как даже использование у них ингибиторов протеаз в комбинированной терапии позволяет достичь УВО у 29-88% пациентов в зависимости от вариантов ответа на предыдущую противовирусную терапию (ПВТ) 9. Вирус гепатита С имеет механизмы противодействия защитным реакциям
Материал и методы исследования
В исследование было включено 26 пациентов (69% мужчин и 31% женщин) с ЫСУ-1, неответивших на первичную ПВТ. Пациенты были разделены на две группы в зависимости от схемы повторной комбинированной терапии и сопоставимы по основным исходным показателям (табл. 1). Первичная ПВТ была проведена у 30% больных стандартными ИФН-а2в,
у 70% — пегилированными ИФН-а (ПегИФН-а2а, ПегИФН-а2в) в сочетании с рибавирином.
Схемы повторной комбинированной ПВТ в исследуемых группах представлены в табл. 2.
Диагноз ХГС устанавливался на основании эпидемиологических, клинико-лабораторных данных и подтверждался выявлением специфических
Исходные показатели пациентов.
Характеристика пациентов 1 группа (n=10) 2 группа (n=16)
Мужчины, п (%) 7 (70) 11(69)
Возраст (годы, М±т) З5,0±2,56 ЗЗ,0±2,11
Срок инфицирования (годы, М±т) 10,7±1,5 7,6З±0,1
ИМТ (М±т) 24,2±1,25 2З,0±1,02
Вирусная нагрузка РНК-НСУ, п (%)
- 400000 МЕ/мл 4 (40) 9(56)
АлАТ (М±т), ед/л 59,06±З,7 48,6±5,З5
¡группа II группа
БВО (4нед. ПВТ) РВО (12нед.ПВТ) УВО(24 нед. ДН)
Частота распределения генотипов СС, СТ, ТТ М2979860) и ТТ, ТО, ОО М099917) ИЛ-28В у пациентов ХГС.
Динамика вирусологического ответа у больных ХГС в исследуемых группах.
70,0 60,0 50,0 40,0 30,0 20,0 10,0 0
Показатели АлАТ у пациентов с ХГС до и на фоне ПВТ.
** (р Не можете найти то, что вам нужно? Попробуйте сервис подбора литературы.
Динамика показателей лейкоцитов и нейтрофилов до и на фоне ПВТ. * (р Не можете найти то, что вам нужно? Попробуйте сервис подбора литературы.
* (р Не можете найти то, что вам нужно? Попробуйте сервис подбора литературы.
В исследовании не выявлено ни одного случая серьезной нежелательной реакции или непредвиденной нежелательной реакции. У всех больных наблюдалась нежелательная реакция в виде грип-поподобного синдрома разной степени выраженности, которая соответствует описанным побочным эффектам в инструкциях по медицинскому применению препаратов Интераль-П' и Беталейкин'. Снижение массы тела отмечалось у 95% пациентов в 1-й группе и у 92% во 2-й, нервно-психические нарушения (раздражительность, бессоница, сонливость и т.д.) зафиксированы у 66% и 62% больных, соответственно. В области подкожного введения рекомбинантного ИЛ-lß через 4-6 ч, как правило, появлялись гиперемия и слабо выраженный инфильтрат, которые не являлись проявлением инфицирования и не требовали врачебного вмешательства. Выраженные побочные явления купировались введением парацетамола или нестероидных противовоспалительных препаратов.
Включение цитокинового препарата ИЛ-lß (Беталейкин') в комбинированную ПВТ (а-ИФН2в и рибавирин) ХГС у пациентов, неответивших на предыдущую терапию, с преобладанием неблагоприятного генетического фона по ИЛ-28В типи-рованию способствовало повышению УВО (44%) с большей эффективностью 45-дневного введения
препарата в первые 12 недель лечения в сочетании с индукционным методом а-ИФН-терапии и достижению биохимического ответа к 24 неделе лечения. Нежелательные явления препарата Беталейкин' ограничивались преимущественно лихорадочной и умеренной местной болевой реакциями, не требовавшие отмены терапии.
1. Manns MP, McHutchison JG, Gordon SC. et al, and the International Hepatitis Interventional Therapy Group. Pegin-terferon alfa-2b plus ribavirin compared with interferon al-fa-2b plus ribavirin for initial treatment of chronic hepatitis C: a randomised trial. Lancet, 2001;358:958-965. Abstract.
2. Rauch A, Kutalik Z, Descombes P et al. Genetic variation in IL28B is associated with chronic hepatitis C and treatment failure: a genomewide association study. Gastroenterology, 2010; 138: 1338-1345.
3. Bruno R., Brunetti E., Maffezzini E.et al. Daily dose interferon for chronic hepatitis C: a prospective randomized study. Hepatology, 1998; vol. 28: (4). pt.2. P. 572A, abstr. 1637.
5. Никитин И. Г., Гогова Л. М., Байкова И. Е. и соавт. Человеческий лейкоцитарный альфа-интерферон в комбинированной терапии больных хроническим гепатитом С, инфицированных не 1-м генотипом вируса. Клинические перспективы гастроэнтерологии, гепатологии, 2009, 1, с. 33-37.
6. Jacobson I. M, McHutchinson J., Dusheiko G. et al. Tel-aprevir for previously untreated chronic Hepatitis C Virus Infection. N Engl J Med, 2011, 364;25, 2405-2416.
7. Zeuzem S. et al. Telaprevir for Retreatment of HCV Infection. N Engl J Med, 2011;364:241728.
8. EASL Clinical Practice Guidelines: Management of hepatitis C virus infection. Journal of Hepatology,2011, vol.55, рр.245-264.
9. Ghany M., Nelson D., Strader D. et al. An Update on Treatment of Genotype 1 Chronic Hepatitis C Virus Infection: 2011 Practice Guideline by the American Association for the Study of Liver Diseases, Hepatology, 2011, vol.54, No. 4, pp. 1433-1444.
10. Кузнецов Н. И., Кабанова В. И., Конусова В. Г. и соавт. Результаты использования рекомбинантных препаратов интерлейкина-1 бета и интерферона альфа^ в терапии больных хроническим вирусным гепатитом С. Клинические перспективы гастроэнтерологии, гепатологии, 2006, № 5, с.8-14.
11. Симбирцев А. С. Интерлейкин-1: от эксперимента в клинику/А. С. Симбирцев // Медицинская иммунология, 2001, т.3, № 3, с.431-438
13. Zhu H., Liu C. Interleukin-1 inhibits hepatitis C virus subgenomic RNA replication by activation of extracellular regulated kinase pathway. J. Virology, 2003, vol.77, рр.5493-5498.
14. Лобзин Ю. В. Жданов К. В., Симбирцев А. С. и соавт. Эффективность и безопасность тройной терапии с использованием рекомбинантного интерлейки-на-1В, рекомбинантного интерферона-а и риба-вирина у пациентов с хроническим гепатитом C, инфицированных генотипом 1, с отсутствием ответа на предшествующее лечение интерфероном и рибавирином. Журнал инфектологии, 2012, т. 4, № 4, с. 81-89.
Читайте также:


