Ингибирование синтеза вирусных рнк

Для лечения гриппа и других ОРВИ АМИКСИН ® может применяться у взрослых и детей с 7 лет.
Узнать подробнее про АМИКСИН ® …

Противовирусный препарат АМИКСИН ® направлен на борьбу с большинством распространенных респираторных вирусов, включая вирусы гриппа.
Узнать больше…

Современные противовирусные препараты, такие как АМИКСИН ® , могут способствовать снижению риска развития осложнений на фоне гриппа и других ОРВИ.
Подробнее…


Для лечения гриппа и других ОРВИ у детей старше 7 лет АМИКСИН ® выпускается в дозировке 60 мг.
Узнать подробнее о детском "Амиксине"…

АМИКСИН ® обладает не только иммуностимулирующим, но и противовирусным действием за счет подавления трансляции вирус-специфических белков.
Узнать подробнее…

Вирусы гриппа и других ОРВИ способны формировать устойчивость к некоторым противовирусным препаратам. АМИКСИН ® способствует стимулированию собственных ресурсов организма на борьбу с инфекцией…
Читать подробнее…

Механизм действия противовирусных средств
Иммунная система умеет распознавать зараженные клетки, поэтому многие противовирусные лекарственные средства направлены на стимулирование собственного иммунитета. Они называются иммуностимуляторами (иммуномодуляторами).
Вообще, создание эффективного противовирусного средства — задача нетривиальная, поскольку вирусы паразитируют внутри клеток, и как в этом случае уничтожить пришельца, не нанеся вреда организму хозяина?
На сегодня в России чаще всего применяется клинико-фармакологическая классификация, означающая, что разделение препаратов на группы производится в зависимости от того, на какие именно виды вирусов они воздействуют [2] . Внутри каждой узкоспециализированной группы препаратов обычно приводится классификация противовирусных средств по механизмам их действия. Давайте изучим вопрос на конкретном примере:
Как можно убедиться, спектр противовирусных лекарственных средств весьма широк. Большую его часть составляют препараты прямого противовирусного действия (ПППД), что означает их специфичность, направленность на конкретные виды вирусов. Однако эти лекарства зачастую оказывают разрушающее воздействие не только на геном вируса и его способность к репликации (размножению), но и на здоровые клетки хозяина. В общем случае можно констатировать, что чем мощнее противовирусный препарат, тем больше у него побочных эффектов. Это обязательно следует учитывать.
В то же время существует категория противовирусных средств неспецифичного (широкого) спектра действия. Преимущественно, это иммуностимуляторы (иммуномодуляторы), призванные активизировать резервные силы организма для борьбы с самыми разнообразными вирусами и другими микроорганизмами.
Итак, вот пример некоторых противовирусных препаратов, разрешенных детям:
Ограничения по возрасту могут быть вызваны не только составом средства, но и его формой выпуска. Например, таблетки не рекомендуются для приема детям до 3 лет, а капсулы — до 7 лет.
- прикрепление вирусов к клеткам;
- проникновение их в клетки;
- размножение;
- выход из клеток.
1) Противовирусные препараты широкого спектра действия:
а) интерфероны – низкомолекулярные гликопротеины: интерферон a, интерферон a-2А, интерферон a-2В – моноцитарный, интерферон b (фибробластный), интерферон γ-1b (Т-лимфоцитарный);
б) интерфероногены – тилорон, арбидол.
2) ингибиторы синтеза поздних вирусных белков – производные тиосемикарбозона: метисазон (для профилактики и лечения оспы).
Назовите ингибиторы самосборки вирусов.
Назовите противогриппозные препараты.
Иминоадомантаны – амантадин, римантадин (ремантадин).
Назовите противогерпетические препараты.
а) аналоги нуклеозидов – трифлуридин, идоксуридин; ацикловир, фамцикловир, валоцикловир, инозин пранобекс, видарабин.
б) производные фосфономуравьиной кислоты: фоскарнет.
Назовите противоцитомегаловирусные препараты.
а) аналоги нуклеозидов – ганцикловир;
б) производные фосфономуравьиной кислоты: фоскарнет.
Назовите препараты для лечения ВИЧ-инфекции.
Препараты для лечения ВИЧ-инфекции:
а) ингибиторы обратной транскриптазы – аналоги нуклеозидов: зидовудин, диданозин, ламивудин, ставудин, зальцитабин, абакавира сульфат;
б) ингибиторы обратной транскриптазы не нуклеозидной структуры: - невирапин, ифавиренц;
в) ингибиторы протеаз – производные пептидов: саквинавир, индинавир, ритонавир.
Назовите препараты для лечения респираторной сентициальной инфекции.
Препараты применяемые при респираторно-синтициальной инфекции:
а) рибавирин (рибофуранозилтриазолокарбоксанид).
Назовите противовирусные препараты широкого спектра действия.
Противовирусные препараты широкого спектра действия:
а) интерфероны – низкомолекулярные гликопротеины: интерферон a, интерферон a-2А, интерферон a-2В – моноцитарный, интерферон b (фибробластный), интерферон γ-1b (Т-лимфоцитарный);
б) интерфероногены – тилорон, арбидол.
Назовите вируцидные препараты местного действия.
Оксолин, теброфен, бутанинофен (РБ), бонафтон (применяется наружно и внутрь).
Назовите гаммаглобулины, применяемые для лечения вирусных инфекций.
Гаммаглобулины против кори, гепатита В и С, бешенства, цитомегаловирусной инфекции;
Механизм действия аминоадамантанов.
Ингибирование процесса высвобождения в клетке вирусного генома.
Механизм действия рибавирина.
Монофосфат рибавирина угнетает синтез гуаниновых нуклеотидов, а трифосфат – ингибирует вирусную РНК-полимеразу и нарушает образование иРНК.
Механизм действия зидовудина.
Фосфорилируясь в клетке и превращаясь в трифосфат, ингибирует обратную транскриптазу вирионов, препятствуя образованию ДНК из вирусной РНК, что подавляет синтез иРНК и вирусных белков и обеспечивает лечебный эффект.
Механизм действия ганцикловира.
Угнетает синтез вирусной ДНК, по механизму действия сходен с ацикловиром.
Механизм действия фоскарнета.
Оказывает ингибирующее влияние на ДНК-полимеразу вирусов.
Механизм действия трифлуридина.
Является фторированным пиримидиновым нуклеозидом, угнетает синтез ДНК.
Механизм действия ацикловира.
Аналог пуриновых нуклеозидов, в клетке фосфорилируется и в виде трифосфата, оказывает ингибирующее влияние на ДНК-полимеразу вируса, что угнетает репликацию вирусной ДНК (фермент в сотни раз чувствительнее к ацикловиру, чем ДНК-полимераза макроорганизма).
Механизм действия невирапина.
Ингибитор обратной транскриптазы не нуклеотидной структуры.
Механизм действия саквинавира.
Высокоактивный и избирательный ингибитор протеаз ВИЧ-1 и ВИЧ-2.
Механизм действия интерферонов.
Интерферон секретируется пораженными клетками в межклеточное пространство и связывается с рецепторами на соседних незараженных клетках. В этих клетках происходит дерепрессия генов и начинается синтез определенных ферментов: протеинкиназа – фосфорилирует рибосомальный белок и фактор инициации, необходимый для синтеза белка, тем самым значительно снижая трансляцию мРНК; второй фермент катализирует образование короткого полипептида адениловой кислоты, активирующего латентную эндонуклеазу, что приводит к деградации мРНК как вируса, так и хозяина. В итоге образуется барьер из неинфицированных клеток вокруг очага вирусной инфекции, что ограничивает его распространение.
Механизм действия тилорона.
Показания к применению ацикловира.
Назначают при простом герпесе, при поражении глаз, гениталий и герпетических поражениях другой локализации, иногда при опоясывающем лишае, а также при цитомегаловирусной инфекции.
Показания к применению трифлуридина.
Применяется при первичном керато-конъюктивите и возвратном эпителиальном кератите, вызванном вирусом простого герпеса.
Показания к применению идоксуридина.
Применяют местно при герпетической инфекции глаз (кератитах).
Противовирусные препараты — соединения природного или синтетического происхождения, применяющиеся для лечения и профилактики вирусных инфекций. Действие многих из них избирательно направлено на различные стадии развития вирусной инфекции и жизненного цик
Противовирусные препараты — соединения природного или синтетического происхождения, применяющиеся для лечения и профилактики вирусных инфекций. Действие многих из них избирательно направлено на различные стадии развития вирусной инфекции и жизненного цикла вирусов.
В настоящее время известно более 500 вирусов, возбудителей заболеваний человека. Вирусы содержат одно- или двухцепочечную рибонуклеиновую кислоту (РНК) или дезоксирибонуклеиновую кислоту (ДНК), заключенную в белковую оболочку — капсид. У некоторых из них есть и внешняя оболочка из липопротеидов. Многие вирусы содержат ферменты или гены, обеспечивающие репродукцию в клетке-хозяине. В отличие от бактерий у вирусов нет собственного обмена веществ: они используют метаболические пути клетки-хозяина.
РНК-содержащие вирусы или синтезируют матричную РНК (мРНК), или сама РНК выполняет функцию мРНК. На ней синтезируются вирусные белки, в том числе РНК-полимераза, при участии которой образуется мРНК вируса. Транскрипция генома некоторых РНК-содержащих вирусов осуществляется в ядре клетки-хозяина. Под действием обратной транскриптазы ретровирусов на основе вирусной РНК синтезируется комплементарная ей ДНК (провирус), которая встраивается в геном клетки-хозяина. В дальнейшем при транскрипции образуется как клеточная РНК, так и мРНК вируса, на которой синтезируются вирусные белки для сборки новых вирусов. Вирусы и заболевания, которые ими вызываются, отражены в табл. 1.

На стадии заражения вирус адсорбируется на клеточной мембране и проникает в клетку. В этот период применяются препараты, нарушающие этот процесс: растворимые ложные рецепторы, антитела к мембранным рецепторам, ингибиторы слияния вируса с клеточной мембраной.
На следующем этапе начинается внутриклеточный синтез вирусных компонентов. На этом этапе эффективны ингибиторы вирусных ДНК-полимераз, РНК-полимераз, обратной транскриптазы, геликазы, праймазы, интегразы. На трансляцию вирусных белков действуют интерфероны (ИФН), антисмысловые олигонуклеотиды, рибозимы и ингибиторы регуляторных белков. На протеолитическое расщепление воздействуют ингибиторы протазы.
ИФН и ингибиторы структурных белков активно воздействует на сборку вируса.
Заключительный этап репликационного цикла включает выход дочерних вирионов из клетки и гибель инфицированной клетки-хозяина. На этом этапе эффективны ингибиторы нейраминидазы, противовирусные антитела и цитотоксические лимфоциты.
Существуют различные классификации противовирусных средств. В данной статье представлена классификация по воздействию на тот или иной вирус (табл. 2).

Рассмотрим противогриппозные и противогерпетические препараты.
Классификация противовирусных препаратов, разрешенных к применению на территории России.
- руппа противогриппозных препаратов:
– Амантадин;
– Арбидол;
– Осельтамивир;
— Римантадин. - Препараты, действующие на герпесвирусы:
– Алпизарин;
– Ацикловир;
– Бонафтон;
– Валацикловир;
– Ганцикловир;
– Глицирризиновая кислота;
– Идоксуридин;
– Пенцикловир;
– Риодоксол;
– Теброфен;
– Тромантадин;
– Фамцикловир;
– Флореналь. - Антиретровирусные препараты:
– Абакавир;
– Ампренавир;
– Атазанавир;
– Диданозин;
– Залцитабин;
– Зидовудин;
– Индинавира сульфат;
– Ламивудин;
– Нелфинавир;
– Ритонавир;
– Саквинавир;
– Ставудин;
– Фосфазид;
– Эфавиренз. - Другие противовирусные препараты:
– Инозин пранобекс;
– Интерферон альфа;
– Интерферон альфа-2;
– Интерферон альфа-2b;
– Интерферон бета-1а;
– Интерферон бета-1b;
– Йодантипирин;
– Рибавирин;
– Тетраоксо-тетрагидронафталин (Оксолин);
– Тилорон;
– Флакозид.
Арбидол — производное индолкарбоновой кислоты. Механизм действия препарата складывается из подавления репродукции вируса гриппа, влияния на синтез ИФН, повышения количества Т-лимфоцитов и функциональной активности макрофагов, а также антиоксидантного эффекта.
Препарат проникает в неизмененном виде как в незараженные, так и в зараженные клетки и определяется в ядерной и цитоплазматической фракциях. Арбидол ингибирует процесс слияния липидной вирусной оболочки с мембранами эндосом (при рН 7,4), приводящий к высвобождению вирусного генома и началу транскрипции. В отличие от амантадина и римантадина, Арбидол ингибирует освобождение самого нуклеокапсида от наружных белков, нейраминидазы и липидной оболочки. Таким образом, Арбидол действует на ранних стадиях вирусной репродукции.
У препарата отсутствует штаммовая специфичность (в культурах клеток он подавляет репродукцию вируса гриппа А на 80%, вируса гриппа В — на 60% и вируса гриппа С — на 20%, а также воздействует и на вирус птичьего гриппа, однако слабее, чем на репродукцию человеческих штаммов вируса гриппа).
Синтез ИФН нарастает, начиная с приема 1 таблетки до 3 таблеток. Однако дальнейшего увеличения уровня ИФН при приеме Арбидола не наблюдается. Быстрое нарастание синтеза ИФН может оказывать профилактическое действие при приеме препарата до начала заболевания гриппом.
Арбидол оказывает иммуномодулирующее действие, приводя к повышению общего количества Т-лимфоцитов и Т-хелперов. Причем нормализация данных показателей наблюдалась у пациентов с исходно сниженным числом CD3- и CD4-клеток, а у лиц с нормальным функционированием клеточного звена иммунитета практически отсутствовали изменения количества Т-лимфоцитов и Т-хелперов. При этом применение Арбидола не ведет к существенному снижению абсолютного числа Т-супрессорных лимфоцитов — таким образом, стимулирующая активность препарата не связана с угнетением функции супрессорных клеток. Арбидол увеличивает общее число макрофагов с поглощенными бактериями и фагоцитарное число. Предполагается, что активирующими стимулами для фагоцитарных клеток явились цитокины и, в частности, ИФН, продукция которого усиливается под воздействием препарата. Увеличивается также содержание натуральных киллеров — NK-клеток, что позволяет характеризовать препарат как индуктор активности естественных киллеров.
Препарат быстро всасывается из желудочно-кишечного тракта (ЖКТ). Т1/2 составляет 16–21 ч. Экскретируется в неизмененном виде с калом (38,9%) и мочой (0,12%). В течение первых суток выводится 90% введенной дозы.
Лекарственные взаимодействия Арбидола с другими лекарственными препаратами в литературе не описаны.
Практически единственными побочными эффектами препарата являются аллергические реакции. Препарат разрешен к применению с 2-летнего возраста.
Арбидол обладает достаточно широким спектром противовирусного действия и используется для профилактики и лечения гриппа типов А и В, в том числе осложненного бронхитом и пневмонией; острых респираторных заболеваний (ОРВИ); хронического бронхита, пневмонии, рецидивирующей герпетической инфекции; в послеоперационном периоде — для нормализации иммунного статуса и профилактики осложнений.
Амантадин и римантадин — производные адамантана. Оба препарата даже в малых дозах подавляют репродукцию вируса А. Их противовирусная активность обусловлена двумя механизмами.
Во-вторых, они могут действовать и на этапе сборки вируса, по-видимому, за счет изменения процессинга гемагглютинина. Этот механизм возможен у некоторых штаммов вирусов.
Среди диких штаммов устойчивость к препаратам возникает редко, однако от больных, принимающих их, получают устойчивые штаммы. Чувствительность и устойчивость вирусов к амантадину и римантадину перекрестная.
Оба препарата хорошо всасываются при приеме внутрь, имеют большой объем распределения. Большая часть амантадина выводится с мочой в неизмененном виде. Период полувыведения (Т1/2) у молодых людей составляет 12–18 ч, у пожилых возрастает почти вдвое, а при почечной недостаточности увеличивается еще больше. Поэтому дозу препарата необходимо уменьшать даже при незначительном изменении функции почек. Римантадин активно метаболизируется в печени, Т1/2 в среднем составляет 24–36 ч, 60–90% препарата выводится с мочой в виде метаболитов.
При приеме обоих препаратов наиболее часто отмечают незначительные дозозависимые нарушения со стороны ЖКТ (тошнота, снижение аппетита) и центральной нервной системы (ЦНС) (раздражительность, бессонница, нарушение концентрации внимания). При приеме высоких доз амантадина возможно значительное нейротоксическое действие: спутанность сознания, галлюцинации, эпилептические припадки, кома (эти эффекты могут усиливаться при одновременном приеме Н1-блокаторов, М-холиноблокаторов, психотропных средств и этанола). Безопасность применения во время беременности не установлена. Разрешено применение с 7-летнего возраста.
Препараты применяются для профилактики и лечения гриппа А. Их прием во время эпидемий гриппа позволяет избежать инфекции в 70–90% случаев. У лиц с неосложненным гриппом А лечение препаратами в течение 5 дней в возрастных дозировках, начатое на ранней стадии заболевания, на 1–2 сут уменьшает длительность лихорадки и общих симптомов, ускоряет выздоровление и иногда сокращает период выделения вируса.
Осельтамивир является неактивным предшественником, который в организме превращается в активный метаболит — осельтамивира карбоксилат. Он является переходным аналогом сиаловой кислоты и избирательным ингибитором нейраминидазы вирусов гриппа А и В. Кроме того, он подавляет штаммы вируса гриппа А, устойчивые к препаратам — производным адамантана.
Нейраминидаза вируса гриппа отщепляет концевые остатки сиаловых кислот и, таким образом, разрушает рецепторы, находящиеся на поверхности клеток и новых вирусов, т. е. способствует выходу вируса из клетки по окончании репродукции. Активный метаболит осельтамивира вызывает изменения в активном центре нейраминидазы и подавляет ее активность. Происходит агрегация вирусов на поверхности клетки и замедляется их распространение.
Устойчивые штаммы вируса гриппа А обнаруживают у 1–2% больных, принимающих препарат. Устойчивых штаммов вируса гриппа В на сегодняшний день не обнаружено.
При приеме внутрь препарат хорошо всасывается. Прием пищи не влияет на его биодоступность, но снижает риск побочного действия на ЖКТ. Препарат подвергается ферментативному гидролизу в ЖКТ и печени с образованием активного метаболита. Объем распределения препарата приближается к объему жидкости в организме. Т1/2 осельтамивира и его активного метаболита составляет 1–3 и 6–10 ч соответственно. Оба соединения выводятся главным образом почками в неизмененном виде.
При приеме внутрь возможны незначительные неприятные ощущения в животе и тошнота, которые уменьшаются при приеме препарата во время еды. Желудочно-кишечные расстройства обычно проходят через 1–2 сут, даже если больной продолжает прием препарата. Клинически значимых взаимодействий осельтамивира с другими препаратами не выявлено. Препарат применяют у детей старше 1 года.
Осельтамивир применяют для лечения и профилактики гриппа. Профилактический прием осельтамивира в период эпидемий снижает заболеваемость как среди вакцинированных противогриппозной вакциной, так и среди невакцинированных. При лечении гриппа этим препаратом выздоровление наступает на 1–2 сут раньше, а количество бактериальных осложнений снижается на 40–50%.
Прежде чем перейти к обсуждению противогерпетических средств, необходимо вспомнить различные вирусы герпеса и заболевания, вызываемые ими (табл. 4). К сожалению, в арсенале современных противовирусных средств нет препаратов, действующих на все вирусы герпеса одновременно (табл. 5).


Вирус простого герпеса типа 1 вызывает поражение кожи, рта, пищевода и головного мозга, вирус простого герпеса типа 2 — поражение наружных половых органов, прямой кишки, кожи и мозговых оболочек. Первым из допущенных к применению противогерпетических препаратов был видарабин (1977). Однако ввиду высокой токсичности его применяли для лечения заболеваний, вызванных вирусом простого герпеса и Varicella–zostervirus, лишь по жизненным показаниям. С 1982 г. для лечения больных с менее тяжелым течением заболевания стали применять ацикловир.
Ацикловир — ациклический аналог гуанозина, а валацикловир — L-валиновый эфир ацикловира. Ацикловир подавляет синтез вирусной ДНК после фосфорилирования вирусной тимидинкиназой внутри зараженных клеток. Образующийся в клетке ацикловиртрифосфат встраивается в синтезируемую в клетке-хозяине цепь ДНК, что приводит к прекращению роста вирусной цепи ДНК. Молекула ДНК, в состав которой входит ацикловир, связывается с ДНК-полимеразой, необратимо инактивируя ее.
Устойчивость вируса может возникнуть в результате снижения активности вирусной тимидинкиназы и изменения вирусной ДНК-полимеразы. Изменение активности ферментов возникает в результате мутаций.
Биодоступность ацикловира при приеме внутрь составляет всего 10–30% и уменьшается с увеличением дозы. В отличие от ацикловира, биодоступность валацикловира при приеме внутрь достигает 70%. Препарат быстро и почти полностью превращается в ацикловир. Ацикловир проникает во многие биологические жидкости, в том числе в содержимое везикул при ветряной оспе, спинно-мозговую жидкость, накапливается в молоке, околоплодных водах и плаценте. Концентрация его во влагалищном содержимом колеблется в широких пределах. Сывороточная концентрация препарата у матери и новорожденного примерно одинаковы. Через кожу препарат практически не всасывается. Т1/2 ацикловира составляет в среднем у взрослых 2,5 ч, у новорожденных — 4 ч, у больных с почечной недостаточностью может увеличиваться до 20 ч. Препарат практически полностью выводится почками в неизмененном виде. При беременности фармакокинетика препаратов не меняется.
Как правило, ацикловир переносится хорошо. При применении мази на основе полиэтиленгликоля возможно раздражение слизистой половых органов и чувство жжения. При приеме внутрь препарат изредка вызывает головную боль, головокружение, сыпь и диарею. Еще реже отмечаются почечная недостаточность и нейротоксическое действие. Побочные эффекты валацикловира сходны с таковыми у ацикловира — тошнота, диарея, головная боль; высокие дозы могут вызвать спутанность сознания, галлюцинации, поражения почек и — очень редко — тромбоцитопению. При внутривенном введении больших доз ацикловира могут развиться почечная недостаточность и поражения ЦНС.
Фамцикловир сам неактивный, но при первом прохождении через печень быстро превращается в пенцикловир. Пенцикловир — это ациклический аналог гуанозина. Механизм действия препарата сходен с механизмом действия ацикловира. Как и ацикловир, пенцикловир действует главным образом на вирусы простого герпеса и Varicella–zostervirus. Устойчивость к пенциклавиру в клинике встречается редко.
В отличие от пенцикловира, биодоступность которого при приме внутрь составляет лишь 5%, фамцикловир хорошо всасывается. При приеме фамцикловира биодоступность пенцикловира возрастает до 65–77%. Прием пищи совместно с препаратом замедляет всасывание последнего, но в целом биодоступность не снижается. Объем распределения пенцикловира в 2 раза превышает объем жидкости в организме, Т1/21/2 увеличивается до 9,9 ч. Препарат легко удаляется при гемодиализе.
Переносится ацикловир хорошо, но иногда возможно возникновение головной боли, тошноты, диареи, крапивницы, а у пожилых людей — галлюцинаций и спутанности сознания. Препараты для местного применения могут вызвать контактный дерматит и изъязвления.
Безопасность препарата во время беременности, а также взаимодействие его с другими лекарственными средствами не установлена.
Ганцикловир — это ациклический аналог гуанозина. Механизм действия препарата сходен с механизмом действия ацикловира. Активен в отношении всех герпесвирусов, но наиболее эффективен в отношении цитомегаловируса.
Биодоступность ганцикловира при приме внутрь во время еды составляет 6–9% и несколько меньше при приеме натощак. Валганцикловир хорошо всасывается и быстро гидролизуется до ганцикловира, биодоступность которого возрастает до 61%. При приеме валганцикловира во время еды биодоступность ганцикловира повышается еще на 25%. При нормальной функции почек Т1/2 составляет 2–4 ч. Более 90% препарата выводится почками в неизмененном виде. При почечной недостаточности Т1/2 увеличивается до 28–40 ч.
Основной дозалимитирующий побочный эффект ганцикловира — угнетение кроветворения (нейтропения, тромбоцитопения). У 5–15% больных отмечают поражения ЦНС разной степени тяжести (от головной боли до судорог и комы). При внутривенном введении возможны флебиты, азотемия, анемия, сыпи, лихорадка, изменение биохимических показателей печени, тошнота, рвота, эозинофилия.
У лабораторных животных препарат оказывал тератогенное и эмбриотоксическое действие, необратимо нарушал репродуктивную функцию. Цитостатические препараты усиливают побочное действие ганцикловира на костный мозг.
Идоксуридин — йодсодержащий аналог тимидина. Механизм противовирусного действия до конца не изучен. Известно, что фосфорилированные производные препарата встраиваются в вирусную и клеточную ДНК, но ингибируют репликацию только вирусной ДНК. При этом ДНК становится более хрупкой, легко разрушается, при ее транскрипции чаще возникают ошибки. Устойчивые штаммы выделяют от больных герпетическим кератитом, получавших идоксуридин. Препарат разрешен лишь для местного применения. При его использовании возможны боль, зуд, воспаление и отек в области глаз, аллергические реакции.
Успехи антимикробной терапии ХХ столетия привели к почти полному контролю над бактериальными инфекциями. Задачей инфекционистов и фармакологов ХХI века является обеспечение контроля над вирусной инфекцией. Помимо высокой эффективности новые противовирусные препараты должны обладать хорошей переносимостью. В настоящее время разрабатываются новые средства с принципиально новыми механизмами действия. Перспективными могут оказаться средства для подавления патологических иммунных реакций и иммунотерапия моноклональными антителами и вакцинами.
Н. М. Киселева, кандидат медицинских наук, доцент
Л. Г. Кузьменко, доктор медицинских наук, профессор
РГМУ, Москва
- 1806
- 1,5
- 0
- 5
Подавление экспрессии мутантного гена TTR, вызывающего семейную амилоидную полинейропатию: РНК-индуцируемый комплекс выключения гена (RISC) совместно с интерферирующей РНК (siRNA) бесстрашно летит навстречу злобной патогенной мРНК-мишени, предвкушая расправу.
иллюстрация авторов статьи

Спонсором приза зрительских симпатий выступил медико-генетический центр Genotek.
Семейная амилоидная полинейропатия (FAP), или наследственный транстиретиновый амилоидоз (hATTR), связана с различными точечными мутациями в гене, кодирующем транстиретин (TTR). В норме он вырабатывается гепатоцитами и осуществляет транспорт витамина А вместе с тиреоидными гормонами к периферическим тканям. Определенные мутации способствуют тому, что мономеры этого белка неправильно сворачиваются и образуют аморфные олигомеры, которые сливаются в фибриллы (рис. 1). По некоторым данным, именно небольшие олигомеры обладают наибольшей токсичностью в клетках [2].
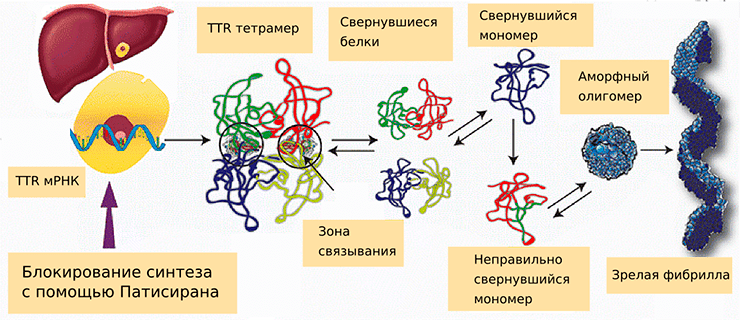
Рисунок 1. Синтез мутантного варианта транстиретина и влияние на этот процесс патисирана. Без лечения мРНК TTR транслируется в белок, который в норме состоит из четырех субъединиц. Мутантные мономеры белка сворачиваются неправильным образом и образуют аморфные олигомеры, кластеры нефиксированного размера, сливающиеся в фибриллы. Образование фибрилл может привести к развитию нейродегенеративных заболеваний и проблемам с сердечно-сосудистой системой.
На начальных стадиях заболевания фибриллы накапливаются в периферической нервной системе, вызывая прогрессирующую полинейропатию. Пациент чувствует мышечную слабость, онемение, боль, позднее происходит иммобилизация. На терминальных стадиях амилоиды препятствуют работе почек и сердца. Насчитывается более 120 амилоидогенных мутаций, определяющих различный характер проявлений наследственного транстиретинового амилоидоза (рис. 2). Заболевание проявляется в среднем возрасте, неумолимо прогрессирует и вызывает смерть через 5–10 лет [3]. К счастью, в мире им страдают лишь около 50 000 человек [4]. По данным Комитета по лекарственным средствам для орфанных заболеваний (COMP), в Европейском союзе частота встречаемости транстиретинового амилоидоза составляет 0,2 на 10 000 человек.

Рисунок 2. Связь генотипа с клиническими проявлениями при транстиретиновом амилоидозе (hATTR). До появления патисирана спасением для таких пациентов являлась трансплантация печени. В Европе также используют препарат тафамидис, который стабилизирует транстиретин. Он связывается с тетрамером и не дает ему диссоциировать на мономеры. Однако в США он так и не смог получить одобрение [5].
А вот один из молекулярных механизмов эукариот уже подарил нам первое лекарство и надежду на лечение огромного спектра заболеваний. Попробуем разобраться в тернистом двадцатилетнем пути с момента открытия РНК-интерференции до первого официально одобренного FDA (Food and Drug Administration, Управление США по контролю за лекарствами и пищевыми продуктами) препарата.
Воздействовать на белок мы можем принципиально тремя способами. Можно придумать молекулу, которая будет связываться с уже синтезированным белком, препятствуя его работе, или, напротив, побуждая его к действию. Так работает большинство лекарств, например, известный анальгетик и жаропонижающее средство ибупрофен ингибирует фермент циклооксигеназу (ЦОГ), уменьшая выработку простагландинов — веществ, ответственных за воспаление [20].
Но ученые мечтают о новых возможностях: о выключении таргетного гена, вызывающего генетическое заболевание, на уровне ДНК (нокаут) и о выключении без затрагивания самой последовательности ДНК на уровне РНК (нокдаун).
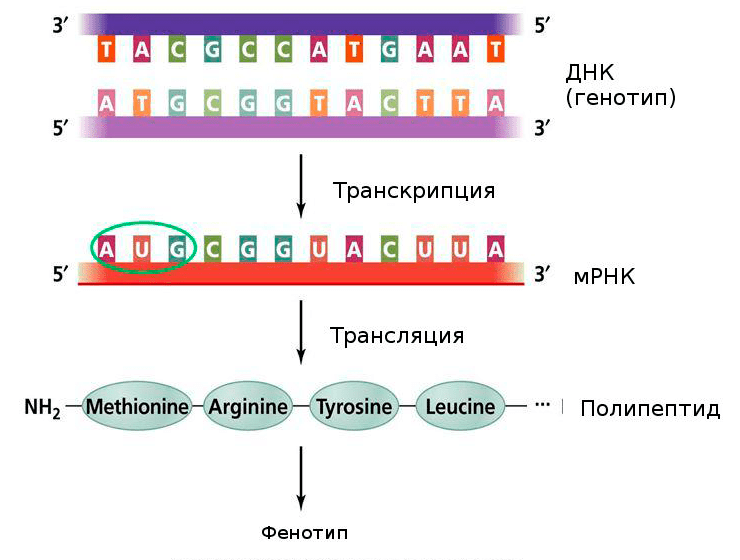
Рисунок 3. Центральная догма молекулярной биологии. Генетическая информация, закодированная в ДНК, переходит в мРНК, и уже с нее синтезируется полипептидная последовательность. Нуклеотиды одной цепочки нуклеиновой кислоты могут быть соединены с нуклеотидами другой по правилу комплементарности. В процессе транскрипции синтезируется смысловая цепь мРНК, и, зная ее последовательность, мы можем синтезировать комплементарную ей цепочку, или антисмысловую цепь.
Pearson Education, Inc., publishing as Benjamin Cummings
Процесс начинается с того, что поступившая в клетку экзогенная двухцепочечная РНК связывается с рибонуклеазой Dicer (да-да, как та самая овощерезка), которая нарезает ее на небольшие фрагменты длиной 20–25 пар нуклеотидов, с двумя неспаренными основаниями на каждом конце. Такая длина, видимо, оказалась оптимальной для специфического связывания с мишенью. Эти фрагменты взаимодействуют с белковым комплексом RISC, который отщепляет одну из цепей РНК, оставляя вторую на съедение нуклеазам (ферментам, расщепляющим нуклеиновые кислоты), и путешествует с ней по клетке в поисках таргетной мРНК. Обнаружив ее, белок Аргонавт из комплекса RISC разрезает свою мишень (рис. 1 и 4).
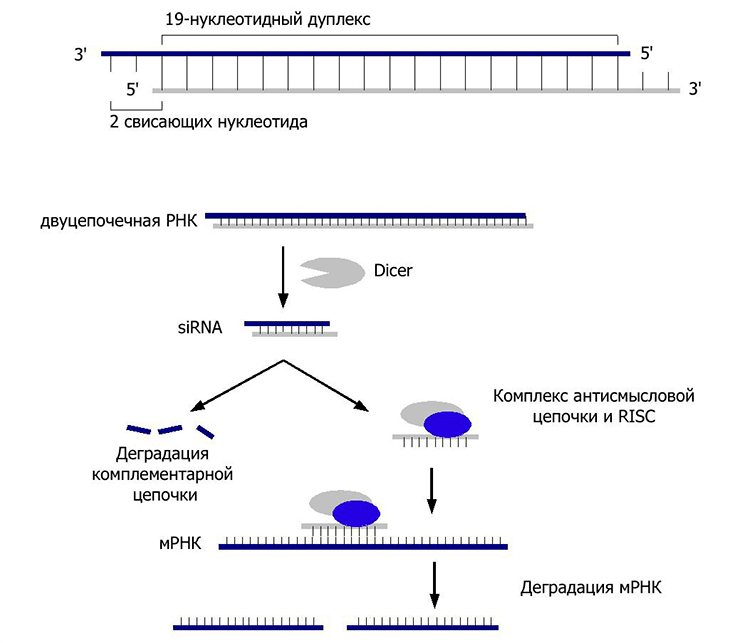
Рисунок 4. РНК-интерференция. Сверху представлена схема строения малой интерферирующей РНК (siRNA). Экзогенная двухцепочечная РНК разрезается ферментом Dicer и встраивается, расплетаясь, в белковый комплекс RISC. Готовый к работе, совместно с siRNA, он путешествует по клетке. При встрече с комплементарной мРНК комплекс индуцирует ее деградацию. Таким образом, клетка уничтожает потенциально вирусную РНК, препятствуя синтезу вирусных белков, а также борется с транспозонами.
Этот механизм выполняет защитную функцию против вирусов, которые стремятся заполучить контроль над клеткой, предоставляя ее белковой машинерии инструкции по производству вирусных агентов. Также интерферирующие РНК могут быть полезны клетке в борьбе с мобильными генетическими элементами, которые активируются при делении клетки и нарушают нормальную работу ее генетического аппарата.
Также стоит отметить, что РНК-интерференция является не единственным механизмом регуляции экспрессии генов. Для трансляции необходимо, чтобы мРНК была одноцепочечной, поэтому при попадании одноцепочечной антисмысловой РНК в клетку блокируется процесс синтеза белка, а также активируется РНКаза H, разрушающая транскрипт.
В каких случаях мы можем использовать этот изящный механизм?
Проблема с применением большинства таких методов для лечения человека заключается в низкой селективности редактирования, что может вносить дополнительные мутации в геном. Клетки могут перерождаться в раковые, уходить в апоптоз. Данные побочные действия затрудняют применение описанных подходов для лечения генетических заболеваний человека.
Всего этого можно избежать, выключая гены с помощью РНК-интерференции. Очень перспективна разработка антивирусных лекарств, препятствующих связыванию вирусных белков с таргетной клеткой, а также противоопухолевых препаратов.
Так что же останавливало ученых в реализации этой простой идеи?
Все, кто работал в лаборатории с РНК, знают ее коварство: она быстро деградирует под действием РНКаз, находящихся на поверхности кожи, в слюне, и в большом количестве в кровяном русле. Получается, что препарат просто не успевает добраться до нужных клеток, гены которых необходимо выключить с помощью RNAi.
После долгих и дорогостоящих попыток фармкомпании практически потеряли надежду на терапевтическое применение этого механизма. Однако решение было найдено [13]. Сегодня у одной только компании Alnylam известно семь препаратов на основе РНК-интерференции, находящихся на разных стадиях клинических испытаний (табл. 1).
| Лекарство | Заболевание | Стадия клинических испытаний |
|---|---|---|
| Patisiran | Наследственный АТТР амилоидоз | Одобрен |
| Givosiran | Острые печеночные порфирии | Поздняя стадия (фаза 2–3) |
| Fitusiran | Гемофилия и редкие кровотечения | Поздняя стадия (фаза 2–3) |
| Inclisiran | Гиперхолестеринемия | Поздняя стадия (фаза 2–3) |
| ALNTTRsc02 | АТТR амилоидоз | Ранняя стадия (фаза 1–2) |
| Lumasiran | Первичная гипероксалурия типа 1 | Ранняя стадия (фаза 1–2) |
| Cemdisiran | Болезни, связанные с системой комплемента | Ранняя стадия (фаза 1–2) |
| * Интересно, что некоторые препараты несут в себе название siRNA, например, Givosiran, Inclisiran; а некоторые препараты, являющиеся антисмысловыми цепочками РНК — Alicaforsen, Inotersen. | ||
Патисиран — первый олигонуклеотидный препарат на основе РНК-интерференции
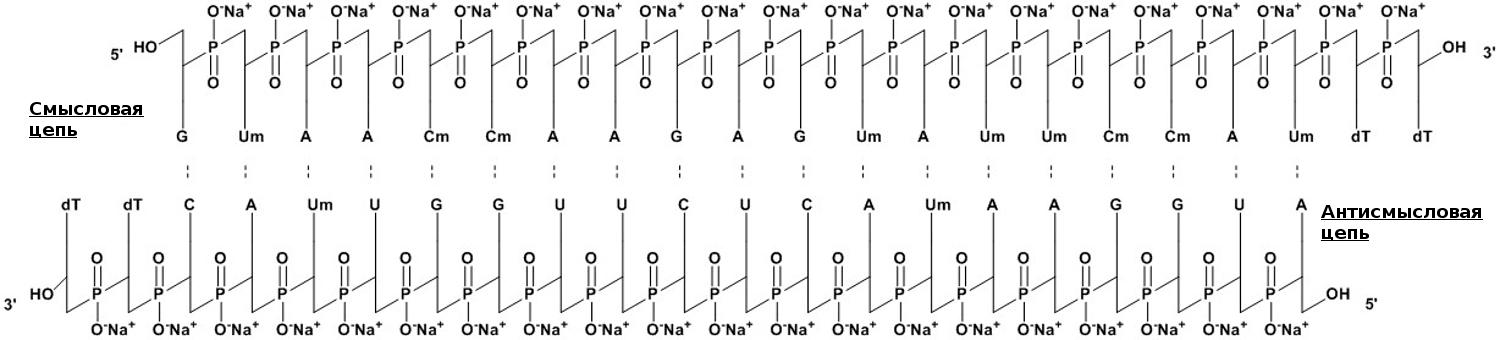
Рисунок 5. Нуклеотидная составляющая патисирана представляет собой короткую 21-буквенную двуцепочечную РНК из смысловой и антисмысловой цепей, которая комплементарна таргетному гену транстиретина (TTR). Для бóльшей устойчивости, некоторые из нуклеотидов О-метилированы (Um, Cm), а на 3′ концах пришиты два тимидина (dT). Молекулярная формула лекарства — C412H480N148Na40O290P40. Молекулярный вес составляет 14 304 Да.
Впервые система доставки малых двухцепочных РНК была предложена в 2010 году и после развивалась вплоть до первого успешного клинического испытания в 2016, которое показало возможность применения РНК-интерференции для лечения генетических заболеваний человека [13].
Липидные наночастицы, защищающие РНК, состоят из внешнего слоя, образованного липидами с полиэтиленгликолем и холестерином, и внутренней полости, заполненной буфером, в которой находятся окруженные катионными частицами интерферирующие агенты (рис. 6).
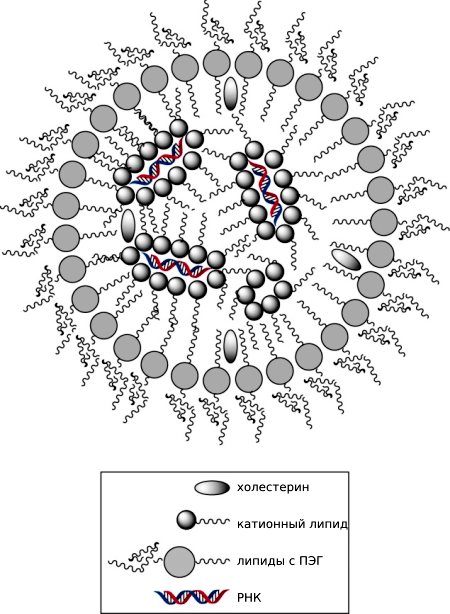
Рисунок 6. Строение липидных наночастиц. Для создания липидных наночастиц эмпирически был разработан специальный протокол, сочетающий различные буферы и типы липидов: смешиваются ионизированные катионные липиды с siRNA в буфере с низкой ионной силой, за счет чего РНК сближаются с липидами и собираются в наночастицы (разноименные заряды катионных липидов и РНК притягиваются). Далее собранные структуры покрываются вспомогательными липидами, холестерином и липидами с полиэтиленгликолем (ПЭГ).
Таким образом, препарат таргетно доставляется в гепатоциты — клетки, продуцирующие амилоидный транстиретин.
Клинические испытания
Для патисирана все клинические испытания прошли успешно. В последней, третьей фазе участвовало 225 пациентов с наследственным транстиретиновым амилоидозом (hATTR), из которых 77 получали плацебо. Ключевым показателем оценки состояния пациентов являлась модифицированная шкала ухудшения нейропатии (mNIS+7). Также использовали тест на ходьбу на расстояние 10 м, оценку индекса массы тела и опрос о качестве жизни. Наблюдение продолжалось в течение 18 месяцев. mNIS+7 ранжируется от 0 до 304 баллов: чем больше, тем хуже состояние пациента (рис. 7). По всем показателям выявили значимое улучшение состояния пациентов по сравнению с группой, принимавшей плацебо [16].
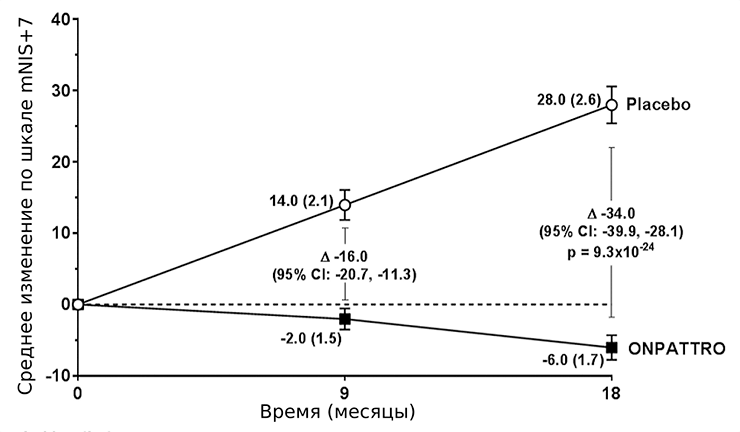
Рисунок 7. Динамика изменений средних значений модифицированной шкалы ухудшения нейропатии (mNIS+7). Разница между группами составляет 34,0 пунктов при p
Во время клинических испытаний возникли побочные эффекты: у 10% пациентов, принимавших лекарство, и 3%, принимавших плацебо, выявили инфекции верхних дыхательных путей. У всех пациентов наблюдали падение концентрации витамина А в крови (вспомним функции транстиретина).
FDA одобрило лекарство для всех стадий заболевания 10 августа 2018 года — так, патисиран стал не только первым одобренным препаратом для лечения наследственного транстиретинового амилоидоза, но и первым одобренным средством, в механизме работы которого лежит РНК-интерференция [17].
Комитет по лекарственным средствам для человека (CHMP), входящий в Европейское агентство лекарственных средств (EMA), рекомендовал предоставить разрешение на применение патисирана для лечения наследственного транстиретин-опосредованного амилоидоза у взрослых пациентов с полинейропатией 1 или 2 стадий. Значимого улучшения состояния пациентов с 3 стадией заболевания, по результатам клинических тестов и судя по комментариям представителя компании, достичь не удалось.
Лекарство будет доступно в виде раствора для внутривенного введения с концентрацией активного компонента 2 мг/мл. Примечательна периодичность инъекций: один раз в три недели.
На данный момент стоимость годового курса составляет $450 000, в ближайшее время предполагается снижение стоимости до $350 000. Назначение патисирана, к сожалению, не покрывается всеми страховыми планами.
Компания Alnylam предоставляет несколько типов финансовых тарифов для пациентов разных категорий. Рассмотрим два из них:
- У пациента есть коммерческая страховка.Компания предоставляет программу быстрого старта, обеспечивающую до трех доз лекарства в ожидании подтверждения страхового покрытия без каких-либо затрат. После подтверждения лечение полностью оплачивается страховой фирмой.
- У пациента нет страховки или его заболевание не подпадает под страховой случай.Компания может предоставить лекарство бесплатно, если у пациента есть Medicare, Medicaid (национальные системы страхования в США) или любое другое спонсируемое правительством страхование. Также покрытие полной стоимости или ее части возможно за счет нескольких частных фондов и благотворительных организаций. В данном случае пациенту приходится ждать соблюдения всех формальностей, он не получает лечение сразу.
Нам удалось узнать подробнее о планах компании Alnylam на расширение рынка препарата. На данный момент патисиран доступен на территории США, о продаже на территории России речи пока не идет. Авторы надеются, что с течением времени терапия станет ближе для бóльшего числа больных.
Кто нас ждет теперь?
Как мы смогли убедиться, создание RNAi-препаратов сопряжено с огромными трудностями, связанными с доставкой хрупких РНК к клеткам. Сегодня остается еще много вопросов касательно дизайна и применения липидных наночастиц.
Читайте также:


