Индекс контагиозности вирусного гепатита с
В настоящее время проблемой хронической HCV-инфекции интересуются как врачи-специалисты, так и люди, никак не связанные с медициной. От гепатита С во всем мире страдают по меньшей мере 200 млн человек.
В настоящее время проблемой хронической HCV-инфекции интересуются как врачи-специалисты, так и люди, никак не связанные с медициной.
От гепатита С во всем мире страдают по меньшей мере 200 млн человек. Последствиями перенесенного заболевания могут быть хронический гепатит, цирроз и первичный рак печени.
Распространенность хронической HCV-инфекции на земном шаре варьирует от 0,5 до 2%. Существуют регионы, для которых характерна более высокая распространенность этого заболевания: 6% в Заире и Саудовской Аравии, 16% в изолированных поселениях в Японии. В России наблюдается рост заболеваемости гепатитом С (3,2 на 100 тыс. населения в 1994 году и 19,3 в 1999 году). Источниками заражения вирусным гепатитом C служат больные острыми и хроническими формами HCV-инфекции, причем в основном это люди, у которых отсутствует желтуха и наблюдается бессимптомное или малосимптомное течение заболевания.
В настоящее время HCV чаще всего инфицируются молодые люди, преимущественно мужчины в возрасте около 20 лет, примерно 40% из них заражаются при внутривенном введении наркотиков. Основным путем инфицирования HCV является парентеральный. Так, у 6,1% больных, которым производилось переливание крови и ее компонентов во время кардиохирургических операций, развивался острый вирусный гепатит C, у 60% из них гепатит принимал хроническую форму.
Существует и риск заражения гепатитом C половым путем, однако он невелик (5-8%). Возможна передача HCV от матерей с острой или хронической формой инфекции; это также редкое явление, встречается не чаще чем в 5-6% случаев. Риск заражения вышеуказанными путями уступает таковому при гепатите В.
Приблизительно у половины больных путь инфицирования HCV установить не удается.
Вирус гепатита С относится к семейству флавивирусов. Геном вируса представлен однонитевой РНК протяженностью около 10 000 нуклеотидов. Вирус гепатита С вызывает заболевание только у человека. В экспериментальных условиях воспроизвести инфекцию можно у высших обезьян.
Определение генотипов вируса гепатита С имеет большое значение для практической медицины. Хотя до сих пор не установлено четкой корреляции между генотипами и уровнем виремии, характеристиками пациента, тяжестью течения заболевания, большинство исследователей соглашаются с выводами о значении генотипов вируса как важного фактора, влияющего на эффективность противовирусной терапии.
Вакцину против гепатита С создать пока не удалось из-за высокой изменчивости вируса гепатита С (ВГС).
Считают, что вирус оказывает прямое цитопатическое действие и вызывает иммуноопосредованное повреждение гепатоцитов. Высокая степень хронизации вирусного гепатита С обусловлена некоторыми особенностями действия вируса:
- возможностью внепеченочной репликации вируса, включая иммунокомпетентные клетки (клетки, предшественники гемопоэза, лимфоциты и моноциты периферической крови, миофибробласты);
- гетерогенностью генотипов и частыми мутациями генома вируса;
- индукцией каскада иммунопатологических реакций;
- активизацией процессов перекисного окисления липидов в печени.
В течении хронической HCV-инфекции может происходить нейтрализация мажорного варианта вируса, но тогда генерируются минорные варианты. Квазивиды HCV представляют собой движущуюся мишень, которую ограничивает иммунная система хозяина. Появление нового мажорного квазивида сопровождается повышением виремии и увеличением титра Ig M антител к вирусным белкам. Постепенно и этот новый мажорный вариант заменяется. Такой процесс приводит к периодической волнообразной виремии, сопровождающейся обострением хронического гепатита С (ХГС) и повышением уровня антител.
Возможно, антивирусному Т-клеточному ответу отведена центральная роль в элиминации ВГC, так как нейтрализующие антитела, по-видимому, очень часто оказываются неэффективными. Т-хелперные (Th) лимфоциты распознают вирусные антигенные пептиды, представленные HLA-комплексом II класса на поверхностной мембране антиген-презентирующих клеток. В зависимости от типа цитокинового профиля Th-клетки делятся на две группы: Th1 и Th2. Первые продуцируют IFNg и IL2, стимулируя Т-клеточный ответ и цитотоксическую Т-лимфоцитную активность, а вторые продуцируют IL4 и IL10, стимулируя В-клеточный ответ. Таким образом, Тh-лимфоциты играют существенную роль в регуляции иммунного ответа. У пациентов, у которых болезнь перешла в хроническую стадию, в острой фазе вирус-специфический Th ответ был ниже и преобладали цитокины типа Th2.
У хронически ВГC-инфицированных пациентов значительно увеличено содержание вирусоспецифических Th2-клеток и их цитокинов. Нарушение баланса Th1/Th2 цитокиновой продукции может играть важную роль в иммунопатогенезе хронической ВГC-инфекции. Показано снижение уровня IFNg и IL12 при ХГС. Этот дефицит является следствием повышенного уровня IL10, предполагаемого отрицательного регулятора для IFNg. Повышенное содержание Th2-клеток при ХГС может снижаться при комбинированной терапии рибавирином и IFNa. Обнаружено, что у пациентов с клинико-биохимическим улучшением после лечения IFNa произошло увеличение уровня Th1-цитокинов.
Цитотоксические лимфоциты (CTL) играют, по-видимому, некоторую роль в ограничении репликации ВГС. Этот ответ недостаточен для полной элиминации вируса при хронической инфекции и, кроме того, может вызывать повреждение печени. Известно, что CTL способны быстро опознавать и направленно лизировать клетки, несущие ВГC-антигены, не провоцируя значительного воспаления, с помощью перфоринового, FasL- и TNFα-базируемых механизмов.
ТNF, как предполагается, индуцируют апоптоз клеток, опосредуя высвобождение свободных радикалов из митохондриальных электронно-транспортных путей и модуляцию синтеза некоторых белков. Взаимодействие нуклеокапсидного белка ВГC с внутрицитоплазматической частью рецептора TNFb, вероятно, представляет собой эволюционно-отобранный механизм, с помощью которого вирус препятствует преждевременному апоптозу клетки-хозяина. В отсутствие доступных модельных клеточных культур прямая цитопатичность вируса гепатита С не может быть исследована в полном объеме.
В подавляющем большинстве случаев острого гепатита С иммунной системе не удается элиминировать вирус. До сих пор нет ясного представления о том, почему это происходит. Очевидно, ВГС обладает эволюционно-закрепленными способностями, обеспечивающими ему персистенцию.
Однако иммунная система может оказывать существенное влияние на ВГC-инфекцию. В 15% случаев острого гепатита С она эффективно уничтожает вирус, а у хронически ВГC-инфицированных обеспечивает умеренное ограничение инфекции в течение почти 20 лет. Возможно, ослабление какого-либо звена антивирусных иммунных механизмов позволяет вирусу активно воздействовать на иммунную систему. Длительная ВГC-персистенция может привести к развитию В-клеточных лимфопролиферативных нарушений, таких, как смешанная криоглобулинемия, злокачественная не-Ходжкинская лимфома и появление органоспецифических и неспецифических аутоантител. Таким образом, хроническую ВГC-инфекцию следует рассматривать как мультисистемное заболевание.
Лабораторная диагностика гепатита С основана на выявлении специфических маркеров инфицирования ВГС (анти-ВГС-IgM/G, РНК ВГС) и должна проводиться разрешенными МЗ РФ к применению диагностическими препаратами отечественного или зарубежного производства в лабораториях, имеющих лицензию на проведение данного вида лабораторных исследований.
HCV RNA — самый ранний маркер репликации вируса, определяемый с помощью полимеразной цепной реакции (ПЦР) спустя несколько недель после заражения. Для выявления анти-ВГС применяют иммуноферментный анализ (ИФА). В настоящее время используют тест-системы третьего поколения ELISA-3. Подтверждающим методом является рекомбинантный иммуноблотинг (RIBA). У 60% больных анти-ВГС определяются в острой фазе, у 35% они появляются спустя 3-6 месяцев после инфицирования, у 5% инфицированных лиц анти-ВГС не определяются.
Болезнь может протекать бессимптомно. Наиболее распространенным симптомом является слабость. Целенаправленный опрос больных часто помогает выявить такие факторы риска, как переливание крови, внутривенное введение наркотиков, хронический гемодиализ и др. Кроме слабости больной может жаловаться на быструю утомляемость, тяжесть в правом подреберье, боли в правом верхнем квадранте живота, диспепсические явления.
Критериями постановки диагноза являются увеличение печени и селезенки, гиперферментемия и анти-ВГС в крови в течение не менее 6 месяцев.
Гепатоспленомегалия выявляется не более чем у 50% обратившихся за помощью больных, активность сывороточных трансаминаз редко превышает верхнюю границу нормы в 6 раз. Следует обратить внимание на то, что активность сывороточных трасаминаз не отражает степени изменений в печени: она может быть нормальной, несмотря на значительные морфологические изменения. Концентрация РНК ВГС в сыворотке имеет существенное значение для определения контагиозности и для мониторинга результатов лечения. При наличии в крови HCV-РНК биопсия печени, как правило, выявляет ряд изменений. Концентрация HCV-РНК в сыворотке, превышающая 105 молекулярных эквивалентов (копий) в 1 мл, наблюдается в активной фазе заболевания и совпадает с пиками активности трансаминаз.
Наличие или отсутствие РНК ВГС, как правило, не является диагностическим критерием хронического гепатита С и определяет фазу процесса (активный, неактивный).
Для раннего выявления ГЦК у больных циррозом печени, особенно у мужчин старше 40 лет, каждые 6 месяцев определяют уровень сывороточного α-фетопротеина и выполняют УЗИ печени.
Инфицирование ВГС приводит к развитию острого гепатита С, протекающего в манифестной (желтушной) или чаще в латентной (безжелтушной) формах, которые развиваются в соотношении 1:6. Около 17-25% больных острым гепатитом С выздоравливают спонтанно, у остальных 75-83% развивается хронический гепатит С. Большинство больных с биохимическими и иммунологическими признаками хронического гепатита имеют слабовыраженную или умеренную степень воспалительно-некротического поражения печени и минимально выраженный фиброз. Примерно у 26-35% больных хроническим гепатитом С в течение 10-40 лет развивается фиброз печени и может наступить смерть от цирроза печени и его осложнений. У 30-40% больных с циррозом печени высок риск заболевания раком печени.
Считается, что не более чем у 30% больных ВГС с минимальной морфологической активностью через 20 лет возможно развитие цирроза печени. Таким образом, больные, у которых при гистологическом исследовании биоптата печени выявляется наличие минимального воспаления и минимального фиброза, нуждаются в динамическом наблюдении.
Если персистенция РНК ВГС сохраняется более 6 месяцев, то спонтанное разрешение хронической HCV-инфекции маловероятно.
У большинства больных с хроническим гепатитом С заболевание протекает бессимптомно. Если жалобы существуют, то это чаще всего слабость, тупые боли в правом подреберье, тошнота, снижение аппетита, кожный зуд, артралгии и миалгии. Физикальный осмотр пациента помогает установить диагноз зачастую только на стадии цирроза печени.
Ассоциация хронического гепатита С с различными внепеченочными проявлениями — хорошо известный врачам факт. Наиболее вероятным для большинства заболеваний и синдромов, наблюдаемых при HCV-инфекции, представляется иммунный патогенез, хотя конкретные механизмы во многом еще не выяснены. Доказанные и предполагаемые иммунные механизмы включают:
- моно- или поликлональную пролиферацию лимфоцитов;
- образование аутоантител;
- отложение иммунных комплексов;
- секрецию цитокинов.
Частота иммуноопосредованных заболеваний и синдромов у больных хроническим гепатитом С достигает 23%. Наиболее характерны аутоиммунные проявления для больных с гаплотипом HLA DR4, который ассоциируется с внепеченочными проявлениями при аутоиммунном гепатите. Этот факт подтверждает гипотезу о триггерной роли вируса в инициации аутоиммунных процессов у генетически предрасположенного индивидуума.
Ассоциированные с продукцией или отложением иммуноглобулинов:
- Криоглобулинемия
- Лейкоцитокластерный васкулит
- Мембранозно-пролиферативный гломерулонефрит
- В-клеточная лимфома
- Плазмоцитома
- MALTома
- Тиреоидит
- Синдром Шегрена
- Гемолитическая анемия
- Тромбоцитопения
- Красный плоский лишай
Ассоциированные с неизвестным механизмом:
- Поздняя кожная порфирия
Выявление сывороточных аутоантител отражает наиболее частый феномен аутоиммунизации при HCV-инфекции, который диагностируют у 40-65% больных. Спектр аутоантител достаточно широк и включает ANA (до 28%), SMA (до 11%), анти-LKM-1 (до 7%), антифосфолипидные (до 25%), антитиреоидные (до 12,5%), ревматоидный фактор, анти-ASGP-R и др. Чаще всего титры этих антител не достигают диагностических значений, показательных для той или иной аутоиммунной патологии.
Анти-GOR являются антителами, специфичными для HCV-инфекции, и их выявляют не менее чем у 80% больных. Эпитоп, распознаваемый анти-GOR, локализуется на пока неидентифицированном ядерном белке, гиперэкспрессию которого наблюдают при гепатоцеллюлярной карциноме. Выработка анти-GOR ассоциирована только с HCV-инфекцией, но не с АИГ.
Аутоиммунные расстройства наблюдаются в среднем у 23% больных хроническим гепатитом С. Наиболее часто встречаются патология щитовидной железы.
Гистологическая картина не является патогномоничной, при этом достаточно часто выявляются характерные изменения. Отличительная особенность ее — лимфоидные агрегаты или фолликулы в портальных трактах, которые могут быть как изолированными, так и частью воспалительных изменений портальных трактов. По клеточному составу эти агрегаты напоминают первичные лимфоидные фолликулы в лимфатических узлах. Жировая дистрофия обнаруживается в 75% случаев. Кроме того, выявляются следующие характерные изменения: негнойный холангит с лимфоидной и плазмоклеточной инфильтрацией стенок протоков; лимфогистиоцитарная инфильтрация перипортальной зоны; слабовыраженные ступенчатые некрозы; мостовидные некрозы (обнаруживаются редко), пролиферация и активация сателлитных клеток печени, пролиферация эпителия желчных канальцев.
Отмечено, что индекс гистологической активности (ИГА) и индекс фиброза (ИФ) у больных хроническим гепатитом С с наличием жировой дистрофии достоверно выше, чем у пациентов без сопутствующей жировой дистрофии. У 93% больных с жировой дистрофией в гепатоцитах обнаруживался Core-протеин ВГС, при отсутствии жировой дистрофии — лишь у 39%. Этим фактом подчеркивается роль Core-протеина в развитии жировой дистрофии гепатоцитов.
Биопсия печени играет существенную роль в уточнении диагноза и оценке активности и стадии заболевания.
РНК ВГС можно определить в ткани печени методом ПЦР.
Основная цель лечения — предотвратить прогрессирование заболевания.
Режим отдыха, диета и прием витаминов не оказывают лечебного действия.
Отбор пациентов для лечения. Показанием к назначению терапии интерфероном служит умеренное (но не минимальное) либо тяжелое воспаление и/или фиброз. Решение о лечении пациентов с циррозом печени принимают индивидуально в каждом конкретном случае. Больные, у которых гистологическая активность минимальна, должны находиться под динамическим наблюдением, так как они имеют хороший жизненный прогноз без лечения и очень низкий риск развития цирроза печени через 10-20 лет.
Факторы, связанные с благоприятным эффектом противовирусной терапии при хронической HCV-инфекции:
- Возраст моложе 45 лет
- Женский пол
- Отсутствие ожирения
- Срок инфицирования менее 5 лет
- Отсутствие коинфекции HBV
- Отсутствие иммунодепрессии
- Отсутствие алкоголизма
- Умеренное повышение АЛТ
- Отсутствие цирроза
- Низкое содержание железа в печени
- Низкий уровень HCV RNA в сыворотке
- Генотип 2 или 3
- Однородность популяции вируса
Больным с нормальным уровнем АЛТ и положительным тестом на HCV RNA без результатов гистологического исследования противовирусное лечение проводить не рекомендуется.
Основной препарат, эффективность которого в лечении гепатита С доказана, — это интерферон альфа (ИФα).
В настоящее время принята оптимальная схема монотерапии ИФ: разовая доза составляет 3 млн МЕ, ее вводят подкожно или внутримышечно 3 раза в неделю в течение 3 месяцев. Через 3 месяца необходимо исследовать РНК ВГС. Если результаты ПЦР положительные схему лечения меняют. Если же РНК не выявляется, лечение продолжают до 12 месяцев. Стойкий положительный ответ в этом случае регистрируется у 15-20% больных.
Оптимальная схема лечения хронического гепатита С в настоящее время — это комбинация ИФa и рибавирина.
- в течение 6 месяцев - при генотипах 2 и 3;
- в течение 6 месяцев - при генотипе 1 и низком уровне виремии;
- в течение 12 месяцев - при генотипе 1 и высоком уровне виремии.
Стойкий положительный ответ при комбинированном лечении ИФa с рибавирином наблюдается в 40-60% случаев.
Суточная масса рибавирина составляет 1000-1200 мг в зависимости от массы тела.
В последние годы для повышения эффективности интерферона применяют пегилирование, которое заключается в присоединении к молекуле интерферона полиэтиленгликоля. В итоге образуется ПЭГ-интерферон, имеющий более длительный период полураспада. Предварительные данные свидетельствуют о большей эффективности такого лечения по сравнению с терапией интерфероном альфа.
Имеются данные, свидетельствующие о положительном действии таких препаратов, как ремантадин, урсодеоксихолевая кислота, пегилированные интерфероны, препараты глициризиновой кислоты, однако эта информация нуждается в дальнейшей проверке.
По вопросам литературы обращаться в редакцию
Исходя из характеристики эпидемического очага в зонах ЧС, санитарные потери среди населения в очаге инфекционных заболеваний будут зависеть от своевременности и полноты проведения комплекса санитарно-противоэпидемических мероприятий.
Под санитарными потерями в эпидемическом очаге понима-. и и число заболевших людей вследствие распространения инфекции на этапе развития эпидемического процесса. В зонах стихийных 111'четвий и катастроф величина санитарных потерь среди населения и очаге инфекционных заболеваний будет зависеть от механизма передачи инфекции.
При оперативных расчетах санитарные потери населения в рнионах стихийных бедствий и катастроф можно определить по следующей формуле:
Сп = К хИ х(1 - Н) х(1 - Р) хЕ, где
Сп- санитарные потери населения, чел.; К - численность заражен-ного и контактировавшего населения, чел.; И - контагиозный индекс, Н - коэффициент неспецифической защиты; Р – коэффициент специфической защиты (коэффициент иммунности); Е-коэффициент экстренной профилактики (антибиотикопрофилактики).
Величина "К" определяется в зависимости от установления инфекционной нозоформы эпидемического очага. Принимается, что при иысококонтагиозных инфекциях 50% населения, оказавшегося в инк- катастрофы, подвергается заражению. При контагиозных и ма-'мжшггагиозных инфекциях заражение людей может составить 10 -п"„ от общей численности населения. При неконтагиозных инфекционных болезнях этот показатель будет зависеть от числа постра-шишего населения и может составить примерно 15 %.
На величину возможных санитарных потерь при контагиозных инфекциях в очаге влияет в первую очередь восприимчивость населения к микроорганизмам и контагиозный индекс инфекции.
Контагиозный индекс "И" - это численное выражение возможности заболевания при первичном инфицировании каким-либо определенным возбудителем. Этот индекс показывает степень вероятности заболевания человека после инфицирования (контакта с больным). Контагиозный индекс инфекций составляет для бубонной чумы, дифтерии, менингококковой инфекции, бруцеллеза - 0,2; для сибирской язвы, брюшного тифа, вирусного гепатита "А" - 0,4; для туляремии, Ку-лихорадки, клещевого энцефалита, сыпного тифа – 0,5; для сапа, мелиоидоза, пситтакоза, холеры - 0,6; для геморрагических лихорадок - 0,7; для кори - 0,75; для легочной чумы и легочной формы сибирской язвы - 0,8. Контагиозный индекс при других контактных инфекциях приблизительно составит 0,5 - 0,6.
Коэффициент неспецифической защиты "Н" зависит от своевременности проведения санитарно-противоэпидемических мероприятий, защищенности питьевой воды и продуктов питания от заражения возбудителями, разобщения населения на мелкие группы при воздушно-капельных инфекциях, наличия индивидуальных средств защиты от насекомых и др. Он может составить при отличной санитарно-противоэпидемической подготовке населения - 0,9, при хорошей - 0,7, удовлетворительной - 0,5, при неудовлетворительной - 0,2. Если население попало в зону катастрофы биологически опасного объекта, то в любом случае коэффициент "Н" будет равен 0,1.
Коэффициент специфической защиты "Р" учитывает эффективность различных вакцин, рекомендуемых в настоящее время для специфической профилактики инфекционных заболеваний. Если население иммунизировано против данной инфекции, то коэффициент иммунности составит: при дифтерии, кори 0,65; при Ку-лихорадке, туляремии, сыпном тифе, вирусном гепатите "А", ме-нингококковой инфекции, скарлатине - 0,55; при легочной чуме, холере, сибирской язве, брюшном тифе - 0,5; при бруцеллезе, геморрагических лихорадках - 0,75; при сапе, мелиоидозе, пситтакозе, клещевом энцефалите, бубонной чуме - 0,8. Если же тип эпидемической вспышки не установлен и не проводилась иммунизация населения, то коэффициент иммунности с некоторым приближением можно считать равным 0,5.
Коэффициент экстренной профилактики "Е" соответствует защите антибиотиками от данного возбудителя болезни. Значение этого коэффициента при холере - 0,2; при бубонной чуме, геморрагических лихорадках - 0,3; при брюшном тифе, вирусном гепатите "А" - 0,4; легочной чуме, туляремии, Ку-лихорадке, менингококко-вой инфекции, дифтерии, сибирской язве - 0,5; при сыпном тифе, клещевом энцефалите - 0,6; при бруцеллезе, мелиоидозе, скарлатине - 0,75; при пситтакозе, сапе - 0,9. Если же экстренная профилактика не проводилась, коэффициент равен 1,0.
Например, по указанной формуле можно провести расчет санитарных потерь при чуме легочной формы в населенном пункте (районе города) с численностью населения 18 тыс. человек. Предположим, 10 чел. больных легочной формой чумы находились не изолированными в коллективах более суток, имея близкий контакт, в результате чего было подвергнуто риску заражения 50% от всего населения, что составит 9000 человек. Индекс контагиозности со-
ставил 0,8 (И=0,8) Учитывая, что население предварительно не вакцинировалось против чумы (Р=0,5), ему не проводилась антибиоти-копрофилактика (Е=1,0), а также при Н=0,1 санитарные потери составят:
Другой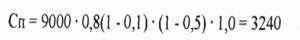
пример расчета: биологический террористический акт совершен в замкнутом пространстве (зал кинотеатра, вокзала, аэропорта) с численностью людей 500 человек - через вентиляционные устройства было произведено распыление спор сибирской язвы, предполагаемые санитарные потери составят при К равном 50%, так как в данном случае используется нетрадиционный для сибирской язвы путь передачи возбудителя - аэрозольный, Н = 0,1 (как при биологической катастрофе), Р = 0,5 (вакцинация не проводилась), Е = 1, (не проводилась антибиотикопрофилактика), И = 0,6 (аэрозольный путь передачи) –
Сп = 250·0,6·0,9·0,5·1,0=68 чел.
На основании полученных данных и выводов разрабатывается прогноз развития эпидемической ситуации и мероприятия по санитарно-гигиеническому и противоэпидемическому обеспечению пострадавшего населения.
Комплексное исследование при подтвержденном вирусном гепатите В (HBV). Анализ маркеров инфекции позволяет установить клиническую стадию заболевания, иммунологический статус обследуемого, а также оценить эффективность лечения. Включает в себя определение белков вируса (антигенов), основных классов специфических антител, а также обнаружение ДНК вируса в крови.
Какой биоматериал можно использовать для исследования?
Как правильно подготовиться к исследованию?
- Исключить из рациона жирную пищу в течение 24 часов до исследования.
- Не курить за 30 минут до исследования.
Общая информация об исследовании
Вирусный гепатит B (HBV) – инфекционное заболевание, которое является причиной серьёзных поражений печени. Зачастую гепатит B переходит в хроническую форму, его течение становится затяжным и провоцирует возникновение цирроза и рака печени.
Вирус гепатита B (Hepadnaviridae) содержит двухцепочечную ДНК, окруженную нуклеокапсидом размером 27 нм, в состав которого входит антиген HBcAg, и внешней оболочкой, содержащей антиген HBsAg. Этот антиген обнаруживается в крови за 6 недель до появления симптомов заболевания и может выявляться длительное время как при их наличии, так и в при их отсутствии (при хроническом гепатите и носительстве). На ранних стадиях заболевания присутствует у 90-95 % больных.
Особенностью вируса гепатита B является то, что он поступает непосредственно в кровь и циркулирует в ней на протяжении всего периода заболевания. У некоторых пациентов вирус в крови сохраняется всю жизнь. По этой причине источником заражения могут стать не только те, кто болен гепатитом в его острой форме, но также те, кто уже перенес данное заболевание, а также люди, у которых заболевание не проявляется, однако они являются носителями вируса.
Полное выздоровление регистрируется у 92-95 % больных острым гепатитом В, и лишь у 5-8 % из них отмечается переход заболевания в хроническую форму.
Гепатит B лечится исключительно в условиях стационара. Это заболевание в случае длительного течения является фактором риска развития первичной гепатоцеллюлярной карциномы (рак печени).
В жизнедеятельности вируса гепатита В различают две фазы: фазу репликации и фазу интеграции. В фазе репликации происходит воспроизведение (размножение) вируса. ДНК вируса проникает в ядро гепатоцита, где с помощью ДНК-полимеразы синтезируется нуклеокапсид, содержащий ДНК вируса, антигены HBcAg, HBeAg, которые являются основной мишенью иммунной системы. Затем нуклеокапсид мигрирует из ядра в цитоплазму, где реплицируются белки внешней оболочки (HBsAg), и, таким образом, происходит сборка полного вириона. При этом избыток HBsAg, не использованный для сборки вируса, через межклеточное пространство попадает в кровь. Полная сборка (репликация) вируса заканчивается презентацией его растворимого нуклеокапсидного антигена – HBeAg на мембране гепатоцита, где происходит его "узнавание" иммуноцитами. Антиген HBcAg серологическими методами не определяется, потому что отсутствует в крови в свободном виде. Определяется наличие в крови антител (anti-HBc) к этому антигену, вырабатывающихся вследствие его высокой иммуногенности.
Маркерами фазы репликации вируса гепатита В являются:
- выявление в крови антигенов HBeAg и anti-HBc (Ig M).
У 7-12 % больных хроническим вирусным гепатитом В возможен спонтанный переход фазы репликации в нерепликативную фазу (при этом из крови исчезает HBeAg и появляются anti-HBe). Именно фаза репликации обусловливает тяжесть поражения печени и контагиозность больного.
В фазе интеграции происходит интегрирование (встраивание) фрагмента вируса гепатита В, несущего ген HBsAg, в геном (ДНК) гепатоцита с последующим образованием преимущественно HBsAg. При этом репликация вируса прекращается, однако генетический аппарат гепатоцита продолжает синтезировать HBsAg в большом количестве.
Вирусная ДНК может быть интегрирована не только в гепатоциты, но и в клетки поджелудочной железы, слюнных желез, лейкоциты, сперматозоиды, клетки почек.
Фаза интеграции сопровождается становлением клинико-морфологической ремиссии. В этой фазе в большинстве случаев формируется состояние иммунологической толерантности к вирусу, что приводит к купированию активности процесса и носительству HBsAg. Интеграция делает вирус недосягаемым для иммунного контроля.
Серологические маркеры фазы интеграции:
- наличие в крови только HBsAg или в сочетании с anti-HBc (IgG);
- отсутствие в крови ДНК-вируса;
- сероконверсия HBeAg в anti-HBe (т.е. исчезновение из крови HBeAg и появление anti-HBe).
Пациенты, перенесшие инфекцию и имеющие антитела к вирусу, не могут повторно заразиться гепатитом B. В некоторых случаях полное выздоровление не наступает и человек становится хроническим вирусоносителем. Вирусоносительство может протекать бессимптомно, но в некоторых случаях развивается хронический активный гепатит B. Ключевым фактором риска активного вирусоносительства является возраст, когда человек был заражен: для грудных детей уровень риска превышает 50 %, в то время как для взрослых остается на уровне 5-10 %. Исследования показывают, что мужчины чаще становятся носителями, чем женщины.
HBsAg – поверхностный антиген вируса гепатита В
Поверхностный антиген вируса гепатита В (HВsAg) является белком, который присутствует на поверхности вируса. Обнаруживается в крови при остром и хроническом гепатите В. Самый ранний маркер. Достигает максимума к 4-6-й неделе заболевания. Сохраняется до 6 месяцев при остром гепатите, свыше 6 месяцев – при переходе заболевания в хроническую форму.
HBeAg – ядерный 'е’-антиген вируса гепатита В
Антиген, находящийся в ядре вируса. Появляется в крови одновременно с HBsAg и сохраняется в течение 3-6 недель. HBeAg появляется в крови больного острым гепатитом В одновременно с HBsAg или вслед за ним и сохраняется в крови 3-6 недель. Указывает на активное размножение и высокий риск передачи вируса при половом контакте, а также перинатально. Инфекционность HBeAg-положительной сыворотки в 3-5 раз выше, чем HBsAg-положительной. Выявление HBeAg в крови более 8-10 недель свидетельствует о переходе заболевания в хроническую форму. При отсутствии репликативной активности вируса во время хронической инфекции HBeAg не выявляется. Его появление же свидетельствует о реактивации вируса, что чаще происходит на фоне иммуносупрессии.
При лечении вирусного гепатита В исчезновение HBeAg и появление антител к HBe-антигену свидетельствует об эффективности терапии.
anti-HBc (Ig M) – специфические антитела класса IgМ к ядерному 'core' антигену вируса
Начинают вырабатываться еще до клинических проявлений, указывают на активную репликацию вируса.
Появляются в крови через 3-5 недель, сохраняются в течение 2-5 месяцев и исчезают в период выздоровления.
anti-HBc – суммарные антитела (IgM+IgG) к ядерному ‘core' антигену вируса гепатита В
Важный диагностический маркер, особенно при отрицательном значении HBsAg. Антитела класса IgM вырабатываются через 3-5 недель. Антитела класса IgG начинают вырабатываться с 4-6-го месяца и могут сохраняться пожизненно. Подтверждают контакт организма с вирусом.
anti-HBs – суммарные антитела к поверхностному антигену вируса гепатита В
Появляются медленно, достигая максимума через 6-12 месяцев. Указывают на перенесенную инфекцию или наличие поствакцинальных антител. Выявление этих антител свидетельствует о выздоровлении и развитии иммунитета. Обнаружение антител в высоком титре в первые недели заболевания может быть связано с развитием гипериммунного варианта фульминантного гепатита В.
anti-HBe – антитела к 'е’-антигену вируса гепатита В
Появляются на 8-16-й неделе после инфицирования у 90 % больных. Свидетельствуют о завершении острого периода болезни и начале периода реконвалесценции. Могут сохраняться до 5 лет после перенесенного заболевания.
HBV (ДНК) – ДНК вируса гепатита В
Маркер наличия и репликации вируса. Методом ПЦР можно определить ДНК вируса качественно или количественно. Благодаря качественному методу подтверждается присутствие вируса гепатита В в организме и его активное размножение. Это особенно важно в сложных диагностических случаях. При инфицировании мутантными штаммами вируса результаты теста на специфические антигены HBsAg и HBeAg могут быть отрицательными, но при этом риск распространения вируса и развития заболевания у зараженного человека сохраняется.
Качественное определение ДНК вируса играет важную роль в раннем выявлении гепатита В у людей с высоким риском инфицирования. Генетический материал вируса обнаруживается в крови на несколько недель раньше, чем HBsAg. Положительный результат ПЦР за период более 6 месяцев указывает на хроническую инфекцию. Определение вирусной нагрузки (количество ДНК вируса в крови) позволяет оценить вероятность перехода заболевания в хроническую форму.
Повышенные уровни печеночных трансаминаз при положительном результате ПЦР являются показателями необходимости проведения терапии. Во время лечения вирусного гепатита В исчезновение ДНК вируса свидетельствует об эффективности лечения.
Для чего используется исследование?
- Для оценки серологического профиля;
- для выяснения стадии заболевания и степени контагиозности;
- для подтверждения заболевания и уточнения его формы (острая, хроническая, носительство);
- для наблюдения за течением хронического гепатита В;
- для оценки эффективности противовирусной терапии.
Когда назначается исследование?
- При выявлении у пациента поверхностного антигена вируса гепатита В (HBsAg);
- при подозрении на инфицирование вирусом гепатита В и сомнительных результатах серологических тестов;
- при микст-гепатитах (сочетанные вирусные гепатиты В и С);
- при динамическом наблюдении за больным гепатитом В (определение стадии процесса при совместном исследовании на другие специфические маркеры инфекции).
Что означают результаты?
Для каждого показателя, входящего в состав комплекса:
Острый гепатит В. Выделяют "дикий" штамм (естественный) и "мутантный" штамм (вид) вируса. Определение штамма вируса имеет определенное значение при выборе противовирусного лечения. Мутантные штаммы вируса несколько хуже поддаются лечению в сравнении с "диким".
Хронический гепатит В (ХВГВ). Выделяют три серологических варианта:
- ХВГВ с минимальной активностью (ранее использовали термин "носительство HBsAg");
- НВе-негативный ХВГВ;
- НВе-позитивный ХВГВ.
Интерпретация сочетаний серологических маркеров гепатита В
Читайте также:


