Иммуностимулирующие препараты при гепатите с
Вирусные гепатиты занимают одно из ведущих мест среди инфекционных заболеваний у детей. В последние годы, по данным Минздрава РФ, наблюдается постоянный рост заболеваемости вирусными гепатитами: так, в 1999 году этот
Вирусные гепатиты занимают одно из ведущих мест среди инфекционных заболеваний у детей. В последние годы, по данным Минздрава РФ, наблюдается постоянный рост заболеваемости вирусными гепатитами: так, в 1999 году этот показатель составил 75 случаев заболевания, в 2000-м — 113 и в 2001 году — 118 случаев на 100 тыс. детского населения. Среди вирусных гепатитов преобладает гепатит А, на него приходится до 80% случаев заболеваний; удельный вес гепатитов В и С колеблется в пределах 15—20%.
Вирусные гепатиты могут иметь разное течение и исход. В значительной степени это зависит от иммунологических сдвигов, возникающих в макроорганизме в ответ на проникновение вируса гепатита. При остром гепатите формируется адекватный иммунный ответ, приводящий к санации от возбудителя и выздоровлению. Однако в 3–5% случаев при гепатите А и В болезнь может принять затяжное течение, что обусловлено запаздыванием адекватного иммунного ответа. Гепатит С отличается крайне неблагоприятным течением и в 53—80% случаев переходит в хроническую форму [1, 2, 3].
В основе формирования хронических вирусных гепатитов лежит иммунопатологический процесс; при этом отмечается стойкий дефицит общего числа Т-лимфоцитов, дисбаланс иммунорегуляторных субпопуляций и нарушение функционального состояния макрофагов.
В связи с большой значимостью иммунологических нарушений при затяжном и хроническом течении вирусных гепатитов первоначально предполагалось, что иммунокорригирующие препараты, применяемые как самостоятельно, так и в сочетании с интерфероном-a, могут положительно воздействовать на патологический процесс при неблагоприятном течении вирусных гепатитов. Однако применяемые в гепатологии иммуномодуляторы, такие как левамизол и препараты тимуса, оказались малоэффективными при данных заболеваниях.
В последние годы появились обнадеживающие сообщения об иммуномодуляторе нового поколения — гепоне, который наряду с активацией иммунных механизмов защиты от инфекций оказывает прямое противовирусное и выраженное противовоспалительное действие [4]. В культуре инфицированных клеток человека показано, что гепон подавляет репликацию вируса гепатита С и отменяет цитопатогенное действие вируса [8].
Имеются публикации об успешном применении гепона при поражениях кожных покровов и слизистых оболочек вирусами простого и опоясывающего герпеса [5], при рецидивирующем урогенитальном кандидозе [6], а также об эффективном лечении гепоном детей с ОРЗ, с сопровождающимся синдромом крупа [7].
Таким образом, целью нашего исследования было изучение эффективности препарата гепон при острых гепатитах А и В и хроническом гепатите С.
В исследовании приняли участие 55 детей в возрасте от 3 до 14 лет, больных вирусными гепатитами. Из них у 20 был диагностирован гепатит А, у 19 — гепатит В и у 16 — хронический гепатит С (ХГС).
Этиологическая диагностика гепатитов осуществлялась с помощью ИФА на наличие антигенов и антител к вирусам гепатитов в сыворотке крови, для обнаружения РНК HCV использовался метод полимеразной цепной реакции (ПЦР). Диагноз гепатита А ставился при обнаружении в сыворотке крови анти-HAV IgM, гепатита В — при обнаружении HBsAg и анти-HBC IgM, а гепатита С — по выявлении в сыворотке крови анти-HCV и РНК НCV.
У всех 20 пациентов с гепатитом А отмечалась среднетяжелая форма заболевания, у 8 детей с гепатитом В была диагностирована легкая, а у 11 — среднетяжелая форма заболевания. Из 16 больных с ХГС, согласно современной классификации, у 9 наблюдалась минимальная активность процесса, у 6 — низкая и у 1 ребенка — неактивный гепатит; у 6 больных не было выявлено фиброза, у 9 — слабый фиброз и у 1 больного — умеренный фиброз печени.
Поражение желчевыводящих путей и поджелудочной железы, по данным УЗИ, было отмечено у 37 больных (у 18 — с гепатитом А, у 13 — с гепатитом В и у 6 — с ХГС). При этом гипомоторная дискинезия желчного пузыря имелась у 7 больных, холестаз — у 7 больных, деформации в области желчного пузыря — у 14, холецистит — у 27 и реактивный панкреатит — у 28 детей.
Лечение. Иммуномодулятор гепон получали 24 больных (10 — с гепатитом А, 7 — с гепатитом В и 7 — с ХГС). Гепон назначался внутрь (per os) в суточной дозе 2 мг. При этом больные с гепатитом А получали препарат по 1 мг 2 раза в день в течение 7 дней, больные с гепатитом В — по 1 мг 2 раза в день 14 дней, больные с ХГС принимали препарат по 1 мг 2 раза в день ежедневно в течение 28 дней. Больным острыми гепатитами А и В гепон назначался на 3–7-й день от начала заболевания.
В группе сравнения (контроль) был 31 ребенок: 10 с гепатитом А, 12 — с гепатитом В и 9 — с ХГС. Эти дети не получали никаких противовирусных и иммуномодулирующих препаратов, им были назначены диета и желчегонные средства.
Гепатит А. У больных гепатитом А, получавших гепон, отмечалась более быстрая обратная динамика клинических симптомов, чем в группе контроля. Cимптомы интоксикации (вялость, снижение аппетита) исчезали раньше (на 1—2 дня), чем в контрольной группе. Желтушность кожных покровов и склер у получавших гепон больных исчезала к 9–11-му дню от начала лечения, в то время как у больных группы сравнения желтушность не определялась лишь к 17–18-му дню от начала параллельного наблюдения. Нормализация размеров печени у получавших гепон детей происходила значительно быстрее — на 12–13-й день от начала терапии, в то время как у больных контрольной группы нормальные границы печени отмечались только к 20-му дню наблюдения. Биохимические позитивные сдвиги при лечении гепоном также развивались быстрее, чем у больных, которым была назначена обычная базисная терапия. Так, уровень общего билирубина по окончании лечения гепоном почти нормализовался и составил 20% от исходного, а в группе контроля в эти же сроки уровень билирубина составлял 50% от начального. Вместе с тем темпы снижения активности аминотрансфераз (АлАТ) были практически одинаковыми у больных обеих групп.
Повышенные показатели щелочной фосфатазы быстрее нормализовались у больных, получавших гепон, по сравнению с теми, кто оставался на базисной терапии.
Гепатит В. Обратная динамика клинических симптомов у больных гепатитом В из основной группы и у тех, кто получал обычную базисную терапию, практически не различалась. Достоверные различия отмечались в характере нормализации биохимических показателей. Так, у пациентов, получавших гепон по окончании терапии, уровень общего билирубина составлял 18% от исходного и наблюдалось дальнейшее его снижение. В группе контроля в эти же сроки уровень общего билирубина был равен 35% от повышенного исходного с последующей замедленной нормализацией. Достоверно более быстрым было падение активности аминотрансфераз (АлАТ и АсАТ) у детей с гепатитом В, получавших гепон, нежели у больных, находившихся на обычной базисной терапии. Так, в основной группе после окончания терапии гепоном активность АлАТ составила 18% от исходной высокой, а в группе сравнения этот показатель был 37% от исходного, та же закономерность прослеживалась и в динамике показателей АсАТ.
Достоверным оказалось различие в темпе нормализации уровня щелочной фосфатазы. При этом у больных, получавших лечение гепоном, по окончании терапии показатели щелочной фосфатазы составили 38%, а в группе контроля — 65% от исходного уровня. Дальнейшая нормализация показателей щелочной фосфатазы у леченных гепоном также протекала быстрее, чем у больных из группы сравнения.
Хронический гепатит С. Под влиянием терапии гепоном у больных хроническим гепатитом С отмечалась тенденция к устойчивому снижению активности аминотрансфераз (по сравнению с группой, получавшей базисную терапию). Так, через месяц после окончания лечения гепоном активность АлАТ снизилась до 80±5 ЕД/л от исходных 95±10 ЕД/л, в то время как в группе сравнения этот показатель повысился до 120±15 ЕД/л (при исходном 90±8 ЕД/л, р
- Tremolada F., Casarin C., Tagger A. et al. Antibody to the hepatitis C virus in posttransfusion hepatitts//Ann. Intern. Med. 1991. V. 114. P. 277-281.
- Shakhgildyan I. V., Kuzin S. N., Martinjuk G. A., Ershova D. N. Clinical character of icteric and anicteric forms of acute hepatitis C and their out courses//New Aspects in Hepatology and Gastroenterology Abstr. International Falk Workshop. Tbilisi (Tiflies), Georgia, May 29-30. 1998. p. 256.
- Учайкин В. Ф., Чередниченко Т. В. Острый гепатит С у детей//Детский доктор. 2000. № 3. С. 12-14.
- Атауллаханов Р. И., Катлинский А. В., Холмс Р. Р. и др. Усиление образования антител под влиянием иммуномодулятора гепон//Иммунология. 2003. № 1. 9-12.
- Бибичева Т. В., Силина А. Лечение рецидивирующего генитального герпеса иммуномодулятором гепон/Тезисы докладов IХ Российского национального конгресса "Человек и лекарство". М. 2002. С. 56.
- Перламутров Ю. Н., Соловьев А. М., Быстрицая Т. Ф. и др. Новый подход к лечению инфекций кожи и слизистых, вызванных грибами рода Candida.//Вестник последипломного медицинского образования. 2001. № 2. С. 21-23.
- Кладова О. В., Харламов Ф. С., Щербакова А. А. и др. Эффективное лечение синдрома крупа с помощью иммуномодулятора гепон//Русский мед. журнал. 2002. Т. 10. № 3. С. 138-141.
- Атауллаханов Р. И., Холмс Р. Д., Катлинский А. В. и др. Иммуномодулятор гепон подавляет репликацию вируса гепатита С в клетках человека in vitro//Антибиотики и химиотерапия. 2002. Т. 47. № 8. С. 9-11.
- Хаитов Р. М., Атауллаханов Р. И., Холмс Р. Д. и др. Повышение эффективности иммунного контроля оппортунистических инфекций при лечении больных ВИЧ-инфекцией иммуномодулятором гепон//Иммунология. 2003 (в печати).
Противовирусная терапия (ПВТ) – базовая методика, используемая при лечении пациентов с диагнозом гепатит С.
Рассмотрим основные препараты для ПВТ, схемы и продолжительность терапевтического курса, разберем необходимые анализы и рекомендацию по восстановлению, а также расскажем о вариантах бесплатного противовирусного лечения в России.
О чем я узнаю? Содержание статьи.
Что такое ПВТ при гепатите С?
Противовирусная терапия при гепатите С, купирующая негативное воздействие возбудителя инфекции, позволяет предотвратить рецидивы и полностью избавиться от заболевания у 40-85% пациентов. Эффективность ПВТ зависит от:
- возраста и пола;
- типа гепатита С;
- степени поражения гепатоцитов;
- продолжительности заболевания.
Терапия признается успешной при отсутствии вирусов в крови через год со дня окончания лечебного курса.
Препараты для противовирусной терапии
Препараты от гепатита С делятся на 3 группы:
- Препараты старого поколения, подавляющие размножение гепаднавируса HCV (Hepatitis С Virus). Противовирусная терапия строится на использовании Интерферона Альфа. Для повышения эффективности применяют Рибавирин, рекомендованный при хронизации заболевания. Такое лечение помогает только в 50 случаях из 100 (данные актуальны для 1 вирусного генотипа, при 2 и 3 показатель увеличивается до 70-90) и имеет ряд возможных побочных эффектов, включающих:
- нарушение сна и депрессии;
- кишечные и желудочные расстройства;
- возникновение дефицита железа и патологий аутоиммунной природы;
- развитие пороков сердца и тахикардии.
- Противовирусные препараты прямого действия (ПППД), препятствующие синтезированию белка возбудителем, что приводит к его смерти. Такие лекарства (Софосбувир, Даклатасвир, Ледипасвир):
- эффективны в 95 случаях из 100 для любого генотипа вируса;
- не теряют эффективности при наличии циррозных рубцов или ВИЧ;
- практически не имеют побочек, но обладают высокой стоимостью.
- Дженерики (Хепсвир, Виропак). Аналоги ПППД, обладающие меньшей стоимостью и выпускаемые Индией или Египтом. Несмотря на идентичный состав и схожее воздействие на организм, дженерики уступают оригиналам в эффективности, помогая избавиться от болезни 60-80% пациентов. Также часть египетских лекарств не имеет лицензию.
Схема и сроки лечения
При проведении ПВТ используют 2 метода:
- комбинированный, сочетающий полезные свойства нескольких препаратов одновременно, что повышает конечную эффективность курса;
- монолечение, используемое в связи с индивидуальными особенностями организма и спецификой гепатита С у пациента, не воспринимающими комбинированный метод.
В зависимости от генотипа HCV применяют следующие схемы:
- Безинтерфероновая терапия (Софосбувир + Рибавирин) – 2 генотип. Используется в течение 3-5 месяцев. При циррозе выздоровление наступает у 83% пациентов, а при его отсутствии показатель повышается до 97%.
- Интерферон + Рибавирин + Софосбувир – 3 генотип. Используется при отсутствии противопоказаний к приему лекарств на основе Интерферона.
- Безинтерфероновая терапия (Софосбувир + Даклатасвир + Рибавирин) – 3 генотип. В ряде случаев допускается отсутствие Рибавирина.
- Для 1 генотипа используют 6 схем в зависимости от подтипа вируса.
Противовирусное лечение гепатита С с использованием Интерферона длится от 6 до 12 месяцев. Интерферон вводят подкожно ежедневно или еженедельно в зависимости от рекомендаций врача. Рибавирин в виде таблеток принимают до или после еды, запивая водой. Если болезнь не удается устранить полностью, то пациентам приходится принимать лекарства до конца жизни, чтобы избежать рецидивов.
Если для лечения гепатита С используются препараты прямого противовирусного действия, то курс составляет не > 3 месяцев. Монотерапию на основе Собусфовира не применяют. Таблетки принимают ежедневно во время еды, фиксируя изменения у лечащего врача.
Анализы перед ПВТ
Перед антивирусной терапией пациентам необходимо сдать следующие анализы:
- общий и биохимический анализ крови;
- ИФА и ПЦР, определяющие количество и генотип вируса;
- эластографию, показывающую количество пораженных тканей печени.
Обратите внимание, что ИФА проводится только до начала противовирусного лечения. Во время и после ПВТ гепатита С количество антител и маркеров HCV лишь подтверждают произошедшее столкновение с возбудителем. При эффективной терапии количество антител снижается, но их часть может сохраниться до конца жизни.
Восстановление после противовирусной терапии
Для восстановления после противовирусной терапии гепатита С придерживайтесь следующих рекомендаций:
- Избегайте стресса и повышенных физических нагрузок.
- Придерживайтесь диетического питания, рекомендованного лечащим врачом.
- Соблюдайте режим дня. Убедитесь в достаточном количестве дня, устраивайте пешие прогулки на свежем воздухе и выполняйте легкие гимнастические упражнения для мышечного тонуса.
- Откажитесь от наркотических веществ, табака и алкоголя.
- Следите за водным балансом. Вода очищает организм от вредных токсинов естественным путем.
Для снятия побочных эффектов воспользуйтесь лекарственными средствами симптоматического действия:
- желчегонными (Аллохол), предупреждающими развитие желтухи;
- противорвотными (Метоклопрамид, Церукал), уменьшающими приступы тошноты;
- гепатопротекторами (Гептрал, Эссенциале, Урсофальк), защищающими гепатоциты от разрушения и нормализующими метаболические процессы;
- спазмолитиками (Дуспаталин), расширяющими протоки для вывода желчи и предотвращающими боли в печени;
- растворами для дезинтоксикации, снижающими количество токсинов.
В течение года после окончания ПВТ пациенты состоят на учете и сдают анализы, определяющими эффективность лечения.
Можно ли пить алкоголь во время и после ПВТ?
Людям с гепатитом С противопоказан прием спиртосодержащих напитков не только во время, но и после окончания ПВТ. Продукты распада этанола, разрушающие гепатоциты, приводят к разрастанию фиброзной ткани, снижающей функциональность печени. Дополнительное воздействие HCV оборачивается развитием карциномы, грозящей летальным исходом.
Новые препараты справляются с циррозом, но даже небольшая доза спирта сводит на нет весь эффект. После окончания противовирусной терапии отказ от алкоголя соблюдается на протяжении всей жизни.
Бесплатная противовирусная терапия гепатита С
Средняя цена месячного курса на российских препаратах составляет 20 тысяч рублей, а на импортных – 50 тысяч рублей. Не каждый гражданин способен позволить себе столь дорогой курс, поэтому на региональном уровне принята программа, предоставляющая бесплатное лечение от государства.
Для получения квоты требуется:
- подтвердить диагноз в районной поликлинике;
- получить направление в региональный центр гепатологии и пройти уточняющее обследование.
Обратите внимание, что получить помощь можно только на уровне отдельных регионов, включающих такие крупные города как Москва и Санкт-Петербург. В первую очередь квота предоставляется пациентам с высокой степенью фиброза (не ниже 3) или коинфекцией.
Если гепатит С протекает без дополнительных осложнений, то попытайтесь получить бесплатную помощь иными путями:
- Участие в исследованиях. Для испытания новых лекарств, появляющихся на российском рынке, требуются добровольцы, удовлетворяющие необходимым требованиям (генотип, степень поражения, возраст).
- Федеральные льготы. Бесплатное лечение предоставляется инвалидам, участникам ВОВ, ветеранам боевых действий и другим льготным категориям.
- ДМС. Ряд страховых компаний покрывает издержки лечения, поэтому имеющаяся страховка компенсирует общую сумму или часть понесенных расходов.
Эффективность и безопасность современных противовирусных препаратов позволяет вылечить гепатит С даже при осложнениях. Единственный недостаток такого лечения – высокая цена, недоступная большинству россиян. Альтернативой является выбор бесплатного лечения или покупка лицензированных дженериков.
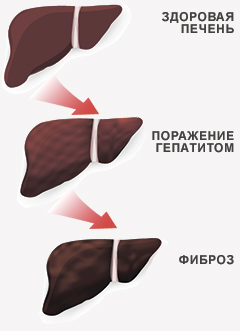
Медицинское сообщество всего мира относится к гепатиту C как к одному из самых опасных заболеваний. Вирус поражает жизненно важную железу человеческого организма — печень, зачастую вызывая необратимые изменения, такие как цирроз и рак. Для эффективной профилактики заболевания каждому из нас следует знать, что представляет собой эта болезнь и какие существуют методы борьбы с ней.
Препараты на основе глицирризиновой кислоты и фосфолипидов оказывают положительное действие в восстановлении клеток печени и замедлении прогрессирования фиброза. Имеются противопоказания. Необходимо проконсультироваться со специалистом.



Гепатит C — бомба замедленного действия
Вирус, вызывающий гепатит C, был открыт сравнительно недавно — в 1989 году. Он относится к семейству флавивирусов и содержит генетический материал в виде РНК (рибонуклеиновой кислоты). Эта болезнь становится причиной смерти около 350 тысяч человек по всему миру ежегодно, при этом 3–4 миллиона людей получают статус инфицированных. Наибольшее распространение вируса отмечают в странах Африки и Центральной Азии.
По статистике в 10% при острой форме гепатита C наступает самоизлечение, а до 90% случаев характеризуется переходом болезни в хроническую форму.
Многие люди являются носителями вируса гепатита С, даже не подозревая об этом. Тем не менее, они представляют угрозу для окружающих. Эта болезнь передается через кровь (одна из самых распространенных причин — использование нестерильных шприцев), а также при половых контактах. Наследственный гепатит C встречается редко — передача вируса от матери к малышу возможна всего в 1–5% случаев.
Современная медицина готова предложить пациентам несколько способов борьбы с таким опасным заболеванием, как гепатит С. До недавнего времени в России единственным методом лечения оставались препараты на основе импортного интерферона и рибавирина. Но длительный курс (до 48 недель) и тяжелые побочные эффекты, порой угрожающие жизни пациента не меньше, чем само заболевание, а также сравнительно невысокий процент выздоравливающих при лечении 1 генотипа (около 50%) побудили медицинское сообщество продолжать исследования в этой области. На смену интерферону и рибавирину пришли гораздо более безопасные противовирусные препараты прямого действия — их эффективность увеличилась до 80-95%, а побочные действия значительно сократились. На российском рынке первый подобный препарат появился в 2012 году.
Широкий набор генотипов гепатита C и их подвидов, а также значительное влияние на течение болезни состояния здоровья каждого отдельного пациента свидетельствуют о необходимости индивидуального подхода к лечению, которое зависит от генотипа вируса, стадии повреждения печени, а также от формы заболевания (острое, впервые выявленное, рецидив). Тем не менее, общие принципы существуют. Основным лечением гепатита С является противовирусная терапия, которую следует осуществлять без необоснованных перерывов.
После постановки диагноза врач назначает соответствующее лечение, которое зависит от стадии повреждения печени, а также от формы заболевания (острая, хроническая, рецидив). Ниже приведем несколько основных типов терапии.
Обычно лечение гепатита C, за исключением тяжелых форм заболевания, не требует пребывания в стационаре и постельного режима. Можно продолжать привычную повседневную активность, однако от тяжелых физических нагрузок следует воздержаться.
Необходимо помнить, что заболевание передается прежде всего через кровь, а также другие биологические жидкости. Это требует соблюдения правил гигиены.
Ученые из Оксфорда уже несколько лет работают над созданием безвредной вакцины против гепатита C. Первая стадия испытаний увенчалась успехом, а полностью завершить исследование планируется в 2016 году.
Можно принимать витамины С, В и Е. Однако их польза при гепатите С не доказана.
Можно встретить информацию, что якобы некоторые растительные средства обладают положительным воздействием на вирус гепатита С. Арника лекарственная, алоэ, мать-и-мачеха, подорожник, фасоль обыкновенная — экстракты этих растений помогают организму начать выработку противовирусного белка, сдерживая распространение инфекции. Но это не доказано, и их эффективность и безопасность при гепатите С не подтверждены.
На данный момент существует много авторских методик лечения гепатита C. Они представляют собой как медикаментозные препараты, так и специальные процедуры. Например, одна из них основана на разогреве тела пациента до 43 градусов и поддержании такой температуры на протяжении 5 минут. Также существует метод, при котором каждый участок печени подвергается кратковременному воздействию жидким азотом. Но следует с осторожностью относиться к подобным экспериментам — если методика не получила признания медицинского сообщества, значит, она окончательно не проверена.
Острая фаза болезни или тяжелое его течение требует экстренных мер по восстановлению стабильного состояния пациента. Для этого проводится интенсивная терапия в специализированных стационарных отделениях.
Часто иммунитет не в состоянии справиться с вирусом гепатита C, так как последний обладает способностью быстро изменяться — организм просто не успевает произвести необходимые антитела. До сих пор продолжают применяться старые схемы лечения, бывшие до недавнего времени стандартом, представляющие собой инъекции аутогенного белка (стандартные и пегилированные интерфероны альфа-2a, альфа-2-b), активирующего противовирусную защиту организма, и специального противовирусного вещества (рибавирин), подавляющего размножение вируса. Тем не менее, на данный момент, как мы уже говорили, медицине известны более эффективные и безопасные способы борьбы с заболеванием. К ним относится применение новейших противовирусных препаратов прямого действия для лечения гепатита С — ингибиторов полимераз и протеаз. Содержащиеся в них вещества воздействуют на клетки вируса, лишая их возможности размножаться. Эффективность лечения данными лекарствами составляет до 95%.
Если знать о способах инфицирования гепатитом C, то несложно вывести ряд простых рекомендаций по избежанию опасного заболевания. Выбирая медицинское учреждение для проведения различных манипуляций, связанных с хирургическим вмешательством или даже просто уколами, следует убедиться, что сотрудники клиники четко соблюдают правила гигиены — например, используют только одноразовые шприцы и стерильные инструменты. Помимо этого следует избегать беспорядочных половых контактов, а если существует вероятность, что партнер является носителем гепатита C, то использовать в качестве средства контрацепции презервативы.
Как мы рассмотрели выше, в настоящее время существует большое количество лекарственных препаратов, которые применяются как средства этиотропной терапии, то есть терапии, направленной на причину возникновения заболевания, а не на ее симптомы и проявления – это ингибиторы полимераз и протеаз, а также старые препараты – интерферон альфа и рибавирин. Однако существуют сложные ситуации, когда ПВТ (противовирусная терапия) не может быть назначена по ряду причин:
- наличие противопоказаний для назначения противовирусных препаратов
- побочные явления, требующие отмены терапии
- опыт неэффективного лечения противовирсуными препаратами (повторное лечение, как правило, не целесообразно)
- высокая стоимость противовирусных препаратов
- ожидание доступных/эффективных/безопасных противовирсуных препаратов.
- отказ пациента проводить противовирусную терапию
В таких случаях для замедления прогрессирования заболевания в цирроз и рак печени показано назначение лекарственных препаратов, способных уменьшать воспаление и темпы прогрессирования фиброза, так называемая альтернативная терапия.
Для того чтобы не допускать развития болезни, лучше всего запомнить основные правила, которые значительно снизят риск заражения гепатитом С.
М.И. Дмитриева 1 , А.Г. Рахманова 2 , В.С. Смирнов 3
1 Главный инфекционист Калининского района г. Санкт-Петербурга, кандидат медицинских наук
2 Главный инфекционист Комитата по здравоохранению администрации Санкт-Петербурга, доктор медицинских наук профессор
3 Ведущий научный сотрудник кафедры военно-полевой терапии Военно-медицинской академии, доктор медицинских наук профессор
Скачать PDF
Мировая статистика показывает, что эпидемическая ситуация по вирусному гепатиту С имеет устойчивую тенденцию к ухудшению. В настоящее время уместно говорить о пандемии вирусного гепатита С, представляющей серьезную угрозу населению планеты. Высока вероятность перехода заболевания в хроническую форму. Чаще всего формирование хронического вирусного гепатита С (ХВГС) происходит исподволь, с неярко выраженной клинической симптоматикой, однако последствия присутствия в организме вируса могут быть катастрофическими: цирроз, рак печени.
Большую роль при ХВГС играет иммунная система. Тяжесть проявления, течение и исход зависят не только от количественного содержания вируса в организме, но и от характера иммунологического реагирования. Лечение больных ХГС с помощью противовирусных препаратов и этиотропных средств далеко не всегда приводит к полному успеху. Нередко возникают проблемы побочных эффектов, таких как, гепатотоксичность, иммуносупрессия и т.д. Актуальным становится вопрос повышения активности иммунной системы, восстановления нарушенных функций, возможности ингибировать развитие вируса в инфицированных клетках.
Возбудитель гепатита С (HCV) относится к группе РНК-содержащих флавиви- русов. Геном вируса содержит ядерный участок р22, участки Е1 и Е2, кодирующие гликопротеиды оболочки и неструктурированные участки (NS2, NS3, NS4, NS5), кодирующие ферменты, необходимые для репликации вируса. Вирус гепатита С существует в виде 6 основных генотипов: 1, 2, 3, 4, 5, 6 и более сотни субтипов, обозначаемых строчными буквами: 1a, 1b, 2a и т.д. В России наиболее распространен генотип 1b (до 80%), менее значимы в эпидемическом отношении генотипы 1a, 2 и 3. Другие генотипы для России менее характерны и встречаются редко. Определение генотипа позволяет прогнозировать течение и исход заболевания, а также эффективность противовирусной терапии. Так, вирус, имеющий генотип 1b, обладает наибольшей резистентностью к интерферону, чаще приводит к циррозу, в то время как гепатоцеллюлярная карцинома более характерна для генотипа 1a. Кроме того, гепатит 1b чаще связан с гемотрансфу- зионным путем передачи инфекции.
Вирусный гепатит С – типичный антропоноз – источником инфекции может быть только больной человек с острой или хронической формой течения заболевания. Механизм передачи вируса – парентеральный. Основная масса больных – лица, употребляющие парентеральные наркотики, а также больные, получающие гемотрансфузии. По данным ВОЗ, на его долю трансфузионного пути передачи приходится до 70 % всех случаев заболевания. Возможно инфицирование реципиентов при трансплантации органов от HCV позитивных доноров. К группе риска относятся также медицинские работники, имеющие контакт с кровью больных. Вероятность заражения среди медицинских работников через случайные уколы иглами, инфицированными вирусом, составляет от 4 до 10 %. HCV является главной причиной посттрансфузионного гепатита; по данным ВОЗ, на его долю приходилось до 70 % всех случаев заболевания. Менее вероятен сексуальный и перинатальный пути передачи. Вероятность такого пути заражения, по разным данным, не превышает 1-5%. В последнее время участились случаи заражения HCV при пирсинге и нанесении татуировок.
Известные пути передачи вируса гепатита С В.Г. Радченко и соавторы (2004) разделили на основные и дополнительные. К основным отнесены:
- внутривенное введение наркотиков;
- трансфузии крови и ее препаратов;
- трансплантация органов и тканей;
- парентеральные вмешательства, в том числе хирургические операции;
- стоматологические процедуры;
- вертикальный путь передачи;
- половой путь передачи.
К дополнительным путям передачи, по мнению авторов, относятся:
- ритуальные обряды (скарификация, обрезание);
- методы народной медицины (кровопускания);
- косметические процедуры (татуировка, пирсинг и др.).
Следует оговориться, что в 20-30% случаев установить путь заражения не удается. Это может быть обусловлено, с одной стороны, медленным развитием инфекции, затрудняющим точный эпидемиологический анализ источника заражения, а с другой — все большее число специалистов считает, что существуют какие-то иные еще не установленные пути передачи вируса.
Как уже говорилось, для вирусного гепатита С характерно латентное или мало- симптомное течение. Нередко больной продолжительное время не обращает внимания на микросимптоматику, и заболевание остается не распознанным. По разным данным, до 70% всех случаев вирусного гепатита С протекает субклинически или бессимптомно. Желтуха возникает у 10-30% больных. Наиболее отчетливый признак клинического течения – уровень трансаминаз в ряде случаев сохраняется на уровне среднестатистической нормы. Острое течение заболевания, заканчивающееся полным выздоровлением, наблюдается у 20 – 50% больных. В остальных случаях развивается хроническая фирма заболевания. Критерием хронизации является длительная (более 6 мес.) вирусе- мия, которая в большинстве случаев сопровождается слабым поражением печени. Заболевание при этом имеет сравнительно благоприятный прогноз и требует минимальной фармакологической поддержки. В 10- 30% больных ХВГС приобретает агрессивный характер и в течение 10 – 15 лет заканчивается циррозом. Примерно у 20 – 30% больных с прогрессирующим течением инфекционного процесса развивается гепато- целлюлярный рак.
Важнейшим звеном, определяющим течение и прогноз ХВГС, является иммунная система. В настоящее время уже не вызывает сомнения, что исход большинства случаев HCV-инфекции зависит от динамики репликации вируса с одной стороны и особенностей иммунного ответа хозяина – с другой. Сильный полиспецифический CD4+ и CD8+ Т-клеточный ответ в сыворотке и печени, как правило, сопровождается элиминацией вируса. Недостаточность этого ответа или его несостоятельность в течение длительного промежутка времени приводит к возникновению вирусных мутаций, приводящих к персистированию вируса, уходу из-под иммунного надзора, и как следствие – развитию хронической формы инфекции.
Можно считать установленным, что поражение гепатоцитов (клеток-мишеней для HCV) и развитие воспалительного процесса в печени обусловлено не прямым цито- топатогенным действием вируса, а опосредованным — через изменения в структурнофункциональной организации иммунокомпетентных клеток. Эти изменения могут проявляться в виде ослабления иммунного надзора вследствие угнетения функциональной активности иммунокомпетентных клеток, а также нарушения баланса провоспалительных и противовоспалительных цитокинов. Установлено, что HCV обладает способностью индуцировать пептиды, которые являются функциональными антагонистами Т- лимфоцитарных рецепторов, а также способны подавлять продукцию эндогенного интерферона. Формирующаяся в результате Т-клеточная анергия приводит к блокаде функциональной активности Т-хелперов и цитотоксических лимфоцитов, что является одним из пусковых механизмов хронизации инфекции.
Названные механизмы позволяют вирусу неопределенно долго персистировать в организме хозяина, приводя к развитию цирроза печени, гепатоцеллюлярной карциномы, а также различным внепеченочным поражениям.
Заболевание чаще всего начинается исподволь и длительное время остается нераспознанным, при этом оно постепенно прогрессирует и с исходом в цирроз печени или гепатоцеллюлярную карциному. При инфицировании наиболее распространенным в России вирусом с генотипом 1b инфекция прогрессирует быстрее. В течении вирусного гепатита С различают 3 последовательных фазы: острую, латентную и реактивации.
Острая фаза заболевания, как правило, остается нераспознанной, если не сопровождается желтухой. Иногда при случайном или целенаправленном обследовании выявляется умеренная гепатомегалия, в редких случаях сопровождающаяся явлениями спленомегалии. Первый пик повышения трансаминаз, в частности АлАТ, свидетельствующий об окончании фазы инкубации, наблюдается на 7-9 неделях после заражения. Сероконверсия формируется значительно позднее. Специфические иммуноглобулины — антитела к ядерному антигену вируса — появляются через 4 – 5 мес. РНК вируса удается выявить уже на 14 – 16 дни после заражения. Такой разрыв в сроках появления РНК и специфических антител является объективным подтверждением HCV-инфекции.
Если заболевание не завершилось самопроизвольным излечением, оно переходит в латентную фазу, развивающуюся через 6 мес. после заражения. Хронизация инфекции происходит в 80% случаев. В этой фазе продолжается вирусемия при полном или почти полном отсутствии каких-либо клинических проявлений и может продолжаться до 20 лет. При обследовании у больных выявляется умеренное увеличение печени. Эпизоды повышения АлАТ сменяются более или менее продолжительными периодами в течение которых содержание фермента не выходит за пределы статистической нормы.
Латентная фаза в любой момент может смениться фазой реактивации для которой характерна выраженная клиническая картина высокая стабильная вирусемия. Фаза реактивации чаще всего завершается формированиям цирроза печени.
При биохимическом исследовании крови наиболее частыми находками являются гипертрансаминаземия (чаще повышение уровня АлАТ), повышение тимоловой пробы, диспротеинемия с повышением содержания гаммаглобулинов. При ультразвуковом исследовании наблюдается повышение эхогенности, диффузная неоднородность паренхимы, признаки портальной гипертензии, увеличение размеров печени и селезенки.
Терапия ХВГС остается одной из наиболее сложных задач. К настоящему времени имеется множество различных средств и методов лечения заболевания. Одни из них прошли клиническую апробацию и внедрены в практику, другие находятся на различных этапах исследования.
Следует также отметить, что эпидемическая и, особенно, экономическая ситуация в России не позволяет в полной мере использовать этот терапевтический стандарт. Как уже было отмечено, для России характерно доминирование вируса с генотипом 1b, наиболее резистентного к препаратам экзогенного интерферона. По разным данным до 60% больных имеют более или менее выраженную резистентность к экзогенному ин- терферону-альфа. Попытки повысить эффективность рекомбинантного интерферона увеличением дозы наталкиваются на существенные побочные эффекты, среди которых наиболее значимыми являются нарушения гемопоэза (анемия, лейкопения, тромбоцитопения), дисфункции центральной нервной системы (от депрессии до острых психозов), нарушения функции эндокринных органов и т.д. Кроме того, при продолжительном применении интерферонов возможна выработка соответствующих антител, снижающих эффективность терапию.
Что касается рибавирина, то у этого препарата в настоящее время выявлены две критические позиции: 1) монотерапия рибавирином не эффективна в плане подавления репликации вируса, 2) гемолитическая анемия, сопровождающая применение рибави- рина, ограничивает величину терапевтической дозы.
Таким образом, существенные недостатки стандартной противовирусной терапии заставляют разрабатывать новые средства и методы лечения вирусного гепатита С. Одним из таких подходов является иммуномодулирующая терапия пептидным тимо- миметиком Тимогеном®. Исследования последних лет показали, что Тимоген® активирует экспрессию CD3+, CD4+, CD25+ рецепторов Т-лимфоцитов и, по-видимому, восстанавливает Th1-иммунный ответ. O6 этом свидетельствует активация синтеза фактора некроза опухолей альфа, интерферонов альфа и гамма, интерлейкина-2 и др. Иначе говоря, Тимоген® может активировать сильный полиспецифический иммунный ответ, который является предпосылкой для ограничения развития инфекционного процесса. С учетом этих данных была разработана методика применения Тимогена® для лечения ХВГС.
Тимоген® представляет собой мононатриевую соль глутамил-триптофана. Препарат обладает свойствами пептидов тимуса, поэтому он отнесен к классу тимомиметиков – синтетических аналогов природных пептидов тимуса. Тимоген® выпускается в двух лекарственных формах: 0,01% раствор для инъекций в ампулах объемом 1,0 мл и 0,025% раствор в виде спрея. в ампулах по 10 мл, оснащенных дозирующих распыли- вающим устройством.
В сравнительное клиническое исследование эффективности различных форм введения пептидного иммуномодулятора Тимоген® было включено 135 пациентов с ХВГС (69 мужчин и 66 женщин)
Больные методом случайной выборки были разделены на 3 группы. Больные 1-й группы (52 человека) получали Тимоген® внутримышечно 1 раз в день. Больные, отнесенные ко 2-й группе (32 человека), получали Тимоген® интраназально по 1 дозе в каждый носовой ход 2 раза в день. Больные, включенные в 3-ю группу (контроль), получали симптоматическое лечение (51 человек). Средний возраст больных в сравнивавшихся группах составлял 47 (20 + 74) лет
Длительность терапии определяли в соответствии с современными рекомендациями по лечению больных ХВГС. Учитывалось: наличие раннего вирусологического ответа, наличие раннего клинико-биохимического ответа у пациента, наличие положительного терапевтического эффекта. Во всех группах больные были сопоставимы по полу, исходному уровню аланинаминотрансферазы (АлАТ), вирусной нагрузке.
Методы обследования: всем больным проводили вирусологические (определение РНК HCV методом ПЦР в сыворотке крови); серологические: (маркеры вирусов гепатита А,В,С методом ИФА) исследования. Определяли основные клиниколабораторные показатели, среди которых особое внимание уделяли биохимическим маркерам ХГВС: содержанию в сыворотке крови АлАТ и аспартатаминотрансферазы (АсАТ)
Инструментальное обследование предусматривало ультразвуковое исследование (УЗИ) печени, желчного пузыря и желчевыводящих путей, поджелудочной железы, селезенки. Отметим, что у всех наблюдаемых пациентов, на основании клинического и ультразвукового исследований, признаков цирроза печени не выявлено.
Диагноз ХВГС установлен на основании комплекса эпидемиологических, анамнестических и клинических данных и подтвержден обнаружением анти-НСV антител.
Общая характеристика частоты клинических проявлений ХВГС у больных сравнивавшихся групп до начала лечения приведены в табл. 1

Из табл. 1 видно, что по клиническим проявлениям больные были сопоставимы между собой. После проведенного обследования больные контрольной группы получали стандартную симптоматическую терапию, включавшую гепатопротекторы, желчегонные, витамины, антиоксиданты, при необходимости трихопол или метронидазол. Больные 1-й группы получали Тимоген® по 100 мкг внутримышечно 1 раз в сутки на протяжении 21 дня. Больные 2-й группы получали Тимоген® интраназально по 1 дозе в каждый носовой ход 2 раза в день в течение 21 дня. В процессе наблюдения структуру клинических проявлений фиксировали на 14 сутки лечения и через 7 дней после окончания курса Тимогена® (30 сутки наблюдения). Результаты приведены в табл. 2.

Как следует из представленных данных, симптоматическая терапия не сопровождалась достоверными изменениями основных клинических проявлений заболевания в течение 30 суток наблюдения. Совершенно иная динамика наблюдалась у больных, получавших монотерапию Тимогеном®. Так, уже к 14 суткам лечения частота наиболее общих симптомов интоксикации слабости и ощущения тяжести в правом подреберье уменьшилась в среднем в 7-8 раз. Более чем в 2 раза реже отмечались явления гепато- и спленомегалии и самое важное – более чем в 11 раз реже наблюдалось повышение АлАТ. Еще более четкие результаты наблюдались на 30 сутки. Только явления гепатомегалии сохранялись в среднем у 15-20% больных, в то же время остальные симптомы у больных практически отсутствовали. Сравнительный анализ результатов лечения парентеральной и интраназальной формами Тимогена® свидетельствует о равной терапевтической эффективности этих лекарственных форм препарата и способов их применения. В правомерности данного вывода убеждают и результаты количественного анализа содержания АлАТ и АсАТ в крови больных, получавших Тимоген®парентерально и интраназально (рис. 1). Как следует из этих результатов, на фоне введения Тимогена® у всех больных отмечается быстрое снижение содержания трансфераз в сыворотке крови. Если считать уровень 40 мкмоль/мл за среднестатистическую норму трансфераз, то на фоне лечения Тимогеном ее удается достичь на 15 – 20 сутки. Важно отметить, что нормальный уровень трансфераз у большинства больных, получавших Тимоген, сохранялся по крайней мере в течение 6 мес.В последующем в исходу 9 мес отмечается некоторое повышение уровня АлАТ и АсАТ до верхней границы статистической нормы. Еще один важный вывод, следующий их представленных данных – заключается в том, что сравнивавшиеся способы применения Тимогена давали практически идентичный клинический результат. Кривые динамики трансфераз у больных, получавших препарат парентерально и интраназально, оказались по существу одинаковыми. Полученные результаты вполне объяснимы, если учесть, что слизистая оболочка носа обладает высокой всасывающей способностью. В то же время интраназальная форма имеет совершенно очевидные эпидемиологические преимущества, поскольку исключает парентеральное вмешательство.
Следует также отметить, что на фоне проводившейся симптоматической терапии наблюдалась некоторая тенденция в снижению уровня трансаминаз, однако она не достигала уровня среднестатистической нормы.

Проведенное открытое сравнительное исследование доказало эффективность применения отечественного иммуномодулятора Тимогена® у больных ХВГС. Пептидный иммуномодулятор Тимоген® позволяет достигать клинической и билхимической стабилизации процесса по крайней мере в течение 6-9 мес. после однократного курса, продолжительностью 21 день. Следует отметить, что в данном исследовании Тимоген® применяли в виде монотерапии. Представляется, что сочетание Тимогена® с другими лекарственными средствами противовирусного и гепатопротективного действия позволит получать еще более прочный результат. В пользу этого положения свидетельствуют успешные результаты лечения ХВГС противовирусными средствами в комбинации тимозином-альфа1.
Клиническими исследованиями доказано, что пептидный иммуномодулятор Тимоген ® эффективное лекарственное средство для лечения больных ХВГС. Терапия Тимогеном® особенно уместна у пожилых больных с хроническим гепатитом С, у этой категории больных стандартная терапия зачастую не эффективна или противопоказана по тем или иным причинам. Тимоген® можно применять и беременным женщинам, страдающим ХВГС, поскольку стандартная терапия этим лицам противопоказана.
В заключение следует отметить в абсолютную безвредность Тимогена®. Опыт клинического применения препарата при разных заболеваниях и патологических состояниях на протяжении почти 20 лет не выявил ни одного случая осложнений или каких-либо побочных эффектов. Более того, Тимоген® в ряде случаев позволяет уменьшить проявления аутоиммунных процессов, которые нередко наблюдаются у больных ХВГС, получающих массивные дозы интерферонов.
Читайте также:


