| № |
Критерии качества
Уровень достоверности доказательств
Уровень убедительности рекомендаций
Выполнен сбор анамнеза и жалоб, физикальное обследование врачом-гематологом и/или аллергологом-иммунологом
Выполнено базовое лабораторное обследование (клинический анализ крови; биохимический анализ крови (мочевина, креатинин, фракции билирубина, аспартатаминотрансфераза, аланинаминотрансфераза, альбумина, лактатдегидрогеназа, щелочная фосфатаза, глюкоза, триглицериды, ферритин, С-реактивный белок, фибриноген)
Выполнено инструментальное обследование (компьютерная томография грудной и брюшной полости с контрастным усилением или УЗИ брюшной полости и рентгенография грудной клетки
Проведено иммунологическое обследование (определение иммуноглобулинов сыворотки крови IgG, IgA, IgM, иммунофенотипирование лимфоцитов)
Проведено вирусологическое исследование для исключения виремии Эпштейн-Барр вируса, цитомегаловируса, вируса герпеса 6 типа с помощью метода ПЦР
Проведено молекулярно-генетическое исследование потенциально пораженных генов (SH2D1A, XIAP, MAGT1)
При подозрении на гемофагоцитоз выполнена костномозговая пункция
Выполнена люмбальная пункция и магнитно-резонансная томография головного мозга (при подозрении на поражение центральной нервной системы)
Проведена заместительная терапия препаратами внутривенных иммуноглобулинов
Проведена антибактериальная, противогрибковая терапии с профилактической целью на этапе наблюдения при наличии рецидивирующих инфекционных заболеваниях
Проведено семейное генетическое консультирование пациента, его непосредственной семьи, а также других родственников с целью информирования их о рисках заболевания у потомства пациента/членов семьи.
Уровень достоверности
Источник доказательств
Проспективные рандомизированные контролируемые исследования
Достаточное количество исследований с достаточной мощностью, с участием большого количества пациентов и получением большого количества данных
Как минимум одно хорошо организованное рандомизированное контролируемое исследование
Репрезентативная выборка пациентов
Проспективные с рандомизацией или без исследования с ограниченным количеством данных
Несколько исследований с небольшим количеством пациентов
Хорошо организованное проспективное исследование когорты
Мета-анализы ограничены, но проведены на хорошем уровне
Результаты не презентативны в отношении целевой популяции
Нерандомизированные контролируемые исследования
Исследования с недостаточным контролем
Рандомизированные клинические исследования с как минимум 1 значительной или как минимум 3 незначительными методологическими ошибками
Ретроспективные или наблюдательные исследования
Серия клинических наблюдений
Противоречивые данные, не позволяющие сформировать окончательную рекомендацию
Мнение эксперта/данные из отчета экспертной комиссии, экспериментально подтвержденные и теоретически обоснованные
Уровень убедительности
Описание
Расшифровка
Рекомендация основана на высоком уровне доказательности (как минимум 1 убедительная публикация I уровня доказательности, показывающая значительное превосходство пользы над риском)
Метод/терапия первой линии; либо в сочетании со стандартной методикой/терапией
Рекомендация основана на среднем уровне доказательности (как минимум 1 убедительная публикация II уровня доказательности, показывающая значительное превосходство пользы над риском)
Метод/терапия второй линии; либо при отказе, противопоказании, или неэффективности стандартной методики/терапии. Рекомендуется мониторирование побочных явлений
Рекомендация основана на слабом уровне доказательности (но как минимум 1 убедительная публикация III уровня доказательности, показывающая значительное превосходство пользы над риском) или
нет убедительных данных ни о пользе, ни о риске)
Нет возражений против данного метода/терапии или нет возражений против продолжения данного метода/терапии
Рекомендовано при отказе, противопоказании, или неэффективности стандартной методики/терапии, при условии отсутствия побочных эффектов
Отсутствие убедительных публикаций I, II или III уровня доказательности, показывающих значительное превосходство пользы над риском, либо убедительные публикации I, II или III уровня доказательности, показывающие значительное превосходство риска над пользой
![]()
ВЭБ-инфекция — одна из самых распространённых вирусных инфекций в мире. Антитела к вирусу имеет 90% взрослого населения и около 50% детского. Я очень часто сталкиваюсь с необоснованным назначением анализов на ВЭБ-инфекцию, к тому же совершенно неправильных. Нередко эта инициатива исходит от самих пациентов — непонятно, с какой целью. И уж тем более непонятно назначение лечения при обнаружении антител к вирусу или его самого в мазке из зева. Давайте разберёмся, нужны ли анализы на ВЭБ большинству пациентов.
ВЭБ-инфекция — это инфекция, вызванная вирусом Эпштейна-Барр, вирусом герпеса 4 типа. Инфицирование человека происходит в детском или подростковом возрасте. Передается инфекция воздушно-капельным, а чаще контактным (при поцелуях) путем. Поэтому ее еще называют "поцелуйной болезнью".
Заразность вируса невысокая. Чтобы произошло инфицирование, необходим тесный и длительный контакт больного и здорового человека. Тем не менее, инфекция широко распространена по всему миру.
Симптомы вируса Эпштейна-Барр
Первичное знакомство организма с ВЭБ обычно проходит бессимптомно. У подростков и молодых людей возможно развитие инфекционного мононуклеоза — это самая яркая клиническая форма ВЭБ-инфекции. Взрослые и пожилые люди инфекционным мононуклеозом болеют крайне редко.
Заболевание развивается примерно через две недели после контакта с больным человеком.
Начало обычно острое
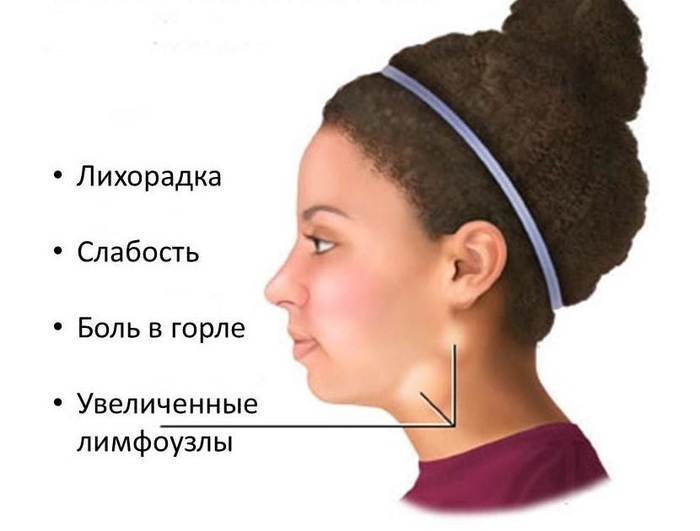
- температура свыше 38 градусов;
Характерные симптомы инфекционного мононуклеоза
1. Увеличение лимфатических узлов. Поражаются околоушные, шейные, подчелюстные узлы. Реже процесс переходит на подмышечные и паховые.
2. Второй типичный признак — ангина. Она бывает разнообразной: катаральной, фолликулярной, лакунарной. Чаще всего наблюдается не только покраснение и отек миндалин, но и налёт на них. Ангина сопровождается болями в горле, особенно при глотании.
3. У большинства пациентов увеличиваются печень и селезёнка. Они хорошо прощупываются, но не болезненны, желтуха возникает редко.
4. У 25% пациентов на коже появляется сыпь. Она может быть пятнистой или в виде мелких бугорков.
![]()
Ангина при инфекционном мононуклеозе — один из главных признаков
Заболевание продолжается 10-14 дней, затем наступает полное выздоровление. Незначительное увеличение лимфоузлов и печени сохраняется до месяца.
Повторно инфекционным мононуклеозом, вызванным ВЭБ, не болеют. Однако возможны мононуклеозоподобные состояния, вызванные цитомегаловирусом, ВИЧ, вирусом герпеса 6 и 7 типов.
![]()
Основные симптомы хронической ВЭБ-инфекции
После завершения первичной инфекции вирус остается в организме человека пожизненно. Он содержится у абсолютно здоровых людей в слюне, моче и даже крови, именно поэтому сдавать мазки на ВЭБ-инфекцию нецелесообразно. В большинстве случаев вирус находится в неактивной форме и такое состояние называют бессимптомным носительством.
Хроническая активная ВЭБ-инфекция выявляется только у людей с нарушениями иммунитета.
Проявляется она следующими симптомами
- длительное увеличение нескольких групп лимфоузлов;
- беспричинное повышение температуры в пределах 37,5 градусов;
- мышечные и суставные боли.
Установлена роль вируса в развитии злокачественных опухолей носоглотки, лимфомы Беркитта.
Диагностика вируса Эпштейна-Барр
Это основная проблема ВЭБ-инфекции. Вирус обвиняют во всевозможных состояниях и заболеваниях — аллергии, хронические тонзиллиты, гаймориты, фурункулезы, гепатиты. На самом деле ничего этого ВЭБ не вызывает. Ангина и гепатит — это проявления только первичного инфицирования, то есть инфекционного мононуклеоза. А если у человека с хроническим тонзиллитом в мазке из зева выявлен ВЭБ — это не причина заболевания. Вирус точно так же содержится в слизистой зева здорового человека.
Как же нужно диагностировать ВЭБ-инфекцию?
1. При остром инфекционном мононуклеозе можно взять мазок из зева на ДНК вируса — и это единственный случай, когда анализ будет целесообразным.
2. В общем анализе крови можно увидеть завышенные лейкоциты, лимфоциты, моноциты. Главный лабораторный признак инфекционного мононуклеоза — атипичные мононуклеары. Это незрелые моноциты, количество которых может достигать 70%. У здоровых людей этих клеток нет.
3. В биохимическом анализе крови видны завышенные печёночные ферменты — АЛТ и АСТ.
4. Серодиагностика — обнаружение антител класса М к капсидному антигену вируса. Эти антитела появляются только при первичном заражении и в дальнейшем больше не образуются. Антитела класса G к капсидному антигену сохраняются на протяжении всей жизни.
5. При остром мононуклеозе также можно взять анализ крови на ДНК вируса методом ПЦР.
6. Острый мононуклеоз — показание для обследования человека на ВИЧ.
Для диагностики хронической активной ВЭБ-инфекции используется только выявление антител к разным антигенам вируса. Только так можно установить степень активности инфекции. Исследуют антитела к раннему и капсидному антигенам вируса. При реактивации инфекции обнаруживают антитела класса М к раннему антигену и высокие титры антител класса G к ядерному антигену. Все остальные антитела — лишь следствие перенесённой когда-то острой инфекции, они не дают информации об активности вируса в настоящем.
Как лечить вирус Эпштейна-Барр?
При инфекционном мононуклеозе лечение симптоматическое. Специфических противовирусных препаратов против ВЭБ нет. Допускается назначение группы ацикловира для уменьшения проявлений ангины. Симптоматическая терапия заключается в назначении жаропонижающих средств, гепатопротекторов, витаминов. Лечение амбулаторное, госпитализация рекомендована при тяжелом течении.
Еще раз повторюсь — не надо лечить антитела в крови и вирус в мазке из зева, если нет никаких нарушений здоровья. Это абсолютно нормальное состояние для человека без иммунодефицита. К тому же противовирусных препаратов, действующих на ВЭБ, нет.
ВЭБ-инфекция клинически проявляется в виде инфекционного мононуклеоза при первичном инфицировании. В дальнейшем вирус сохраняется в организме пожизненно в неактивной форме. Хроническая активная ВЭБ-инфекция возникает лишь у людей с иммунодефицитом.
Человеку, перенесшему инфекционный мононуклеоз, нужно обратиться к участковому инфекционисту для постановки на диспансерное наблюдение. Оно проводится от 6 до 24 месяцев в зависимости от тяжести болезни. В течение полугода следует избегать переохлаждений, перегреваний, физической нагрузки. Обязательно нужно двукратно обследоваться на ВИЧ.
![]()
Герпес-вирусная инфекция. Мнение
Выкладываю с разрешения жены, врача оториноларинголога.
Статья носит ознакомительный характер, не претендует на научную точность и является личным мнением автора по итогу десятилетних наблюдений за амбулаторными (посетители поликлиник) больными, в большинстве своем детьми, маленького уездного города N.
По итогу 10 лет работы в направлении ЛОР болезней мною было отмечено, что у детей особенно часто встречается герпес-вирусная инфекция. К разновидностям герпес-вирусной инфекции относится: Вирус Эпштейн – Барр (ВЭБ), цитомегаловирус, герпес 6, 7 типа. В сети полно информацию об этих инфекциях. Но в большинстве своем большими буквами будет написано, что лечить их не нужно, они есть у всех. Нет определенных стандартов в лечении этих инфекций, затруднительна так же диагностика.
Если брать клинические рекомендации 2016 года, то при подозрении на вирусную инфекцию необходимо сдать ПЦР крови на герпесвирусы, но отрицательный результат на практике не гарантирует того, что вирус не активный. Так же предлагается сдать ИФА крови, но если по ВЭБ инфекции расшифровка понятна : присутствие иммуноглобулинов М является острым процессом и обязательно подлежит лечению, а также отсутствие иммуноглобулинов М при увеличении G (капсидные антитела больше чем ядерные, повышенные антитела к ранним белкам). Что касается цитомегаловирусной инфекции : наличие М-антител говорит об остром процессе, но их отсутствие при увеличенных G c низкоавидными антителами подлежит лечению. Так же лаборатории предлагают сдать слюну методом ПЦР, положительным результатом считаются цифры больше 500 клеток, но это можно расценить как носительство, поэтому наиболее информативно сдавать и кровь и слюну и оценивать результат.
Теперь по поводу противовирусного лечения. Существует множество противовирусных препаратов. Наиболее известные: интерфероны (виферон, кипферон, генферон, реаферон), индукторы интерферонов (изопринозин, арбидол, циклоферон), стимуляторы Т звена: тимоген, т-активин, иммунофан, вироцидные, ацикловир, валацикловир, фамвир, антибактериальная терапия, иммуноглобулины человека. Но интернет опять вам скажет, что большинство из них с недоказанной эффективностью. Чем лечить? Не лечить? Обильное питье, прогулки на свежем воздухе, проветривания, витаминотерапия-все это важно! НО этого чаще всего бывает недостаточно и организму нужно помочь медикаментозно!
ПОЧЕМУ ВИРУС НЕ СПИТ? Ведь он есть у всех и если человек заболел, то организм сам с ним должен справиться, скажет вам интернет! Согласна, но почему то у многих он не самоизлечивается. Предполагаются следующие причины: аллергия, глистные инвазии, рефлюс –эзофагит, стресс, носительство бактериальных инфекций, недостаток витамина D, врожденные иммунодефициты, железодефицитная анемия, патология тимуса.
Что касается лечения то при всех вирусных инфекциях страдает интерфероновый статус, поэтому считаю оправданным назначение интерферонов коротким курсом. Для того чтобы остановить цикл размножения герпесов нужны производные ацикловира курсом 5-7 дней. Индукторы интерферона нужны, чтобы поддержать интерфероновый статус после отмены препаратов с готовым интерфероном. Стимуляторы Т звена необходимы при нарушении его работы (только после сдачи иммунограммы). Препараты иммуноглобулина человека назначаются и имеют доказанную эффективность только при внутривенном введении (что затруднительно в амбулаторных условиях). И очень ВАЖНО выяснить и лечить причины которые мешают организму самоисцелиться (см. выше) это поможет предотвратить новый рецидив.
Герпесвирусную инфекцию должны диагностировать и лечить врачи педиатры, терапевты. Но на практике эти пациенты оказываются на приеме у Лор-врача с осложнениями, из-за трудности диагностики герпесвирусной инфекции.
Когда можно заподозрить герпесвирусную инфекцию?
1. Частые тонзиллофарингиты.
2. Длительный кашел.
3. Субфебрилитет (периодическое повышение температуры до +37/38 градусов)
4. Длительный насморк.
5. Синдром хронической усталости.
6. Частые отиты, аденоидиты.
При подозрении на герпесвирусную инфекцию необходимо сдать:
1. ПЦР крови, ИФА крови, ПЦР слюны на вирусы
2. Общий анализ крови с формулой- поможет заподозрить причины почему нет самоизлечения.
3.Мазки на флору из зева и носа с чувствительностью к антибиотикам (при присоединении бактериальных осложнений)
4.Пройти консультацию смежных специалистов инфекциониста, аллерголога -иммунолога по показаниям.
Если заинтересовало, то продолжение следует.
Структура иммунной системы
Иммунная система- совокупность органов, тканей и клеток, обеспечивающих клеточно- генетическое постоянство организма. Принципы антигенной (генетической) чистоты основываются на распознавании "своего- чужого" и в значительной степени обусловлены системой генов и гликопротеидов (продуктов их экспрессии)- главным комплексом гистосовместимости (MHC), у человека часто называемой системой HLA (human leucocyte antigens). На лейкоцитах человека четко экспрессированы белки МНС, с помощью исследования лейкоцитов типируют антигены МНС.
Органы иммунной системы.
Выделяют центральные (костный мозг- кроветворный орган, вилочковая железа или тимус, лимфоидная ткань кишечника) и периферические (селезенка, лимфатические узлы, скопления лимфоидной ткани в собственном слое слизистых оболочек кишечного типа) органы иммунитета.
Клетки- предшественники иммунокомпетентных клеток продуцируются костным мозгом. Некоторые потомки стволовых клеток становятся лимфоцитами. Лимфоциты подразделяют на два класса- Т и В. Предшественники Т- лимфоцитов мигрируют в тимус, где созревают в клетки, способные участвовать в иммунном ответе. У человека В- лимфоциты созревают в костном мозге. У птиц незрелые В- клетки мигрируют в сумку (бурсу) Фабрициуса, где достигают зрелости. Зрелые В- и Т- лимфоциты заселяют периферические лимфоузлы. Таким образом, центральные органы иммунной системы осуществляют образование и созревание иммунокомпетентных клеток, периферические органы обеспечивают адекватный иммунный ответ на антигенную стимуляцию- "обработку" антигена, его распознавание и клональную пролиферацию лимфоцитов- антиген- зависимую дифференцировку.
Иммунная система обладает особыми физиологическими механизмами функционирования (распознавание антигена, активация иммунокомпетентных клеток, их пролиферация, дифференцировка и иммунорегуляция). Если в одном или нескольких звеньях иммунной системы возникают дефекты, это приводит к иммунодефицитным состояниям.
По происхождению различают первичные (генетически обусловленные) и вторичные (возникающие в связи с инфекциями, инвазиями, опухолями, старением, ожогами, травмами и др.) иммунодефициты.
В зависимости от уровня дефекта выделяют :
- иммунодефициты, обусловленные преимущественным поражением В- звена;
- иммунодефициты, обусловленные преимущественным поражением Т- звена;
Различают также гуморальные (самые частые), клеточные и клеточно- гуморальные иммунодефициты.
Дефицит лимфоцитов, макрофагов, плазмацитов, гранулоцитов - это клеточная форма иммунодефицита. Дефицит иммуноглобулинов (антител) - это гуморальный иммунодефицит.
Первичные (врожденные) иммунодефициты.
В основе первичных (врожденных) иммунодефицитов - генетический дефект, который может реализоваться на разных стадиях развития иммунокомпетентных клеток - стволовой клетки, этапах дифференциации Т- и В- клеток, при созревании плазматических клеток. Спектр хромосомных дефектов иммунитета достаточно широк - мутации, нарушения транскрипции и трансляции, генетически детерминированные дефекты мембран клеток. Особое значение придается аномалиям короткого плеча X - хромосомы, с которыми связан механизм иммунорегуляции. С областью HLA-D сцеплены гены Ir (силы иммунного ответа) и Is (супрессии иммунного ответа). Около трети первичных иммунодефицитов сцеплены с полом и передаются по наследству.
Проблема врожденных иммунодефицитов- это преимущественно проблема педиатрии, только в последние десятилетия после разработки методов диагностики и лечения первичных иммунодефицитов стало возможным продлевать жизнь этим больным (проблема оппортунистических инфекций, опухолей и т.д.). Иммунодефициты могут быть связаны с нарушением любого из звеньев иммунитета (т.е. не только Т- и В- лимфоцитов, но и макрофагов, комплемента, главной системы гистосовместимости, интерлейкинов и др. Наиболее часто выделяют иммунодефициты, обусловленные:
- нарушениями гуморального звена иммунитета (гипо- и агаммаглобулинемии и др.;
- нарушениями функций тимуса и клеточного иммунитета;
- нарушениями в системе фагоцитоза;
- дефектами системы комплемента;
- тяжелыми комбинированными нарушениями.
Из числа первичных иммунодефицитов приведем наиболее яркие примеры.
1. Болезнь Брутона - наследственная , сцепленная с полом гипогаммаглобулинемия, обусловленная дефектом В- клеток. Болеют мальчики от клинически здоровой матери ( рецессивный тип наследственности, сцепленный с полом). Не вырабатываются антитела против бактериальных инфекций, необходима защита иммуноглобулинами и антибиотиками.
2. Швейцарская агаммаглобулинемия - тяжелый комбинированный Т- и В- иммунодефицит, связанный с нарушениями на уровне стволовой клетки. Снижено количество Т- клеток и иммуноглобулинов основных классов. Наследование аутосомно- рецессивное (болеют и мальчики и девочки) или рецессивное, сцепленное с полом. Отмечается гипоплазия тимуса и лимфоузлов, экзантемы, желудочно- кишечные расстройства и пневмонии. Дети редко доживают до трех лет, лечение- пересадкой костного мозга.
3. Синдром Луи- Бар (атаксия- телеангиэктазия). Связан с дефектом тимуса и мутациями в 7 и 14 хромосомах. Уменьшено количество Т- клеток (преимущественно Т- хелперов) и В- клеток. Клинически- нарушение координации движений, дебильность, телеангиэктазии, инфекции дыхательных путей (отсутствие IgA), опухоли лимфоидной ткани.
4. Синдром третьего и четвертого глоточных мешков (синдром Ди Джорджи). Наблюдается аплазия тимуса и паращитовидных желез. Синтез иммуноглобулинов осуществляется нормально. Клеточный иммунитет отсутствует, что делает таких больных восприимчивыми к вирусным инфекциям и грибковым поражениям. Ранний признак болезни - тетания, обусловленная дефицитом кальция.
5. Хронический гранулематоз - заболевание, связанное с нарушениями лизосомальных ферментов. Фагоцитоз осуществляется, однако киллинг и переваривание микроорганизмов не происходит, отсутствует способность восстанавливать нитросиний тетразолий (НСТ). У больных выявляют рецидивирующие стафилококковые абсцессы, отиты и другие гнойно- воспалительные заболевания. Болезнь обусловлена наследственным X - сцепленным аутосомным дефектом кислородного взрыва в нейтрофилах и моноцитах (макрофагах).
При всех формах первичных иммунодефицитов повышена частота злокачественных новообразований, особенно лимфоретикулярной системы. Опухоли иммунной системы подразделяются на В- клеточные, Т- клеточные и связанные с усиленной пролиферацией "нулевых" лимфоцитов (третьей популяции). Возникая в результате нарушения "надзорной" функции иммунитета, злокачественные опухоли сами становятся основой развития тяжелого вторичного иммунодефицита.
К общим проявлениям иммунодефицитов относятся:
- инфекционный синдром (гнойно- септические процессы связаны с нарушениями преимущественно гуморального иммунитета, оппортунистические вирусные, грибковые и протозойные заболевания - с дефектами клеточного иммунитета);
- желудочно- кишечные расстройства (нарушения всасывания, дефицит IgA, инфекции желудочно- кишечного тракта);
- опухоли иммунной системы;
- аллергический и аутоиммунный синдромы (атопии, аутоиммунные гемолитические анемии);
- частое сочетание с пороками развития (при врожденных иммунодефицитах);
- гематологические изменения (снижение количества лимфоцитов и нейтрофилов, эозинофилия, анемия, тромбоцитопения).
Вторичные (приобретенные) иммунодефициты.
Вторичные или приобретенные иммунодефициты возникают вследствие какого- либо тяжелого заболевания (т.е. как правило при ранее нормальном иммунном статусе). К основным причинам возникновения вторичных иммунодефицитов можно отнести следующие.
1. Паразитарные и протозойные болезни (описторхоз, малярия, шисто- и трипаносомозы, трихинеллез и др.).
2. Вирусные инфекции - наиболее крупная группа инфекционных агентов, вызывающих иммунодефициты:
- внутриутробные инфекции (цитомегаловирусная инфекция, краснуха);
- острые инфекции (корь, грипп, краснуха, паротит, ветряная оспа, вирусные гепатиты);
- персистирующие (гепатит В и С, герпес);
- инфекции иммунной системы (ВИЧ, ЦМВ, вирус Эпштейн - Барр).
3. Бактериальные инфекции (туберкулез, сифилис, лепра).
4. Хирургические вмешательства, травмы.
6. Нарушения обмена веществ (сахарный диабет) и истощение (голодание).
7. Заболевания органов выделения (уремия).
9. Хронические соматические заболевания.
10. Действие лекарств, экологических и производственных факторов, радиации.
Кратко дадим характеристику основных видов вторичных иммунодефицитов.
Дефекты иммунного статуса при паразитарных и протозойных заболеваниях связаны с рядом механизмов :
- угнетением функции макрофагов (малярия);
- выработкой лимфоцитотоксинов (описторхоз, трихинеллез);
- выработкой супрессивно действующих факторов (трипано- и шистосомозы);
- различными нарушениями иммунорегуляции.
Иммунодефициты при бактериальных инфекциях. Часто наблюдается снижение Т- лимфоцитов и митогенной активности на фитогемагглютинин (ФГА)- лепра, туберкулез, сифилис, пневмококковые инфекции, коклюш, бруцеллез, скарлатина). При стрепто- и стафилококковых инфекциях подавление Т- звена иммунитета часто сочетается с повышением функции В- системы и формированием инфекционно- аллергических и аутоиммунных осложнений (заболеваний).
Иммунодефициты при вирусных инфекциях. Многие вирусы вызывают резкое угнетение Т- звена иммунитета ( вирусы кори, краснухи, гриппа, паротита). При кори и гриппе это нарушение сочетается с дефектами фагоцитоза, что еще более угнетает противомикробную защиту и способствует присоединению бактериальных осложнений. Однако наиболее существенные нарушения иммунной системы вызывают вирусы, непосредственно поражающие иммунную систему.
1. Вирус иммунодефицита человека (ВИЧ) вызывает заболевание, которое называют "синдром приобретенного иммунодефицита (СПИД)". Этот вирус относится к ретровирусам и имеет тропизм к клеткам иммунной системы и некоторым другим клеткам, несущим CD4+ рецептор. CD4 является фактически рецептором для ВИЧ, благодаря которому РНК вируса попадает (инфицирует) клетки, формирует ДНК- копию, которая встраивается в ДНК (геном) клетки хозяина и получает возможность реплицироваться. Вирус оказывает на клетки цитопатический эффект, вызывая поражение Т- хелперов и других СД4+ клеток, снижение индекса CD4/CD8, глобальный дефект гуморального и клеточного иммунитета в сочетании с поликлональной активацией В- лимфоцитов, резкое ослабление противоинфекционной и противоопухолевой защиты. Парадокс- прогрессирование болезни (иммунодефицита) на фоне активного антительного ответа и ГЗТ на ВИЧ. На этом фоне присоединяются оппортунистические (СПИД- ассоциированные) вторичные инфекции и инвазии (ЦМВ, гепрес, пневмоцистоз, токсоплазмоз, микоплазмоз и др.).
2. Цитомегаловирус. ЦМВ инфекция приводит к резкому снижению CD4+ Т- лимфоцитов и гиперактивности CD8+ Т- клеток, угнетению клеточного иммунитета. ЦМВ относится к семейству герпес- вирусов , часто вызывающих персистентные инфекции и развитие вторичных иммунодефицитов.
3. Вирус Эпштейн- Барр вызывает инфекционный мононуклеоз. Рецептором для этого вируса является CD21- рецептор, поэтому поражаются преимущественно В- клетки. Эти же рецепторы имеются на дендритных клетках лимфоидных фолликулов, цервикальном эпителии. СД21 рецептор является местом присоединения С3d- компонента комплемента. Присоединение к рецептору вируса Эпштейн- Барр вызывает экспрессию на мембране В- лимфоцитов особого антигена, распознаваемого СД8+ лимфоцитами как чужеродного. В результате В- клетки становятся мишенью для собственных Т- клеток. В крови определяется атипичный Т- лимфоцитоз, бласттрансформация В- клеток, выработка гетерофильных антител. Формируется сложный иммунодефицит с элементами аутоагрессии.
Иммунодефициты при ожогах усугубляют опасность инфекционных осложнений. В первые дни преобладает снижение иммуноглобулинов основных классов (особенно IgG). В дальнейшем действие ожоговых антигенов приводит к В- клеточной стимуляции. Отмечено снижение ряда показателей Т- клеточного иммунитета в результате действия ожоговых токсинов- CD3+ и CD4+ клеток, ингибируется фагоцитоз, снижается активность комплемента. Прогностически неблагоприятен дисбаланс соотношения CD4/CD8.
Иммунодефициты, связанные с недостаточностью питания, голоданием, нарушениями обмена веществ.
При сахарном диабете возникает предрасположенность к бактериальным инфекциям, связанная с нарушением функций лейкоцитов- хемотаксиса, адгезивных и бактерицидных свойств.
Дефицит белка в организме также повышает восприимчивость к инфекциям. Угнетается первичный иммунный ответ (синтез IgM), фагоцитарная активность клеток, митогенная активность (по данным РБТЛ с ФГА).
Дефицит микроэлементов существенно сказывается на иммунной системе. Дефицит железа ведет к снижению активности железосодержащих ферментов, Т- звена, уровня миелопероксидазы и АФК. Дефицит цинка ведет к гипофункции тимуса со снижением CD4+ Т- лимфоцитов, ответа на митогены, активности NK клеток, фагоцитарного звена. Дефицит лития ведет к недостаточности Т- лимфоцитов, особенно CD8+ клеток. Существенно сказывается на иммунную систему дефицит меди, селена, кальция, магния. С дефицитом магния связаны нарушения синтеза антител, активации системы комплемента.
Лекарственные иммунодефициты связаны преимущественно с их иммунотоксическим действием. Достаточно часто отмечается активация Т- супрессоров, уменьшение количества В- клеток, снижение IgA. Существенное влияние на иммунный статус оказывают антибиотики, даже при коротких циклах применения, прежде всего - пенициллины, тетрациклины, стрептомицин, противотуберкулезные и антигрибковые препараты. Они вызывают :
- дефекты формирования первичного иммунного ответа (скорости образования клона плазматических клеток и антителообразования);
- снижение противовирусной защиты;
- снижение цитотоксической активности Т- лимфоцитов;
- уменьшение фагоцитарной активности нейтрофилов и макрофагов.
Около 70 тысяч химических соединений, связанных с производственной деятельностью и нарушениями экологической обстановки относятся к разряду токсических и оказывают разнообразное действие на иммунную систему.
Существенное влияние на иммунную систему оказывает стресс. Начальный период острого стресса характеризуется снижением противоопухолевого и противоинфекционного иммунитета, в дальнейшем могут присоединяться аутоиммунные и аллергические реакции. Хронический стресс неизбежно приводит к формированию вторичного иммунодефицита.
Существенное меняется иммунный статус при старении. Отмечается инволюция тимуса, снижается уровень тимического фактора. С возрастом снижается активность клеточного иммунитета, страдают этапы распознавания антигена, пролиферативная активность Т- клеток, изменяется CD4/CD8 индекс в сторону супрессорной активности, страдают надзорные функции противоопухолевой защиты.
В отличии от первичных иммунодефицитов, вторичные иммунодефициты в большинстве случаев не носят необратимого характера и функции иммунной системы могут восстанавливаться, если прекращается действие факторов, обословивших иммунодефицит.
Читайте также:
 Пожалуйста, не занимайтесь самолечением!При симпотмах заболевания - обратитесь к врачу.
Пожалуйста, не занимайтесь самолечением!При симпотмах заболевания - обратитесь к врачу.