Иммунитет антибактериальный антитоксический противовирусный
Сайт СТУДОПЕДИЯ проводит ОПРОС! Прими участие :) - нам важно ваше мнение.
Реакция макроорганизма на антигены однотипна, так как ограничена набором факторов иммунной защиты. Но в зависимости от природы антигена иммунная система использует лишь наиболее эффективные в отношении конкретного антигена. Поэтому характер иммунного реагирования макроорганизма имеет особенности при воздействии различных антигенов.
Антибактериальный иммунитет. Бывает против структурных компонентов бактериальной клетки и антитоксический - против экзотоксинов.
Основными факторами антибактериальной защиты являются антитела и фагоциты. Антитела инактивируют биологически активные молекулы бактериальной клетки (токсины, ферменты агрессии и др.), запускают механизм комплементзависимого бактериолиза и участвуют в иммунном фагоцитозе. Бактерии, устойчивые к действию комплемента, лизоцима и фагоцитов (микобактерии, бруцеллы, сальмонеллы) приводят к хроническому течению инфекции. В такой ситуации макроорганизм вынужден переключать нагрузку на клеточное звено иммунитета: активируются Т-киллеры, что ведет к аллергизации организма и формированию специфической реакции ГЗТ.
Противогрибковый иммунитет. Антигены грибов имеют низкую иммуногенность. Они практически не индуцируют антителообразование (титры антител низкие), но стимулируют клеточное звено иммунитета. Основными факторами являются Т-киллеры и фагоциты, которые осуществляют антителозависимый лизис грибов. Кожные и глубокие микозы сопровождаются, реакцией ГЗТ, грибковые поражения слизистых оболочек дыхательных и мочеполовых путей вызывают аллергизацию по типу ГНТ .
Противопаразитарный иммунитет определяется особенностями жизненного цикла паразита, что обеспечивает большую антигенную изменчивость и это позволяет им избегать действия факторов иммунитета. Паразитарная инвазия сопровождается формированием гуморального и клеточного иммунитета. Специфические антитела классов М и G не обладают протективным действием. Активируются Т-киллеры ( ГЗТ) и фагоцитоз.
Трансплантационный иммунитет. Иммунная реакция на чужеродные клетки и ткани обусловлена тем, что в их составе содержатся генетически чужеродные для организма антигены гистосовместимости. Основным фактором являются Т-киллеры, которые мигрируют в пересаженную ткань (трансплантат) и оказывают цитолитическое действие. Сначала вокруг трансплантата и сосудов наблюдается лимфоидная инфильтрация, а затем при действии Т-киллеров возникают воспаление и тромбоз кровеносных сосудов, нарушается питание трансплантата и последний гибнет. Погибшие клетки утилизируются фагоцитами. При этом формируется клон Т-клеток памяти. Повторная попытка пересадки тех же органов и тканей заканчивается реакцией отторжения трансплантата - криз отторжения.
Противоопухолевый иммунитет. Мутантные и раково-трансформированные клетки отличаются от нормальных антигенным составом (измененные антигены гистосовместимости, раково-эмбриональные антигены), которые вызывают клеточные и гуморальные реакции. Основную роль играют клеточные реакции. Мутантные клетки распознаются и уничтожаются Т-киллерами, раково-трансформированные клетки - естественными киллерами.
Гуморальный иммунитет имеет второстепенное значение и не всегда играет защитную роль. Специфические антитела могут экранировать антигены опухолевых клеток от иммунных лимфоцитов.
Серологические методы диагностики: реакции антиген – ангтитело.
Реакция in vitro между антигеном и антителом двухфазная — специфическая и неспецифическая фазы. В специфическую фазу происходит быстрое специфическое связывание активного центра антитела с соответствующим эпитопом антигена. Неспецифическая фаза протекает в присутствии электролитов или других веществ и проявляется разнообразными явлениями: образованием хлопьев (агглютината), помутнения (преципитата) и т.д.
При диагностике заболеваний применяют серологические реакции (от лат. serum - сыворотка и logos - учение), т.е. методы изучения антител и антигенов на основе их комплементарного взаимодействия.
При выделении микроба от больного проводят идентификацию возбудителя путем изучения его антигенных свойств с помощью иммунных диагностических сывороток. Это серологическая идентификация микроорганизмов. При заболевании определяют в сыворотке больного наличие специфических АТ –серодиагностика заболеваний.
Используются разнообразные реакции, но все они основаны на реакции взаимодействия антигена с антителом и применяются для выявления как антител, так и антигенов.
Реакция агглютинации (РА) — простая реакция, при которой происходит связывание антителами корпускулярных антигенов (бактерий, эритроцитов и других клеток) с образованием хлопьев или осадка в присутствии электролита. Применяются различные варианты реакции агглютинации: развернутая, ориентировочная, непрямая и др. Для определения возбудителя пользуются известными агглютинирующими сыворотками, для определения специфических антител в сыворотке больных применяют известные АГ -диагностикумы.
РПГА основана на использовании эритроцитов (или латекса) с адсорбированными на их поверхности антигенами, взаимодействие которых с комплементарными антителами сыворотки крови вызывает их склеивание, что проявляется выпадением эритроцитов на дно лунки в виде фестончатого осадка.
Реакция преципитации - это осаждение растворимого молекулярного антигена специфическими антителами. Осадок называется преципитатом. Реакцию проводят в пробирках, наслаивая растворимый антиген на иммунную сыворотку. При комплементарности антигена и антител на границе этих двух растворов образуется кольцо преципитата (реакция кольцепреципитации). При постановке реакции радиальной иммунодиффузии (по Манчини) иммунную сыворотку вносят в агаровый гель. В лунки геля помещают исследуемые сыворотки, где в качестве АГ выступает определенный класс Ig. Они, диффундируя в гель, преципитируются антиглобулиновой сывороткой и образут кольца преципитации вокруг лунок. Диаметр кольца преципитации пропорционален концентрации Ig.
Реакция нейтрализации (РН). Антитела иммунной сыворотки нейтрализуют действие бактериальных токсинов на чувствительные организмы и отдельные клетки. Реакцию проводят путем введения смеси токсин - антитело животным или на культуру клеток. При отсутствии повреждающего действия токсинов говорят о нейтрализующем действии иммунной сыворотки и, следовательно, о специфичности взаимодействия комплекса антиген - антитело.
РН высоко чувствительна и специфична, однако требует наличия лабораторных животных или КК, и длительного наблюдения (от нескольких дней до неск.недель), что снижает возможности его использования.
1-я - (специфическая) инкубация смеси, содержащей антиген + антитело + комплемент; 2-я фаза (индикаторная) - выявление в смеси свободного комплемента путем добавления к ней гемолитической системы, состоящей из эритроцитов барана и гемолитической сыворотки.
Если образуется специфический комплекс антиген - антитело им активируется комплемент и во 2-й фазе гемолиз эритроцитов не произойдет (реакция положительная). Если антиген и антитело несоответствуют друг другу комплемент остается свободным и во 2-й фазе запускает реакцию гемолиза (реакция отрицательная).
| | | следующая лекция ==> | |
| Динамика образования АТ, первичный и вторичный ИО | | | ВАКЦИНОПРОФИЛАКТИКА |
Нам важно ваше мнение! Был ли полезен опубликованный материал? Да | Нет
Основным механизмом антибактериального иммунитета является фагоцитоз. Фагоциты направленно перемещаются к объекту фагоцитоза, реагируя на хемоаттрактанты: вещества микробов, активированные компоненты комплемента (С5а, С3а) и цитокины. Противобактериальная защита слизистых оболочек обусловлена секреторными IgA, которые, взаимодействуя с бактериями, препятствуют их адгезии на эпителиоцитах.
Противогрибковый иммунитет. Антитела (IgM, IgG) при микозах выявляются в низких титрах. Основой противогрибкового иммунитета является клеточный иммунитет. В тканях происходит фагоцитоз, развивается эпителиоидная гранулематозная реакция, иногда тромбоз кровеносных сосудов. Микозы, особенно оппортунистические, часто развиваются после длительной антибактериальной терапии и при иммунодефицитах. Они сопровождаются развитием гиперчувствительности замедленного типа. Возможно развитие аллергических заболеваний после реcпираторной сенсибилизации фрагментами условно-патогенных грибов родов Aspergillus, Penicillium, Mucor, Fusarium и др.
Противоопухолевый иммунитет основан на Th1-зависимом клеточном иммунном ответе, активирующем цитотоксические Т-лимфоциты, макрофаги и NK-клетки. Роль гуморального (антительного) иммунного ответа невелика, поскольку антитела, соединяясь с антигенными детерминантами на опухолевых клетках, экранируют их от цитопатогенного действиях иммунных лимфоцитов. Опухолевый антиген распознается антигенпрезентирующими клетками (дендритными клетками и макрофагами) и непосредственно или через Т-хелперы (Th1) представляется цитотоксическим Т-лимфоцитам, разрушающим опухолевую клетку-мишень.
Кроме специфического противоопухолевого иммунитета, иммунный надзор за нормальным составом тканей реализуется за счет неспецифических факторов. Неспецифические факторы, повреждающие опухолевые клетки: 1) NK-клетки, система мононуклеарных клеток, противоопухолевая активность которых усиливается под воздействием интерлейкина-2 (ИЛ-2) и ?-, ?-интерферонов; 2) ЛАК-клетки (мононуклеарные клетки и NK-клетки, активированные ИЛ-2); 3) цитокины (? - и ? -интерфероны, ФНО- ? и ИЛ-2).
Трансплантационным иммунитетом называют иммунную реакцию макроорганизма, направленную против пересаженной в него чужеродной ткани (трансплантата). Знание механизмов трансплантационного иммунитета необходимо для решения одной из важнейших проблем современной медицины — пересадки органов и тканей. Многолетний опыт показал, что успех операции по пересадке чужеродных органов и тканей в подавляющем большинстве случаев зависит от иммунологической совместимости тканей донора и реципиента.
Иммунная реакция на чужеродные клетки и ткани обусловлена тем, что в их составе содержатся генетически чужеродные для организма антигены. Эти антигены, получившие название трансплантационных или антигенов гистосовместимости, наиболее полно представлены на ЦПМ клеток.
Реакция отторжения не возникает в случае полной совместимости донора и реципиента по антигенам гистосовместимости — такое возможно лишь для однояйцовых близнецов. Выраженность реакции отторжения во многом зависит от степени чужеродности, объема трансплантируемого материала и состояния иммунореактивности реципиента.
При контакте с чужеродными трансплантационными антигенами организм реагирует факторами клеточного и гуморального звеньев иммунитета. Основным фактором клеточного трансплантационного иммунитета являются Т-киллеры. Эти клетки после сенсибилизации антигенами донора мигрируют в ткани трансплантата и оказывают на них антителонезависимую клеточно-опосредованную цитотоксичность.
Специфические антитела, которые образуются на чужеродные антигены (гемагглютинины, гемолизины, лейкотоксины, цитотоксины), имеют важное значение в формировании трансплантационного иммунитета. Они запускают антителоопосредованный цитолиз трансплантата (комплемент-опосредованный и антителозависимая клеточно-опосредованная цитотоксичность).
Возможен адоптивный перенос трансплантационного иммунитета с помощью активированных лимфоцитов или со специфической антисывороткой от сенсибилизированной особи интактному макроорганизму.
Механизм иммунного отторжения пересаженных клеток и тканей имеет две фазы. В первой фазе вокруг трансплантата и сосудов наблюдается скопление иммунокомпетентных клеток (лимфоидная инфильтрация), в том числе Т-киллеров. Во второй фазе происходит деструкция клеток трансплантата Т-киллерами, активируются макрофагальное звено, естественные киллеры, специфический антителогенез. Возникает иммунное воспаление, тромбоз кровеносных сосудов, нарушается питание трансплантата и происходит его гибель. Разрушенные ткани утилизируются фагоцитами.
В процессе реакции отторжения формируется клон Т- и В-клеток иммунной памяти. Повторная попытка пересадки тех же органов и тканей вызывает вторичный иммунный ответ, который протекает очень бурно и быстро заканчивается отторжением трансплантата.
С клинической точки зрения выделяют острое, сверхострое и отсроченное отторжение трансплантата. Различаются они по времени реализации реакции и отдельным механизмам.
Иммунологическая память. При повторной встрече с антигеном организм формирует более активную и быструю иммунную реакцию — вторичный иммунный ответ. Этот феномен получил название иммунологической памяти.
Иммунологическая память имеет высокую специфичность к конкретному антигену, распространяется как на гуморальное, так и клеточное звено иммунитета и обусловлена В- и Т-лимфоцитами. Она образуется практически всегда и сохраняется годами и даже десятилетиями. Благодаря ней наш организм надежно защищен от повторных антигенных интервенций.
На сегодняшний день рассматривают два наиболее вероятных механизма формирования иммунологической памяти. Один из них предполагает длительное сохранение антигена в организме. Этому имеется множество примеров: инкапсулированный возбудитель туберкулеза, персистирующие вирусы кори, полиомиелита, ветряной оспы и некоторые другие патогены длительное время, иногда всю жизнь, сохраняются в организме, поддерживая в напряжении иммунную систему. Вероятно также наличие долгоживущих дендритных АПК, способных длительно сохранять и презентировать антиген.
Другой механизм предусматривает, что в процессе развития в организме продуктивного иммунного ответа часть антигенореактивных Т- или В-лимфоцитов дифференцируется в малые покоящиеся клетки, или клетки иммунологической памяти. Эти клетки отличаются высокой специфичностью к конкретной антигенной детерминанте и большой продолжительностью жизни (до 10 лет и более). Они активно рециркулируют в организме, распределяясь в тканях и органах, но постоянно возвращаются в места своего происхождения за счет хоминговых рецепторов. Это обеспечивает постоянную готовность иммунной системы реагировать на повторный контакт с антигеном по вторичному типу.
Феномен иммунологической памяти широко используется в практике вакцинации людей для создания напряженного иммунитета и поддержания его длительное время на защитном уровне. Осуществляют это 2—3-кратными прививками при первичной вакцинации и периодическими повторными введениями вакцинного препарата — ревакцинациями.
Однако феномен иммунологической памяти имеет и отрицательные стороны. Например, повторная попытка трансплантировать уже однажды отторгнутую ткань вызывает быструю и бурную реакцию — криз отторжения.
Иммунологическая толерантность — явление, противоположное иммунному ответу и иммунологической памяти. Проявляется она отсутствием специфического продуктивного иммунного ответа организма на антиген в связи с неспособностью его распознавания.
В отличие от иммуносупрессии иммунологическая толерантность предполагает изначальную ареактивность иммунокомпетентных клеток к определенному антигену.
Иммунологическую толерантность вызывают антигены, которые получили название толерогены. Ими могут быть практически все вещества, однако наибольшей толерогенностью обладают полисахариды.
Иммунологическая толерантность бывает врожденной и приобретенной. Примером врожденной толерантности является отсутствие реакции иммунной системы на свои собственные антигены. Приобретенную толерантность можно создать, вводя в организм вещества, подавляющие иммунитет (иммунодепрессанты), или же путем введения антигена в эмбриональном периоде или в первые дни после рождения индивидуума. Приобретенная толерантность может быть активной и пассивной. Активная толерантность создается путем введения в организм толерогена, который формирует специфическую толерантность. Пассивную толерантность можно вызвать веществами, тормозящими биосинтетическую или пролиферативную активность иммунокомпетентных клеток (антилимфоцитарная сыворотка, цитостатики и пр.).
Иммунологическая толерантность отличается специфичностью — она направлена к строго определенным антигенам. По степени распространенности различают поливалентную и расщепленную толерантность. Поливалентная толерантность возникает одновременно на все антигенные детерминанты, входящие в состав конкретного антигена. Для расщепленной, или моновалентной, толерантности характерна избирательная невосприимчивость каких-то отдельных антигенных детерминант.
Степень проявления иммунологической толерантности существенно зависит от ряда свойств макроорганизма и толерогена.
Важное значение в индукции иммунологической толерантности имеют доза антигена и продолжительность его воздействия. Различают высокодозовую и низкодозовую толерантность. Высокодозовую толерантность вызывают введением больших количеств высококонцентрированного антигена. Низкодозовая толерантность, наоборот, вызывается очень малым количеством высокогомогенного молекулярного антигена.
Механизмы толерантности многообразны и до конца не расшифрованы. Известно, что ее основу составляют нормальные процессы регуляции иммунной системы. Выделяют три наиболее вероятные причины развития иммунологической толерантности:
1. Элиминация из организма антигенспецифических клонов лимфоцитов.
2. Блокада биологической активности иммунокомпетентных клеток.
3. Быстрая нейтрализация антигена антителами.
Феномен иммунологической толерантности имеет большое практическое значение. Он используется для решения многих важных проблем медицины, таких как пересадка органов и тканей, подавление аутоиммунных реакций, лечение аллергий и других патологических состояний, связанных с агрессивным поведением иммунной системы.
У большинства россиян представление об иммунитете складывается под влиянием рекламных роликов. Средства для его поддержания и укрепления предлагают в виде йогуртов, творожков, витаминов, употребляя которые можно начисто забыть обо всех болячках. На самом деле, состояние иммунной системы зависит не только от приема кисломолочного продукта или биологической добавки. Более того, при изобилии всех широко рекламируемых средств для укрепления иммунитета, особенно лекарственных, таких как иммуномодуляторы и иммуностимуляторы, к их применению нужно подходить крайне осторожно. Зачастую громкие слова о чудодейственных продуктах - просто ловкий рекламный ход.
Понятие иммунитета
Иммунитет - это механизм действия иммунных клеток, направленный на поддержание постоянства внутренней среды организма, сформированный с целью защиты от инфекций и вирусов и выработки методов противостояния воздействию последних при их проникновении.
Виды иммунитета
Виды иммунитета имеют множество классификаций по различным признакам.
В первую очередь, разделяют врожденный и приобретенный виды иммунитета.
Врожденный тип обусловлен наследственностью, передается через плаценту с кровью матери, при грудном вскармливании с молоком.
Приобретенный иммунитет формируется на протяжении жизни человека. Факторами влияния являются окружающая среда с ее бактериями, перенесенные инфекции. Данный вид предполагает деление на активный иммунитет, который модулируется при помощи запоминания иммунными клетками возбудителя заболевания, и пассивный, когда в организм вводятся уже готовые антитела при помощи вакцин и сывороток.
Локально иммунитет подразделяют на общий и местный. Общая иммунная система охватывает защитой весь организм, местная - определенный орган.
По действию различают гуморальный и клеточный иммунитет.
По направлениям выделяют противоинфекционный, противоопухолевый и трансплантационный иммунитет.
К одному из видов противоинфекционного иммунитета относят иммунитет антитоксический.
Антитоксический тип иммунной реакции
Антитоксический иммунитет направлен на обезвреживание отравляющих веществ, выделяемых возбудителями таких заболеваний как дифтерия, столбняк, газовая гангрена, ботулизм, полиомиелит, дизентерия. Его защитные свойства основаны на действии иммуноглобулина G. Именно он строит защиту от токсического воздействия зловредных микроорганизмов, вырабатывая к каждому свои определенные антитела. Иммуноглобулин G также обладает памятью, и если в организм повторно подвергся интоксикации одним и тем же вирусом, он достаточно быстро удалит его.
Способ воздействия и особенности антитоксинов
Антитоксический иммунитет обусловлен действиями антитоксинов, которые вырабатываются в ответ на отравляющее влияние токсинов, выделяемых микроорганизмами-разносчиками инфекции, подавляя активность их токсических свойств.
Немецкий ученый П. Эрлих разработал схему, которая отображает принцип действия антитоксинов на токсины. Отравляющее действие токсина происходит в том случае, когда он сумел прицепиться к живому веществу в крови. Если такое соединение произошло, живой элемент крови подвергается ядовитому влиянию токсина.

Звенья живого элемента с присоединившимся чуждым токсином действуют в организме далеко не в этом направлении, поэтому соединяющие части, занятые токсинами, иммунная система начинает заменять новыми. Эти новые звенья и есть антитоксины. В спайке с токсином, они подавляют действие последнего на живое вещество.
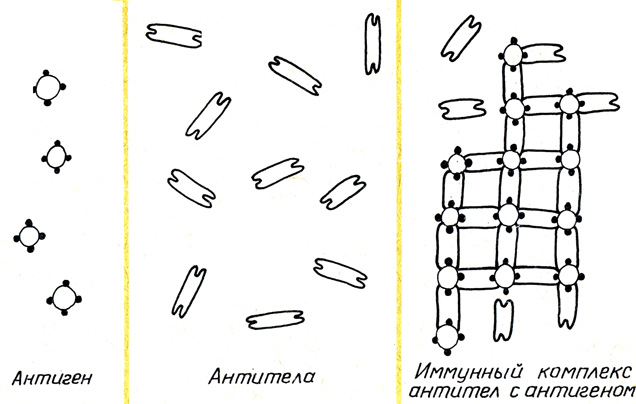
Отсюда была выведена главная особенность антитоксического иммунитета: антитела (антитоксины) не убивают антиген, а нейтрализуют его токсические свойства. Исследования Эрлиха дали новую характеристику видам иммунитета. Он стал разделяться на клеточный (открытый ранее И. Мечниковым) и гуморальный, который образуется в плазме крови.
Использование антитоксинов в медицине
Не всегда вырабатываемых самим организмом антител хватает на подавление токсического воздействия антигенов. Немецким иммунологом-микробиологом А. Берингом и французом Э. Ру на основе исследований Эрлиха была изобретена антитоксическая сыворотка. На ранних стадиях такого заболевания как дифтерия пациенту вводятся антитела к дифтерийному токсину, и при их помощи больной успешно справляется с болезнью.
В общих чертах, антидифтерийная сыворотка представляет собой жидкость, содержащую большое число антитоксинов. Добывается она при участии лошадей, устойчивых к дифтерии. Животному впрыскивается дифтерийный антиген до тех пор, пока животное не начинает вырабатывать огромное количество антител к нему. Такая кровяная сыворотка с высокой концентрацией антител к дифтерии является мощным оружием против этой ядовитой инфекции.

Такой же метод лечения используется и при остальных инфекционных заболеваниях, таких как столбняк, дизентерия и др. Больным вводится сыворотка с высоким содержанием антитоксинов к отравляющим антигенам болезни.
Механизмы выработки антитоксической иммунной реакции
Эта форма иммунной реакции не является наследственной, способной передаваться от матери плоду. Антитоксический иммунитет - приобретенный, вырабатывается при внедрении отравляющих антигенов естественным или искусственным путем. Естественным образом антитоксическая защита приобретается при перенесении высокотоксикогенных инфекционных заболеваний, когда самостоятельная выработка организмом антитоксинов является ответом на ядовитое воздействие возбудителей.
Искусственно антитоксический иммунитет вырабатывается при введении вакцин или анатоксина, а также иммунных сывороток.
Напряженность иммунитета
Риск поражения организма инфекционным заболеванием зависит от количества антител, вырабатываемых в жидкой части крови против этого заболевания. Устойчивость организма к возбудителям называют напряженностью иммунитета.
Уровень устойчивости анализируется отдельно к каждой болезни и определяется количеством производимых антитоксинов. К примеру, если 1/30 в составе 1 мл крови составляет антитоксин против дифтерии, то можно уверенно говорить об отсутствии риска поражения инфекцией.
В заключении надо отметить, что иммунологией антитоксическому иммунитету отводится свое почетное место, поскольку изучение его механизмов действия и выработки дало возможность избавления человечества от таких смертельно опасных заболеваний как дифтерия, столбняк, дизентерия, ботулизм, газовая гангрена и др.
Здоровая иммунная система постоянно защищает организм человека от самых разных болезнетворных угроз. Но стоит иммунитету снизить свои функции, начинают развиваться заболевания. Переболев каким-либо заболеванием или проведя вакцинирование против болезни, вызываемой соответствующим патогенным микроорганизмом, иммунная защита вырабатывает противоинфекционный и антитоксический иммунитет.

Иммунитет, его виды
Сложная совокупная система специфических механизмов, реакций и барьеров, направленных на защиту и сохранения здоровья человека называется иммунитетом.
Иммунную конструкцию составляют специальные органы и клетки.
Видовое подразделение иммунных сил определяется как:
- Врожденный потенциал — самая сильная форма защитных реакций, передающаяся из поколения в поколение. Обладает быстрой реакцией, способен блокировать инфекционный процесс, не дав ему распространится. Специальные рецепторные компоненты запускают процессы по разрушению патогена;
- Приобретенный потенциал — резистентность, приобретаемая на протяжении всей жизни, но не имеет наследственных параметров. Он действует медленнее, чем врожденный, но способствует адаптации и обучению иммунных клеток, предоставляя возможность формированию антител и клеток-киллеров.
По формам иммунологической приобретенной защиты выделяют:
- Естественную сопротивляемость, проявляющеюся пассивно, то есть это вид иммунитета новорожденных, защищающий его от пагубного воздействия окружающей среды до года, или активно, способ невосприимчивости, вырабатывающийся после перенесения инфекционных и неинфекционных заболеваний;
- Искусственную устойчивость, которая приобретается пассивным способом, благодаря введению иммуноглобулинов с сывороток, содержащих активные антитела, или активным, проявляющимся через прививочные методики, провоцирующие организм на образование соответствующей защиты в виде антител.
Иммунную защиту рассматривают по совокупности действий и механизмов, распределяя на:
- Общие процессы защиты — иммунные клетки, циркулирующие в крови;
- Местные источники обороны — защитные механизмы локализованные в определенном органе.

Общий иммунитет
Общий иммунитет создает защиту для всего организма путем распространения иммунных клеток через кровоток:
- Фагоциты — иммунологические клеточные элементы, которые обеспечивают защиту организма, используя систему фагоцитоза: поглощения вредоносных объектов, погибших, зараженных и собственных мутировавших клеток;
- Антитела — иммуноглобулиновые белковые соединения, находящиеся в плазме кровеносной системы, которые образуются в качестве ответной реакции на появление возбудителя.
Иммуноглобулины подразделяются на типы:
- М — самый крупный тип, является главным действующим механизмом при выработке первичного иммунного ответа, так же определяют принадлежность человека к той или иной группе крови;
- G – образуются после перенесения заболевания или при повторном заражении соответствующей инфекцией;
- А — располагается в крови, слизистых секретах и ферментах, обеспечивая своевременную защиту местного иммунитета;
- Е — синтезируются в плазме для участия в быстрых аллергических реакциях;
- Д — способствует активации распознающей функции лимфоцитов типа В.

Местный иммунитет
Местный иммунитет, или локальный, функционирует в местах непосредственного контакта с окружающим миром. Его клетки, механизмы и барьеры имеют направленное действие для обеспечения защиты организма от внедрения вирусов, бактерий, других вредоносных микроорганизмов.
Главными исполнителями защитных функции локального иммунитета являются: секреторные выделения, слизь, слюна, слезы, ферменты, в состав которых входят различные макрофаги, интерфероны, естественная микрофлора кожи и внутренних органов и систем, эпителиальные и другие клетки.
Видовое разнообразие
Так же в иммунологической практике рассматривается видовое подразделение иммунологических механизмов по влиянию соответствующих антигенов.
Антигены — это молекулы генетически чужеродного вида, имеющие способность связываться с антителами организма. Антигены непосредственно вызывают иммунологический ответ на свое присутствие.
- Экзогенные — начинают свое развитие после непосредственного попадания из окружающего мира с водой, пищей, воздухом;
- Эндогенные — образование которых связано с деятельностью инфекции вирусного или бактериального характера;
- Аутоантигенные — развиваются при наличии аутоиммунного заболевания.
Иммунная защита, которая приобретается после инфицирования определенным патогенным возбудителем и выработки специфических средств защитными механизмами, является противоинфекционной защитой организма.
Антимикробный иммунитет обусловлен деятельность организма направленной на уничтожение чужеродных микроорганизмов при заражении или вакцинировании. Различают по развитию защитного механизма:
- Антибактериальный;
- Противовирусный;
- Антипаразитарный;
- Противогрибковый;
- Атитоксический.

Антибактериальная защита
Иммунитет против бактериальной инфекции вырабатывается под действием внедрения бактерий. Главными механизмами бактериальной защиты являются:
- Лизоцим — агент антибактериального направления, специализирующийся на разрушении клеточной стенки бактерии;
- Система комплимента — протеолитическая ферментная конструкция, состоящая из сложных белков, постоянно присутствующая в жидкости крови;
- Лизинов типа В — незаменимый вид аминокислоты, входящий в состав белков, производящих антитела, ферменты, альбумины, имеющие противобактериальное свойство;
- Фагоцитов — клетки, предназначенные для окружения и поглощения бактерии, после ее связывания специфическими рецепторами;
Реакции специфического иммунитета — механизмы и реакции, направленные на уничтожение бактерии на гуморальном и клеточном уровне.
Наличие противобактериальной защиты оценивается по количеству иммуноглобулинов типа G и М в крови, по уровню неспецифических клеток, имеющих антибактериальное действие.
Иммунитет вырабатывается через вакцинацию, введение специальных сывороток и после заражения.

Противовирусная защита
Противовирусная структура защитных механизмов связана с особенностью вирусного размножения и патогенеза болезней.
Такой вид иммунитета основан на действии специальных:
- Неспецифических ингибиторов противовирусной природы, подавляющих вирусы, находящиеся не в кровяной жидкости;
- Нуклеазидов — клетки, блокирующие ДНК и РНК вируса;
- Иммуноглобулины — вещества, имеющие противовирусный нейтрализатор, способствует выработке антител;
- Лимфоцитов типа В и Т — главные иммунные клетки, обеспечивающие клеточный и гуморальный иммунитет, воздействуют на развитие притивовирусного иммунитета;
- Интерферонов — белковые соединения, выделяемые при наступлении иммунологического ответа;
- Естественных киллеров — уничтожают вирусные молекулы и активизируют работу рецепторных ингибиторов;
- Макрофагов — захватывают и переваривают чужеродные патогены.
В практической медицине для повышения уровня сопротивляемости к вирусным инфекциям используют вакцинацию, препараты на основе интерферона, иммуномодуляторы.

Противопаразитарная защита
Паразиты и простейшие нарушают нормальную деятельность всего организма. Иммуннологический ответ вырабатывается исходя из:
Основным оружием иммунной системы служат:
- Иммуноглобулины типа Е — защитники тканей и органов, имеющих непосредственную связь с окружающей средой;
- Цитолитические антитела — клетки растворяющие патогенные микроорганизмы;
- Макрофаги — уничтожают паразитов и простейших;
- Кишечная ткань и микрофлора — способствует угнетению роста колонии, выводит особей из организма.
Противогрибковая защита
Грибковая инфекция развивается у людей со сниженным иммунным статусом на клеточном уровне. Как правило, грибки поражают не только кожу и слизистые, но и внутренние органы, в том числе мозг.
Антитела при борьбе с грибковым заболеванием играет не столь важную роль. Главным оружием иммунитета является клетки типа Т, вырабатываемые тимусом и костным мозгом:
- Полиморфноядерные — белые круглые клетки, обеспечивающие иммунитет в тканях;
- Клетки типа Т — осуществляют клеточные иммунологические реакции;
- Лимфоциты типа НК — клетки, приводящие к гибели отдельные особи и колонии.
Антитоксическая защита
Иммунитет антитоксический — это одна из форм гуморального иммунитета, основанная на работе иммуноглобулина G по предотвращению действий токсических веществ, выделяемых при инфекционном заболевании. От действии данной иммунологической формы зависит процесс выздоровления, так как все бактерии, вирусы, паразиты, простейшие и различного рода патогенные объекты при своей жизнедеятельности внутри организма человека выделяют токсические вещества.
Главным механизмом обезвреживания отравляющих веществ являются антитоксины.
Иммунитет антитоксический вырабатывает антитела при воздействии:
- Токсинов — яды, выделяемые болезнетворными объектами;
- Анатоксинов — токсоидный препарат на основе токсинов без ярко выраженного отравляющего эффекта.
Данный иммунологический ответ не является врожденным, а приобретается организмом. Синтез антитоксинов происходит вследствие естественного проникновения токсических патогенов или искусственно:
- При использовании сывороток на основе токсинов;
- Иммунизации с помощью анатоксинами.

Иммунитет антитоксический вырабатывается при введении вакцины против сильно токсичных инфекций: дифтерии, полиомиелита, столбняка, ботулизма, дизентерии, а так же против змеиных ядов. А так же в комплексной терапии антибиотиками и другими видами терапии, так как последние уничтожают только причину появления токсичных компонентов в организме.
Действия антитоксических клеток обусловлены:
- Провоцированием напряженности состояния иммунитета;
- Активностью и количеством Иммуноглобулина типа А — специфический секреторный белок, содержащийся в слюне, слизистых оболочках, секрете органов ЖКТ, желчи, в органах дыхания, способствуют нейтрализации токсичных веществ;
- Выраженными свойствами;
- Нейтрализующем действием на определенный вид токсина;
- Накоплением антитоксических типов иммуноглобулина;
- Действиями других видов иммунитета, как например противовирусного.
Все видовые иммунологические проявления формируются на основе специфических механизмов и реакций. При которых неспецифические функции включаются в активную работу при внедрении любого вредоносного элемента, а специфические — при определенном патогенном воздействии. При чем действия их совокупно и целенаправленно защищают организм по всем направлениям, исходящим от угрозы здоровью.
Видео
Читайте также:


