Гепатит при болезни вильсона коновалова


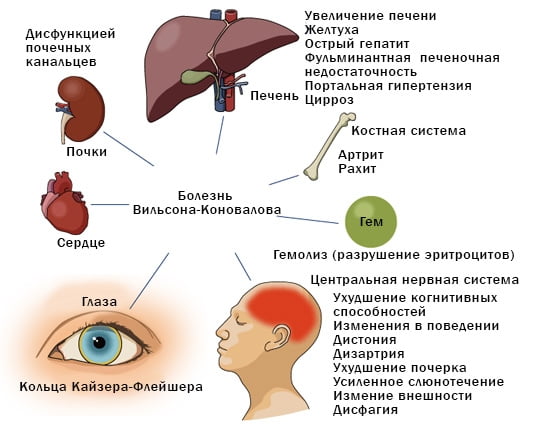
Болезнь Вильсона-Коновалова (гепатолентикулярная дегенерация)
Болезнь Вильсона-Коновалова - (гепатоцеллюлярная дистрофия, болезнь Вильсона, гепатолентикулярная дегенерация) - редкое наследственное заболевание, наследуемое по аутосомно-рецессивному типу, проявляющееся преимущественно в молодом возрасте и характеризующееся избыточным накоплением меди в организме.
У пациентов медь накапливается в печени и мозге, а также в почках, роговице. Подробнее: Медь .
Болезнь Вильсона-Коновалова является причиной 15-20% всех болезней печени у детей.
Болезнь проявляется признаками поражения печени (часто развиваются цирроз печени и печеночная недостаточность ), нейропсихическими нарушениями, сочетанием указанных проявлений.
Патогномоничным симптомом для болезни Вильсона-Коновалова является обнаружение желто-коричневого кольца по периферии роговицы (кольцо Кайзера-Флейшера).
Диагноз заболевания устанавливается на основе физикального исследования, результатах лабораторных анализов, подтверждающих наличие нарушения метаболизма меди в организме (снижение уровня церулоплазмина в крови, повышение суточной экскреции меди с мочой); данных визуализирующих методов (УЗИ, КТ и МРТ ), при которых выявляются гепато- и спленомегалия, дегенерация базальных ганглиев головного мозга. В биоптатах печени обнаруживается повышенное содержание меди. Пациенту и его ближайшим родственникам проводится генетическое тестирование.
Лечение направлено на ограничение поступления меди в организм и уменьшение его содержания за счет назначения хелирующих препаратов ( D-пеницилламина , триентина).
-
Классификация болезни Вильсона-Коновалова
В соответствии с клинической симптоматикой выделяются три формы заболевания:
- Болезнь Вильсона-Коновалова протекающая с преимущественным поражением ЦНС.
- Смешанная форма болезни Вильсона-Коновалова.
- Эпидемиология болезни Вильсона-Коновалова
В последние годы наблюдается тенденция к увеличению числа диагностируемых случаев болезни Вильсона-Коновалова. Распространенность заболевания в среднем - 30 случаев на 1 млн. человек.
В мире заболевание регистрируется с частотой 1: 35-100 тыс. новорожденных (уже насчитывается 10-30 млн. больных); носительство патологического гена отмечается в 0,56% случаев. В США частота выявления болезни Вильсона составляет 1:30 тыс. населения; носители мутантного гена (расположен на 13 хромосоме) обнаруживаются с частотой 1:90.
Высокая заболеваемость отмечается в регионах, где существуют близкородственные браки (Иран, Йемен, Ирландия), а также в Японии и на острове Сардиния. Так, в Японии болезнь Вильсона-Коновалова диагностируется с частотой 1:30 тыс.; для сравнения в Австралии - 1:100 тыс. населения.
Болезнь Вильсона-Коновалова встречается одинаково часто как у мужчин, так и у женщин.
Болезнь манифестирует в возрасте 8-16 лет, однако неврологические симптомы появляются только к 19-20 годам. У детей младше 5 лет проявления болезни Вильсона нередко могут отсутствовать, хотя заболевание иногда диагностируется как у пациентов в возрасте до 3 лет, так и у людей, которым уже за 50.
Без лечения болезнь Вильсона-Коновалова приводит к летальному исходу (примерно в возрасте 30 лет) в результате печеночной , почечной недостаточности, а также геморрагических осложнений.
Показатель смертности среди больных с возникшей фульминантной печеночной недостаточностью составляет 70%. Течение болезни Вильсона-Коновалова с развитием фульминантной печеночной недостаточности чаще наблюдается у женщин, чем у мужчин (4:1).
В 1953 г. Bearn, проведя анализ 30 семей, где были пациенты с болезнью Вильсона, установил аутосомно-рецессивный тип наследования этого заболевания.
В 1956 г. Walshe продемонстрировал хелирующий эффект препарата D-пеницилламина . В 1974 г. Frommer привел доказательства нарушения процесса билиарной экскреции меди при болезни Вильсона-Коновалова.
Мутантный ген (ATP7B), детерминирующий развитие этого заболевания и расположенный на 13 хромосоме (локус13q14-q21), был открыт Frydman и др. в 1985 г.
В дальнейшем было установлено, что этот ген кодирует кодирует белок, ответственный за внутриклеточный транспорт ионов меди (транспортирующий медь АТФазный протеин Р-типа). Медь - важный микроэлемент, так как он входит в состав целого ряда ферментов в организме. Но избыток меди приводит к цитотоксическим эффектам, которые опосредованы окислительными повреждениями клеточных мембран, дестабилизацией ядерной ДНК, разрушением лизосом.
В настоящее время идентифицировано более 200 мутаций гена ATP7B, которые приводят к нарушениям билиарной экскреции меди и к накоплению этого микроэлемента сначала в печени, а затем и в других органах и тканях (ЦНС, почках, сердце, костно-суставной системе). В результате возникает токсическое поражение этих органов и нарушение их функций.
По рекомендации ВОЗ суточная потребность в меди для взрослых составляет 1,5 мг. Содержание меди в обычной диете составляет 2-5 мг в день.
К продуктам с высоким содержанием меди относятся: баранина, свинина, мясо фазана, уток, гусей; кальмары, семга, субпродукты (печень, почки, сердце), морепродукты (устрицы, креветки, крабы, лобстер, морские гребешки, мидии), соевые продукты, орехи, грибы, сухофрукты (изюм, финики, чернослив), некоторые фрукты (авокадо), фасоль, горох, чечевица, пшено, ячмень, ржаной хлеб, свежий картофель, молочный шоколад, какао, минеральная вода.
Богатые источники меди содержат 0,3–2 мг/100 г продукта. Это: морепродукты, орехи, семена (включая порошок какао), бобы, отруби, зародышевые части зерен, печень и мясо.
Считается также, что 1 л питьевой воды содержит примерно 1 мг меди.
В организм медь поступает в основном с пищей. В желудочно-кишечном тракте абсорбируется до 95% поступившей в организм меди (причем в желудке ее максимальное количество), затем в двенадцатиперстной кишке, тощей и подвздошной кишке. Лучше всего организмом усваивается двухвалентная медь. В крови медь связывается с сывороточным альбумином (12-17%), аминокислотами - гистидином, треонином, глутамином (10-15%), транспортным белком транскуприном (12-14%) и церулоплазмином (до 60-65%). Небольшая часть меди ( 100-1000
Суточная экскреция меди с мочой при проведении пеницилламинового теста (прием 500 мг пеницилламина) мкг/сут Повышается незначительно >1500 Концентрация меди в ткани печени мкг/г 20-50 >250 (до 3000) Включение изотопа меди (64Cu или 67Cu) в церулоплазмин - Высокий уровень включения изотопа меди в церулоплазмин; второй пик через 48 часов. Не происходит включение изотопа меди в церулоплазмин; нет второго пика через 48 часов. Критериями диагностики болезни Вильсона-Коновалова являются:
- Обнаружение кольца Кайзера-Флейшера.
- Снижение содержания церулоплазмина сыворотки крови (менее 20 мг/дл).
- Снижение содержания меди в сыворотке крови (менее 12 мкг/дл).
- Повышение экскреции меди с мочой (более 100 мкг/сут).
- Положительные результаты пеницилламинового теста.
- Повышенное содержание меди в ткани печени (более 250 мкг/г сухого вещества).
- Отсутствие включения изотопа меди в церулоплазмин.
У больного с нейропсихическими симптомами (или другими проявлениями, позволяющими заподозрить болезнь Вильсона-Коновалова) наличие кольца Кайзера-Флейшера и снижение содержания церулоплазмина сыворотки (менее 20 мг/дл) будут свидетельствовать в пользу болезни Вильсона-Коновалова.
Если у пациента имеются признаки хронического заболевания печени, но нет кольца Кайзера-Флейшера, то для установления диагноза болезни Вильсона-Коновалова достаточно получить доказательства повышенного содержания меди в ткани печени (более 250 мкг/г сухого вещества) и снижения содержания церулоплазмина в сыворотке крови.
Дифференциальный диагноз болезни Вильсона-Коновалова необходимо проводить со следующими заболеваниями и клиническими синдромами:
- Болезнь Паркинсона.
- Паркинсонизм, вызванный приемом лекарственных препаратов.
К паркинсонизму может приводить применение следующих лекарственных средств: нейролептиков - например, хлорпромазин ( Аминазин ); антиэметиков: например, метоклопрамид ( Церукал ); антигипертензивных средств: верапамил ( Изоптин , Феноптин ); метилдопы ( Допегит ), резерпина ; флунаризина (Сибелиум, Флунар); ловастатина ( Холетар , Кардиостатин ); амиодарона ( Кордарон ).
Паркинсонизм, вызванный воздействием токсических веществ.
Паркинсонизм может развиваться при контакте с монооксидом углерода; при отравлении цианидами; при отравлении магнием; при контакте с промышленными химикатами: дисульфидом углерода, метанолом, н-гексаном, дикватом (гербицид), разбавителями лаков.
Паркинсонизм, наблюдающийся при других патологических состояниях.
В эту группу входят случаи возникновения паркинсонизма при сосудистых и структурных аномалиях головного мозга; гидроцефалии; метаболических нарушениях (при гипертиреоидизме, гипопаратиреоидизме); гемиатрофии; травмах головного мозга; энцефалитах.
- Заболевания, сопровождающиеся появлением пигментации роговицы.
- Сенильная каротинемия.
- Хронический активный гепатит.
- Хронический холестаз.
- Хроническая желтуха .
- Множественная миелома.
- Первичный билиарный цирроз печени .
- Трипаносомоз.
- Цирроз печени .
- Аутоиммунная гемолитическая анемия.
- Ревматические заболевания (ревматоидный артрит, полимиозит, склеродермия).
- Рассеянный склероз.
- Болезнь Гентингтона.
- Депрессия.
- Лейкодистрофия.
- Васкулиты.
- Дефицит альфа-1-антитрипсина.
- Наследственный гемохроматоз .
Аннотация научной статьи по клинической медицине, автор научной работы — Соколов С. А., Воробьев И. А., Чеснокова Л. В.
В статье описаны два клинических случая болезни Вильсона-Коновалова у пациенток молодого возраста. В первом случае поздняя диагностика и не своевременное лечение Д-пеницилламином привели только к уменьшению клинических проявлений болезни. Во втором случае раннее выявление и патогенетическое лечение способствовали регрессу заболевания.
Похожие темы научных работ по клинической медицине , автор научной работы — Соколов С. А., Воробьев И. А., Чеснокова Л. В.
The article is describing two clinical case of the Wilson s disease which have the young patients. In the first case late diagnostics and not duly treatment by D-penicillamini have resulted only in reduction of clinical displays of illness. In the second case early revealing and pathogenic treatment return development of disease.
ПОЗДНЯЯ И РАННЯЯ ДИАГНОСТИКА БОЛЕЗНИ ВИЛЬСОНА-КОНОВАЛОВА. ДВА КЛИНИЧЕСКИХ СЛУЧАЯ
С.А. Соколов, И.А. Воробьев, Л.В. Чеснокова*
Тюменское отделение Южно-Уральского научного центра Российской академии медицинских наук, г. Тюмень; *Тюменская государственная медицинская академия Федерального агентства по здравоохранению и социальному развитию, г. Тюмень
В статье описаны два клинических случая болезни Вильсона-Коновалова у пациенток молодого возраста. В первом случае поздняя диагностика и не своевременное лечение Д-пеницилламином привели только к уменьшению клинических проявлений болезни. Во втором случае раннее выявление и патогенетическое лечение способствовали регрессу заболевания.
Ключевые слова: болезнь Вильсона-Коновалова, цирроз печени.
Редкая встречаемость болезни Вильсона-Коновалова (1-2 % в структуре хронических диффузных заболеваний печени [4]) приводит к поздней его диагностике, тогда как ражее начало патогенетической терапии Д-пеницилламином способствует благоприятному прогнозу, улучшению качества жизни и, в ряде случаев, регрессу заболевания. Преимущественное поражение лиц молодого и трудоспособного возраста, делает проблему раннего выявления и своевременного лечения при данном заболевании актуальной.
Болезнь Вильсона-Коновалова (гепатоцереб-ральная дистрофия) представляет собой генетически обусловленное нарушение метаболизма меди в печени, ведущее к снижению её экскреции в желчь и избыточному накоплению в печени, головном мозге, почках, глазах и других органах. Болезнь Вильсона-Коновалова опосредуется рецессивным геном, расположенным в 13-й хромосоме. Данное заболевание распространено повсеместно с приблизительной частотой 1 на 30 ООО населения 6.
Диагностические критерии [3, 5,7, 9,10):
• низкий уровень церулоплазмина сыворотки (ниже 20 мг/дл);
• увеличение экскреции меди с мочой (выше 100 мкг/сут);
• концентрация меди в ткани печени более 250 мкг/г сухой массы;
Кольцо Кайзера-Флейшера представляет собой отложение коричневато-зеленоватого пигмента в десцеметовой оболочке по периферии задней поверхности роговицы. При вовлечении ЦНС кольцо выявляется почти в 100 % случаев, а в отсутствии признаков поражения ЦНС у 55-70 % больных [3].
Первые признаки болезни Вильсона-Конова-лова обычно появляются у детей старшего возрас-
та, подростков и молодых людей. Манифестация с признаков поражения печени отмечена у 42 %, ЦНС у 44 % (неврологические симптомы у 34 %, психические у 10 %), системы крови у 12 %, эндокринных расстройств у 12 % и почек у 1 % больных. В 35 % случаев абдоминальной формы болезни наблюдается нормальный уровень церулоплазмина и отсутствует кольцо Кайзера-Флейшера. В этом случае определение суточной экскреции меди с мочой, магнитно-резонансная томография (МРТ) или компьютерная томография (КТ) головного мозга могут помочь в установлении диагноза [3].
При болезни Вильсона-Коновалова наблюдаются три основных клинических варианта поражения печени: фульминантная печёночная недостаточность, хронический гепатит и цирроз печени. В большинстве случаев длительное время поражение печени протекает латентно и без лечения приводит к циррозу.
Морфологические изменения в ткани печени выявляются даже у маленьких детей без клинических признаков заболевания. Самые ранние повреждения включают накопление гликогена в ядрах пе-рипортальных гепатоцитов и умеренную жировую инфильтрацию. В биоптате печени находят тельца Мэллори в 25-86 % случаев. У большинства пациентов обнаруживают фиброз различной степени и картину хронического гепатита высокой степени активности [3].
Клиническая проблема болезни Вильсона-Ко-новалова заключается в том, что в практике врача она встречается нечасто, и на момент выявления, пациент находится уже в тяжёлой стадии болезни с необратимыми изменениями, как в центральной нервной системе, так и в печени. Поэтому лечение зачастую не ведёт к выздоровлению, а лишь к некоторой стабилизации процесса. Это иллюстрирует первый клинический случай.
Больная Л., 1974 г.р. на момент обращения 26 лет.
Обратилась к гастроэнтерологу в октябре
2000 года, когда появились: резкая слабость, быстрая утомляемость, невозможность выполнять работу (работала воспитателем в детском саду), бессонница, тремор головы, кистей рук, увеличение живота, тяжесть в правом подреберье. Тремор кистей рук появился в 1997 году.
При физикальном исследовании: состояние средней тяжести, несколько заторможена. Положение активное. Кожные покровы бледные, склеры иктеричны, обращало внимание значительное расширение венозной сети на передней брюшной стенке (до 1,0 см). Голени отёчны, на коже их гиперпигментация. При пальпации живота отмечалась небольшая болезненность в правом подреберье. Печень увеличена незначительно (+1,5 см из-под края рёберной дуги). В то время как селезёнка значительно увеличена (+11 см), уплотнена, чувствительна при пальпации. Асцита нет.
Неврологически: выраженный тремор рук и головы, нистагма нет, лёгкая рассогласованность сухожильных рефлексов.
Лабораторно: в биохимическом анализе крови незначительное повышение общего билирубина за счёт связанной фракции до 29-33 ммоль/л, АЛТ и ACT не превышали норму, отмечалась небольшая диспротеинемия (гамма-глобулины 24 %). В общем анализе крови нормохромная анемия лёгкой степени тяжести.
По фиброгастродуоденоскопии: выявлены варикозно расширенные вены пищевода 2 степени.
По данным ультразвукового исследования: печень незначительно увеличена, контур бугристый, выраженные фиброзные изменения. Сосудистый рисунок деформирован. Портальная вена расширена (V.porta —1,4 см). Селезёнка увеличена с размерами 21,0 см на 7,7 см. Расширены ветви селезёночной вены (V.lienalis — 1,2 см). Свободной жидкости в брюшной полости не определяется.
Учитывая выраженные признаки портальной гипертензии, пациентка направлена на дальнейшее обследование в стационар.
При дообследовании в анализе крови обнаружены маркёры вирусного гепатита В (НВсогАЬ, HBeAg, HBV-DNA-качественным методом). И, таким образом, цирроз печени верифицировался как вирусный. Была предпринята попытка противовирусной терапии ламивудином, на фоне которой у пациентки резко ухудшилось самочувствие, и лечение было отменено. При повторном исследовании маркёры гепатита В не определились.
Биопсия печени не проводилась из-за высокого риска кровотечения.
В течение года больной назначались мочегонные препараты (верошпирон 100 мг/сут, фуро-семид 40 мг через два дня, бета-блокаторы (ана-прилин 80 мг/сут), пищеварительные ферменты,
лактулоза, гепатопротекторы. Однако состояние больной прогрессивно ухудшалось, и в октябре
2001 года она была госпитализирована в гастроэнтерологическое отделение для проведения дополнительного обследования. Обращало внимание усиление тремора и нарастание признаков портальной гипертензии (асцит). Пациентка с трудом держала равновесие, могла сидеть только с посторонней помощью. Учитывая клинические данные, была выполнена КТ головного мозга, где определилась диффузная и очаговая атрофия серого и белого вещества. По результатам данного исследования была заподозрена болезнь Вильсона-Ко-новалова. При осмотре с помощью щелевой лампы обнаружено кольцо Кайзера-Флейшера в лимбической зоне роговицы глаз, в анализе крови снижен уровень церулоплазмина. Проконсультирована нейрохирургом. Консилиумом выставлен диагноз:
Болезнь Вильсона-Коновалова в стадии цирроза печени, декомпенсация. Класс С по Чайлду-Пью. Портальная гипертензия 3 степени. Энцефалопатия 2-3 степени. Экстрапирамидная недостаточность. Гиперкинетический синдром.
Учитывая диагноз, больной была назначена патогенетическая терапия.
Диета с исключением продуктов, богатых медью: печень, почки, колбасы, шоколад, какао, орехи, грибы, бобовые, ракообразные.
Медикаментозная терапия включала в себя два препарата:
• Д-пеницилламин (образует с медью легко экскретируемые хелатные соединения) внутрь по 500 мг 4 раза в день за 30 минут до еды. Суточная доза составляет 2000 мг. Препарат пациентке назначен для постоянного приема.
• Цинктерал (предотвращает поступление меди в портальный кровоток и увеличивает её экскрецию с калом) назначен по 50 мг 3 раза в день за 30 минут до еды для постоянного приёма.
Назначенную терапию пациентка переносила удовлетворительно.
В продолжение трёх лет (2001-2003 гг.) лечения заболевания отмечалась некоторая стабилизация и регресс неврологических проявлений: уменьшился тремор головы и рук, пациентка самостоятельно ходила и сидела, но явления портальной гипертензии не купировались. Сохранялась спле-номегалия, и, как следствие, гиперспленизм (анемия, тромбоцитопения).
В настоящее время пациентка наблюдается гастроэнтерологом и неврологом. Прогноз для жизни благоприятный, но трудоспособность стойко утрачена (инвалид 2 группы 3 степени). У больной есть родной брат 20 лет. В настоящее время признаков болезни Вильсона-Коновалова у него нет.
Второй случай болезни Вильсона-Коновалова демонстрирует то, как ранняя диагностика и своевременно начатое лечение ведет к регрессу заболевания.
Соколов C.A., Воробьев ИЛ., Чеснокова J1.B.
Поздняя и ранняя диагностика болезни Вильсона-Коновалова.
Больная Н., 1995 г.р. на момент обращения 15 лет.
Обратилась к инфекционисту в мае 2010 года, с единственной жалобой на желтушность склер и периодическое ее усиление. При физикальном исследовании: состояние удовлетворительное, сознание ясное, положение активное. Кожные покровы смуглые, склеры иктеричны. Лимфатические узлы не увеличены. Со стороны органов дыхания и сердечно-сосудистой системы физикальных отклонений не выявлено. При пальпации живота отмечалась небольшая болезненность в правом подреберье. Печень увеличена незначительно (+1,0 см из-под края рёберной дуги). Размеры селезёнки несколько увеличены. Асцита нет.
Лабораторно: в общем анализе крови нормо-хромная анемия лёгкой степени тяжести, в биохимическом анализе крови выявлено повышение общего билирубина до 35 ммоль/л (прямого до 8,0 ммоль/л), АЛТ и ACT превышали норму в 1,5 раза, показатели щелочной фосфатазы в норме, ПТИ 85 %.
По данным УЗИ: печень незначительно увеличена, контур ровный, диффузные изменения паренхимы. Портальная вена незначительно расширена (V.porta - 1,3 см). Селезёнка увеличена с размерами 15,0 см на 8,5 см. Небольшое расширение ветви селезёночной вены (V.lienalis - 1,0 см). Свободная жидкость в брюшной полости не определялась.
Маркеры гепатитов HAV, HBV, HCV, HGV, TTV отрицательные, обследование на описторхоз, лямблиоз, токсоплазмоз, токсокароз, активность цитомегаловирусной инфекции и вируса Эпштейн-Барра ничего не выявило. В динамике выявлено колебание уровня билирубина крови, преимущественно за счет непрямой фракции.
Назначены гепатопротекторы (гептрал по 1 табл. 2 раза в день, фосфоглив по 2 капе. 3 раза в день), глюкоза внутривенно капельно, ферментные препараты. На фоне лечения существенной положительной динамики ACT и АЛТ не отмечено.
Осмотрена гематологом, выполнена стернальная пункция, данных о заболевании крови не установлено, рекомендовано наблюдение у гастроэнтеролога.
Осмотрена невропатологом - неврологические отклонения не выявлены.
Учитывая отсутствие убедительных данных за инфекционное поражение печени, пациентка направлена к гастроэнтерологу (гепатологу) для уточнения диагноза. Г астроэнтерологом проведено дополнительное обследование: кровь на аутоантитела (антинуклеарные, антигладкомышечные, к печеночно-почечным микросомам) - не обнаружены, исследование сыворотки крови на церулоплазмин выявило значительное его снижение, исследование мочи установило повышение уровня экскреции меди. При осмотре с помощью щелевой лампы кольцо Кайзера-Флейшера не обнаружено. Исследование печени с помощью аппарата «Фиб-
Был выставлен окончательный диагноз: болезнь Вильсона - Коновалова в стадии хронического гепатита. Печеночно-клеточная недостаточность 0. Гемолитические кризы.
Учитывая диагноз, больной была назначена патогенетическая терапия:
• медикаментозная терапия Д-пенициллами-ном в суточной дозе 1500 мг;
• антиоксиданты (витамин Е) и витамины В1 и В6 в течение месяца.
Назначенную терапию пациентка переносила удовлетворительно.
В течение двух месяцев проводимой терапии у больной нормализовались показатели билирубина, ACT и АЛТ. Размеры печени и селезенки, а также диаметры воротной и селезеночной вен сократились до нормальных значений. Больной рекомендован пожизненный прием Д-пенициллами-на с последующей коррекцией дозы в зависимости от клинических проявлений заболевания и уровня экскреции меди с мочой.
1. Раннее выявление болезни Вильсона-Коновалова и незамедлительное назначение патогенетической терапии Д-пеницилламином способствует благоприятному прогнозу, улучшению качества жизни и регрессу заболевания на стадии гепатита у данной категории пациентов.
2. Всем пациентам, особенно в возрасте до 35 лет, с клиническими признаками поражения печени и ЦНС необходимо выполнять исследование уровня церулоплазмина сыворотки, уровня экскреции меди с мочой и проводить осмотр роговицы с помощью щелевой лампы. Данное обследование целесообразно проводить родственникам пациента с болезнью Вильсона-Коновалова.
3. В обоих случаях отсутствовал положительный клинический эффект от назначения гепа-топротекторов, что может служить дополнительным косвенным критерием, позволяющим заподозрить данное заболевание.
4. Больные с тяжёлой формой заболевания на стадии декомпенсированного цирроза печени должны включаться в лист ожидания трансплантации печени.
1. Подьшова, С.Д. Болезни печени: руководство для врачей / С.Д. Подымова. — 3-е изд., пере-раб. и доп. — М.: Медицина, 1998. — 704 с.
2. Поражение почек при болезни Вильсона-Коновалова, обусловленные заболеванием и медъ-элиминирующей терапией / О.Ю. Рахимова, Т.Н. Краснова, Т.П. Розина и др. //Врач. - 2004. — № 10. - С. 29-32.
3. Розина, Т.П. Болезнь Вильсона-Коновалова. Обзор литературы / Т.П. Розина // Клиническая гепатология. — 2006. -№2(1). - С. 23-28.
4. Розина, Т.П. Внепеченочные проявления абдоминальной формы болезни Вильсона-Коновалова / Т.П. Розина, О.Ю. Рахимов, Т.Н. Лопаткина // Клиническая гепатология. — 2006. - № 2(3). -С. 11-14.
5. Шерлок, Ш. Заболевания печени и желчных путей: практич. руководство: пер. с англ. / Ш. Шерлок, Дж. Дули; под ред. З.Г. Апросиной, Н.А. Мухина. -М.: ГЭОТАР-МЕД 2002. -864 с.
6. Durand, F. Wilson's disease: an old disease keeps its old secrets / F. Durand // Eur. J. of Gasroen-terology and Hepatology. — 2007. — Vol. 19, №2. — P. 97-99.

Проявления этой болезни еще в начале XX века описал английский врач Вильсон (Уилсон), а спустя 50 лет русский невропатолог Коновалов более детально изучил и описал эту патологию, выделил различные формы болезни и предложил ее второе название — гепатоцеребральная дистрофия.
Медь в организме человека присутствует в очень маленьком количестве, однако выполняет важнейшие функции. В норме ее содержание не должно превышать 24 мкмоль/л (у беременных женщин концентрация этого элемента может возрастать почти в 2 раза – это физиологические изменения).
Когда количество этого микроэлемента в организме повышается, он начинает накапливаться во внутренних органах, вызывая тяжелейшие повреждения.
Формы и симптомы болезни Вильсона – Коновалова
Симптомы заболевания проявляются в молодом или зрелом возрасте. Существует несколько форм заболевания. Каждая из форм характеризуется преимущественным поражением той или иной системы организма человека.
Встречается чаще всего: 50-80% случаев. Развивается либо как хронический гепатит, либо как цирроз печени. Такую форму заболевания очень сложно лечить. Характерные симптомы болезни Вильсона-Коновалова:
Существует три вида желтухи: печеночная, механическая, гемолитическая.
- Механическая желтуха появляется при закупорке выводных желчных протоков. Цвет кожи приобретает зелено-желтый оттенок. Также характерным симптомом является кожный зуд. Желтуха очень сильно выражена.
- Гемолитическая желтуха появляется при повышенном разрушении эритроцитов (красных телец крови). Цвет кожи при этом становится бледно-лимонным. Обычно данный вид желтухи не интенсивен. Кожный зуд отсутствует.
- Печеночная желтуха. Данная форма желтухи проявляется при болезни Вильсона-Коновалова. Печеночная желтуха характеризуется поражением клеток печени, вырабатывающих желчь, что ведет к попаданию билирубина в кровь. Цвет кожи при данной форме желтухи становится желто-оранжевым. Интенсивность печеночной желтухи – умеренная. Кожный зуд появляется редко. Характерными признаками печеночной желтухи служат моча темного цвета (коньячного) и кал белого (бесцветный).
При печеночной желтухе в крови повышается связанный билирубин. Этот билирубин легко выделяется с мочой. Именно поэтому моча приобретает коньячный цвет. Как было описано выше, разрушаются клетки печени, что ведет к снижению выработки желчи. Именно метаболиты желчных кислот окрашивают кал в нормальный цвет. А раз желчь не вырабатывается, поэтому и кал бесцветный.
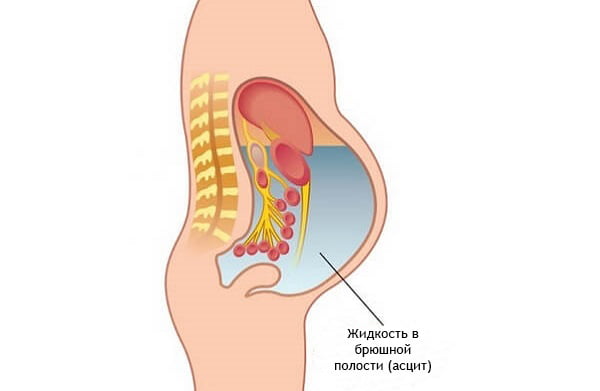
- Асцит
Асцит – скопление в брюшной полости жидкости. Этот симптом появляется в данном случае при значительном поражении печени. Жидкость, похожая по составу на плазму крови, скапливаясь в брюшной полости, давит на все органы, которые там расположены.
У пациента с выраженным асцитом увеличен в размере живот. Причем при смене положения тела увеличенный живот тоже меняет свое положение. Жидкость двигается под действием силы притяжения земли. Жидкость всегда двигается в место, наиболее приближенное к поверхности земли.
Отёки появляются чаще всего на ногах. При поражении почек отеки возникают под глазами.
Кровотечения происходят из-за нарушения свертываемости крови. Печень вырабатывает различные факторы свертывания. При болезни Вильсона клетки печени разрушаются, поэтому печень не способна вырабатывать факторы свертывания крови.
Аменорея – это отсутствие у женщин менструальных циклов. Печень помимо всего еще и инактивирует различные гормоны. В норме печень инактивирует избыток эстрогенов. В данном случае печень не выполняет этой функции, тем самым вызывая аменорею.
Характерными симптомами заболевания являются:
- Тремор рук, головы. Тремор – непроизвольные быстрые движения рук или головы. Для тремора характерна ритмичность, небольшой объем (размах) движений. Тремор может быть постоянным или периодическим (например, отсутствие тремора во время сна).
- Гримасничанье – преувеличенные быстро меняющиеся движения лицевых мышц, возникающие непроизвольно.
- Нарушения почерка. Почерк становится неровным, неразборчивым. При написании какого-либо текста наблюдается неодинаковые по размеру и расположению буквы в слове (одни буквы меньше – другие больше, одни выше – другие ниже).
- Дизартрия – расстройство речи, при котором происходит нарушение произношения звуков, слов. Речь становится непонятной, “говорит, как с кашей во рту”. Данное расстройство возникает вследствие нарушения иннервации органов, участвующих в создании речи (мягкого нёба, языка, губ).
- Более поздними симптомами являются: контрактура при сгибании и мышечная ригидность. Контрактура – ограничение пассивных и движений в различных суставах. В данном случае ограничивается разгибательные движения в суставах рук и ног. Мышечная ригидность – повышенный тонус мышц. Из-за увеличенного тонуса различных групп мышц происходит увеличение сопротивления при осуществлении движений (труднее совершить то или иное движение).
- Нарушение психики встречается в 20% случаев. Среди нарушений можно отметить психоз, депрессию. Психоз – психическое расстройство, проявляющееся крайне неадекватным поведением, с присутствием таких явлений, как галлюцинации и бред. Депрессия – расстройство, при котором происходит значительное и стабильное снижение настроения, утрата способности радоваться, потеря интереса к жизни, двигательная заторможенность.
Симптомом, характерным для обеих форм болезни Вильсона, служит Кольцо Кайзера – Флейшера. Он встречается в 50-62% случаев. Кольцо Кайзера – Флейшера – это кольцо коричневатого цвета, которое расположено на наружном крае роговицы глаза. Оно появляется из-за накопления в роговице меди.
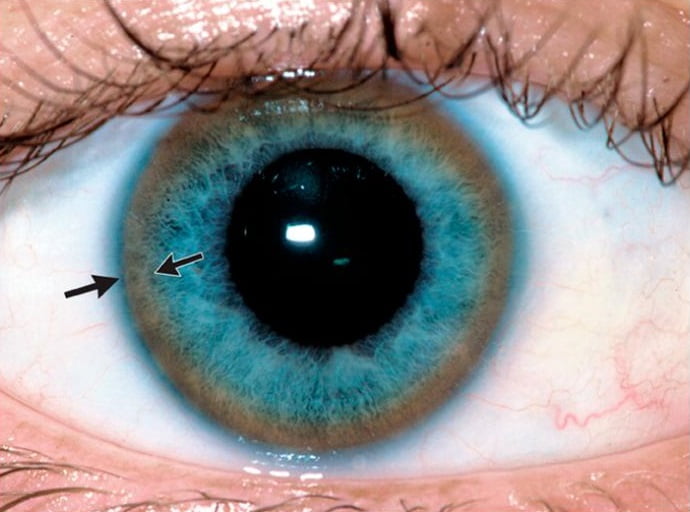
Интересно, что хорошо выраженное кольцо можно увидеть невооруженным глазом. Если интенсивность кольца невелика, чтобы его определить, необходимо специальное оборудование.
- Изменения со стороны почек встречается в 10% случаев. Они случаются из-за накопления меди в клетках почек. Чрезмерное накопление меди ведет к разрушению клеток почки, в результате чего появляются следующие симптомы: Гематурия – присутствие в моче элементов крови (эритроцитов). В норме в моче нет крови. Гликозурия – присутствие в моче глюкозы. В норме в моче не должно быть глюкозы.
- Внутрисосудистый гемолиз – разрушение эритроцитов в полости сосудов. Встречается в 10-15:% случаев. Гемолиз в конечном итоге приводит к анемии (снижение количества эритроцитов и гемоглобина в крови).
- Поражение костной системы – встречается в 20% случаев. Одним из главных проявлений является остеопороз. Остеопороз – заболевание, при котором снижается плотность, и нарушается структура костей. Вследствие остеопороза повышается ломкость костей, что в свою очередь ведет к частым переломам.

Диагностика заболевания Вильсона-Коновалова
- Начальным этапом диагностики болезни Вильсона-Коновалова является физикальное обследование. Уже во время него вероятным признаком заболевания оказывается типичный для данной болезни симптом – кольцо Кайзера-Флейшера. Оно представляет собой жёлто-коричневую обводку по периферии роговицы глаза.
- Следующий этап диагностики болезни Вильсона-Коновалова – лабораторные исследования крови и мочи пациента. Предварительный диагноз подтверждает обнаружение повышенного уровня печёночных ферментов и суточного выделения меди в урине.
- К инструментальным методам диагностики болезни Вильсона-Коновалова относят УЗИ, МРТ и КТ. Благодаря им визуализируется увеличение печени и селезёнки (гепато- и спленомегалия), а также разрушение подкорковых нейронных узлов в головном мозге.
- Генетическая часть диагностики болезни Вильсона-Коновалова заключается тестировании крови пациента и ближайших его родственников на предмет обнаружения патологического гена.
- При диагностике болезни Вильсона неврологу необходимо дифференцировать ее от паркинсонизма, гепатоцеребрального синдрома, болезни Геллервордена-Шпатца.
Лечение болезни Вильсона
Основой патогенетического лечения болезни Вильсона является назначение тиоловых препаратов, в первую очередь — D-пеницилламина либо унитиола.
Главное преимущество купренила — низкая токсичность и возможность длительного приема при отсутствии побочных эффектов. Его назначают по 0,15 г (1 капсула) в сутки (только после еды), в дальнейшем, в течение 2,5-3 месяцев дозу увеличивают до 6-10 капсул/сутки (оптимальная доза).
Лечение D-пеницилламином проводится годами и даже пожизненно с небольшими перерывами (на 2-3 недели) в случае появления побочных эффектов (тромбоцитопения, лейкопения, обострения язвенной болезни желудка и т. д.).
Унитиол назначают в случае непереносимости (плохой переносимости) D-пеницилламина. Длительность одного курса лечения — 1 месяц, после чего лечение приостанавливают на 2,5-3 месяца. В большинстве случаев наступает улучшение общего состояния пациента, а также регресс неврологических симптомов (скованности, гиперкинезов).
В случае доминирования гиперкинезов рекомендуется назначение небольших курсов нейролептиков, при ригидности (повышенном тонусе мышц) прописывают леводопы и карбидопы, тригексифенидил (препараты, назначаемые при болезни Паркинсона).
В случае тяжелого течения болезни Вильсона, при неэффективности консервативного лечения за рубежом прибегают к трансплантации печени. При положительном исходе операции состояние пациента улучшается, восстанавливается обмен меди в организме.
В дальнейшем лечение пациента составляет иммуносупрессивная терапия. В России на сегодня постепенно внедряется в клиническую практику метод биогемоперфузии с изолированными живыми клетками селезенки и печени (т. н. аппарат «вспомогательная печень).

Немедикаментозное лечение болезни Вильсона состоит в назначении диеты (рекомендация – стол №5 с шестиразовым дробным питанием, в котором преоболадает прием белков, ограничен прием липидов и соли) в целях исключения продуктов богатых медью (кофе, шоколад, бобовые, орехи и т. д.)
Прогноз и профилактика болезни Вильсона
В случае своевременного диагностирования болезни Вильсона и проведения адекватной медьснижающей терапии возможна нормализация общего состояние пациента и обмена меди в организме.
Для предотвращения рецидивов болезни Вильсона рекомендовано проведение лабораторных исследований крови и мочи пациента несколько раз в год. Необходим контроль следующих показателей: концентрация меди, церулоплазмина и цинка. Кроме того, рекомендовано проведение биохимического анализа крови, общего анализа крови, а также регулярные консультации у терапевта и невролога.
Читайте также:


