Гемагглютинин поверхностный антиген вируса гриппа ответствен за
Эпилог: статья больше для любознательных, желающих разбираться в обозначениях вируса: что значат буквы A, H1N1. Практической полезности для прагматиков, желающих начать профилактику или лечение, не несущая: расширяет кругозор, позволяет понять структуру вируса, проанализировать, понять с кем (а применительно для вирусов с чем) придется в итоге воевать. Для понимания механизмов распространения и борьбы с вирусом самое то.
Вирус – это микроскопическая частица (именно частица, а не организм, раньше даже считалось, что вирусы совсем и не живые организмы, а что-то вроде дерева или металла) состоящая из набора белков и нуклеиновых кислот (РНК или ДНК), способная инфицировать клетки живых организмов.
Возбудитель гриппа – это вирус, относящийся к семейству ортомиксовирусов, включает в себя три типа вирусов (типы A, B и C).
Все три типа значительно отличаются друг от друга по строению, поэтому при выработке защитных антител к одному типу (например, после болезни или вакцинации), можно спокойно заболеть другим типом вируса.
Кроме того, вирусы могут быстро мутировать в пределах своего типа (особенно типа A) и изменять структуру своих белков, за которые могут зацепиться защитные белки организма человека (антитела) и уничтожить вирус, что также затрудняет борьбу и меры профилактики против гриппа.
Именно этими факторами и объясняется, что каждый год огромное количество людей заболевает гриппом.
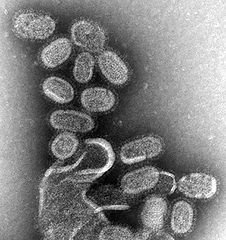
Теперь пройдемся по структуре вируса гриппа типа А и узнаем все эти непонятные буквы H или N которые все уже, думаю, слышали в новостях.
Вирус типа A включает в себя подтипы, которые различаются характеристиками белка гемагглютинина и фермента нейраминидазы.
Гемагглютинин (буковка H в подтипах вирусов от латинского названия Нemagglutinin) – поверхностный белок вируса гриппа, благодаря которому он может присоединяться к поверхности клетки хозяина, то есть некие такие клещи или щупальца, которыми вирус фиксируется на поверхности клеток. А надо отметить, что вирусы (любые, не только гриппа) могут существовать только, если фиксированы к клетке, ибо нет живого организма и вирус быстро погибает во внешней среде, особенно неблагоприятной для себя. Антитела именно к этому белку гемагглютинину и способствуют выработке иммунитета (барьера) против гриппа. Различают 15 антигенных подтипа этого белка: H1-H15
Нейраминизда (буква N, от Neuraminidase) – фермент, поверхностный антиген вируса, причем не только гриппа, а и многих других вирусов и бактерий. Поверхностный – это значит входит в состав оболочки вируса. Его роль заключается в разрушении рецепторов клеток организма к вирусу, благодаря чему вирус способен проникать к клеткам-мишеням (клеткам, где он внедряется, размножается, то есть проходит свой цикл), а также он облегчает высвобождение вновь образовавшихся вирусных частиц с поверхности зараженных клеток (размножение вируса). Для данного антигена гриппа характерны 9 подтипов: N1-N9
В результате мы имеем картину того, что вирус гриппа может иметь различную генетическую комбинацию, как в подтипах к гемагглютинину, так и в подтипах нейраминидазы, отсюда и вытекают различные типы вируса: H2N2, H3N2, H1N1 А учитывая еще разнородность и изменчивость структуры белка гемагглютинина, то комбинаций можно насоставлять на многие миллионы.
Что характерно, циркулирующий сейчас (будем верить вирусологам) вирус гриппа H1N1 это такой первенец, с которого начались последующие мутации набора белков и антигенов, произошло это в 1957 году, когда вирус типа H1N1 перешел в H2N2.
Вирусы гриппа типов B и C имеют меньше вариантов антигенов H и N и поэтому (возможно, что и пока) их на подтипы не делят.
Итог. Пытался написать это раздел максимально понятно, человеческим языком, если что-то конкретно не поняли, спрашивайте – поменяю, перепишу. Главное тут понять два момента:
1) вирус гриппа очень изменчив, по изменчивости он сравним с тем же вирусом иммунодефицита человека (ВИЧ/СПИД), который меняется в тех же пропорциях, что и вирус гриппа и поэтому лекарства доказанного и стопроцентно эффективного от него не найдено, также как и от вируса гриппа
2) теперь должны быть понятнее незнакомые до этого обозначения номенклатуры вируса гриппа, в частности почему новомодный свиной грипп называют вирусом А (тип вируса), H1N1 – набор гемагглютинина и нейраминидазы.
На пороге сезона гриппа многие задумываются о прививках. Основной компонент противогриппозных вакцин – гемагглютинин. Специалисты Ростеха, главного поставщика таких препаратов в России, рассказали, что это за вещество, откуда оно берется и как помогает нашему иммунитету справиться с возбудителем.
В результате ежегодных эпидемий по всему миру гриппом заражаются 5 миллионов человек, из них до 500 тысяч погибают. В первую очередь в опасности дети и пожилые люди.
Орудие преступления и главная мишень для иммунной системы
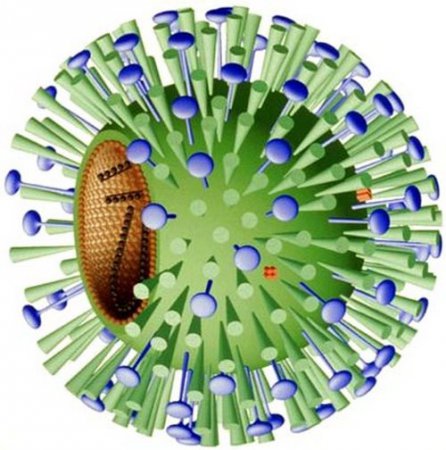
Вирус гриппа – шар диаметром 100 нанометров (хотя встречаются и похожие на нити длиной 300 нанометров и больше). Внутри него спрятан генетический материал в виде РНК – рибонуклеиновой кислоты. Именно она, проникая в клетку, превращает ее в фабрику по производству новых вирусных частиц.
Если для вируса гемагглютинин и нейраминидаза – важные инструменты, то для организма человека это чужеродные частицы, антигены. Иммунитет умеет их распознавать с помощью антител, в результате чего развивается реакция, направленная на борьбу с инфекцией. Антитела против гемагглютинина не дают вирусу инфицировать клетки, а против нейраминидазы – выходить из клеток новым вирусным частицам. Причем, самым сильным антигеном является гемагглютинин. Именно он привлекает наиболее пристальное внимание иммунной системы. И это его свойство лежит в основе работы противогриппозных вакцин.
В 2009 году весь мир паниковал из-за эпидемии свиного гриппа, вызванной новым штаммом H1N1. Эти буквы как раз обозначают гемагглютинин (H) и нейраминидазу (N). Цифры рядом с ними указывают на подтипы этих веществ. Ученым известно 16 антигенных подтипов гемагглютинина (H1–16) и 9 подтипов нейраминидазы (N1–9). Они характерны для вируса гриппа A – он является самым распространенным и может инфицировать не только людей, но и животных.
Довольно часто встречается инфекция, вызванная вирусом гриппа B – она протекает немного легче и распространяется только среди людей. Однако, как и вирус гриппа A, он может вызывать серьезные осложнения. Все современные вакцины направлены против этих двух возбудителей. Есть еще вирус гриппа C – им тоже заражаются только люди, он встречается редко и вызывает легкие симптомы. Если говорить о вирусе A, то у людей чаще всего встречаются антигенные подтипы H1–3 и N1–2.
Как гемагглютинин применяют в вакцинах?
В зависимости от того, насколько сильно разрушен вирус, противогриппозные вакцины делятся на три вида. Цельновирионные – содержат целые инактивированные вирусы; расщепленные (сплит-вакцины) – содержат отдельные фрагменты вирусов, а субъединичные – поверхностные и внутренние антигены вируса.
Побочные эффекты после введения вакцины возможны, но они бывают очень редко. У некоторых людей повышается температура, возникает легкое недомогание и боли в мышцах. Иногда болит место укола. Это происходит из-за того, что иммунная система реагирует на антигены и вызывает воспалительный процесс. Обычно симптомы сохраняются один день, потом проходят.
Историческая справка
В XIX веке ученые активно пытались понять причину гриппа. Основными подозреваемыми были бактерии, но иногда высказывались и более экзотические теории о том, что болезнь вызывает пороховой дым, загрязнение воздуха, курение некачественных сигар. Только во время эпидемии 1918–1919 годов появились подозрения, что виновниками являются некие вирусы. Впервые они были выделены из носовой слизи больных людей (вирус гриппа A) в 1932 году английскими учеными Уилсоном Смитом, Кристофером Эндрюсом и Патриком Лейдлоу.
В 1936 году удалось получить нейтрализованные антитела, и начались испытания вакцины. Поначалу она защищала только от вируса A. Во время испытаний в 1942–1945 годах ученые обнаружили вирус B, и была создана двухвалентная вакцина (против двух возбудителей).
Большой вклад в развитие противогриппозных вакцин внесли советские ученые. Выдающийся русский вирусолог Анатолий Александрович Смородинцев, основавший Научно-исследовательский институт, который сейчас носит его имя, впервые в мире создал живую аттенуированную (ослабленную, — NS) вакцину против гриппа. Результаты его работы с соавторами были опубликованы в 1937 году в журнале American Journal of the Medical Sciences. Анатолий Александрович активно занимался вопросами комплексной профилактики гриппа, разработки живых ассоциированных вакцин, коллективного иммунитета к гриппу.
Во время очередной пандемии в 1978 году была создана трехвалентная вакцина против двух штаммов A и одного B. Наконец, в 2012 году появились четырехвалентные вакцины, которые и рекомендуется использовать сегодня.
Как производят вакцины против гриппа?
Есть разные технологии. Чаще всего, для того чтобы получить гемагглютинин, вирусы выращивают на куриных эмбрионах. В первую очередь важно понимать, от каких штаммов вируса нужна защита в текущем сезоне. Эксперты из Всемирной организации здравоохранения (ВОЗ) дважды в год проводят обзор мировой эпидемиологической ситуации и выпускают соответствующие рекомендации. Производители вакцин получают нужные штаммы из лабораторий ВОЗ.
Готовую вакцину нельзя сразу отправлять в больницы. Ее нужно протестировать с помощью реагентов, полученных из лаборатории ВОЗ. Обычно процесс занимает две недели. Сотрудники лаборатории проверяют, содержится ли в вакцине нужное количество антигена, нет ли посторонних примесей, насколько она безопасна, стерильна и так далее. Когда проверка окончена, препарат можно разливать по одноразовым шприцам. Каждый шприц повторно проверяют, чтобы убедиться, что он не поврежден, и в нем находится необходимая доза.
Опасны ли вакцины против гриппа для людей, у которых аллергия на яйца?
Даже после очень тщательной очистки в противогриппозной вакцине остается минимальное количество яичного белка. Теоретически это опасно для аллергиков, но на практике все не так однозначно. Еще в 1976 году в Америке было проведено крупное исследование, которое показало, что на 48 миллионов введенных доз вакцины описано 11 случаев тяжелой аллергической реакции – анафилаксии. Но ни один пациент не погиб. При этом, до прививки ни один из этих 11 людей не сказал, что у него есть аллергия на яйца.
По последним данным, анафилактические реакции на противогриппозные вакцины встречаются в одном случае на миллион. Если в препарате содержится не более 0,12 мкг/мл яичного белка, это считается безопасным даже для аллергиков. И все же людей, у которых были анафилактические реакции на куриные яйца, рекомендуется прививать в стационаре, где за их состоянием может наблюдать врач.
Производство гемагглютинина для противогриппозных вакцин – процесс сложный. Для него требуется высокотехнологичное оборудование. Производитель должен соблюсти массу требований и обеспечить тщательный контроль. Ситуация осложняется еще и тем, что во время пандемии может потребоваться очень много доз в короткие сроки.
Зачем прививаться каждый год?
| гемагглютинин | |||||||||
|---|---|---|---|---|---|---|---|---|---|
 | |||||||||
| Идентификаторы | |||||||||
| Условное обозначение | гемагглютинин | ||||||||
| Pfam | PF00509 | ||||||||
| InterPro | IPR001364 | ||||||||
| СКОП | 1hgd | ||||||||
| СУПЕРСЕМЕЙСТВА | 1hgd | ||||||||
| OPM надсемейство | 109 | ||||||||
| белок OPM | 6hjq | ||||||||
| |||||||||
| С гриппа гемагглютинин Стебель | |||||||||
|---|---|---|---|---|---|---|---|---|---|
 | |||||||||
| Идентификаторы | |||||||||
| Условное обозначение | Hema_stalk | ||||||||
| Pfam | PF08720 | ||||||||
| InterPro | IPR014831 | ||||||||
| СКОП | 1flc | ||||||||
| СУПЕРСЕМЕЙСТВА | 1flc | ||||||||
| OPM надсемейство | 277 | ||||||||
| белок OPM | 2jrd | ||||||||
| |||||||||
содержание
Подтипы
Гриппа А могут быть классифицированы на основе различных подтипа белков , присутствующих: гемагглютинина (НА) и нейраминидазы (NA). ГК имеет по крайней мере 18 различных подтипов. Эти подтипы называются H1 через H18. H16 был обнаружен в 2004 году на вирусы гриппа А , выделенных из озерных чаек из Швеции и Норвегии . H17 был обнаружен в 2012 году в крыланами. Совсем недавно, H18 был обнаружен в перуанской летучей мыши в 2013 году Первые три гемагглютинины, H1, H2 и H3, встречаются в человеческих вирусов гриппа. Нейраминидазы (NA) имеет 11 известных подтипов, следовательно , вирус гриппа назван как H1N1, H5N2 и т.д., в зависимости от комбинации HA и NA.

Состав
- НА представляет собой гомотримерный интегральный мембранный гликопротеин . Это имеет форму цилиндра , и приблизительно длиной 13,5 нм. ГК тример состоит из трех идентичных мономеров . Каждый мономер состоит из интактного HA0 одной полипептидной цепи с НА1 и HA2 областей, которые связаны с 2 дисульфидных мостика . Каждая область НА2 принимает альфа - спиральную структуру спиральной катушки и сидит на верхней части области ГА1, которая является небольшим шаровым доменом , который состоит из смеси α / бета структур. НА тример синтезируется как неактивный предшественник белка HA0 для предотвращения преждевременного и нежелательного слитый активности и должен быть расщеплен принимающими протеаз для того , чтобы быть заразными. При нейтральном рН, в 23 остатков вблизи N-конца ГА2, также известный как слитый пептид , который в конечном счете ответственен за слияние вирусной и принимающей мембраны, скрыт в гидрофобном кармане между тримера интерфейсом HA2. С-конец из HA2, известный также как трансмембранного домена , охватывает вирусную мембрану и анкеры белка к мембране.
- НА1 в основном состоит из антипараллельных бета-листов.
- НА2 домен содержит три длинных альфа-спирали, по одному от каждого мономера. Каждый из этих спиралей соединен посредством гибкой, называемой областью петли петля-Б (остаток 59 до 76).
Функция HA в Вирусный Входа
HA играет две основные функции в проникновении вируса в клетку. Во - первых, она позволяет распознавать цели позвоночных животных клеток, осуществляется через связывание с этими клетками сиаловой кислоты отработанный рецепторы . Во- вторых, когда - то связан он облегчает проникновение вирусного генома в клетки - мишени, вызывая слияние хозяина эндосомный мембраны с вирусной мембраной.
В частности, НА1 домен белка связывается с моносахаридов сиаловой кислоты , которая присутствует на поверхности его клеток - мишеней, что позволяет прикрепление вирусной частицы к поверхности клетки - хозяина. Мембраны клетки - хозяина , а затем поглощают вирус, процесс , известный как эндоцитоз и зажимают прочь , чтобы сформировать новую связанные с мембраной отсекла внутри клетки , называемой эндосомой . Затем клетка пытается начать переваривать содержимое эндосомы путем подкисления его интерьера и превращая его в лизосомы . После того , как рН в пределах эндосого падает до приблизительно 5,0 до 6,0, серия конформационной перестройки происходит с белком. Во- первых, слитый пептид высвобождается из гидрофобного кармана и НА1 диссоциирует от домена HA2. Домен HA2 затем претерпевает обширные изменения конформации , которые в конечном итоге привести две мембраны в тесный контакт.
Противовирусное лечение Ориентация гемагглютинина
- Моноклональные антитела / В широком смысле нейтрализующих антител
Так как гемагглютинин является основным поверхностным белком вируса А гриппа , и имеет важное значение для процесса ввода, она является главной мишенью нейтрализующих антител . Нейтрализующие антитела против гриппа были найдены действовать двумя различными механизмами, отражая двойные функции гемагглютинина:
Вирус гриппа (Myxovirus influenzae) — РНК-содержащий вирус, принадлежит к семейству ортомиксовирусов (Orthomyxoviridae). В настоящее время выявлено более 2000 вариантов вируса гриппа, различающихся между собой антигенными свойствами внутренних белков, что определяет принадлежность вируса гриппа к типу А, В или С. Вирус гриппа А открыт в 1933 г. Смитом, Эндрюсом
Вирус гриппа B не вызывает пандемий и обычно являются причиной локальных вспышек, более ограниченных эпидемий, по сравнению с гриппом типа А. Вспышки гриппа типа В могут совпадать с таковыми гриппа типа А или предшествовать ему. Вирусы гриппа В циркулируют только в человеческой популяции (чаще вызывая заболевание у детей).
Вирус гриппа C мало изучен. Известно, что в отличие от вирусов А и В, он не вызывает эпидемий и не приводит к серьезным последствиям. Является причиной спорадических заболеваний, в основном у детей. Инфицирует только человека.
Строение и функции
Вирус гриппа имеет близкую к сферической форму и диаметр частиц 80-120 нм. Некоторые штаммы вирусов имеют форму палочек, а иногда и нитей различной длины (филаментозная форма). Вирусные частицы состоят из 0,8-1,1% РНК, 70-75% белка, 20-24% липидов и 5-8% углеводов. Вирион состоит из белковой оболочки, которая образована ворсинками длиной 10-12 нм, внутри которой находится генетическая информация: молекулы рибонуклеиновой кислоты (РНК), кодирующие 7 структурных белков. Из них четыре основных вирус-специфичных антигена: нуклеопротеид (RNP), матриксный белок (М1, М2), гемагглютинин (Н) и нейраминидаза (N) (рис. 1)
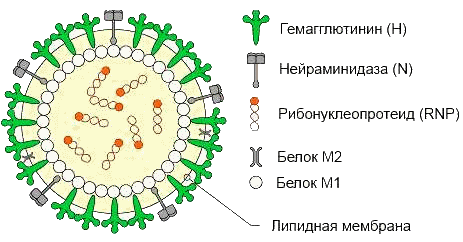
Рис. 1. Структура вируса гриппа.
Нуклеопротеид, тесно связанный с РНК-геномом, и матриксный белок, выстилающий изнутри липидную мембрану, — внутренние стабильные и типоспецифичные (S) антигены. Нуклеопротеиды типов А, B и C отличаются, что позволяет их детектировать. Гемагглютинин (Н) и нейраминидаза (N) — поверхностные антигены оболочки (V-антигены) — подвержены значительным изменениям.
Вирус репродуцируется в ядре и цитоплазме: нуклеопротеид формируется в ядре, нуклеокапсид собирается в цитоплазме, вирусная частица формируется полностью в процессе отпочкования и отделения от цитоплазматической мембраны клетки-хозяина.
Вирус гриппа малоустойчив во внешней среде. В воздухе помещений он погибает в течение нескольких часов, при 60°С — через 4–5 мин. Однако месяцами сохраняется в высушенном состоянии при —20° и —70°С. Чувствителен к хлорамину, формалину, эфиру, действию ультрафиолетовых лучей, ультразвуку и нагреванию.
Диагностика вирусов гриппа на сегодняшний день включает в себя иммунохимические методы и полимеразную цепную реакцию (ПЦР).
Широко применяется прямой и непрямой метод иммунофлюоресценции (выявление антигенов возбудителя в биологическом материале). Иммуноферментный анализ (ИФА) позволяет выявить антигены вирусов гриппа А и В с помощью моноклинальных антител к белкам соответствующих возбудителей в сэндвич-варианте. ПЦР применяется для экспресс-диагностики гриппа.
Серологическая диагностика гриппа базируется на выявлении возрастания титра противогриппозных антител в динамике заболевания или на определении специфичных иммуноглобулинов класса М. Для данного вида диагностики гриппа чаще применяют реакцию торможения гемагглютинации (РТГА). РТГА-тест позволяет определить тип и подтип вируса ввиду различия между V-антигенами вирусов гриппа. Реакция основана на том, что вирус гриппа способен агглютинировать человеческие или куриные эритроциты, а специфичные антитела ингибируют этот процесс. Реакция связывания комплемента (РСК) служит выявлению различия между S-антигенами и позволяет узнать тип вируса, вызвавшего инфекцию (А или В).
Среди других рекомендованных для ретроспективной диагностики методов можно отметить реакцию непрямой гемагглютинации (РНГА), метод дифференцированного определения антител с помощью редуцирующих веществ, реакцию определения антител к нейраминидазе (РИНА) и другие (иммунодиффузные, иммуноэнзимные и радиоиммунные методы).
ГЕМАГГЛЮТИНАЦИЯ (греч, haima кровь + лат. agglutinatio склеивание) — феномен склеивания эритроцитов. Гемагглютинация может быть прямой, т. е. происходить за счет непосредственного воздействия тех или иных агентов на эритроциты, и непрямой (пассивной), когда обработанные антигеном (или антителами) эритроциты агглютинируются соответственно иммунной сывороткой (или антигеном).
Прямую Гемагглютинацию могут вызывать антиэритроцитарные сыворотки, экстракты из тканей слюны, сыворотка человека и животных, а также некоторые бактерии (стафилококки, кишечная палочка, брюшнотифозные, паратифозные, дизентерийные микробы) и многие вирусы. Агглютинация эритроцитов нормальными сыворотками делится на изогемагглютинацию, если сыворотка и эритроциты принадлежат особям одного вида, и гетероагглютинацию, когда происходит склеивание чужеродных эритроцитов.
Способность к Г. сыворотка может приобретать при некоторых заболеваниях. Так, напр., сыворотка больных инфекционным мононуклеозом агглютинирует эритроциты барана (см. Пауля-Буннелля реакция).
Большое теоретическое и практическое значение имеет Г., вызываемая вирусами. Ее впервые описали в 1941 г. Херст (G. К. Hirst), Мак-Клилленд и Хейр (L. Mac Clelland, R. Hare). Они установили, что вирус гриппа агглютинирует эритроциты кур, на основании чего была разработана реакция гемагглютинации (РГА). Впоследствии гемагглютинирующие свойства были обнаружены у многих вирусов. С явлением Г. связана также гемадсорбция, т. е. способность клеток, инфицированных нек-рыми гемагглютинирующими вирусами, адсорбировать эритроциты на своей поверхности (см. Гемадсорбция). Способность вирусов вызывать Г. подавляется соответствующими противовирусными сыворотками, что используется в реакции торможения (погашения) гемагглютинации (РТГА).
РГА и РТГА широко используются как при теоретических исследованиях в области вирусологии, так и при диагностике вирусных инфекций для индикации, идентификации и классификации вирусов, а также для выявления противовирусных антител (антигемагглютининов) в сыворотке крови больных. Так, при выделении вирусов гриппа и паротита индикатором является агглютинация куриных эритроцитов аллантоисной и амниотической жидкостью зараженных куриных эмбрионов.
Для целей идентификации используется избирательная способность некоторых вирусов агглютинировать определенный вид эритроцитов. Вирус кори, напр., агглютинирует только эритроциты обезьян, а вирус энцефаломиокардита мышей — эритроциты барана.
У большинства вирусов гемагглютинин (субстрат, ответственный за Г.) является структурным компонентом вириона.
У вирусов, капсид которых одет наружной липопротеиновой оболочкой (вирусы гриппа, парагриппа, большинство арбовирусов), гемагглютинин находится в этой оболочке и структурно связан с так наз. ворсинками. По хим. природе Гемагглютинины этих вирусов являются глико- или липопротеидами. Так, гемагглютинин вируса гриппа представляет собой тетрамер, состоящий из двух пар гликопротеидов с общим мол. весом 150 000. Гемагглютинирующий гликопротеид оболочки арбовирусов группы В имеет мол. вес 50 000.
У вирусов, не имеющих внешней оболочки, гемагглютинин связан со структурами капсида. Так, у аденовирусов гемагглютинирующей активностью обладают фибриллы, выходящие из вершинных капсомеров.
Гемагглютинин оспенных вирусов является липопротеидом и представляет собой один из продуктов их репродукции, но, по-видимому, не включается в состав вириона, поскольку очищенные вирусные частицы Г. не вызывают.
Г. могут обусловливать как инфекционные вирусные частицы, так и инактивированные, поэтому Гемагглютинирующий титр вируса не отражает его инфекционной активности. В ряде случаев гемагглютинин может отделяться от вирусной частицы (напр., у аденовирусов). Некоторые вирусы (гриппа, кори, ECHO) могут в процессе своей репродукции формировать пустые, лишенные РНК вирионы, которые также обладают гемагглютинирующей активностью.
Механизм Г. изучался гл. обр. в опытах с вирусом гриппа. Его взаимодействие с эритроцитами проходит две фазы — адсорбцию и последующую элюцию (см.). Первый этап адсорбции вирусов на эритроцитах представляет собой физ. процесс и определяется разностью зарядов и межмолекулярным притяжением (силами Ван-дер-Ваальса). Вторым этапом является хим. взаимодействие вируса с рецепторами эритроцита.
Механизм самого процесса склеивания эритроцитов не совсем ясен. Может иметь значение изменение электростатического заряда эритроцитов после адсорбции на них вирусов.
Местом соединения вируса гриппа и некоторых парамиксовирусов с поверхностью эритроцитов являются рецепторы последнего, представляющие собой дисахарид 6-(N-ацетилнейраминил) альфа-D-N-ацетилгалактозамин. Под действием вирусного фермента нейраминидазы рецепторы эритроцитов расщепляются на N-ацетилгалактозамин и N-аце-тилнейраминовую к-ту.
При t° 37° через несколько часов происходит элюция вируса гриппа с эритроцитов. В гипертоническом р-ре хлорида натрия этот процесс протекает (быстрее. Вследствие разрушения рецепторов эритроциты теряют способность агглютинироваться повторно тем же вирусом, хотя могут склеиваться под действием ряда других вирусов.
Гликопротеидные рецепторы эритроцитов можно разрушить также перйодатом, трипсином и фильтратом холерных вибрионов, содержащим нейраминидазу.
Большинство других вирусов (оспенные, арбовирусы и др.) не разрушает рецепторов эритроцитов. Их элюция происходит не спонтанно, а при воздействии иммунной сыворотки, изменении электролитного состава среды, ее pH и др.
Г. зависит от свойств как вируса, так и эритроцитов (табл.).
ВИРУСЫ, СПОСОБНЫЕ ВЫЗЫВАТЬ АГГЛЮТИНАЦИЮ ЭРИТРОЦИТОВ НЕКОТОРЫХ ПОЗВОНОЧНЫХ
3, 7, 11, 14, 16, 20,
8, 9, 10, 13, 15, 17, 19, 22, 23, 24, 26, 27
Арбовирусы антигенных групп А, В, супергруппы Буньямвера
Ортомиксовирусы группа А, В, C
Человек, куры, морская свинка
Оспенные вирусы натуральной оспы, вакцины, оспы обезьян, эктромелии
Определенные особи кур
паротита, ньюкаслской болезни кур
Человек, куры, морская свинка
парагриппа НА-1, НА-2, НА-3
Человек, куры, морская свинка
Полиомавирусы полиомы мышей и вирус К
Рабдовирусы бешенства, везикулярного стоматита
Энтеровирусы ECHO 3, 6, 7, 11, 12, 15, 19, 20, 21, 24, 25, 29, 30, 33
Определенные особи кур
энцефаломиелита мышей GD VII
Гемагглютинирующая активность различна как у членов одной классификационной группы, так и у разных штаммов одного вируса и даже у отдельных клонов одного штамма. Напр., штаммовые различия выражены у энтеровирусов некоторых серотипов. В популяции вируса Коксаки А-21 были обнаружены как гемагглютинирующие частицы, так и лишенные этого свойства.
Для получения видимой Г. вирусная суспензия должна содержать не менее 105—106 вирусных частиц в 1 мл.
Гемагглютинирующую активность некоторых вирусов (напр., кори, паротита, краснухи) можно повысить путем обработки вирусной взвеси твином-80 и эфиром, вероятно, вследствие дезинтеграции наружной оболочки вируса.
Г. зависит также от среды культивирования вируса и от наличия ингибиторов, блокирующих этот процесс.
Напр., при культивировании вируса Коксаки А-21 в перевиваемых клетках злокачественного происхождения продуцируются только негемагглютинирующие частицы. Источником получения гемагглютинирующих антигенов арбовирусов является гл. обр. мозг зараженных мышей-сосунков, содержащих много ингибиторов Г. Поэтому для приготовления этих антигенов применяют экстракцию мозговой ткани боратно-солевым р-ром с pH 9,0, очистку фреоном, преципитацию ацетоном.
Разблокировки гемагглютинина с большой эффективностью можно добиться также путем дополнительной обработки взвеси твином-80 и эфиром, ультразвуком и трипсином в малой концентрации.
У некоторых вирусов способность вызывать Г. зависит от числа пассажей в том или ином субстрате. Здесь играет роль адаптация вируса к условиям культивирования и повышения активности его репродукции до уровня, когда концентрация вирусных частиц становится достаточной для появления Г. Иногда наблюдается обратная зависимость: с числом пассажей Гемагглютинирующая активность вируса уменьшается вплоть до полного исчезновения. Возможно, в основе этих явлений лежит селекция (во время пассажей) гемагглютинирующих или негемагглютинирующих частиц.
Из числа факторов, характеризующих эритроциты, особое значение имеет их видовая принадлежность.
Способность эритроцитов агглютинироваться тем или иным вирусом устанавливается эмпирически. Обычно вирусы, относящиеся к одной классификационной группе, агглютинируют одни и те же виды эритроцитов. Вместе с тем имеют значение и индивидуальные свойства донора.
Влияет на Г. также возраст и пол донора. Напр., вирус осповакцины более активно агглютинирует эритроциты взрослых кур, чем цыплят.
Для работы с арбовирусами предпочтительны эритроциты молодых птиц. Кроме того, рекомендуется использовать эритроциты гусаков, а не гусынь, поскольку гормональные сдвиги в период яйцекладки и высиживания яиц меняют свойства поверхности эритроцитов, в результате чего у них может появиться рефрактерность к действию вируса или склонность к спонтанной агглютинации.
Эритроциты некоторых видов животных (кроликов, крыс, мышей) нередко дают спонтанную агглютинацию, что необходимо учитывать при разработке стандартных условий Г. с каждым вирусом. Эритроциты птиц предпочтительнее эритроцитов млекопитающих, поскольку они быстро оседают, дают четкую картину и мало подвержены спонтанной агглютинации. При постановке РГА с нек-рыми вирусами, напр, вирусом гриппа, могут быть использованы как свежие эритроциты, так и консервированные с помощью 25% формалина.
Г. зависит от электролитного состава среды, концентрации водородных ионов и температуры. В среде без электролитов агглютинации эритроцитов вирусами не происходит.
Существует определенный оптимум электролитного состава среды; напр., адсорбция гемагглютининов вируса осповакцины на куриных эритроцитах является максимальной при 0,45—1,8% хлорида натрия.
Постановка РГА осуществляется при t° 4; 20—25 или 37°. Вирус гриппа, напр., лучше всего агглютинирует эритроциты при t° 4°, вирус осповакцины — при t° 37°, а для Г. арбовирусами температура не имеет значения.
Требования разных вирусов к концентрации водородных ионов также неодинаковы. Большинство из них вызывает Г. при pH 6,0—8,5. Поэтому в качестве среды чаще всего используют изотонический р-р хлорида натрия, к к-рому иногда прибавляют 0,014 М фосфатный буфер с pH 7,2 (при Г. с вирусами гриппа, кори, осповакцины и др.).
Арбовирусы, способность которых к Г. очень слабая, требуют строго определенной концентрации во дородны х ионов: отклонение от pH, оптимального для каждого вируса, допускается не более, чем на 0,3— 0,4 ед.
Поскольку Гемагглютинины этих вирусов стабильны лишь в щелочной среде (при pH 9,0), а оптимальной для постановки РГА является зона с pH 5,6—7,0, необходимую концентрацию водородных ионов создают в момент соединения антигена с эритроцитами, добавляя к щелочной взвеси вируса находящиеся в кислом буферном р-ре эритроциты.
Состав буферных р-ров может влиять на видовой спектр чувствительности эритроцитов. Если, напр., в среде обычного состава вирус краснухи агглютинирует эритроциты цыплят, голубей и гусей, то при использовании 0,025 М HEPES-бу-фера (N-2-hydroxyethylpiperazine — N12-ethanesulfouic acid) pH 6,2 с прибавлением 0,4 М NaCl, 0,001 М CaCl2, 1% альбумина сыворотки крупного рогатого скота и 0,00025% желатины он агглютинирует также эритроциты взрослых кур, человека (кровь 0 группы), обезьян, овец, свиней, кошек, кроликов, крыс, хомячков и мышей.
Для подтверждения специфичности вирусной Г., а также для выявления в сыворотках вирусных антигемагглютининов при серол, исследованиях служит РТГА. Специфичность ее не одинакова для разных групп вирусов. Для арбовирусов рода альфа- и флавивирусов РТГА, является группоспецифической, т. е. выявляет антигенные связи между членами данной группы. Это затрудняет оценку результатов серол, исследований при существовании в какой-либо местности нескольких вирусов одной группы. У адено- и реовирусов с помощью РТГА выявляются типоспецифические особенности, а у вирусов гриппа улавливаются даже тонкие различия между штаммами одного вида.
Для РТГА желательно использовать высокоактивные антигены. Антигены с низкой активностью нередко содержат много негемагглютинирующих вирусных частиц, которые могут соединяться с антителами и препятствовать их выявлению. При использовании в качестве источника гемагглютинина инфицированных клеточных культур из состава среды исключают сыворотку или предварительно удаляют из нее ингибиторы Г.
Блокирующие Г. сывороточные ингибиторы по хим. составу являются в основном бета-липопротеидами, а по размеру молекул близки к 198-антителам . Сыворотки, исследуемые в РТГА, освобождают от ингибиторов путем нагревания при t° 56 или 62° в течение 30 мин., обработки фильтратом холерных вибрионов или нейраминидазой, трипсином, адсорбции ингибиторов каолином, преципитации антител ацетоном, обработки хлоридом магния и гепарином, обработки сульфатным декстраном и хлоридом кальция, обработки риванолом. Эффективность отдельных методов в отношении удаления различных ингибиторов неодинакова. Первые три метода достаточны для удаления ингибиторов Г., вызываемой вирусами гриппа и парагриппа. Обработку сывороток каолином и ацетоном используют при работе с арбовирусами, риванолом, при изучении энтеровирусных инфекций. При выявлении антител к вирусу краснухи применяют обработку каолином, хлоридом магния и гепарином или сульфатом декстрана и хлоридом кальция.
Исследуемые в РТГА сыворотки освобождают также от агглютининов того вида эритроцитов, который используется при постановке-реакции. Это осуществляется путем адсорбции агглютининов концентрированной взвесью этих эритроцитов.
Техника постановки РГА и РТГА

Реакция непрямой (пассивной) гемагглютинации (РНГА или РПГА) имеет две основные разновидности: а) агглютинация эритроцитов, сенсибилизированных антигеном, иммунной сывороткой; б) агглютинация сенсибилизированных антителами эритроцитов в присутствии антигена. Различают две фазы реакции. Во время первой происходит изменение поверхностных свойств эритроцитов в результате адсорбции на них антигенов (или антител). Во второй фазе на сенсибилизированных эритроцитах адсорбируются антитела (или антигены) и происходит образование конгломератов.
Для диагностических целей с бактериальными антигенами РНГА была использована А. Т. Кравченко и М. И. Соколовым в 1946 г. В щелочной среде из бактериальных клеток извлекали полисахаридный антиген, адсорбировали на эритроцитах человека группы 0 и тотчас соединяли с диагностической сывороткой. Метод не требует выделения чистых культур бактерий, т. к. адсорбцию антигена можно проводить непосредственно из патол, материала. С помощью этой методики удавалось обнаружить такое количество антигена в 1 мл солевого р-ра, к-рое соответствует 50—100 млн. микробных тел, определяемых по оптическому стандарту.
РНГА по Кравченко и Соколову и ее модификации нашли применение в бактериологии, но возможности ее были ограничены тем, что на нативных эритроцитах можно адсорбировать лишь полисахаридные антигены, а не белки. Но в 1951 г. Бойден (S. V. Boyden) показал, что эритроциты, протравленные таниновой к-той, приобретают способность адсорбировать на своей поверхности и белки (см. Бойдена реакция).
В 1956 г. Рыцай (Т. Rycaj) модифицировал методику Бойдена: эритроциты сенсибилизируют антителами и используют для обнаружения различных антигенов. Для адсорбции на эритроцитах используют иммуноглобулин иммунных сывороток. РНГА по Рыцаю можно применять не только для индикации антигенов, но и для титрования сывороток, используя феномен гашения, или торможения, РНГА. В этом случае исследуемую сыворотку в соответствующих разведениях соединяют с антигеном, против к-рого предполагают обнаружить антитела, а потом добавляют сенсибилизированные эритроциты. При наличии антител антиген связывается ими и агглютинации не происходит. При исследовании сывороток как по оригинальной методике Бойдена, так и по Рыцаю из сыворотки предварительно следует удалить ингибиторы и гетерогемагглютинины.
Механизм РНГА изучен недостаточно; в связи с этим при подборе условий сенсибилизации эритроцитов разными антигенами и антителами, а также при выборе вида эритроцитов используется в основном эмпирический подход.
Адсорбционная активность нативных эритроцитов невелика, но ее удается повысить, обрабатывая эритроциты танином, акролеином, глутаровым альдегидом, бидиазотированными соединениями (агрегат-гемагглютинация).
Для создания стабильных препаратов ведутся разработки методов хим. присоединения антигена или антител к эритроцитам, в частности путем создания диазосвязей. С этой целью используют, напр., диазотированный бензидин, толулен-2,4-диизоцианат, растворимый в воде карбодимид, дифтородинитробензен. Описано использование борфторида 4,4-бис-дифенилдиазония для присоединения поликонденсированных антител к эритроцитам барана для индикации возбудителей клещевых риккетсиозов.
РНГА широко применяется в бактериологии. При чуме, холере, бруцеллезе и туляремии используют обе разновидности реакции, при скарлатине, дифтерии и дизентерии— только антигенный вариант, для обнаружения ботулинического токсина служат эритроциты, сенсибилизированные антителами.
В вирусол. исследованиях РНГА впервые была проведена с вирусами паротита и ньюкаслской болезни в 1946—1948 гг., затем после почти десятилетнего перерыва последовали сообщения о воспроизведении этой реакции с аденовирусами, вирусом герпеса, миксовирусами, вирусом осповакцины, арбовирусами, цитомегаловирусами, вирусом ящура, лейкозов кур и др. Оптимальные условия реакции для разных вирусов подбирают индивидуально.
Для выявления вируса клещевого энцефалита описана реакция в модификации Рыцая. Эритроциты, сенсибилизированные иммуноглобулином из сыворотки лошади, иммунной к клещевому энцефалиту, используют для индикации вирусов клещевого и шотландского энцефалита в культуре ВНК-21. Для этого вируссодержащую жидкость разводят в 1 % р-ре нормальной лошадиной сыворотки с коэффициентом 2. К 0,5 мл антигена каждого разведения добавляют 1—2 капли сенсибилизированных эритроцитов. Реакцию учитывают через 1—2 часа. Может быть применена РНГА для выявления вируса осповакцины и натуральной оспы как в лабораторных культурах, так и в патол, материале от больных (детрите и корках).
Библиография: Гайдамович С. Я. и Казале Дж. Сравнительное изучение гемагглютинирующих арбовирусных антигенов, приготовленных из тканевых культур и из мозга мышей, Вопр, вирусол., № 2, с. 238, 1968; Леви М. И. и Басова H. Н. Эритроцитарные диагностикумы и их применение в серологии, Пробл. особо-опасных инфекц., в. 2, с. 207, Саратов, 1970; Носков Ф. С. и др. Применение реакции непрямой гемагглютинации для лабораторной диагностики натуральной оспы, Вопр, вирусол., № 3, с. 347, 1972;
Рыцай Т. Обнаружение ботулинического токсина типа А в пищевых продуктах методом специфической гемагглютинации, Бюлл. Польск., акад. наук, т. 4, JsTs 9, с. 341, 1956.
Читайте также:


