Экспериментальные модели токсического гепатита
Одним из методов познания сложных механизмов развития патологических процессов в организме является биологическое моделирование. Для создания моделей, которые могли бы быть максимально полезными, необходимо выбрать один или два существенных признака, общих для оригинала и модели. Организм человека подвергается действию физических, химических, биологических, социальных факторов, что приводит в ряде случаев к развитию патологического процесса или болезни. Исследования, проводимые на животных, позволяют ответить на ряд вопросов, касающихся пусковых механизмов, общих звеньев патогенеза, и принципов терапии и профилактики ряда болезней. В настоящее время возможно воспроизвести в экспериментальных условиях практически любую модель патологии. Приведем несколько примеров видов моделирования патологических процессов на животных.
Создание модели экспериментального токсического гепатита. Для создания модели экспериментального токсического гепатита часто используется ССl4, который является органоспецифическим токсином, обладающим гепатотропным эффектом. После суточной пищевой депривации крысам с помощью специального зонда в пищевод вводят ССl4 в вазелиновом масле (доза – 0,064 мл на 100 г веса животного). Максимальный цитолиз гепатоцитов наблюдается на 3-4 сутки после однократного введения ССl4 /1/. Печень крыс, подвергнутых токсическому гепатиту, используется для дальнейших биохимических, морфологических, гистологических и других исследований. СС14-гепатит характеризуется развитием некроза, белковой и жировой дистрофии гепатоцитов, локализованных преимущественно в центральной зоне печеночной дольки, где максимальна активность зависимых от цитохрома Р-450 монооксигеназ и преобладает продукция повреждающих метаболитов гепатотоксина. Создание моделей патологических состояний на животных также позволяет изучать влияние новых гепатопротекторов на процессы регенерации паренхимы печени.
Создание моделей аутоиммунных заболеваний на примере ревматоидного артрита. Аутоиммунную патологию можно характеризовать как атаку иммунной системы против органов и тканей собственного организма, в результате которой происходят их структурно-функциональные повреждения. Морфологические изменения при аутоиммунных болезнях характеризуются воспалительными и дистрофическими изменениями в поврежденных органах. В клетках паренхимы выявляются зернистая дистрофия и некроз. В кровеносных сосудах отмечается мукоидное и фибриноидное набухание и некроз их стенок, тромбоз, вокруг сосудов формируются лимфоцитарно-макрофагальные и плазмоцитарные инфильтраты. В соединительной ткани стромы органов выявляются дистрофия в форме мукоидного и фибриноидного набухания, некроз и склероз. В селезенке и лимфатических узлах выражена гиперплазия, интенсивная инфильтрация лимфоцитами, макрофагами и плазматическими клетками. Адъювантный артрит у крыс. Хроническое иммунное воспаление моделируют у крыс субплантарным введением в правую заднюю лапу 0,1 мл адъюванта Фрейнда. Воспалительная реакция, как правило, оценивается в динамике каждые 2 дня /2/. Могут учитываться также и другие симптомы генерализованной реакции организма на введение адъюванта (отек ушей, хвоста, полиартрит, ухудшение общего состояния, снижение массы тела, гибель). Первичная реакция (отек на правой лапе) оценивается онкометрически на 3-й день после инъекции адъюванта. Вторичная иммунологическая реакция (отек на левой лапе) оценивается на 14-й день после введения адъюванта (при профилактической схеме введения) или на 25-й день (при лечебной схеме введения).
Модели экспериментальной онкологии. Арсенал моделей экспериментальной онкологии включает спонтанные, перевиваемые и индуцированные опухоли животных, культуры опухолей человека и животных, опухоли человека, привитые животным, и молекулярно-генетические модели. Спонтанныеопухоли обнаруживаются у животных, не подвергшихся каким-либо воздействиям со стороны экспериментатора. Показано, что у кроликов часто возникает вызываемая ДНК-содержащим вирусом спонтанная папиллома. Она представляет собой доброкачественные бородавчатые разрастания на коже ушей, которые впоследствии превращаются в злокачественную опухоль, метастазирующую в легкие и лимфоузлы. Эта модель с успехом применяется для решения проблем вирусологии и иммунологии опухолей. Из домашних животных в большей степени опухолями поражаются собаки. У них возникают опухоли разных органов, чаще молочных желез. Спонтанные опухоли собак иногда используют на последних предклинических этапах испытания противоопухолевых химических соединений. Опухоли могут быть индуцированы различными видами облучения, химическими канцерогенами, онковирусами. Модели индуцированных вирусами опухолей животных, а также модели злокачественно трансформированных под влиянием вирусов клеток, культивируемых в условиях in vitro, позволили не только раскрыть многие тайны вирусного канцерогенеза, но и создать общую концепцию молекулярных механизмов возникновения опухолей. Молекулярно-генетические модели. С развитием молекулярной биологии появилась возможность исследования механизмов злокачественной трансформации на молекулярном уровне. Интересующий экспериментатора ген может быть выделен из генома, клонирован (то есть получено много его копий) и расшифрована его структура. Кроме того, ген может быть перенесен в геном другого животного, которое будет называться трансгенным. Манипулирование с генами позволяет также осуществить выбивание (нокаут) определенного гена /3/.
Моделирование гипертонической болезни. В опытах на животных (собаки, обезьяны) была показана принципиальная возможность моделирования гипертонической болезни путем создания тяжелых невротических расстройств. Использование столкновения наиболее сильных врожденных рефлексов – полового и оборонительного приводило к невротическим состояниям со стойкими соматическими нарушениями в виде стабильного повышения артериального давления. В этих и других опытах было установлено, что сердечно-сосудистая патология, гипертоническая болезнь как ее изначальное проявление – наиболее частое соматическое проявление неврозов /4/.
Таким образом, моделирование патологических состояний на животных помогает выяснить этиологию, патогенез заболеваний, методы лечения и профилактики. Биологическое моделирование также широко используется на доклинической стадии при исследовании механизмов действия новых лекарственных препаратов.

Владельцы патента RU 2564758:
Изобретение относится к медицине, а именно к экспериментальной биологии, токсикологии, и может быть использовано для изучения формирования и прогрессирования изменений печени, возникающих под действием токсико-химических повреждающих факторов. Для этого предложен способ моделирования подострого токсического поражения печени. Способ включает введение крысам-самцам перорально в течение 21 дня формалина. Введение осуществляют через день, из расчета 0,2 мл на 100 г массы животного. Одновременно воздействуют 10% раствором этанола, который используют вместо питьевой воды свободным поением животных. Способ обеспечивает развитие выраженных дегенеративных повреждений практически всех участков печени, что подтверждается повышением трансаминаз в сыворотке крови, креатининемией, снижением синтетической функции печени и развитием холестаза. 1 табл., 3 пр.
Изобретение относится к медицине, а именно к экспериментальной биологии, токсикологии, и может быть использовано для изучения способов формирования и изучения прогрессирования изменений в печени, возникающих в эксперименте, под действием токсико-химических повреждающих факторов.
Основными инициаторами неинфекционных заболеваний печени у людей являются неправильное питание и злоупотребление алкоголем. Кроме того, разнообразные химические вещества, широко применяемые в промышленности, зачастую вызывают токсические поражения, сопровождающиеся различными нарушениями ферментативного равновесия в ней и изменением активности ферментов печеночного поражения. В связи с этим для изучения механизмов формирования неинфекционных заболеваний печени и возможности их профилактики и лечения природными факторами требуются экспериментальные модели, наиболее приближенные к реальным клиническим условиям.
Известны способы моделирования токсического гепатита у крыс путем помещения животного в клетку с открытым резервуаром, наполненным 70%-ным раствором формалина. В этих условиях лабораторные животные содержатся в течение 5-7 месяцев (пат. RU 94026117. Способ создания модели гепатита печени млекопитающих. Бояринов Г.А., Смирнов В.П., Кауров Я.В. и др., опубл. 27.08.1996), а также трехкратного подкожного введения масляного раствора четыреххлористого углерода (CCl4) с интервалом инъекций в 4 суток, из расчета 0,45 мл раствора на 100 г массы тела животного в течение 44 дней (Глушакова Е.С.Функциональное состояние печени в норме при экспериментальном токсическом гепатите и его физиотерапевтической коррекции в разные фазы окологодового цикла: автореферат дис. канд. биол. наук: 14.00.51, 14.00.16 / Глушакова Елена Сергеевна. - Томск, 2005. - 20 с).
Недостатками перечисленных выше способов моделирования токсической гепатопатии являются трудоемкий и длительный период моделирования от одного до семи месяцев, воздействие формалина на дыхательную и сердечно-сосудистую системы. Кроме того, при создании концентраций аэрозолей и удержании на заданном уровне в затравочных камерах отмечаются значительные трудности. Кроме того, количество вещества, попавшее в организм, зависит не только от его концентрации в воздухе, но и от степени его дисперсности в воздухе, а также от индивидуально выраженных защитных способностей верхних дыхательных путей лабораторных животных, что приводит к очень низкой степени воспроизводимости результатов исследования. Введение 50% масляного раствора четыреххлористого углерода в виде инъекций отличается от формирования большинства профессиональных заболеваний токсическими веществами путем поступления в организм ингаляционно или per os.
Наиболее близким по технической сущности к предлагаемому изобретению является способ инициации токсического гепатита посредством поения животных 10% раствором этанола в сочетании с инъекциями 50% масляного раствора четыреххлористого углерода с интервалом инъекций в 4 суток из расчета 0,45 мл раствора на 100 г массы животного в течение 30 дней (Скакун Н.П. Эффективность антиоксидантов при комбинированном поражении печени четыреххлористым углеродом и этанолом / Н.П. Скакун, С.Ф.Ковальчук // Фармакология и токсикология. - 1987. - №3. - С. 104-107).
Недостатком данного способа является способ введения четыреххлористого углерода, а также длительность создания экспериментальной патологической модели. При этом следует отметить, что основным временным показателем для создания экспериментальных моделей подострого токсического гепатита токсическими веществами является 21 день, что четко соблюдается при нашем варианте моделирования.
Техническим результатом предлагаемого способа является решение задачи, заключающейся в создании модели токсического гепатита 10% этанолом в сочетании с формалином в более короткие сроки, и с соответствующей картиной поражения, более физиологичным способом, с высокой воспроизводимостью, что позволяет более полно изучить патофизиологические механизмы развития патологии. Преимущества предлагаемой модели в том, что она легко воспроизводима, результат достигается за более короткий промежуток времени по сравнению с прототипом. Повышение воспроизводимости формирования подострого патологического процесса в печени и сокращение сроков опыта достигаются за счет потенцирования гепатотоксического эффекта, вызванного воздействием 10% раствором этанола и формалина.
Указанный технический результат достигается воздействием токсического средства, которое вводят крысам-самцам перорально шприцем в течение 21 дня, в качестве токсического средства используют формалин (CH2O), который вводят через день, из расчета 0,2 мл на 100 г массы животного с одновременным ежедневным использованием вместо питьевой воды 10% раствора этанола (С2Н5ОН) свободным поением.
Способ осуществлялся следующим образом. Для достижения адекватности предлагаемой модели изучено 50 крыс-самцов линии Вистар массой тела 180-200 г, разделенных на группы. Первую группу представляют 10 интактных животных. 20 крысам-самцам, представляющим вторую группу, вводят токсическое средство через день перорально, шприцем, в течение 21 дня, в качестве токсического средства используют формалин (СН2О) из расчета 0,2 мл на 100 г массы животного, с одновременным ежедневным использованием вместо питьевой воды 10% раствора этанола (С2Н5ОН) свободным поением.
20 крысам-самцам третьей группы инициируют токсическое поражение печени путем поения животных 10% раствором этанола ежедневно вместо питьевой воды в сочетании с инъекциями 50% масляного раствора четыреххлористого углерода (CCL4) с интервалом инъекций в 4 суток из расчета 0,45 мл на 100 г массы тела животного в течение 30 дней по способу прототипа.
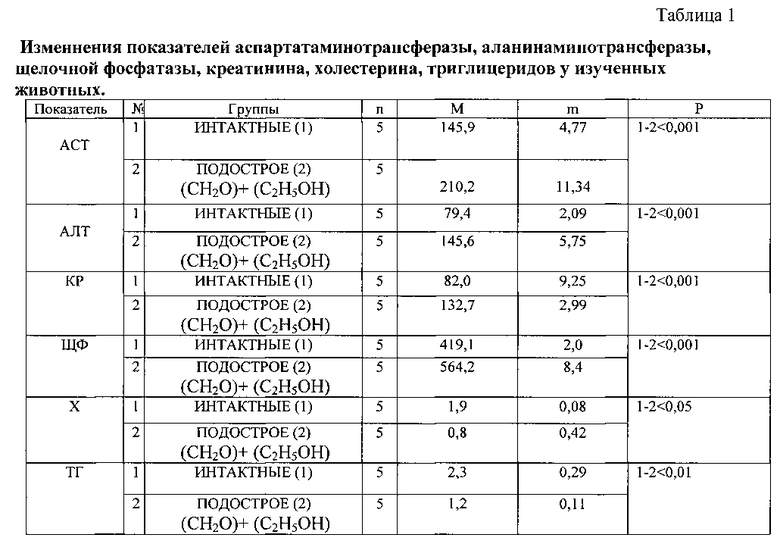
На 21 день животных декапитируют с последующим проведением лабораторных тестов. Изучают содержание в сыворотке крови аспартатаминотрансферазы (ACT) и аланинаминотрансферазы (АЛТ) в (Ед/л), креатинина (КР) в (мкмоль/л), щелочной фосфатазы (ЩФ) в (МЕ/л), холестерина (X) в (ммоль/л), триглицеридов (ТГ) в (ммоль/л).
Приготовление формалина (CH2O) производили путем растворения формальдегида в воде до концентрации 40%, и разведения 96° спирта до 10%-ной концентрации.
Способ апробирован в условиях отдела изучения механизмов действия физических факторов (ОИМДФФ) ФГБУ ПГНИИК ФМБА России.
Способ может быть проиллюстрирован следующими примерами.
Пример №1. Интактная крыса-самец линии Вистар №5, масса тела 190 г. Дополнительных воздействий не получает. Исследование животного осуществляется одновременно с животными опытной группы. Содержание в крови КР - 78,2 мкмоль/л, ЩФ - 395,4 МЕ/л, ACT - 141,3 Ед/л, АЛТ - 83,4 Ед/л, X - 1,9 ммоль/л, ТГ - 2,3 ммоль/л.
Пример №2. Крыса-самец линии Вистар №13, масса тела - 200 г. Осуществляют поение животного 10% раствором этанола ежедневно вместо питьевой воды в сочетании с инъекциями 50% масляного раствора четыреххлористого углерода (CCl4) с интервалом инъекций в 4 суток в течение 30 дней из расчета 0,45 мл на 100 г массы тела животного. КР - 112,7 мкмоль/л, ЩФ - 477,2 МЕ/л, ACT - 200,0 Ед/л, АЛТ - 105,8 Ед/л, X - 1,8 ммоль/л, ТГ - 1,6 ммоль/л. Результат расценен как подострое отравление.
Пример №3. Крыса-самец №35 линии Вистар, масса тела 195 г. Вводят токсическое средство через день перорально шприцем в течение 21 дня, в качестве токсического средства используют формалин (CH2O) из расчета 0,2 мл на 100 г массы животного с одновременным ежедневным использованием вместо питьевой воды 10% раствора этанола (С2Н5ОН) свободным поением.
Содержание в крови КР - 86,7 мкмоль/л, ЩФ - 591,2 МЕ/л, ACT - 215,1 Ед/л, АЛТ - 138,4 Ед/л, X - 0,9 ммоль/л, ТГ - 1,2 ммоль/л. Результат расценен как подострое отравление.

Из представленной таблицы следует, что увеличение содержания ACT; АЛТ (Р Изобретение относится к медицине, экспериментальной хирургии и может быть использовано для лечения, коррекции и профилактики последствий ишемического воздействия на печень в условиях временного ее выключения из кровообращения.
Описание патента на изобретение RU2564758C1
Изобретение относится к медицине, а именно к экспериментальной биологии, токсикологии, и может быть использовано для изучения способов формирования и изучения прогрессирования изменений в печени, возникающих в эксперименте, под действием токсико-химических повреждающих факторов.
Основными инициаторами неинфекционных заболеваний печени у людей являются неправильное питание и злоупотребление алкоголем. Кроме того, разнообразные химические вещества, широко применяемые в промышленности, зачастую вызывают токсические поражения, сопровождающиеся различными нарушениями ферментативного равновесия в ней и изменением активности ферментов печеночного поражения. В связи с этим для изучения механизмов формирования неинфекционных заболеваний печени и возможности их профилактики и лечения природными факторами требуются экспериментальные модели, наиболее приближенные к реальным клиническим условиям.
Известны способы моделирования токсического гепатита у крыс путем помещения животного в клетку с открытым резервуаром, наполненным 70%-ным раствором формалина. В этих условиях лабораторные животные содержатся в течение 5-7 месяцев (пат. RU 94026117. Способ создания модели гепатита печени млекопитающих. Бояринов Г.А., Смирнов В.П., Кауров Я.В. и др., опубл. 27.08.1996), а также трехкратного подкожного введения масляного раствора четыреххлористого углерода (CCl4) с интервалом инъекций в 4 суток, из расчета 0,45 мл раствора на 100 г массы тела животного в течение 44 дней (Глушакова Е.С.Функциональное состояние печени в норме при экспериментальном токсическом гепатите и его физиотерапевтической коррекции в разные фазы окологодового цикла: автореферат дис. канд. биол. наук: 14.00.51, 14.00.16 / Глушакова Елена Сергеевна. - Томск, 2005. - 20 с).
Недостатками перечисленных выше способов моделирования токсической гепатопатии являются трудоемкий и длительный период моделирования от одного до семи месяцев, воздействие формалина на дыхательную и сердечно-сосудистую системы. Кроме того, при создании концентраций аэрозолей и удержании на заданном уровне в затравочных камерах отмечаются значительные трудности. Кроме того, количество вещества, попавшее в организм, зависит не только от его концентрации в воздухе, но и от степени его дисперсности в воздухе, а также от индивидуально выраженных защитных способностей верхних дыхательных путей лабораторных животных, что приводит к очень низкой степени воспроизводимости результатов исследования. Введение 50% масляного раствора четыреххлористого углерода в виде инъекций отличается от формирования большинства профессиональных заболеваний токсическими веществами путем поступления в организм ингаляционно или per os.
Наиболее близким по технической сущности к предлагаемому изобретению является способ инициации токсического гепатита посредством поения животных 10% раствором этанола в сочетании с инъекциями 50% масляного раствора четыреххлористого углерода с интервалом инъекций в 4 суток из расчета 0,45 мл раствора на 100 г массы животного в течение 30 дней (Скакун Н.П. Эффективность антиоксидантов при комбинированном поражении печени четыреххлористым углеродом и этанолом / Н.П. Скакун, С.Ф.Ковальчук // Фармакология и токсикология. - 1987. - №3. - С. 104-107).
Недостатком данного способа является способ введения четыреххлористого углерода, а также длительность создания экспериментальной патологической модели. При этом следует отметить, что основным временным показателем для создания экспериментальных моделей подострого токсического гепатита токсическими веществами является 21 день, что четко соблюдается при нашем варианте моделирования.
Техническим результатом предлагаемого способа является решение задачи, заключающейся в создании модели токсического гепатита 10% этанолом в сочетании с формалином в более короткие сроки, и с соответствующей картиной поражения, более физиологичным способом, с высокой воспроизводимостью, что позволяет более полно изучить патофизиологические механизмы развития патологии. Преимущества предлагаемой модели в том, что она легко воспроизводима, результат достигается за более короткий промежуток времени по сравнению с прототипом. Повышение воспроизводимости формирования подострого патологического процесса в печени и сокращение сроков опыта достигаются за счет потенцирования гепатотоксического эффекта, вызванного воздействием 10% раствором этанола и формалина.
Указанный технический результат достигается воздействием токсического средства, которое вводят крысам-самцам перорально шприцем в течение 21 дня, в качестве токсического средства используют формалин (CH2O), который вводят через день, из расчета 0,2 мл на 100 г массы животного с одновременным ежедневным использованием вместо питьевой воды 10% раствора этанола (С2Н5ОН) свободным поением.
Способ осуществлялся следующим образом. Для достижения адекватности предлагаемой модели изучено 50 крыс-самцов линии Вистар массой тела 180-200 г, разделенных на группы. Первую группу представляют 10 интактных животных. 20 крысам-самцам, представляющим вторую группу, вводят токсическое средство через день перорально, шприцем, в течение 21 дня, в качестве токсического средства используют формалин (СН2О) из расчета 0,2 мл на 100 г массы животного, с одновременным ежедневным использованием вместо питьевой воды 10% раствора этанола (С2Н5ОН) свободным поением.
20 крысам-самцам третьей группы инициируют токсическое поражение печени путем поения животных 10% раствором этанола ежедневно вместо питьевой воды в сочетании с инъекциями 50% масляного раствора четыреххлористого углерода (CCL4) с интервалом инъекций в 4 суток из расчета 0,45 мл на 100 г массы тела животного в течение 30 дней по способу прототипа.
На 21 день животных декапитируют с последующим проведением лабораторных тестов. Изучают содержание в сыворотке крови аспартатаминотрансферазы (ACT) и аланинаминотрансферазы (АЛТ) в (Ед/л), креатинина (КР) в (мкмоль/л), щелочной фосфатазы (ЩФ) в (МЕ/л), холестерина (X) в (ммоль/л), триглицеридов (ТГ) в (ммоль/л).
Приготовление формалина (CH2O) производили путем растворения формальдегида в воде до концентрации 40%, и разведения 96° спирта до 10%-ной концентрации.
Способ апробирован в условиях отдела изучения механизмов действия физических факторов (ОИМДФФ) ФГБУ ПГНИИК ФМБА России.
Способ может быть проиллюстрирован следующими примерами.
Пример №1. Интактная крыса-самец линии Вистар №5, масса тела 190 г. Дополнительных воздействий не получает. Исследование животного осуществляется одновременно с животными опытной группы. Содержание в крови КР - 78,2 мкмоль/л, ЩФ - 395,4 МЕ/л, ACT - 141,3 Ед/л, АЛТ - 83,4 Ед/л, X - 1,9 ммоль/л, ТГ - 2,3 ммоль/л.
Пример №2. Крыса-самец линии Вистар №13, масса тела - 200 г. Осуществляют поение животного 10% раствором этанола ежедневно вместо питьевой воды в сочетании с инъекциями 50% масляного раствора четыреххлористого углерода (CCl4) с интервалом инъекций в 4 суток в течение 30 дней из расчета 0,45 мл на 100 г массы тела животного. КР - 112,7 мкмоль/л, ЩФ - 477,2 МЕ/л, ACT - 200,0 Ед/л, АЛТ - 105,8 Ед/л, X - 1,8 ммоль/л, ТГ - 1,6 ммоль/л. Результат расценен как подострое отравление.
Пример №3. Крыса-самец №35 линии Вистар, масса тела 195 г. Вводят токсическое средство через день перорально шприцем в течение 21 дня, в качестве токсического средства используют формалин (CH2O) из расчета 0,2 мл на 100 г массы животного с одновременным ежедневным использованием вместо питьевой воды 10% раствора этанола (С2Н5ОН) свободным поением.
Содержание в крови КР - 86,7 мкмоль/л, ЩФ - 591,2 МЕ/л, ACT - 215,1 Ед/л, АЛТ - 138,4 Ед/л, X - 0,9 ммоль/л, ТГ - 1,2 ммоль/л. Результат расценен как подострое отравление.
Из представленной таблицы следует, что увеличение содержания ACT; АЛТ (Р RU2564758C1
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ МОДЕЛИРОВАНИЯ ПОДОСТРОГО ТОКСИЧЕСКОГО ПОРАЖЕНИЯ ПЕЧЕНИ ФОРМАЛИНОМ | 2016 |
| RU2627444C1 |
| СПОСОБ МОДЕЛИРОВАНИЯ ХРОНИЧЕСКОЙ ИНТОКСИКАЦИИ ФОРМАЛИНОМ В ТОКСИКОЛОГИЧЕСКОМ ЭКСПЕРИМЕНТЕ | 2014 |
| RU2564761C1 |
| СПОСОБ МОДЕЛИРОВАНИЯ ТОКСИЧЕСКОГО ПОРАЖЕНИЯ ЧЕТЫРЕХХЛОРИСТЫМ УГЛЕРОДОМ В ТОКСИКОЛОГИЧЕСКОМ ЭКСПЕРИМЕНТЕ | 2011 |
| RU2487421C1 |
| КОМПОЗИЦИЯ И ПРИМЕНЕНИЕ КОМПОЗИЦИИ ДЛЯ ПОЛУЧЕНИЯ СРЕДСТВА, ОБЛАДАЮЩЕГО ГЕПАТОПРОТЕКТИВНОЙ АКТИВНОСТЬЮ | 2012 |
| RU2485970C1 |
| СПОСОБ МОДЕЛИРОВАНИЯ ОСТРОГО ЖИРОВОГО ГЕПАТОЗА БЕРЕМЕННЫХ | 2015 |
| RU2610536C1 |
| ПРИМЕНЕНИЕ АЦИЗОЛА В КАЧЕСТВЕ ГЕПАТОПРОТЕКТОРА | 2004 |
| RU2260427C1 |
| СПОСОБ ЛЕЧЕНИЯ ЗАБОЛЕВАНИЙ ПЕЧЕНИ РАЗЛИЧНОГО ГЕНЕЗА | 2009 |
| RU2400233C1 |
| (Z)-МЕТИЛ-16-(5-ОКСО-2-ФЕНИЛ-ОКСАЗОЛ-4-ИЛИДЕНМЕТИЛ)-15,16-ЭПОКСИ-8(17),13(16),14-ЛАБДАТРИЕН-18-ОАТ, ОБЛАДАЮЩИЙ АНТИОКСИДАНТНОЙ, ГЕПАТОПРОТЕКТОРНОЙ И ГЕМОСТИМУЛИРУЮЩЕЙ АКТИВНОСТЬЮ | 2007 |
| RU2353620C1 |
| ПРИМЕНЕНИЕ ПОЛИДАТИНА ДЛЯ ЛЕЧЕНИЯ ЗАБОЛЕВАНИЙ ПЕЧЕНИ И ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ НА ОСНОВЕ ПОЛИДАТИНА | 2011 |
| RU2468803C2 |
| СПОСОБ МОДЕЛИРОВАНИЯ ХРОНИЧЕСКОЙ ТОКСИЧЕСКОЙ ГЕПАТОПАТИИ | 2010 |
| RU2440621C1 |
Реферат патента 2015 года СПОСОБ МОДЕЛИРОВАНИЯ ТОКСИЧЕСКОГО ГЕПАТИТА ФОРМАЛИНОМ И ЭТИЛОВЫМ СПИРТОМ В ТОКСИКОЛОГИЧЕСКОМ ЭКСПЕРИМЕНТЕ
Изобретение относится к медицине, а именно к экспериментальной биологии, токсикологии, и может быть использовано для изучения формирования и прогрессирования изменений печени, возникающих под действием токсико-химических повреждающих факторов. Для этого предложен способ моделирования подострого токсического поражения печени. Способ включает введение крысам-самцам перорально в течение 21 дня формалина. Введение осуществляют через день, из расчета 0,2 мл на 100 г массы животного. Одновременно воздействуют 10% раствором этанола, который используют вместо питьевой воды свободным поением животных. Способ обеспечивает развитие выраженных дегенеративных повреждений практически всех участков печени, что подтверждается повышением трансаминаз в сыворотке крови, креатининемией, снижением синтетической функции печени и развитием холестаза. 1 табл., 3 пр.
Формула изобретения RU 2 564 758 C1
Способ моделирования подострого токсического поражения печени, включающий воздействие токсическим средством, которое вводят крысам-самцам перорально шприцем в течение 21 дня, отличающийся тем, что в качестве токсического средства используют формалин (CH2O), который вводят через день из расчета 0,2 мл на 100 г массы животного с одновременным ежедневным использованием вместо питьевой воды 10% раствора этанола (С2Н5ОН) свободным поением.
Гепатотоксичность – это свойство химических веществ, действуя на организм немеханическим путем, вызывать структурно-функциональные нарушения печени [24,69]. Гепатотоксичностью обладают природные соединения, продуцируемые растениями, грибами, микроорганизмами, минералы, продукты химической и фармацевтической промышленности, отходы этих видов производственной деятельности, однако лишь некоторые из числа перечисленных, к которым порог чувствительности печени существенно ниже чем других органов и систем условно могут быть названы гепатотоксикантами [69,90]. Наиболее важное токсикологическое значение имеют хлорированные углеводороды и полихлорированные бифенилы.
Высокая чувствительность печени к химическим соединениям определяется несколькими обстоятельствами.
Во-первых, печень – это первый орган, стоящий на пути ксенобиотика, резорбировавшегося во внутренние среды организма. Во-вторых, печень – это основной орган, ответственный за метаболизм чужеродных веществ. Поскольку биопревращение ксенобиотика сопряжено с образованием высоко реакционноспособных промежуточных продуктов и инициацией свободнорадикальных процессов, в ходе метаболизма весьма вероятно повреждение органа.
Проведение гигиенических мероприятий позволило существенно оздоровить условия труда на производстве, поэтому случаи острых токсических поражений печени редки. Однако подострое и хроническое поражение печени отмечают достаточно часто [47,90].
Изменения со стороны органа у лиц, подвергшихся воздействию токсиканта, могут быть трудно диагностируемы. Рутинные методы исследования порой оказываются недостаточно чувствительными, чтобы выявить неблагоприятный эффект от длительного действия производственного токсиканта.
В таких случаях патологию логично выявить только с помощью специальных методов диагностики. Поэтому гепатотоксическое действие может развиваться постепенно, в течение нескольких месяцев и даже лет, при этом оставаясь нераспознанным [26].
Клинические проявления токсических поражений печени многообразны – от бессимптомных кратковременных изменений биохимических тестов до длительной желтухи и тяжелой печеночной недостаточности. Литература, посвященная тому вопросу, подтверждает сложность проблемы из-за разнообразия клинического материала [24,88,89], а также из-за взаимосвязанности патологических процессов у одного и того же пациента, особенностей генетического полиморфизма ферментов метаболизма ксенобиотиков и связанных с этим вариантов фармакологического ответа [32,88].
Молекулярной основой генетического полиморфизма является наличие мутантных аллелей генов. В организме человека полиморфными являются гены цитохром-зависимых монооксигенов [СУР 4505]: СУР ½, СУР 2А6, СУР 2С9, СУР2Д6, СУР2Е [26]. Основными осложнениями гепатотоксичности являются: гепатопатии, токсические гепатиты, фиброз и цирроз печени [18,99]. Чаще других встречаются токсические гепатопатии (повышение активности аминотрансфераз, фосфатаз, гипербилирубинемия) [13,41].
Морфологические проявления гепатотоксичности вариабельны и, как правило, характеризуются гепатоцеллюлярными и холестатическими нарушениями [24,26]. Структурными маркерами гепатотоксичности являются центральный (метаболический) и перисинусоидальный фиброз, центролобулярные некрозы, мелкокапельная жировая дистрофия гепатоцитов и интрагепатоцеллюлярный холестаз [13,18]. Различают следующие морфологические варианты поражения печени: некроз гепатоцитов I зоны ацинуса; митохондриальные цитопатии; фиброз; стеатогепатит; поражение сосудов; паренхиматозно-канальцевый холестаз; внутрипротоковый холестаз; склерозирующий холангит [1,13,18]. Механизмы гепатотоксичности галогенированных углеводородов связывают с мембраноповреждающим эффектом, который приводит к расстройству функционирования каскада митохондриальных и микросомальных ферментов, участвующих в поддержании гомеостаза клетки, ее репарации и элиминации ксенобиотиков [7,24,26] (рисунок).
С учетом современной структуры этиологических факторов, инициирующих развитие острых токсических нарушений печени преобладают этанол и лекарственные препараты [38,77]. В то же время, промышленные токсиканты так же являются самыми распространенными факторами токсического поражения печени у людей [26,47]. Наибольшее значение с токсикологической точки зрения имеют хлорированные углеводороды – тетрахлорметан (ТХМ) и дихлорэтан (ДХЭ). [47].
Механизмы гепатотоксичности ТХМ и ДХЭ связывают с прямым ингибирующим влиянием на клеточные мембраны и мультиферментную систему цитохрома Р-450 зависимых монооксигенез, основная функция которой заключается в превращении гидрофобных липофильных молекул в их полярные водорастворимые аналоги. Образующиеся метаболиты превращаются в еще более полярные и легко экскретируемые соединения при участии форменных систем II фазы биотрансформации: глутатион-S-трансферазы, глутатионпероксидазы, сульфотрансферазы, эпоксигидролазы, УДФ – глюкуронилтрансферазы, глутатионредуктазы и др. [7,24,26,58].
При участии цитохрома Р-450 в ходе монооксигенирования ксенобиотиков образуются реактивные метаболиты, реализующие специфические эффекты, в то же время осуществляется выведение токсических продуктов из организма путем реакции конъюгирования.

Принципиальная схема патогенного действия галогенированных углеводородов с учетом свободно-радикального механизма повреждения
На основании этих представлений сформировано положение о том, что подавление монооксигеназ, участвующих в биотрансформации ксенобиотиков снижает их биологическую активность не только за счет индукции резистентности, но и в результате неблагоприятного воздействия на метаболические превращения [1,7,24]. Ингибирование монооксигеназ сопровождается увеличением проявлений их токсического действия [1,7,26]. В результате развивается печеночная недостаточность со снижением детоксицирующей функции печени, что способствует поддержанию в крови высоких концентраций ксенобиотиков и их активированных метаболитов – так формируется порочный круг органных поражений.
Независимо от повреждающего фактора: ТХМ или ДХЭ, одним из первых звеньев цепочки патологических нарушений (токсогенеза) является мембраноповреждающий эффект, который приводит к расстройству функционирования каскада микросомальных и митохондриальных ферментов, участвующих в поддержании гомеостаза клетки, ее репарации и элиминации ксенобиотиков (или их метаболитов) [65].
Следующим этапом становится нарушение энергообразования в клетке, и как следствие, избыточное образование свободных радикалов, что в свою очередь приводит к двум типичным интегральным механизмам повреждения и гибели клеток: гипоксическому и свободнорадикальному некробиозу. Возникший порочный круг не дает возможности гепатоцитам реализовать механизмы естественной цитопротекции [24,41,65]. С точки зрения фармакологической коррекции, весьма существенной помощью для клеток печени являются два основных принципа:
1) восстановление энергетического обеспечения (энергокоррекция).
2) антиоксидантная цитопротекция.
Таким образом, несмотря на различные этиологические факторы при остром токсическом поражении печени, имеет место цитолиз, обусловленный начальными механизмами гипоксического и свободнорадикального некробиоза [65].
Влияние глицирризиновой кислоты на окислительный статус клетки возможен и через регуляцию активности монооксигеназной системы. В литературе имеются данные о вероятности реализации антиоксидантного эффекта тритерпеноидов и на геномном уровне. В частности, показано снижение в гепатоцитах мРНК СУР2Е1 – главного прооксидантного фермента цитохрома Р-450- под влиянием 18β – глицирризиновой кислоты [18]. Принципиальная возможность антиоксидантного действия на геномном уровне недавно установлена нами и для оксиметилурацила [34].
Комплексное соединение оксиметилурацила содержащее сукцинат натрия способствовало восстановлению белоксинтезирующей функции печени благодаря мембраностабилизирующему действию, что доказывается оценкой состояния системы ПОЛ-АОС [63,69,70].
Коррекция (ограничение) гепатотоксичности экотоксикантов антиоксидантами также являются актуальной научной задачей. Арсенал таких средств достаточно широк и представлен природными и синтетическими антиоксидантами [1,10,16,26,32].
Среди последних важное значение приобретают производные пиримидина – синтез, безопасность, доступность и биологическая активность которых определили их широкое применение в медицинской практике. [21,22,23,29,30,71].
В меньшей степени исследованы другие антиоксиданты пиримидиновой структуры – 5-аминоурацил, 5-амино-6-метилурацил, 5-гидрокси-1,3,6-триметилурацил, а также комплексные соединения производных 5-гидрокси-6-метилурацила с полифункциональными карбоновыми кислотами – янтарной, фумаровой, аскорбиновой, лимонной, также проявляющими антиоксидантную активность [22,55,56,63].
В фармакологической коррекции токсических повреждений, вызванных свободнорадикальными процессами, успех в изыскании эффективных антиоксидантов может быть достигнут лишь при условии выяснения характера прооксидантного действия ядов, природы необходимого при этом антиоксидантного воздействия и учета общих механизмов токсичности. Только при таком подходе эти препараты могут быть причислены к истинным средствам патогенетической терапии. Накопленный опыт свидетельствует о чрезвычайной сложности этой проблемы. К химическим веществам, обладающим антиоксидантной активностью, относится огромное число соединений. Механизмы их антиоксидантного действия весьма разнообразны. Часть из них устраняет убыль природных антиоксидантов. Так действуют α-токоферол, тиолы, каротиноиды. Некоторые из них активируют супероксиддисмутазу, стимулируя тем самым перевод высокотоксического супероксидного анионрадикала в менее токсичную перекись водорода. Применение таких антиоксидантов целесообразно при интоксикациях ядами, угнетающими активность супероксиддисмутазы. Другие антиоксиданты осуществляют свой эффект, взаимодействуя с теми или иными активными формами кислорода. Наконец, многочисленные антиоксиданты обладают в той или иной степени комплексообразующими свойствами и, взаимодействуя с микроэлементами, тормозят их биокаталитическое действие, угнетая активность ряда ферментов [8,19,21,31,57,58,59,60].
В настоящем разделе обзора представлены обобщающие сведения об антиоксидантных эффектах производных пиримидина при различных формах токсического процесса с момента установления в 1982 году у 5-гидрокси-6-метилурацила антиоксидантных свойств (таблица). Данные о наличии самостоятельной антиоксидантной активности у исследованных производных пиримидина и особенностях механизма их действия получены на основе комплексного изучения их влияния на свободнорадикальные процессы в модельных системах различной сложности в совокупности с антиоксидантной защитой, проявляемой препаратами in vivo [38-64; 66-70; 74,75,76].
Антиоксидантные эффекты производных пиримидина при различных формах токсического процесса
Читайте также:


