Днк геномные вирусы герпеса
1. Классификация и характеристика ДНК-геномных вирусов
2. Вирус папилломы человека. Характеристика. Онкогенность. Лабораторная диагностика
3. Вирус полиомы человека. Характеристика. Онкогенность
1. Классификация и характеристика ДНК-геномных вирусов
ДНК-содержащие вирусы – вирусы, геном которых представлен дезоксирибонуклеиновой кислотой и репликация идет посредством ДНК-зависимой ДНК-полимеразы, без использования промежуточного звена-посредника РНК.
Геномная ДНК этих вирусов может быть двуцепочечной или одноцепочечной и иметь линейную или кольцевую форму.
| ДНК-содержащие вирусы | Наличие суперкапсида | Размер вириона в нанометрах | Типовые представители |
| Аденовирусы | Отсутствует | 70-90 | Аденовирусы человека 42 типов |
| Гепаднавирусы | Имеется | 45-50 | Вирус гепатита В |
| Герпесвирусы | Имеется | 200 | Вирусы простого герпеса, цитомегалии, Эпстайна-Барр |
| Паповавирусы | Отсутствует | 45-55 | Вирусы папилломы, полиомы |
| Парвовирусы | Отсутствует | 18-26 | Аденоассоциированный вирус |
| Поксвирусы | Имеется | 130-240 | Вирусы осповакцины |
Геномы большинства ДНК-содержащих вирусов (за исключением поксвирусов) транскрибируются в ядре клетки-хозяина с помощью клеточной РНК-полимеразы II . Синтез и процессинг мРНК у этих вирусов практически полностью осуществляется за счет клеточных механизмов (несколько вирусных белков участвуют только в регуляции транскрипции).
У многих ДНК-содержащих вирусов транскрипция происходит в три этапа, во время которых избирательно считываются сверхранние, ранние и поздние гены.
Нуклеокапсиды герпесвирусов проникают в цитоплазму вместе с белками матрикса, затем этот комплекс транспортируется вдоль микротрубочек к порам ядерной оболочки и далее в ядро. Белки матрикса вместе с клеточными факторами транскрипции запускают транскрипцию сверхранних генов. У герпесвирусов продукты сверхранних генов, так называемые сверхранние белки, играют роль трансактиваторов и необходимы для начала транскрипции ранних генов. Однако у других ДНК-содержащих вирусов транскрипция ранних генов может происходить и без участия сверхранних белков.
Большинство ранних генов кодируют белки, осуществляющие репликацию вирусной ДНК и запуск транскрипции поздних генов. Поздние гены кодируют главным образом структурные белки, необходимые для сборки вирусов и их выхода из зараженной клетки. Транскрипция поздних генов зависит от репликации ДНК и прекращается в присутствии ингибиторов репликации.
Для каждого семейства ДНК-содержащих вирусов характерен уникальный механизм репликации ДНК.
Геном герпесвирусов представлен линейной ДНК, которая в зараженной клетке замыкается в кольцо. Кольцевые молекулы вирусной ДНК реплицируются по механизму "катящегося кольца" с образованием длинных линейных конкатемерных молекул, состоящих из многих копий генома. Затем конкатемерные молекулы расщепляются на полноценные геномы. В репродукции герпесвирусов участвуют вирусные ДНК-полимераза и ферменты, увеличивающие внутриклеточную концентрацию дезоксинуклеозидтрифосфатов - структурных элементов ДНК.
Репликация линейных геномов аденовирусов происходит при участии вирусной ДНК-полимеразы и нуклеотид-белкового комплекса, выполняющего роль праймера.
Двухцепочечные кольцевые геномы паповавирусов реплицируются с сохранением кольцевой структуры. Репликация осуществляется клеточными ферментами, а для запуска репликации необходим ранний вирусный белок - Т-антиген.
Изредка геномы паповавирусов (например, папилломавирусов) встраиваются в хромосому зараженной клетки, что приводит к усиленной экспрессии вирусных белков и неконтролируемому делению клетки. Интеграция паповавирусов в клеточный геном может стать причиной злокачественного новообразования, например рака шейки матки.
В отличие от репродукции других ДНК-содержащих вирусов, репродукция поксвирусов полностью происходит в цитоплазме. Эти вирусы содержат факторы транскрипции, РНК-полимеразу, а также набор ферментов, обеспечивающих процессинг мРНК (присоединение 7-метилгуанозина, полиаденилирование). Геном поксвирусов имеет уникальное строение: комплементарные цепи двухцепочечной ДНК на обоих концах ковалентно соединены между собой, так что в действительности геном состоит из одноцепочечной кольцевой молекулы ДНК. Кроме того, в геноме имеются инвертированные концевые повторы. Репликация вирусной ДНК начинается с расщепления одной из цепей в области инвертированных концевых повторов; затем одновременно на обоих концах генома начинается синтез комплементарной цепи, который осуществляет вирусная ДНК-полимераза. Праймером служит прилегающий к месту расщепления короткий участок расщепленной цепи (самозатраванный механизм). Поксвирусы, как и герпесвирусы, кодируют несколько ферментов, способствующих репликации ДНК путем увеличения концентрации дезоксирибонуклеозидтрифосфатов.
2. Вирус папилломы человека. Характеристика. Онкогенность. Лабораторная диагностика
Папилломавирус человека (HPV – Human Papillomavirus) – вирус из рода папилломавирусов, семейства паповавирусов. Передаётся только от человека к человеку и приводит к изменению характера роста тканей. Известно более 100 видов ВПЧ. Из них более 40 – могут вызвать поражение аногенитального тракта (половые органы и задний проход) мужчин и женщин и появление остроконечных кондилом. Некоторые из них безвредны, другие вызывают бородавки, некоторые вызывают рак.
HPV – одна из наиболее распространённых болезней, передаваемых половым путём.
Жизненный цикл вируса:
Характерные проявления инфекции - простые бородавки.
В настоящее время известно уже более 100 типов (штаммов) папилломавируса, обнаруженных у человека. Большинство представителей обладает онкогенными свойствами и вызывает доброкачественные или злокачественные опухоли (папилломы). Доказана этиологическая роль папилломавируса в развитии рака шейки матки. Папилломавирусы имеют видоспецифические и некоторые типоспецифические антигены. Не культивируются в клеточных системах.
Вирус папилломы человека выявляется в кератоцитах в виде эписомы, 50 – 200 копий на пораженную клетку. Процессы продуктивной инфекции и интеграции не наблюдаются.
Папилломавирус человека (ВПЧ) известен достаточно давно, именно он вызывает бородавки. Однако в 80-е годы XX века стали появляться сообщения о связи инфицирования папилломавирусами и онкологическими заболеваниями шейки матки у женщин, которые вскоре были доказаны убедительной статистикой.
Папилломавирусы являются антропонозными возбудителями – то есть передача их возможна только от человека к человеку.
Есть вероятность сохранения вирусов в отшелушивающих клетках кожи определенное время – поэтому для некоторых заболеваний, вызываемых вирусом, вероятен контактно-бытовой путь заражения (бородавки) при условии микроповреждений кожи.
Основным путем заражения аногенитальными бородавками (остроконечными кондилломами) является половой путь заражения (включая орально – генитальные контакты (крайне редко) и анальный секс).
Возможно заражение папилломавирусом новорожденных при родах, что является причиной возникновения ларингеального папилломатоза у детей и аногенитальных бородавок у младенцев.
Попав в организм, вирусы папиллом инфицируют базальный слой эпителия, причем наиболее пораженным участком является зона перехода многослойного плоского эпителия в цилиндрический эпителий. В зараженной клетке вирус существует в двух формах: эписомальной (вне хромосом клетки), которая считается доброкачественной формой, и интросомальной – интегрированной (встраиваясь в геном клетки) – которую определяют как злокачественную форму паразитирования вируса.
Условно все известные папилломавирусы можно разбить на три основные группы:
1) Неонкогенные папилломавирусы (HPV 1,2,3,5)
2) Онкогенные папилломавирусы низкого онкогенного риска (в основном HPV 6,11,42,43,44)
3) Онкогенные папилломавирусы высокого онкогенного риска (HPV 16,18,31,33,35,39,45,51,52,56,58,59 и 68)
Диагностика папилломавирусной инфекции
1. Клинический осмотр.
По характерной клинической картине выявляются все виды бородавок, остроконечные кондиломы. При наличии аногенитальных бородавок обязателен осмотр шейки матки, по показаниям – для исключения эндоуретральных кондилом – уретроскопия
2. Кольпоскопия. Кольпоскопия и биопсия показаны всем женщинам с цервикальной интраэпителиальной неоплазией класса II(CIN II) или класса III(CIN III), независимо от подтверждения у них наличия ВПЧ-инфекции Тест с уксусной кислотой (Acetic Acid Test). В настоящее время специфическим кольпоскопическим признаком ПВИ шейки матки считается неравномерное поглощение йодного раствора Люголя беловатым после уксуса участком эпителия (в виде йодпозитивных пунктации и мозаики). Признаками ПВИ шейки матки могут также быть ацетобелый эпителий, лейкоплакия, пунктация, белые выросты и мозаика, атипичная зона трансформации, жемчужная поверхность после обработки уксусом.
3. Цитологическое исследование шеечных мазков по Папаниколау.
Цитологическое исследование шеечных мазков по Папаниколау (PAP – smear test) выделяет следующие результаты:
1-й класс – атипические клетки отсутствуют, нормальная цитологическая картина.
2-й класс – изменение клеточных элементов обусловлено воспалительным процессом во влагалище и (или) шейки матки.
Таблица 10.
Характеристика герпесвирусов человека (ГВЧ) (семейство Herpesviridae)
| Подсемейство | Название вируса (общепринятое и официальное) | Цитопатология | Локализация резервуаров в организме | Латентная инфекция | Клинические проявления | |
| Alphaherpesvirinae | Herpes simplex virus тип 1 (вирус простого герпеса) | ГВЧ-1 | Цитолиз эпителия | Ганглии тройничного нерва | Нейроны | Оральный герпес, офтальмо-герпес, энцефалит |
| Herpes simplex virus тип 2 (вирус простого герпеса) | ГВЧ-2 | Ганглии крестцово-подвздошного сочленения | Генитальный герпес, менинго-энцефалит | |||
| Varicella-zoster virus (вирус ветряной оспы – опоясывающего герпеса) | ГВЧ-3 | Спинно-мозговые корешки | Ветряная оспа, опоясывающий герпес (лишай) | |||
| Betaherpesvirinae | Цитомегаловирус | ГВЧ-5 | Цитомегалия | Лейкоциты, эпителий, слюнные железы, почечные канальцы | Моноциты, лимфоциты | Цитомегалия, поражения ЦНС, пневмонии, гепатиты, рак предстательной железы |
| Herpes lymphotropic virus | ГВЧ-6 | Лимфо-пролиферативное действие | В-лимфоциты | Т-клетки | Внезапная экзантема младенцев (до 2 лет), синдром хронической усталости | |
| Герпесвирус человека 7 тип | ГВЧ-7 | Неизвестна | ||||
| Gammaherpesvirinae | Вирус Эпсайна-Барр | ГВЧ-4 | Лимфо-пролиферативное действие | В-лимфоциты, эпителий носоглотки | В-клетки | Инфекционный мононуклеоз, лимфома Беркитта, назо-фарингеальная карцинома, В-клеточная лимфома |
| Герпесвирус человека 8 тип | ГВЧ-8 | Неизвестна | В-клетки, лимф. ткани | Саркома Капоши |
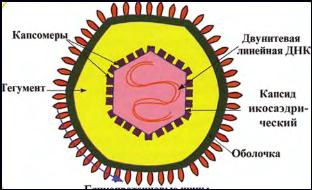 |
Структура.Вирион герпесвируса имеет овальную форму диаметром 150-200 нм. В центральной части вириона находится двунитевая линейная ДНК, окруженная икосаэдрическим капсидом, состоящим из 162 капсомеров. Снаружи вирус окружает оболочка с гликопротеиновыми шипами, сформированными из внутреннего слоя ядерной мембраны клетки. Пространство между капсидом и оболочкой называется тегумент (содержит вирусные белки и ферменты, необходимые для инициации репликации) (рис.27).
Рис. 27. Структура герпесвируса.
Геном – двунитевая линейная ДНК. Она состоит: у ВПГ и ЦМВ – из двух фрагментов: короткого S и длинного L, каждый из которых у ВПГ заключен между двумя наборами инвертированных повторов, позволяющим геному рекомбинировать с образованием 4 изомеров; у вируса ветряной оспы и опоясывающего герпеса ДНК также состоит из двух фрагментов, но содержит один набор инвертированных повторов, поэтому формируется две изомерные формы.
Репродукция. После прикрепления к рецепторам клетки оболочка вириона сливается с клеточной мембраной (рис. 28, 1, 2). Освободившийся нуклеокапсид (рис. 28, 3) доставляет в ядро клетки ДНК вируса. Далее происходит транскрипция части вирусного генома (с помощью клеточной ДНК-зависимой РНК-полимеразы); образовавшиеся иРНК (рис. 28, 4) проникают в цитоплазму, где происходит синтез (трансляция) самых ранних альфа-белков (рис. 28, I), обладающих регулирующей активностью. Затем синтезируются ранние бета-белки (рис. 28, II) – ферменты, включая ДНК-зависимую ДНК-полимеразу и тимидинкиназу, участвующие в репликации геномной ДНК вируса. Поздние гамма-белки (рис. 28, III) являются структурными белками, включая капсид и гликопротеины (А, В, C, D, E, F, G, X). Гликопротеины диффузно прилегают к ядерной оболочке (рис. 28, 5). Формирующийся капсид (рис. 28, 6) заполняется вирусной ДНК и почкуется через модифицированные мембраны ядерной оболочки (рис. 28, 8). Перемещаясь через аппарат Гольджи,
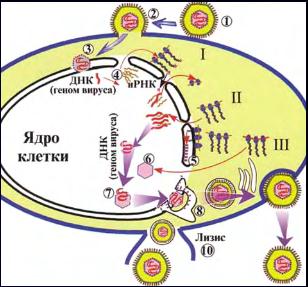 |
вирионы транспортируются через цитоплазму и выходят из клетки путем экзоцитоза (рис. 28, 9)или лизиса клетки (рис. 28, 10).
Рис. 28. Репродукция герпесвируса.
ВПГ вызывает простой герпес (Herpes simplex), характеризующийся везикулезными высыпаниями на коже, слизистых оболочках, поражением глаз, ЦНС и внутренних органов, а также пожизненным носительством (персистенцией) и рецидивами болезни.
Различают два типа вируса – ВПГ-1 и ВПГ-2, которые повсеместно распространены и поражают большую часть населения земли. ВПГ-1 чаще поражает слизистые оболочки ротовой полости и глотки, глаза, вызывает энцефалиты, а ВПГ-2 – половые органы, за что и получил название генитального штамма. ВПГ относится к роду Simplexvirus, семейству Herpesviridae. Открыт У. Грютером в 1912 г.
Структура ВПГ сходна с другими герпесвирусами. На поверхности вириона расположены гликопротеины gA, gB, gC, gD, gH, gF.
Различают структурные белки, белки слияния (gB), иммунные белки уклонения (gC, gE, gI) и др. Например, СЗ-компонент комплемента связывается с gC, а Fc-фрагмент IgG – с gE/gI-комплексом, маскируя вирус и вирусинфицированные клетки. Некоторые гликопротеины имеют общие антигенные детерминанты (gB и gD) для HSV-1 и HSV-2 и типоспецифические – gC.
Культивирование. Вирус герпеса культивируется в хорион-аллантоисной оболочке куриного зародыша, вызывая образование воспалительно-некротических очагов. Хорошо развивается в культуре человеческой эмбриональной легочной и почечной ткани. В инфицированных клетках формируются внутриклеточные включения, образуются симпласты.
Антигенная структура. Вирус герпеса содержит два антигена: V-антиген, прочно связанный с вирусной частицей, и растворимый S-антиген.
Резистентность. Резистентность вируса невысокая. Он погибает при температуре 52 °С и от высушивания при температуре 90 °С в течение 30 минут, чувствителен к действию 0,5 % раствора формалина, 1 % раствора фенола, перманганата калия, эфира, хлороформа, алкоголя и других дезинфицирующих веществ. Длительно сохраняется в 50 % растворе глицерина, при низких температурах и в высушенном состоянии.
Эпидемиология. Источник инфекции - больной или носитель. Оба типа вирусов могут вызывать оральный и генитальный герпес. Вирусы передаются контактным путем (с везикулярной жидкостью, при поцелуях со слюной, при половых контактах с секретами слизистых оболочек, спермой), через предметы обихода, реже воздушно-капельным путем, через плаценту при рождении ребенка. У 80-90 % взрослых людей обнаруживаются антитела к ВПГ. Герпес широко распространен в виде спорадических случаев и небольших вспышек в детских коллективах, больницах. Возможна реактивация вируса при снижении иммунитета (рецидивирующий герпес). Начальное инфицирование ВПГ-2 происходит в жизни позже, чем инфицирование ВПГ-1, и коррелирует с возрастанием половой активности.
Патогенез. Основные входные ворота для вируса – кожа и слизистые оболочки. Чаще вирус вызывает бессимптомную или латентную инфекцию. Различают первичный и рецидивирующий простой герпес.
При первичной инфекции инкубационный период составляет 2-12 суток. Обычно появляются везикулы с дегенерацией эпителиальных клеток. Основу везикулы составляют многоядерные клетки. Пораженные ядра клеток содержат тельца Каудри (эозинофильные включения). Верхушка везикулы через некоторое время вскрывается, образуется язвочка, которая вскоре покрывается струпом, корочкой. Далее наступает заживление.
При инфицировании вирусы, минуя входные ворота эпителия, проходят через чувствительные нервные окончания с дальнейшим передвижением нуклеокапсидов вдоль аксона к телу нейрона в чувствительных ганглиях. Репликация вируса в нейроне приводит к его гибели. Некоторые вирусы герпеса вызывают латентную инфекцию, при которой нейроны содержат в себе вирусный геном, но не погибают.
Латентная инфекция чувствительных нейронов – характерная особенность нейротропных герпесвирусов ВПГ и вируса герпеса Зостер. Большинство людей (70-90 %) являются пожизненными носителями вируса, который сохраняется в ганглиях, вызывая в нейронах латентную персистирующую инфекцию. Наиболее изучена латентная инфекция, вызванная ВПГ-1. В латентно инфицированных нейронах около 1 % клеток в пораженном ганглии несет вирусный геном. При этом вирусная ДНК существует в виде свободных циркулярных эписом (около 20 копий в клетке). ВПГ-1 обнаруживается в узлах тройничного и обонятельного нервов, а ВПГ-2 – в сакральных ганглиях.
Реактивация герпесвирусов и обострение (рецидив) вызываются различными факторами, снижающими иммунитет (переохлаждение, лихорадка, травма, стресс, сопутствующие заболевания, УФ-облучение, лечение иммунодепрессантами и др.). В результате геном герпесвирусов проходит обратно по аксону к нервному окончанию, что способствует репликации вируса в эпителиальных клетках.
Клиническая картина. Болезнь начинается с появления на пораженных участках зуда, отека и пузырьков, заполненных жидкостью. При образовании везикулы ощущается жгучая боль. После подсыхания пузырьков и отторжения корочек рубцы не образуются. ВПГ поражает кожу (везикулы, экзема), слизистые оболочки рта, глотки (стоматит) и кишечника, печень (гепатиты), глаза (кератит и др.) и ЦНС (энцефалит, менингоэнцефалит). Рецидивирующий герпес обусловлен реактивацией вируса, сохранившегося в ганглиях. Он характеризуется повторными высыпаниями и поражением органов и тканей.
Генитальный герпес – результат аутоинокуляции из других пораженных участков тела, но наиболее часто встречается половой путь заражения. Образуются быстро изъязвляющиеся везикулы. У мужчин чаще поражаются головка и тело полового члена, а у женщин – половые губы и вагина, иногда шейка матки. Ранее предполагали, что ВПГ-2 может вызывать рак шейки матки, однако доказано, что эта роль принадлежит папилломавирусам.
Вирус простого герпеса, в основном ВПГ-2, проникает во время прохождения новорожденного через родовые пути матери, вызывая неонатальный герпес (герпес новорожденных), который обнаруживается на 6-й день после родов, т.е. с момента заражения. Вирус диссеминирует во внутренние органы с развитием генерализованного сепсиса. Основой предупреждения развития неонатального герпеса являются выявление и лечение генитального герпеса матери или кесарево сечение при наличии выраженных клинических симптомов инфекции.
Иммунитет в основном клеточный. Развивается гиперчувствительность замедленного типа. Организм человека реагирует на гликопротеины вируса, продуцируя цитотоксические Т-лимфоциты (CD8 + ), а также T-хелперы (CD4 + ), активирующие В-лимфоциты с последующей продукцией специфических вируснейтрализующих антител. Важную роль в ранней защите играют NK-клетки. Антитела матери, передающиеся через плаценту, смягчают последствия неонатального герпеса.
Диагностика. Исследуют содержимое герпетических везикул, слюну, соскобы с роговой оболочки глаз, кровь, спинномозговую жидкость и мозг при летальном исходе. В мазках, окрашенных по Романовскому-Гимзе, наблюдают гигантские многоядерные клетки (синцитий), клетки с увеличенной цитоплазмой и внутриядерными включениями Каудри. Для идентификации вируса используют также ПЦР. Вирус выделяют, заражая клетки HeLa, Hep-2, человеческие эмбриональные фибробласты. Цитопатический эффект становится видимым через сутки после заражения: клетки округляются с последующим прогрессирующим поражением всей культуры клеток. Заражают также куриные эмбрионы или мышей-сосунков, у которых после внутримозгового заражения развивается энцефалит. Вирус идентифицируют в РИФ и ИФА с использованием моноклональных антител.
Серологическую диагностику проводят с помощью РСК, РИФ, ИФА и реакции нейтрализации по нарастанию титра антител больного. Возможно применение иммуноблоттинга.
Лечение. Применяют противовирусные химиотерапевтические препараты (ацикловир, фамцикловир, валацикловир, идоксуридин, видарабин, теброфеновую и флореналевую мазь и др.), препараты интерферонов и индукторы интерферонов.
Профилактика. Специфическая профилактика рецидивирующего герпеса осуществляется в период ремиссии многократным введением инактивированной культуральной герпетической вакцины из штаммов ВПГ-1 и ВПГ-2.
В последние годы в инфекционной патологии все большее значение приобретают герпес-вирусы (от греч. herpes — ползучий). Внимание, которое вирусологи и клиницисты проявляют в последние 25 лет к герпес-вирусным заболеваниям человека, связано
В последние годы в инфекционной патологии все большее значение приобретают герпес-вирусы (от греч. herpes — ползучий). Внимание, которое вирусологи и клиницисты проявляют в последние 25 лет к герпес-вирусным заболеваниям человека, связано с их значительной эпидемиологической ролью и социальной значимостью в современном мире. Неуклонный рост числа герпетических заболеваний у взрослых и детей обусловливает необходимость всестороннего изучения герпетической инфекции и разработки эффективных методов профилактики и лечения разнообразных форм этой инфекции. Среди вирусных инфекций герпес занимает одно из ведущих мест в силу повсеместного распространения вирусов, многообразия клинических проявлений, как правило, хронического течения, а также различных путей передачи вирусов.
Он входит в число наиболее распространенных и плохо контролируемых инфекций человека. Герпес-вирусы могут циркулировать в организме с нормальной иммунной системой бессимптомно, но у людей с иммуносупрессией вызывают тяжелые заболевания со смертельным исходом. По данным ВОЗ, смертность от герпетической инфекции среди вирусных заболеваний находится на втором месте (15,8%) после гепатита (35,8%).
Герпес-вирусы объединены в обширное семейство Herpesviridae и в настоящее время наиболее четко классифицированы. Семейство Herpesviridae включает в себя более 80 представителей, 8 из которых для человека наиболее патогенны (human herpes virus-HHV). Герпес-вирусы — филогенетически древнее семейство крупных ДНК-вирусов — подразделяются на 3 подсемейства в зависимости от типа клеток, в которых протекает инфекционный процесс, характера репродукции вируса, структуры генома, молекулярно-биологических и иммунологических особенностей: α, β и γ (табл. 1, по данным Н. Г. Перминова, И. В. Тимофеева и др., Государственный научный центр вирусологии и биотехнологий).
α-герпес-вирусы, включающие HSV-1, HSV-2 и VZV, характеризуются быстрой репликацией вируса и цитопатическим действием на культуры инфицированных клеток. Репродукция α-герпес-вирусов протекает в различных типах клеток, вирусы могут сохраняться в латентной форме, преимущественно в ганглиях.
β-герпес-вирусы видоспецифичны, поражают различные виды клеток, которые при этом увеличиваются в размерах (цитомегалия), могут вызывать иммуносупрессивные состояния. Инфекция может принимать генерализованную или латентную форму, в культуре клеток легко возникает персистентная инфекция. К этой группе относятся CMV, HHV-6, HHV-7.
γ-герпес-вирусы характеризуются тропностью к лимфоидным клеткам (Т- и В-лимфоцитам), в которых они длительно персистируют и которые могут трансформировать, вызывая лимфомы, саркомы. В эту группу входят вирус Эпштейна-Барр и HHV-8-герпес — вирус, ассоциированный с саркомой Капоши (KSHV). KSHV является наиболее близким по геномной организации Т-клеточно-тропному обезьяньему герпес-вирусу Саймири (HVS).
Герпес-вирусы ассоциированы с малигнизацией и способны (по крайней мере, EBV и HVS) трансформировать клетки in vitro. Все герпес-вирусы сходны по морфологическим признакам, размерам, типу нуклеиновой кислоты (двухцепочечная ДНК), икосадельтаэдрическому капсиду, сборка которого происходит в ядре инфицированной клетки, оболочке, типу репродукции, способности вызывать хроническую и латентную инфекцию у человека.
В эпидемиологическом плане наиболее интересны следующие сведения о герпес-вирусах: вирионы чрезвычайно термолабильны — инактивируются при температуре 50–52°С в течение 30 мин, при температуре 37,5°С — в течение 20 ч, устойчивы при температуре 70°С; хорошо переносят лиофилизацию, длительно сохраняются в тканях в 50-процентном растворе глицерина. На металлических поверхностях (монеты, дверные ручки, водопроводные краны) герпес-вирусы выживают в течение 2 ч, на пластике и дереве — до 3 ч, во влажных медицинских вате и марле — до их высыхания при комнатной температуре (до 6 ч).
Уникальными биологическими свойствами всех герпес-вирусов человека является тканевой тропизм, способность к персистенции и латенции в организме инфицированного человека. Персистенция представляет собой способность герпес-вирусов непрерывно или циклично размножаться (реплицироваться) в инфицированных клетках тропных тканей, что создает постоянную угрозу развития инфекционного процесса. Латенция герпес-вирусов — это пожизненное сохранение вирусов в морфологически и иммунохимически видоизмененной форме в нервных клетках регионарных (по отношению к месту внедрения герпес-вируса) ганглиев чувствительных нервов. Штаммы герпес-вирусов обладают неодинаковой способностью к персистенции и латенции и чувствительностью к противогерпетическим препаратам в связи с особенностями их ферментных систем. У каждого герпес-вируса свой темп персистенции и латенции. Среди изучаемых наиболее активны в этом отношении вирусы простого герпеса, наименее — вирус Эпштейна-Барр.
По данным многочисленных исследований, к 18 годам более 90% жителей городов инфицируются одним или несколькими штаммами по меньшей мере 7 клинически значимых герпес-вирусов (простого герпеса 1 и 2 типов, варицелла зостер, цитомегаловирусом, Эпштейна-Барр, герпеса человека 6 и 8 типов). В большинстве случаев первичное и повторное инфицирование происходит воздушно-капельным путем, при прямом контакте или через предметы обихода и гигиены (общие полотенца, носовые платки и т. п.). Доказаны также оральный, генитальный, орогенитальный, трансфузионный, трансплантационный и трансплацентарный пути передачи инфекции.
Герпес-вирусные инфекции широко распространены в мире и имеют тенденцию к неуклонному росту. Особенностью герпес-вирусной инфекции является возможность вовлечения в инфекционный процесс многих органов и систем, чем и обусловлено многообразие вызываемых герпес-вирусами заболеваний, варьирующих от простых кожно-слизистых до угрожающих жизни генерализованных инфекций. Важное свойство герпес-вирусов — это способность после первичного инфицирования в детском возрасте пожизненно персистировать в организме и реактивироваться под влиянием различных экзо- и эндогенных провоцирующих факторов.
Инфицирование человека указанными герпес-вирусами сопровождается клиническими симптомами соответствующего острого инфекционного заболевания в среднем не более чем у 50% людей, в основном у детей: внезапная эритема (вирус герпеса человека 6 типа), афтозный стоматит (вирусы простого герпеса 1 или 2 типов), ветряная оспа (вирус варицелла зостер), инфекционный мононуклеоз (вирус Эпштейна-Барр), мононуклеозоподобный синдром (цитомегаловирус). У остальных пациентов инфекция протекает бессимптомно, что особенно характерно для подростков и взрослых людей. Помимо биологических свойств штамма герпес-вируса, влияние на течение острых и рецидивирующих герпес-вирусных заболеваний оказывают индивидуальные (возрастные, половые, фило- и онкогенетические) особенности иммунного ответа инфицированного человека на многочисленные антигены вируса.
Часто, особенно при снижении иммунореактивности организма, герпес-вирусы выступают в качестве вирусов-оппортунистов, приводя к более тяжелому, с необычными клиническими проявлениями, течению основного заболевания. Вирусы простого герпеса 1 и 2 типов, а также ЦМВ входят в число возбудителей TORCH-инфекций. Они играют важную роль в нарушении репродуктивной функции человека, развитии серьезных заболеваний матери, плода, новорожденного и детей младшего возраста.
Вызываемые вирусами ВПГ, CMV, ВЭБ заболевания рассматриваются как СПИД-индикаторные в связи с их частым обнаружением при данной патологии. В 1988 г. они включены в расширенное определение случаев, подлежащих эпидемиологическому надзору по поводу СПИДа. Результаты исследований последних лет свидетельствуют о роли некоторых герпес-вирусов (ВГЧ-8, ЦМВ, ВЭБ и др.) в развитии ряда злокачественных новообразований: назофарингеальной карциномы, лимфомы Беркитта, В-клеточной лимфомы, рака груди, аденокарциномы кишечника и простаты, карциномы цервикального канала шейки матки, саркомы Капоши, нейробластомы и др.
Наибольшую угрозу для здоровья представляют герпетические нейроинфекции (летальность достигает 20%, а частота инвалидизации — 50%), офтальмогерпес (почти у половины больных приводит к развитию катаракты или глаукомы) и генитальный герпес.
Все методы индикации и идентификации вирусов основаны на следующих принципах:
- выявление вируса per se (электронная микроскопия);
- выявление и идентификация вирусов посредством взаимодействующих с ними клеток (накопление вирусов в чувствительных к ним клетках);
- выявление и идентификация вирусов с помощью антител (МФА, ИФА, РАЛ, ИБ, РН, РСК);
- выявление и идентификация нуклеиновых кислот (ПЦР, МГ).
Электронная микроскопия: быстрая диагностика позволяет обнаружить ГВ или их компоненты непосредственно в пробах, взятых от больного, и дать быстрый ответ через несколько часов. Возбудитель выявляют с помощью электронной микроскопии клинического материала при негативном контрастировании.
Серологические методы уступают по информативности и чувствительности другим способам лабораторной диагностики и не позволяют с достаточной степенью достоверности установить этиологию той или иной формы заболевания. Нарастание титров антител происходит
в поздние сроки (через несколько недель) после заражения или реактивации вируса, и в то же время оно может и не наблюдаться у иммунодефицитных лиц. Для установления 4-кратного нарастания титра антител к герпес-вирусной инфекции (показатель первичной инфекции) необходимо исследование парных сывороток. Серологические реакции (РСК, РН) обладают высокой специфичностью, но относительно низкой чувствительностью, а кроме того, сложны в постановке.
Широкое практическое применение получили иммунофлюоресцентный метод, ИФА, РАЛ, ИБ.
Наиболее точным методом диагностики герпес-вирусной инфекции является выделение вируса из различных клеточных культур.
Для обнаружения вируса герпеса используют молекулярно-биологические методы: полимеразную цепную реакцию и реакцию молекулярной гибридизации, которые позволяют выявить наличие вирусной нуклеиновой кислоты в исследуемом материале. ПЦР может считаться самой чувствительной и быстрой реакцией. Чувствительность метода дает возможность определить одну молекулу искомой ДНК в образцах, содержащих 10 клеток.
Лечение герпетической инфекции до настоящего времени остается сложной задачей. Хроническое течение процесса приводит к иммунной перестройке организма: развитию вторичной иммунной недостаточности, угнетению реакции клеточного иммунитета, снижению неспецифической защиты организма. Несмотря на разнообразие лекарственных препаратов, использующихся для лечения герпетической инфекции, лекарственных средств, обеспечивающих полное излечение от герпеса, не существует. Герпес-вирусная инфекция относится к трудно контролируемым заболеваниям. Это связано, в первую очередь, с разнообразием клинических поражений, развитием резистентности вируса к лекарственным средствам, наличием у герпес-вирусов молекулярной мимикрии. Поэтому для успешного лечения герпетической инфекции необходимо правильно подобрать противовирусный препарат, его дозу и длительность лечения, использовать комбинацию различных лекарств. В схемы терапии для повышения эффективности лечения необходимо также включать иммунобиологические препараты, способствующие коррекции иммунного статуса, а также патогенетические средства, облегчающие состояние пациента.
В настоящее время все антигерпетические средства подразделяются на 3 основные группы антивирусных препаратов (табл. 3).
Механизм действия химиопрепаратов (аномальных нуклеозидов: валтрекса, вектавира, фамвира, цимевена) связан с угнетением синтеза вирусной ДНК и репликации вирусов путем конкурентного ингибирования вирусной ДНК-полимеразы.
В препаратах-иммуномодуляторах (алпизарин, имунофан, ликопид, полиоксидоний) активно действующие вещества обладают иммуностимулирующими свойствами в отношении клеточного и гуморального иммунитетов, окислительно-восстановительных процессов, синтеза цитокинов.
Препараты-индукторы ИФН (амиксин, неовир, циклоферон) сочетают этиотропный и иммуномодулирующий эффекты действия. Препараты индуцируют образование эндогенных ИФН (α, β, γ) Т- и В-лимфоцитами, энтероцитами, гепатоцитами.
Особое место среди средств антигерпес-вирусной терапии занимает герпетическая вакцина для активации клеточного иммунитета, его иммунокоррекции в фазе ремиссии. Вакцинация преследует 2 цели: предупреждение первичной инфекции и возникновения состояния латентности, а также предупреждение или облегчение течения заболевания.
Однако, несмотря на наличие обширного списка антигерпетических препаратов, герпес остается до сих пор плохо контролируемой инфекцией. Это обусловлено и генотипическими особенностями возбудителя, и длительной персистенцией вируса в организме, и формированием штаммов, устойчивых к антивирусным препаратам. Максимальный клинический эффект может быть получен только при рациональной комплексной терапии лекарственных средств с различным механизмом действия.
Санкт-Петербургской группой ученых вирусологов и инфекционистов во главе с В. А. Исаковым предложена программа лечения и профилактики герпетической инфекции (табл. 4).
Преимущества комплексной терапии ГИ.
- Сочетанное применение противогерпетических химиопрепаратов и иммунобиологических средств обеспечивает синергидный эффект.
- Благодаря снижению дозы противовирусного ХПП уменьшается вероятность развития побочных эффектов, сокращается токсическое воздействие на организм больного.
- Снижается вероятность возникновения устойчивых штаммов герпес-вирусов к данному препарату.
- Достигается иммунокорригирующий эффект.
- Сокращается продолжительность острого периода болезни и сроков лечения.
Таким образом, терапия ГИ является сложной и многокомпонентной задачей.
По вопросам литературы обращайтесь в редакцию.
Т. К. Кускова, кандидат медицинских наук
Е. Г. Белова, кандидат медицинских наук
МГМСУ, Москва
Читайте также:


