Что относится к пикорнавирусам относятся
Часть II. РНК-содержащие вирусы.
1. Пикорнавирусы: классификация, структура вириона, строение генома, используемые клеточные рецепторы. Пикорнавирусные IRES. Процессинг полипротеина, рибосомальный пропуск. Репликация пикорнавирусов, сre-элемент. 1
2. Заболевания, вызываемые пикорнавирусами. Терапевтические средства, вакцины. 10
3. Калицивирусы, Хепевирусы, Астровирусы. Структура вирионов и строение геномов. Вирус Норфолк. Вирус гепатита Е. Вирусы, вызывающие гастроэнтериты. 11
4. Тогавирусы: классификация, структура вириона, строение генома. Жизненный цикл, функции неструктурных белков, временной контроль матричных синтезов. 16
5. Вирусы, переносимые членистоногими. Циклы трансмиссии. Особенности арбовирусных инфекций, пережидание неблагоприятных климатических условий. 18
6. Флавивирусы: классификация, структура вириона, строение генома. Экспрессия генома, репликация флавивирусов. Формирование вирионов. 19
7. Заболевания, вызываемые тога- и флавивирусами. Вирус краснухи. Альфавирусы, вызывающие артриты и энцефалиты. Лихорадка Денге, жёлтая лихорадка, клещевой энцефалит. Вирус гепатита С. 22
8. Коронавирусы: классификация, структура вириона, строение генома. Субгеномные РНК. Неструктурные белки, поверхностные гликопротеины. 24
9. Общие свойства (-)РНК-вирусов. Строение геномов. Молекулярно-биологические особенности. 27
10. Рабдовирусы: классификация, структура вириона, строение генома. Синтез мРНК и репликация генома. Вирус везикулярного стоматита и вирус бешенства. 29
11. Парамиксовирусы: классификация, структура вириона, строение генома. Вирусные гликопротеины. Стратегии получения белков с гена Р. Заболевания, вызываемые парамиксовирусами. 31
12. Ортомиксовирусы: классификация, структура вириона, строение генома. Функции белков. Гемагглютинин и нейраминидаза. Особенности репликации и транскрипции. Грипп. 35
13. Буньявирусы: классификация, структура вириона, строение генома. Ambisense-стратегия. Синтез мРНК. Заболевания, вызываемые буньявирусами. 40
14. Аренавирусы: классификация, строение генома. Экспрессия генома аренавирусов. Заболевания, вызываемые аренавирусами. 45
15. Филовирусы: классификация, структура вириона, особенности строения генома. Функции белков. Эпидемиология филовирусов. Патогенез филовирусных геморрагических лихорадок. 47
16. Реовирусы: классификация, структура вириона, строение генома. Жизненный цикл. Функции белков. Ротавирусная инфекция. 51
17. Ретровирусы. Обратная транскрипция и интеграция в геном клетки-хозяина. Вирус Т-клеточного лейкоза человека (HTLV/PTLV). Заболевания, ассоциированные с HTLV, географическая распространённость. Вирус иммунодефицита человека (ВИЧ/HIV). Изменчивость ВИЧ. СПИД, основные клинические проявления. Терапевтические средства. 56
1. Пикорнавирусы: классификация, структура вириона, строение генома, используемые клеточные рецепторы. Пикорнавирусные IRES. Процессинг полипротеина, рибосомальный пропуск. Репликация пикорнавирусов, сre-элемент.
Пикорнавирусы
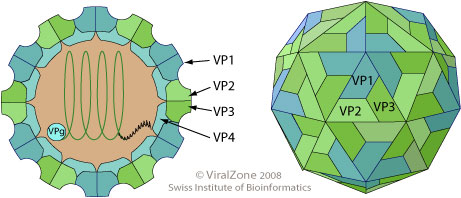
Пикорнавирусы относятся к простым вирусам (без оболочки). Диаметр вируса около 30нм. Однонитевая плюс РНК с протеином VPg окружена икосаэдрическим капсидом. Капсид состоит из 12 пятиугольников (пентамеров), каждый из которых в свою очередь состоит из 5-ти белковых субъединиц (протомеры). Протомеры образованы 4-мя вирусными полипептидами (VP1,VP2, VP3, VP4).
· Линейная ssRNA(+), 7.1-8.9 kb
· d=30 нм, T= pseudo 3 (P=3), 4 капсидных белка: VP1, VP2, VP3, VP4
· 1 ORF → полипротеин (
Порядок
ü Порядок: Picornavirales
Ø Семейство: Picornaviridae
· Род: Avihepatovirus new
· Род: Sapelovirus new
· Род: Senecavirus new
· Род: Tremovirus new
| Род | Вирус | Заболевание |
| Aphthovirus | FMDV | Ящур (домашний скот) |
| Cardiovirus | EMCV, ThV | Энцефаломиелит, миокардит (мыши, домашний скот) |
| Enterovirus | Poliovirus, Rhinoviruses | Полиомиелит, простуда |
| Erbovirus | Equine rhinitis virus | Инфекция верхних дыхательных путей (лошади) |
| Hepatovirus | HAV | Гепатит |
| Kobuvirus | Alchi virus | Гастроэнтерит |
| Parechovirus | Human parechovirus | Гастроэнтерит, паралич, энцефалит |
| Teschovirus | Porcine teschovirus | Энцефалит, паралич (свиньи) |
Жизненный цикл пикорнавирусов
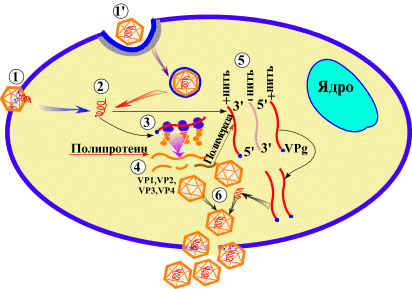
Вирус взаимодействует с рецепторами на поверхности клетки. Геном вируса может поступить в клетку путем эндоцитоза (1') с последующим выходом нуклеиновой кислоты (2) из вакуоли или путем инъекции РНК через цитоплазматическую мембрану (1) клетки. На конце РНК имеется вирусный протеин (3) - VPg. Геном используется как иРНК для синтеза белка (4,5). Один большой полипротеин (4) транслируется с вирусного генома. Затем полипротеин расщепляется на индивидуальные вирусные протеины, включая РНК-зависимую полимеразу. Полимераза синтезирует минус нить-матрицу с поверхности плюс-нити и реплицирует геном. VPg ковалентно присоединяется к (5') концу вирусного генома. Структурные белки собираются в капсид (6), в него включается геном, образуя вирион. Вирионы освобождаются из клетки посредством ее лизиса. Репродукция происходит в цитоплазме клеток и сопровождается цитопатическим действием. В культурах клеток под агаровым покрытием вирусы образуют бляшки.
Дата добавления: 2018-06-01 ; просмотров: 657 ;
Вирусы из семейства Picornaviridae (образовано от двух слов: picos – маленький, RNA – содержит РНК) имеют размеры 17-40 нм; кубический тип симметрии; содержат (+)РНК, линейную, однонитчатую, обладающую инфекциозностью; состоят из 60 капсомеров; суперкапсида нет. Вирусы не имеют липидов, устойчивы к эфиру и детергентам.
В семействе имеются роды: Enterovirus,Parechovirus,Hepatovirus, Rhinovirus, Cardiovirus, Aphtovirus.
20.1.4.1. Энтеровирусы
К роду энтеровирусов относятся: 3 типа (1, 2, 3) вируса полиомиелита, патогенные для человека; вирусы Коксаки А 1-22, 24; Коксаки В 1-6 серотипы; вирус ECHO 1-33 серотипы (кроме 10, 22, 23, 28 типов); пареховирусы – типы 22, 23; энтеровирусы серотипов 68-71.
Вирус полиомиелита вызывает полиомиелит – одно из древнейших заболеваний человека, о чем свидетельствуют археологические материалы. Полиомиелит – воспаление серого вещества мозга (polies – серый, myelitis – воспаление спинного мозга). Открыт в 1909 г. Ландштейнером и Поппером при заражении обезьян мозговой тканью ребенка, умершего от полиомиелита. Полиовирус представлен тремя серотипами, которые относятся к роду Enterovirus семейства Picornaviridae.
Вирус имеет особенности: не содержит гемагглютинина, не культивируется в курином эмбрионе и в организме экспериментальных животных.
Резистентность. Устойчив во внешней среде: в воде, молоке, сточной канализационной воде сохраняет активность при 0°С в течение года, при кислых значениях рН в течение 1-3 часов, имеет плавучую плотность 1,34 г/см 3 . Так как вирион не имеет оболочки, содержащей липиды, он не повреждается растворителями жиров (этиловым эфиром, хлороформом). Одномолярный раствор хлористого магния защищает полиовирус от тепловой инактивации, что используется для термостабилизации оральной вакцины. При 50°С инактивируется в течение 30 минут, при 20°С – 3 месяца, на овощах сохраняется 20 дней. Вирус быстро погибает в 1% растворе хлорамина, 3% перекиси водорода, чувствителен к УФ-лучам.
Репродукция. Вирусы адсорбируются на липопротеиновых рецепторах клетки, в которую они проникают путем виропексиса – вирус связывается с клеточной мембраной, образуется микровакуоль.
После освобождения вириона от капсида образуется репликативная форма РНК, которая является матрицей для синтеза информационной РНК. Репродукция происходит в цитоплазме. Вначале синтезируется единый гигантский полипептид, который разрезается протеолитическими ферментами на несколько фрагментов. Одни из них представляют капсомеры, из которых строится капсид, другие – внутренние белки, третьи – вирионные ферменты. Далее формируются несколько сотен вирионов в каждой инфицированной клетке, которые освобождаются после лизиса клетки.
Культивирование. В лабораторных условиях вирус культивируют в первичных или перевиваемых культурах клеток различных тканей человека и обезьян. Полиовирус, выделяемый из естествнных источников, способен инфицировать только клетки приматов, содержащие на клеточной поверхности специфические мембранные рецепторы для вируса.
Патогенез и клиника. Источник инфекции – больные люди и вирусоносители. Путь заражения – фекально-оральный, чаще алиментарный или водный. Инкубационный период 7-14 дней. Вирус попадает в носоглотку (лимфоглоточное кольцо Пирогова), далее в лимфатический аппарат тонкого кишечника, а затем проникает в кровь. Из кровяного русла вирус может проникать в ЦНС, если нейтрализующие антитела не вырабатываются в количествах, достаточных для блокирования этого пути. В ЦНС вирус распространяется вдоль нервных волокон и в процессе внутриклеточного размножения может повредить или полностью разрушить нервные клетки, результатом чего может быть вялый паралич. Чаще поражаются клетки передних рогов спинного мозга, в тяжелых случаях вирус проникает в головной мозг. Нарушение функций периферических нервов и двигательной мускулатуры являются следствием размножения вируса в мотонейронах. Изменения в этих клетках развиваются быстро.
Если человек инфицируется вирулентным полиовирусом, могут быть: бессимптомная инфекция, легкие клинические формы без параличей, асептический серозный менингит, паралитический полиомиелит (отмечается в 1% случаев полиовирусной инфекции).
Легкие формы заболевания могут протекать с лихорадкой, головными болями, тошнотой, рвотой, запором, ангиной. В течение нескольких дней больной выздоравливает. Асептический менингит кроме перечисленных признаков может проявляться ригидностью и болями в затылке и спине; болезнь длиться 2-10 дней и заканчивается выздоровлением.
При паралитическом полиомиелите возникает вялый паралич, обусловленный поражением мотонейронов. Некоторое восстановление утраченных функций может произойти в течение 6 месяцев после начала болезни, но остаточные параличи сохраняют постоянный характер.
Иммунитет. После заболевания остается стойкий иммунитет к соответствующему серотипу вируса. Пассивный иммунитет (после рождения) сохраняется в течение 4-5 недель жизни ребенка. Протективными свойствами обладают вируснейтрализующие антитела, которые появляются до появления параличей. Образование антител в ранние сроки инфекции является результатом размножения вируса в кишечном тракте и глубоких лимфатических структурах до внедрения его в нервную систему. Антитела, появившиеся в крови рано, могут предотвратить переход вируса в ЦНС, поэтому вакцинация способна защищать ЦНС, если проводится до появления неврологических симптомов.
Понижение устойчивости к полиовирусной инфекции наступает после удаления миндалин и аденоидов, так как после операции резко снижается уровень секреторных антител в носоглотке.
Вирусологический метод – выделение вируса и его идентификация. Материал – фекалии больного (в 1 г фекалий содержится до 1 млн инфекционных доз), реже носоглоточный смыв, кровь, ликвор. Материал фильтруют, обрабатывают антибиотиком, вносят в культуру клеток Hep-2 и RD (из рабдомиосаркомы человека). Использование только двух клеточных линий для лабораторной диагностики полиомиелита позволяет стандартизировать полученные результаты. Через 5-7 дней возникает ЦПД в виде мелкозернистой деструкции клеток.
Идентификация вируса проводится в реакции нейтрализации, т. е. в культуры тканей вносят вирус в смеси с поливалентной противополиомиелитной сывороткой типов 1, 2, 3, а затем для определения типа – с отдельными типовыми сыворотками. При идентичности типа вируса и данной сыворотки ЦПД не возникает. Для установления внутритиповых различий между штаммами полиовирусов используют штаммоспецифические адсорбированные поликлональные и моноклональные иммунные сыворотки, молекулярную гибридизацию, полимеразную цепную реакцию и секвенирование вирусного генома.
Для программы ликвидации полиомиелита важное значение имеет дифференциация между штаммами дикого и вакцинного штамма.
Серологический диагноз используют для определения нарастания титра АТ в крови переболевших людей. С этой целью применяют реакцию нейтрализации в культуре ткани с парными сыворотками, полученными в острой стадии болезни и в период реконвалесценции. Ставят РСК, ИФА. При положительном результате выявляют четырехкратное нарастание титра антител во второй сыворотке по сравнению с первой.
Специфическая профилактика осуществляется живыми и убитыми вакцинами, благодаря которым достигнут значительный прогресс в борьбе с полиомиелитом. ВОЗ принято решение о глобальной ликвидации полиомиелита после 2000 г.
Убитая вакцина получена американским ученым Солком в 1953 г. и содержит вирусы полиомиелита 1, 2, 3 типов, выращенные в почечной ткани обезьян. Она вызывает гуморальный иммунитет – образование IgG и IgM, но не препятствует репродукции вирусов в клетках слизистой оболочки кишечника.
Пероральная живая вакцина типов 1, 2, 3, получена в 1956 г. Сейбиным из аттенуированных штаммов вируса полиомиелита, культивированных в культуре клеток почек африканских зеленых мартышек. Помимо IgG и IgM-антител она индуцирует образование секреторных IgA-антител в слизистой оболочке пищеварительного тракта, особенно тонкого кишечника, и тем самым препятствует циркуляции диких штаммов вируса полиомиелита.
В настоящее время вакцина выпускается в жидком виде, применяется для вакцинации детей, начиная с 3-х месячного возраста, (вводят трехкратно, чтобы создать иммунитет против всех трех типов вируса) с интервалом в 4-6 недель и далее по схеме (в два года и 7 лет).
Для лечения используют сывороточный человеческий иммуноглобулин против полиомиелита, полученный из сыворотки доноров.
Выделены в 1947 г. Долдорфом и Сиклсом в местечке Коксаки от больного ребенка с симптомами полиомиелита. В настоящее время известно 30 серотипов Коксаки-вирусов, из них к группе Коксаки А относятся 1-24 серотипа (тип 23 отсутствует), к В – 1-6 серотипы.
Строение вирусов типично для всех пикорнавирусов, но есть следующие особенности: содержат гемагглютинин; патогенны для новорожденных мышей-сосунков. Причем, внутримышечное введение вируса Коксаки А вызывает вялые параличи и участки омертвения мышц, а Коксаки В – поражение внутренних органов и энцефаломиелит.
Клиника. Вирусы вызывают разнообразные по клинике заболевания:
а) герпангину – острую лихорадку с болями в животе, зеве и пузырьковыми высыпаниями на слизистой ротовой полости, иногда с ригидностью затылочных мышц;
б) эпидемическую миалгию – протекает с высокой температурой и колющими мышечными болями в области грудной клетки и живота;
в) эпидемическую плевродинию – сопровождается лихорадкой, плевритами, болевыми приступами в области груди (болезнь Борнхольма);
г) асептический серозный менингит – острая лихорадка с менингеальными симптомами;
д) энцефаломиокардит новорожденных – миокардит и паралитичекие формы, похожие на полиомиелит, кардиотропность больше выражена у вирусов Коксаки В.
В целом для вирусов Коксаки характерен полиорганный тропизм.
Диагностика осуществляется при выделении вируса из фекалий, смыва из носоглотки, ликвора путем заражения материалом мышей-сосунков и культур клеток. Для идентификации ставят реакцию нейтрализации в культуре клеток, на новорожденных мышах со специфическими сыворотками.
Серологический диагноз проводят путем выявления нарастания титра антител в парных сыворотках больного в РН, РТГА, ИФА.
Вирусы вызывают различные заболевания преимущественно в детском возрасте. Сродство к лимфоидной ткани – одна из характерных особенностей этих вирусов. После размножения вирусы проникают в лимфу, а затем в кровь, наступает вирусемия и генерализация инфекции. Дальнейшее развитие болезни зависит от свойств вируса, его тканевого тропизма и иммунного статуса организма. Многие серотипы способны поражать ЦНС, вызывая полиомиелитоподобные заболевания, асептический серозный менингит (серовары 2-9, 12, 14, 16, 21), желудочно-кишечные заболевания с синдромом диареи, респираторные заболевания (серовары 8-11, 20), увеит – воспаление слизистой оболочки глаза, заболевания паренхиматозных органов.
Диагностика проводится так же, как и при вирусах Коксаки.
Энтеровирус 70 вызывает субконъюнктивальные кровоизлияния и кератит. Иногда возникают осложнения со стороны ЦНС – боли в области корешков спинномозгового нерва, слабость мышц конечностей, парезы лицевого и языкоглоточного нервов. Основной путь передачи – контактный, реже фекально-оральный.
Энтеровирус 71 по свойствам занимает промежуточное положение между вирусами полиомиелита и нейротропными штаммами вируса Коксаки. Против энтеровируса 71 разработана эффективная инактивированная вакцина.
Специфическая профилактика. Получены положительные результаты при применении формалинизированных вакцин из наиболее патогенных энтеровирусов (Коксаки А-9, В-1, ЕСНО-6).
Данное семейство включает более 200 вирусов, которые объединены в 6 родов: энтеро-, афто-, кардно-, рино-, гепато- и парэховирусы. Вирусы, вызывающие заболевания человека, входят в 4 рода, а вызывающие заболевания животных - в 6 родов. Важным признаком дифференцирующим родовую принадлежность является стабильность при низком рН. Афтовирусы нестабильны при рН ниже 7,0; риновирусы — при рН ниже 5,0; энтеро-, гепато-, кардио- и парэховирусы стабильны при рН=3,0. 5'-нетранслируемая область генома кардио- и афтовирусов содержит длинный поли (С) участок, отсутствующий у представителей других родов. Афтовирусы уникальны по наличию в геноме трех подобных, но не идентичных участков, кодирующих белок VPg.
Вирионы представляют собой безоболочечные частицы, округлой формы с гладкой поверхностью диаметром 27 нм.
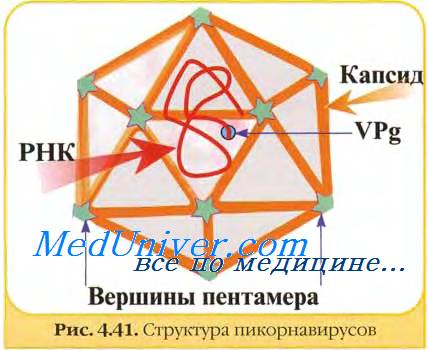
Геном представлен одной молекулой одноцепочечной (+)РНК размером 7,2—8,4 тн. Геномная РНК полиаденилирована на З'-конце и имеет белок VPg, связанный ковалентно с 5'-концом. Геномная РНК обладает инфекционностью, т.е. функционирует как мРНК, имеет одну открытую рамку считывания и транслируется в полипротеин, который затем расщепляется на 11 индивидуальных белков. Пикорнавирусы содержат 60 копий каждого из 4 капсидных белков: VP1, VP2 и VP3 (м.м. каждого 30000) и VP4 (м.м. 7000-8000) и 1 копию небольшого белка VPg (м.м. варьирует; афтовирусы кодируют 3 варианта VPg). Кроме того, в вирионах многих пикорнавирусов были обнаружены минорные белки, функция которых неизвестна.
Три белка VP1, VP2 и VP3, структурноподобных друг другу, образуют наружную поверхность вириона, а белок VP4 расположен внутри капсида и, вероятно, связан с геномной РНК. Белок VPg участвует в репликации РНК и, вероятно, выполняет сигнальные функции при инкапсидации.
В этом отношении риновирусы подобны вирусу ящура, который имеет относительно гладкую поверхность без структуры каньона; места прикрепления к клеточным рецепторам локализованы на верхушке выступов поверхности вириона. Эти участки являются весьма антигенными и определяют серотиповую специфичность вируса ящура. Установлены общие закономерности в антигенной структуре пикорнавирусов. Инфекция или иммунизация (146 S-частицами, но не 12-14 S-субъединицами) сопровождаются образованием вируснейтрализующих антител (ВНА). Главный иммуногенный сайт локализован в VP1, хотя нейтрализующие эпитопы локализованы в двух других капсидных белках - VP2 и VP3. Обнаружена многокомпонентность эпитопов, учавствующих в нейтрализации вируса. Замена только одной аминокислоты в эпитопе в процессе мутации может привести к изменению антигенной структуры пикорнавирусов. Ренгеноструктурный анализ позволил локализовать нейтрализующие антигенные участки энтеровирусов. У вируса полиомиелита идентифицировано три основных нейтрализующих участка: первый находится в VP1 и включает область аминокислот 89-100; второй - аминокислот 220-222 полипептида VP1 и аминокислот 270 или 164—172 полипептида VP2; третий — области аминокислот 58—60 и 70—74 полипептида VP3 или аминокислот 286—290 полипептида VP1 и 58-59 полипепттида VP3. таким образом, вирус полиомиелита содержит три основных антигенных участка, в которые вовлечены три капсидных белка. Первый нейтрализующий участок - непрерывный (области 89-100 аминокислот VP1), второй и третий — нейтрализующие состоят из двух областей: второй - из участков аминокислот белков VP1, VP2, третий - из участков аминокислот полипептида VP3 или VP1 и VP3.
Антигенные участки, связывающие антитела, не участвуют во взаимодействии полиовируса с клеточными рецепторами. У антигенных вариантов полиовируса устойчивость к нейтрализующим антителам сопровождалась аминокислотными заменами во всех трех наружных капсидных белках. На VP1 полиовируса типа 1 идентифицирован антигенный участок нейтрализации 1В. Он представлен эпитопом, который формируется двумя петлями VP1, а также включает аминокислотные остатки 69—104 и 141 — 152. Моноклональные антитела, реагирующие с VP1 полиовируса типа 1, связывались с областью аминокислот 93—104 указанного полипептида. Антигенные сайты сохраняли иммуногенную активность в инвактивированной вакцине. Протеолитическая активизация VP1 полиовируса повышала его антигенность для мышей. Вирус гепетита А, в отличие от полиовируса, по-видимому, обладает одним доминантным нейтрализующим участком. Хотя у энтеровирусов отсутствует групповой антиген, тем не менее, выявлены перекрестные реакции с антисыворотками на денатурированные антигены.
У энтеровирусов парнокопытных животных, кроме того, обнаружены общие эпитопы в полипептидах VP1. Вирус везикулярной болезни свиней содержит три белка: VP1, VP2 и VP3 с молекулярной массой соответственно - 33, 29 и 32 кД. Белки VP1 и VP2 ответственны за индукцию ВН-антител. Энтеровирусы энцефаломиелита и нефрита птиц антигенно не связаны между собой.
Эпитопы, расположенные в VP1, в отличие от эпитопов, расположенных в VP2, чувствительны к трипсину.
Субвирусные частицы 12S вируса ящура содержат высококонсервативный белок, который выявляется моноклональными антителами одной специфичности у шести из семи известных типов вируса. Однако иммунизация ими не сопровождалась образованием ВН-антител. Возможно, в создании специфической защиты существенную роль играют Т-хелперы и антителозависимые факторы иммунитета. Введение инактивированной противоящурной вакцины крупному рогатому скоту сопровождается образованием антител к капсидным белкам и полимеразе ЗД, тогда как при репликации инфекционного вируса дополнительно образуются антитела к неструктурным вирусным белкам (2В, 2С, ЗАВ 1 и/или ЗС). Репликация инфекционного вируса вызывает синтез последних независимо от предварительной вакцинации или клинического проявления заболевания. Данное явление дает возможность выявлять репликацию вируса ящура и различать иммунных и инфицированных животных.
Нейтрализующий эпитоп риновируса человека типа 2 включает аминокислотные остатки 153-164 2Р2. Зрелые вирионы пикорнавирусов по антигенности значительно превосходят собственные субвирусные частицы, образуемые как в процессе синтеза и морфогенеза вирионов, так и при их дезинтеграции. Это, по-видимому, в основном связано с конформационными изменениями структурных полипептидов. При денатурации различными факторами полиовирус, например, может потерять сердцевину. Такая ДС-антигенная конверсия сопровождается потерей способности индуцировать образование ВН-антител. У вируса ящура образование ВН-антител практически вызывали только полные вирионные (140S частицы), а не их компоненты. На этом основании об иммуногенности инактивированных вакцин против данных заболеваний можно судить по концентрации соответственно D- или 140S антигена.
Семейство Picornaviridae (от англ. pico — маленький, rna — РНК) — большая группа вирусов, поражающая позвоночных.
Вирионы пикорнавирусов представляют собой лишенные суперкапсидной оболочки частицы кубической симметрии диаметром 22—30 нм. Капсид состоит из 60 структурных единиц. Липидов и углеводов в составе вирионов не обнаружено. Молекулярная масса вирионов — 8—9 МД, плавучая плотность в CsCl 1,33 — 1,45 г/см 3 , коэффициент седиментации — 140—165S.
Геном пикорнавирусов представлен односпиральной линейной плюс-РНК с молекулярной массой 2,4—2,7 МД. На 3′-конце геномной РНК имеется поли-А последовательность, на 5′-конце — ковалентно связанный белок VPg (2,4 кД).
В вирионах пикорнавирусов обнаружены 4 полипептида, которые в порядке уменьшения молекулярной массы обозначены как VP1, VP2, VP3, VP4.
Вирусная РНК инфекционна и может выполнять функции как геномной, так и иРНК. Размножаются пикорнавирусы в цитоплазме клеток. Вирионная РНК транслируется с образованием гигантского полипептида (240—250 кД), который подвергается последовательному расщеплению до функционально активных структурных и неструктурных белков. После трансляции вирионная PHК служит матрицей для образования минус-РНК. Последняя, в свою очередь, служит матрицей для синтеза плюс-РНК. Репликация вирусной РНК происходит в комплексах, ассоциированных с цитоплазматическими мембранами. Сборка вирионов происходит в цитоплазме клеток в несколько этапов. Зрелые вирионы освобождаются из клетки при ее разрушении путем лизиса. В процессе морфогенеза образуются различные морфологические структуры, с последовательно возрастающими коэффициентами седиментации.
Большинство пикорнавирусов специфичны одному хозяину пни небольшому количеству их видов. Исключения составляют вирус ящура и вирус эндефаломиокардита. Распространение инфекции происходит горизонтально — алиментарно или аэрозольно. Сведений о существовании членистоногих переносчиков (векторов) нет, хотя вирусы энцефаломиокардита выделяли от клещей и москитов.
Обычно инфекция цитолитическая, однако персистентная инфекция также часто встречается.
Семейство Picornaviridae состоит из шести родов: Enterovirus, Rhinovirus, Cardiovirus, Aphtovirus, Hepatovirus и Parechovirus.
Род Enterovirus. Включает полиовирусы человека — типов 1 (прототипный вирус), 2 и 3, энтеровирусы — коксакивирусы человека, энтеровирусы крупного рогатого скота и свиней, вирус болезни Тешена, вирус везикулярной болезни свиней и др. Вирусы репродуцируются в основном в клетках желудочно-кишечного тракта, но могут накапливаться и в других тканях, например в нервной, мышечной и др. Клинически болезнь может характеризоваться менингитами, энцефалитами, миелитами, миокардитами, конъюнктивитами, энтеритами и везикулярными поражениями.
Род Rhinovirus. Включает несколько десятков серотипов риновирусов человека и 3 серотипа риновируса крупного рогатого скота. Прототипный вирус — риновирус человека А. Вирусы вызывают патологию верхних и нижних дыхательных путей, распространяются аэрогенно.
Род Cardiovirus. Включает вирусы энцефаломиокардита (прототипный вирус). Вирус энцефаломиокардита был выделен от животных, более чем 30 видов, включая млекопитающих, птиц и членистоногих. Клиническая картина характеризуется энцефалитами и миокардитами. К этому роду относится вирус вилюйского энцефалита, который является этиологическим агентом дегенеративной неврологической болезни человека, наблюдаемой в регионе Вилюйской долины в Сибири.
Род Aphtovirus. Включает вирусы ящура (прототипный вирус типа О). В настоящее время установлено 7 типов вируса ящура: А, О, С, Азия 1, Satl, Sat2, Sat3. В этот род относят еще вирус ринита лошадей А (серотип 1). Вирус ящура поражает в основном парнокопытных животных. Афтовирусы вызывают поражения слизистой оболочки ротовой полости, бесшерстных участков кожи головы, вымени, венчика и области межкопытной щели у парнокопытных животных, а у молодых животных возможен фатальный миокардит.
Род Hepatovirus. Включает вирусы гепатита А человека (прототипный вирус) и обезьян. Вирус инфицирует эпителиальные клетки тонкого кишечника и гелатоциты приматов. Клинически болезнь проявляется лихорадкой, желтухой, нарушением пищеварения, брюшными болями, иногда диареей. Передается вирус главным образом фекально-оральным путем. Предполагают, что к этому роду относится вирус, вызывающий энцефаломиелит у молодняка кур, фазанов, перепелов и индеек.
Род Parechovirus. Включает два серотипа парэховируса человека, Вирусы изучены недостаточно. Известно, что инфекция встречается в основном среди детей раннего возраста с признаками поражения желудочно-кишечного и респираторного трактов.
Если вы нашли ошибку, пожалуйста, выделите фрагмент текста и нажмите Ctrl+Enter.
К пикорнавирусам относятся энтеровирусы – возбудители полиомиелита, Коксаки и ЕСНО. К этой группе принадлежат и недавно описанные калицивирусы.
Среди энтеровирусов гастроэнтериты могут вызывать вирусы Коксаки А 18, 20, 21, 22, 24; ЕСНО 11, 14, 18; возможно, Коксаки В 2, 3, 4 и др. Источник инфекции – больной человек и вирусоносители, число последних чрезвычайно велико, особенно среди детей дошкольного возраста. Во внешнюю среду возбудители поступают с фекалиями и носоглоточным секретом, обеспечивая широкое инфицирование воды, предметов домашнего обихода, продуктов питания и др.
Вопрос о ведущем механизме передачи дискутируется. Актуальны и фекально‑оральный, и аэрогенный (в рамках последнего – воздушно‑капельный путь) механизмы.
Контагиозность энтеровирусной инфекции высока, отмечается склонность к большим эпидемическим вспышкам, хотя возможна и спорадическая заболеваемость. Болеют лица всех возрастов, чаще дети.
Клиническая картина. Включает в себя синдром интоксикации, сопровождающийся внезапным повышением температуры тела до 38–39 °С, и синдром гастроэнтерита (несильные боли в области живота, тошнота, рвота, нечастый, но обильный водянистый стул без патологических примесей, нередко со зловонным запахом и зеленоватого цвета, обычно не чаще 4–6 раз в сутки). При пальпации живота определяются небольшое вздутие, урчание. У 1/3 больных увеличивается печень.
Течение чаще всего нетяжелое, общая продолжительность заболевания 1–3 дня.
Прогноз. Благоприятный.
Энтеровирусная инфекция часто протекает без кишечных проявлений в форме серозных менингитов, энцефалитов, миокардитов и миокардиодистрофий, эпидемической миалгии, герпангины и др.
Калицивирусная инфекция описана впервые в 1980 г. в Японии как причина гастроэнтерита у детей. В последующем появились сведения о вспышках этого заболевания и у взрослых.
Контагиозность инфекции высокая. Инкубационный период 24–48 ч. Течение непродолжительное, представлено симптомами гастроэнтерита, завершается быстрым выздоровлением.
Диагностика вирусной диареи. Диагноз острых кишечных инфекций вирусной природы базируется на клинической картине заболевания (особенно важно сочетание синдрома гастроэнтерита и поражения верхних дыхательных путей), учете эпидемиологических данных и исключении бактериальной природы заболевания.
Для подтверждения вирусной этиологии заболевания проводят вирусологические и серологические исследования: 1) выявление вируса или вирусного антигена в фекалиях с помощью электронной, в том числе иммуноэлектронной микроскопии; методом иммуноэлектроосмофореза; 2) выделение вируса в культуре клеток из различных биологических субстратов (смывы из зева, фекалии); 3) серологические исследования для определения специфических противовирусных антител и нарастания их титра в динамике болезни (реакция нейтрализации вируса, реакция подавления гемагглютинации, реакция связывания комплемента, ИФМ, латекс‑агглютинация).
Лечение больных вирусной диареей принципиально не отличается от комплексной терапии больных другими острыми кишечными инфекциями. Очень важны лечебное питание и коррекция ферментной недостаточности желудочно‑кишечного тракта. С этой целью назначают полиферментные препараты (полизим, абомин, фестал, панзинорм форте, панкреатин, мезим форте, дигестал и др.). Необходима также соответствующая диетотерапия с исключением, а затем ограничением приема молока.
При обезвоживании проводят пероральную регидратацию стандартным глюкозо‑электролитным раствором, содержащим бикарбонат. В тяжелых случаях дегидратации проводят регидратационную терапию путем внутривенного введения полиионных растворов в объеме до 3–4 л под контролем содержания электролитов в плазме крови и функции почек. При этом учитывают продолжающиеся потери жидкости и солей.
Ввиду неэффективности антибактериальных препаратов при вирусных заболеваниях их назначение нецелесообразно, если нет доказательств присоединения бактериальных осложнений.
Профилактика. Специфическая профилактика вирусных диарей в нашей стране не разработана. Общие меры профилактики совпадают с таковыми при других кишечных инфекциях и дополняются мерами предупреждения распространения инфекции воздушно‑капельным путем.
Читайте также:


