Антитела при вирусной инфекции
Вслед за праймированием антигеном и клональной экспансией лимфоцитов образуется популяция долгоживущих клеток иммунологической памяти, персистирующей неопределенно долго без деления до стимуляции последующей реинфекцией или реиммунизацией. Т-клетки памяти характеризуются особыми поверхностными маркерами (СД4/5RO) и хоминг-молекулами, связанными с определенным путем рециркуляции. При повторной встрече с тем же антигеном, даже много лет спустя, Т- и В-клетки отвечают более быстро и более интенсивно, чем при первичной встрече.
Клетки памяти на повторное введение того же антигена также реагируют анамнестическим (вторичным) ответом с продукцией большого количества специфических антител.
Немного известно о механизме продолжительной иммунологической памяти Т- и В-лимфоцитов в отсутствии выраженной хронической инфекции. Возможной причиной иммунологической памяти является продолжительная антигенная индукция, исходящая от фолликулярных дендритных клеток-ловушек в терминальных центрах лимфатических узлов, где происходит индукция В-клеток памяти. Опыты на кроликах, вакцинированных против бешенства, убеждают, что соматическая мутация В-клеток является результатом антигенспецифического иммунного ответа.
Так как соматические мутации не происходят в генах, кодирующих Т-клеточные рецепторы, а роль персистенции вирусного антигена не подтверждена, развитие иммунологической памяти Т-клеток зависит от размера клональной экспансии на первую встречу с антигеном. В этой связи при разработке новых, более эффективных вакцин следует обращать внимание на длительное поддержание Т-клеточной памяти.
Важно знать возникновение памяти у различных компонентов иммунной системы, а также ее персистенцию после иммунизации инактивированными и живыми вирусными вакцинами при различных путях введения.
Известны примеры, когда Тц-клетки памяти способны длительно персистировать в организме иммунизированных животных. После энтеральной иммунизации мышей реовирусом Тц-лимфоциты и клетки памяти, продуцирующие IgA, способны длительное время персистировать в лимфоидной ткани, особенно в пейеровых бляшках. В легких мышей, инфицированных вирусом гриппа, клетки, секретирующие специфические IgG и IgA, сохранялись в течение 11 мес, а время полужизни Тц клеток иммунологической памяти при гриппе человека составляет 2—3 года. Введение повышенной дозы вирусных антигенов способствовало ранней индукции Тц-клеток, оказывающих протективный эффект in vivo при бешенстве и ускоренному наступлению иммунитета при гепатите В.
Клон Тц-клеток памяти, способных реагировать на повторную иммунизацию, формируется к 30-му дню после введения антигена вируса бешенства. У мышей-реконвалесцентов Тц-клетки могут сохраняться в течение года, а у человека—в течение нескольких лет. Антитела к вирусу гепатита В после буферизации сохраняются в течение трех лет, а после иммунизации вакциной 17D против желтой лихорадки нейтрализующие антитела сохранялись 30—35 лет.
Существует мнение, что живые и инактивированные вакцины индуцируют В- и Тц-лимфоциты и клетки иммунологической памяти не столь эффективно, как естественное инфицирование. Так, иммунитет у переболевших корью людей сохраняется пожизненно, а после первичной иммунизации живой вакциной — около 15 лет.
Хотя инактивированные вирусные вакцины обычно индуцируют выработку антител и В-клеток памяти, тем не менее, они по-разному влияют на индукцию двух типов эффекторных клеток. Препараты инактивированного вируса гриппа вызывали у мышей длительную память Т-хелперов, но слабовыраженную память цитотоксических клеток. В то же время инактивированные препараты вируса парагриппа-1 типа Сендай, антигены которого эффективно включаются в структуру клеточных мембран, индуцируют образование Тц-клеток.
При одних заболеваниях (оспа человека, оспа животных, полиомиелит, чума крупного рогатого скота, классическая чума свиней) имеются живые вакцины, создающие длительный или пожизненный иммунитет, при других — разработаны высокоэффективные инактивированные или компонентные вакцины (ящур, болезнь Ауески, гепатит В и др.). Вакцинальный иммунитет во многих случаях по всем или основным компонентам иммунного ответа практически не уступает или немногим уступает состоянию реконвалесценции.
Таким образом, можно констатировать, что время появления, интенсивность образования антиген-стимулированных В- и Тц-клеток и персистенция клеток иммунологической памяти при прочих равных условиях зависит не столько от вида примененной вакцины (живой или инактивированной), сколько от ее антигенного воздействия на различные компоненты иммунной системы привитого организма. Реализация потенциальной антигенной активности вакцинных препаратов в значительной мере может зависеть от способа их введения, схемы применения, а в случае использования инактивированных вакцин также и от качества иммунологических адъювантов.
В зависимости от степени устойчивости вакцинированных особей к заражению вирулентным штаммом соответствующего возбудителя, следует различать клинический и биологический иммунитет. В первом случае, вирус проникает и размножается в организме без манифестации признаков болезни. Во втором -организм противостоит инфицированию, то есть способен остановить размножение вируса в воротах инфекции.
Характерным примером, демонстрирующим индукцию клинического иммунитета, могут служить вакцинные препараты против простого герпеса, предотвращающие заболевание, но не персистентную вирусную инфекцию. Указанная особенность присуща вакцинальному иммунитету при ряде других инфекций и, прежде всего, вызванных герпесвирусами.
Трехкратная парентеральная иммунизация обезьян инактивированной вакциной против полиомиелита предотвращала заболевание и экскрецию вируса с фекалиями после контрольного заражения. Однако у таких обезьян в ответ на введение вируса наблюдали бустерный антительный ответ, свидетельствующий о приживляемости вируса на вакцинальном фоне. У поросят с материнским иммунитетом ротавирус размножался в кишечнике и выделялся с фекалиями при отсутствии клинических признаков болезни. Подобные явления имеют место в случаях, когда переболевание, а тем более вакцинация, сопровождаются развитием относительно слабовыраженного иммунитета. Инфекции, при которых ре-конвалесценция сопровождается напряженным и длительным иммунитетом, теоретически могут контролироваться биологическим вакцинальным иммунитетом.
К ним, прежде всего, относятся остропротекающие инфекции, с выраженным системным иммунитетом, такие как корь, классическая чума свиней, чума крупного рогатого скота и др. Поросята, вакцинированные живой культуральной вакциной против классической чумы свиней, вскоре после парентерального контрольного заражения были свободны от вирулентного штамма вируса. При контакте с больными у вакцинированных животных не отмечали появления вторичных антител.
В заключение следует сказать, что эффективный гуморальный или клеточный иммунитет имеет поликлональную природу. В подтверждение сказанного можно привести два примера. Адоптивный перенос 4х107 Т-лимфоцитов двух субпопуляций (CD4 и CD8) от иммунизированных вирусом Раушера мышей полностью защищал реципиентов от виремии и спленомегалии после заражения вирусом. Перенос клеток одной из этих субпопуляций обеспечивал лишь частичную защиту мышей. Протективный иммунитет к вирусу японского энцефалита у мышей, коз и обезьян значительно усиливался после смешивания различных моноклональных вируснейтрализующих антител.
Существуют тесные взаимоотношения между резистентностью, клеточным и гуморальным иммунитетом. В реакциях клеточного иммунитета принимают участие как Тц-лимфоциты, так и антитела (например, в зависимой от антител клеточной цитотоксичности). Главные эффекторы резистентности — макрофаги — также играют важную роль эффекторов клеточного иммунитета. Активность их в известной мере зависит от комплемента, антител и лимфокинов.
Следует отметить, что иммунокомпетентные клетки не всегда играют положительную роль. Способность цитотоксических лимфоцитов разрушать зараженные вирусом клетки также может быть причиной развития иммунопатологических поражений органов и тканей. Кроме того, дендритные и макрофагальные клетки способны захватывать иммунные комплексы и сохранять их длительное время, что способствует развитию персистентной инфекции, обусловленной лентивирусами и вирусом алеутской болезни норок. А лимфоциты, являясь местом первичной латентной инфекции вирусом Эпштейн-Барр, способствуют распространению его в организме.
- Вернуться в оглавление раздела "Микробиология."
Сильный иммунитет, слабый иммунитет, риски тяжёлой формы болезни COVID-19.
Люди по всему миру болеют новой коронавирусной инфекцией. Одни переносят легко, другие тяжело, с угрозой для жизни — какие тут факторы важны и какова роль иммунитета? Есть накапливающаяся статистика: все уже запомнили, что риски тяжёлого течения COVID-19 сильно растут с возрастом пациента, значительно выше для мужчин, чем для женщин, выше для людей с астмой, заболеваниями сердца и почек, для тех, кто принимает сартаны (распространённое лекарство для лечения артериальной гипертензии) и т.д. Но эти разрозненные факты не особо помогают понять патогенез, т.е. как развивается болезнь, и выделить важные факторы выздоровления или наоборот, проявления тяжёлой формы COVID-19.
Есть основания полагать, что большинство смертей от коронавируса связаны с чрезмерной и разрушительной реакцией иммунной системы, а не с прямыми повреждениями, которые организму наносит размножающийся вирус.
Иммунная реакция на вирус отличается у разных людей уже с первых часов заражения, она зависит и от наследственных факторов, факторов среды (например, загрязнённый городской воздух) и от привычек (например, курения или занятий спортом), влияющих на состояние иммунитета слизистых оболочек дыхательных путей. У кого-то быстро вырабатываются интерфероны — первые сигналы для организма о необходимости противовирусной защиты. В идеальной ситуации сигнал интерферонов I типа приводит к тому, что эпителий сам защищается от репликации вируса, и вдобавок иммунные клетки приходят и уничтожают заражённые клетки, которых на первой стадии немного. Если выработка интерферонов происходит с задержкой, вирус успевает размножиться, и для борьбы с ним требуется больше активирующих сигналов иммунитету, воспаление развивается интенсивнее/стремительнее, что приводит к — бóльшему повреждению ткани (эпителия альвеол лёгких).
Хорошо изучено, что для разных вирусных инфекций очень важен тайминг продукции интерферонов I типа. Ранняя выработка интерферона или системное введение дополнительного экзогенного интерферона (на ранних асимптоматических стадиях болезни) в моделях на животных защищает от различных вирусов (первого SARS-коронавируса, хорошо изученной модельной инфекции LCMV , вируса иммунодефицита обезьян): ткань, подвергающаяся атаке инфекции, и врождённый иммунитет справляются с первой порцией вируса сразу после заражения. А вот если продукция интерферонов I типа начинается с задержкой, вирус успевает размножиться и распространиться по площади органа и дальше по организму. В тех же моделях на животных такая динамика ассоциирована со сниженным числом Т-киллеров субпопуляции CD8+ и патологически сильным системным воспалением — организм сильнее повреждается из-за действия врождённого иммунитета, и в таком случае становится гораздо сложнее полностью избавиться от вируса.
У вируса Эболы, например, есть белок VP35, ответственный за подавление выработки интерферона, поэтому Эбола сразу переходит на второй тип динамики вирусного иммунного ответа. Из других респираторных вирусов пандемический штамм гриппа 1918 года тоже отличался нехарактерным для большинства сезонных штаммов гриппа эффективным подавлением продукции интерферонов I типа и параллельно повышал, как считается, уровень воспалительных сигналов (цитокинов) в системном кровотоке, что приводило к тяжёлому устойчивому воспалению ткани лёгких.
- настроить иммунный ответ с общей непонятной паники на противовирусный ответ (выбрать и активировать нужные клетки Т-хелперы);
- выбрать из разнообразия Т-клеток те, которые способны убить зараженные вирусом клетки, не повредив соседние клетки лёгких (активировать Т-киллеры);
- дополнительно выработать антитела с помощью В-клеток, чтобы блокировать готовые вирусные частицы.
Реакция адаптивного иммунитета точнее и безопаснее, на этой фазе организм стремится уменьшить мощности врождённого иммунитета и быстро ответить с помощью адаптивных иммунных клеток. Если нашлись специфичные к вирусу Т-клетки и В-клетки (способные узнать белковые фрагменты вируса своими Т- и В-клеточными рецепторами), они получают лицензию на работу и размножение, это значит, что в организме формируется клон клеток — множество одинаковых специфичных к вирусу клеток. Из этого множества одинаковых потомков часть клеток скорее всего выживет и сформирует иммунную память, чтобы повторно человек не заразился.
Самая важная часть противовирусного адаптивного иммунного ответа — это специфичные Т-киллеры (CD8+ Т-клетки), которые уничтожают заражённые клетки респираторного/кишечного эпителия. При этом тоже повреждается ткань альвеол, но иначе мы не можем избавиться от вируса, уютно и спокойно размножающегося внутри наших клеток. Т-клеточный иммунный ответ на новые инфекции сильно ослабляется с возрастом, особенно после 60 лет. Специфичную Т-клетку к совершенно новой инфекции сложно подобрать, скорее всего, у пожилого пациента в организме вообще нет таких подходящих клеток: почти все Т-клетки представляют собой клоны иммунной памяти на старые прошедшие инфекции, а тимус (вилочковая железа) уже не производит новые Т-клетки [2].
Очень многие эксперты сейчас говорят и пишут, что как только ваш организм начинает вырабатывать нейтрализующие коронавирус антитела, вы точно выздоровеете, это дело времени. Это не совсем так. Кроме того, что можно не успеть обогнать вирус, сейчас всё больше данных говорит о том, что антитела усиливают повреждение лёгких и ускоряют кровоизлияние в них, от которого человек погибает. Например, здесь показано, что титр (концентрация, уровень в плазме крови) IgG-антител скоррелирован с возрастом, тяжёлыми симптомами и лимфопенией (снижением количества клеток адаптивного иммунитета). Это же показывает и модель, в которой макак заражали предыдущим вирусом SARS (высокий титр эффективных нейтрализующих антител IgG к spike-белку оболочки коронавируса коррелировал с сильным повреждением ткани лёгких). Почему так происходит, что от антител ухудшается течение COVID-19, интуитивно же должно же быть наоборот?
Дело в том, что кроме последовательности
врождённый иммунитет → доставка вируса или его обломков в лимфоузел → подбор, поиск и активация адаптивного иммунитета
есть и следующая часть: адаптивный иммунитет выбрал стратегию конкретного иммунного ответа (Т-хелперы подумали и решили) → часть оружия врождённого иммунитета выключается, нужная часть продолжает использоваться. Здесь антитела типа IgG1 направляют и активируют конкретную часть врождённого иммунитета: атаку М1-воспалительных макрофагов на клетки, на поверхности которых сидит вирус. Это не сломанная, а адекватная реакция именно на вирусную инфекцию, но чрезмерная. До этого часть макрофагов в лёгких находились в спокойном режиме, в котором они стимулируют регенерацию: размножение клеток, рост матрикса [4], на котором клетки живут; а также занимались уборкой мёртвых клеток и мусора. М1-воспалительные макрофаги уничтожают матрикс, атакуют клетки, облепленные вирусом, и очень быстро разрушают тонкие альвеолы.
Возможно, при производстве терапевтических антител подойдёт применяющийся сейчас подход с оптимизацией по максимальной прочности связывания антител с вирусом. При этом может возникнуть необходимость поменять изотип гуманизованных антител, например, с IgG1 на IgG4, т.к. IgG4 будут мешать вирусу проникать в клетку, но не будут активировать макрофаги. Возможно, подход к подбору терапевтических антител придётся поменять и это вообще будет антитело не на spike-гликопротен вируса, а на другой антиген. Относительно лечения пациентов с COVID-19 сывороткой, полученной от переболевших этим заболеванием людей, что-то определённое сказать сложно, т.к. подобный препарат будет содержать смесь антител с разными свойствами и функциями, и прогнозировать результат терапии на современном этапе весьма затруднительно. Об этом проще будет говорить по результатам, которые мы увидим в течение следующих двух-трёх месяцев.
За последние недели я видела довольно много противоречивых данных о лимфопении (снижении количества клеток адаптивного иммунитета) у пациентов COVID-19. Пока непонятно, это все клетки ушли на войну в лёгкие/кишечник и поэтому снижена численность в крови? Или иммунные клетки активно погибают? Вопрос остаётся открытым, но и не все исследования подтверждают этот факт. В некоторых когортах не было разницы по общей численности лимфоидных клеток между пациентами с лёгким и тяжёлым протеканием болезни, то есть лимфопения под вопросом.
Кажется, есть возможность для более сложной регуляции работы В-клеток и выработки антител, но это на данный момент не до конца изучено. В геноме SARS-CoV-2 (у первого SARS такого не было) есть участок, комплементарный продукту гена BLNK, который важен для развития В-лимфоцитов. Теоретически, коронавирус может с помощью этой РНК влиять на дифференцировку новых наивных В-клеток и в селекции активированных В-клеток, пока идёт отбор оптимальных антител, тем самым меняя адаптивный иммунный ответ.
Мать переболевшего семейства решилась выяснить правду
два дня назад в 13:01, просмотров: 152988
Госпиталь в Сколково стал первой медицинской организацией в России, где можно в массовом порядке пройти тестирование на антитела к COVID-19. В марте я и мои дети переболели с температурой и кашлем. Но был ли это коронавирус? С таким внутренним вопросом я отправилась сдавать тест на антитела.
С того момента, когда предложение проходить тест начало действовать, минула всего неделя, и за это время сдать экспресс-анализ успело около 1000 человек. Часть пробирок с кровью приехала сюда в пробирках из различных организаций, с которыми у госпиталя заключен договор. Половина клиентов – сотрудники московских больниц, медработники, врачи, для которых эта информация особенно важна. Ведь наличие антител к этому вирусу означает, что они уже успели переболеть COVID-19 в лёгкой или бессимптомной форме, и теперь могут безбоязненно работать даже в тесном контакте с зараженными людьми, не боясь тяжелых последствий для себя и окружающих. В число испытуемых попал и репортер "МК".
Госпиталь не похож на привычную больницу или поликлинику. Это ярко-зеленое здание в стиле хайтек с прозрачными лифтами, огромными сферическими фигурами на потолке, которые вечером освещают холл вместо люстр, и просторными диванами округлых форм, в которых хочется утонуть. Если бы не встречающие на ресепшн девушки в глухих защитных комбинезонах, очках и респираторах – можно было бы подумать, что попал в современный пятизвездочный отель.
Первым делом всем входящим измеряют температуру бесконтактным способом. Если она оказалась повышенной, гостя сразу направляют к врачу-инфекционисту, который собирает эпиданамнез и осматривает больного. Контакт с другими посетителями исключен – потенциально больных и здоровых разделяют на входе.
У меня температура оказалась нормальной, да и чувствую я себя хорошо. Поэтому меня сразу направляют на стойку, где оформляются все документы для прохождения анализа, а затем предлагают пройти в процедурный кабинет.
Зачем мне вообще нужно сдавать такой анализ? Я ведь за границей не была. С больными не общалась.
Дело в том, что примерно месяц назад, в марте, в течение недели я плохо себя чувствовала – держалась субфебрильная температура (порядка 37,3-37,5) , побаливало и першило горло, а главное – ощущалась сильная слабость и ломота в мышцах. Перед этим по очереди переболели довольно тяжелыми бронхитами два моих сына. Вот я и решила, что это, наверное, был наш новый знакомый коронавирус. И теоретически мы можем стать донорами плазмы для тех, кто в ней сейчас так отчаянно нуждается, спасти чью-то жизнь. Классно же!
Сразу после анализа пробирка с венозной кровью через специальное окошечко в стене попадает в лабораторию, где её помещают в центрифугу и начинают раскручивать со скоростью более 3000 оборотов в минуту. Этого достаточно, чтобы разделить кровь на плазму и эритроциты. Крутится пробирка, словно космонавт-испытатель, пять минут, а затем разделенную плазму помещают в индивидуальный планшет – небольшую светлую коробочку из пластика, и с помощью белков-антигенов производится анализ.

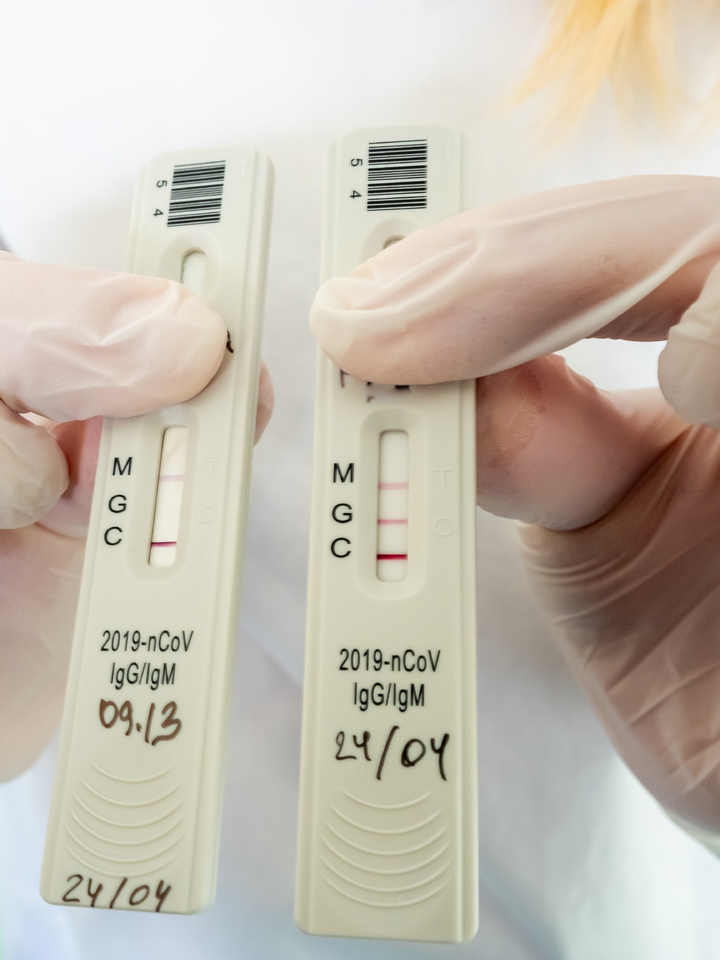
Повышенный уровень IgM говорит о том, что человек является носителем коронавирусной инфекции в данный момент. Он может этого не знать и не чувствовать – но организм реагирует на чужеродный белок иммунным ответом. Повышенный уровень IgG – это как раз тот показатель, который волновал меня больше всего: он показывает, что человек уже переболел данной инфекцией и теперь у него есть к ней иммунитет.
Любовь Станкевич, заведующая отделением лабораторной диагностики, показывает мне различные варианты таких планшетов, спрятав под пальцем написанные маркером фамилии пациентов, которые являются медицинской тайной. Вот планшет, где уровень IgM выше нормы – человек болен. А вот этот, видимо, переболел – там высок уровень IgG.
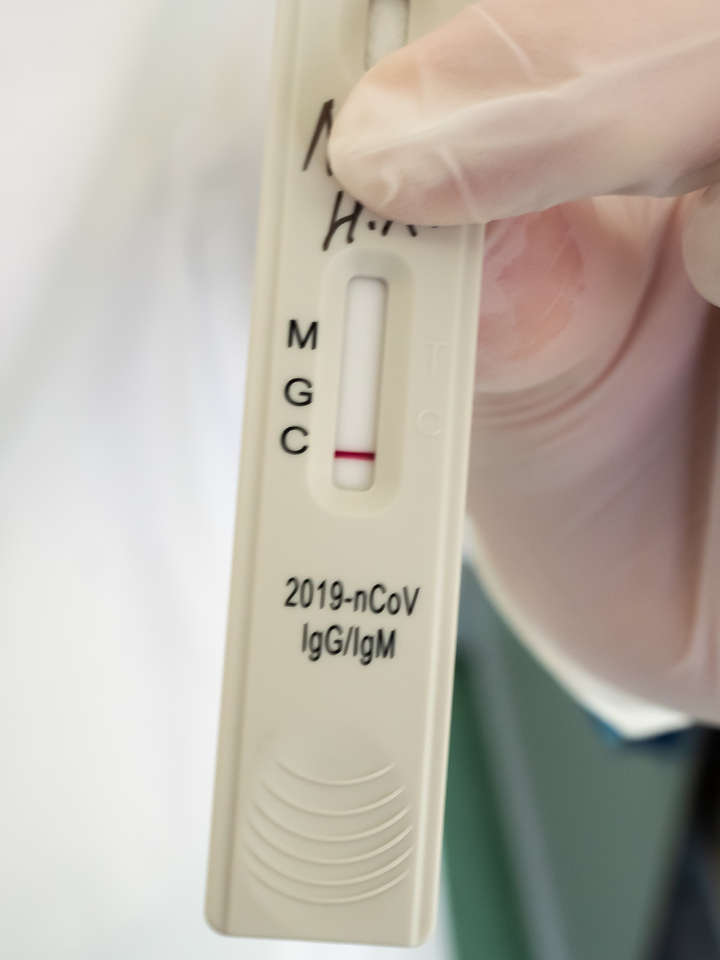
Это очень хороший вариант течения болезни. Намного хуже, когда человек длительное время болеет, а антитела никак не вырабатываются. Именно такие варианты считаются самыми тяжелыми. Мало того: тут есть особые сложности для создания вакцины. Ведь на такого человека она может и не подействовать.
Ожидание результатов экспресс-теста занимает всего 20-30 минут. За это время мы успеваем обсудить важные детали. Например, может ли такой тест заменить уже привычную ПЦР-диагностику? Ведь её порой приходится ждать до недели, да и результаты, чего греха таить, не всегда точны. А тут точность превышает 95 процентов, и ждать ответа совсем недолго.
Тест, который сегодня используется, поставлен из Сингапура. Он специфичен и высокоточен. Вообще в мире таких тестов создано немало. Сейчас все идут по этому пути, который представляется более перспективным, чем ПЦР-диагностика, дающая массу ложноотрицательных результатов.
По словам Любови Станкевич, причина проста – мы, как в известном анекдоте, ищем ключ не там, где он может быть, а там, где светлее – а именно в наиболее доступной ротоглотке, откуда и берут мазок на коронавирус. Однако это, как выяснилось, не главный резервуар для его обитания. А главный – это наша дыхательная система, альвеолы легких, секрет из которых получить значительно сложнее. Тут на помощь и пришла наша иммунная система, которая с готовностью отвечает на любой вызов извне. И такие тесты, действительно, оказались значительно надежнее, чем ПЦР. Так, может быть, надо оказаться от прежнего метода и повсеместно внедрить тестирование на антитела к COVID-19?
Но вот тайная дверь, за которой заканчивается колдовское действо над моей кровью, приоткрывается, оттуда показывается облаченная в ярко-синий капюшон голова лаборанта, и он передает все сведения заведующей, а та относит их обратно на ресепшн, где мне распечатывают результат. С замиранием сердца жду, что же написано в заветной бумажке. Открываю…
Что ж, жаль, конечно, но, с другой стороны, ничего не изменилось: надо беречься, минимизировать контакты, фанатично мыть и обрабатывать антисептиками руки, пользоваться масками и сохранять информированный оптимизм. Уверена, что это нас всех, в конце концов, спасёт – вкупе с учеными и врачами, которые у нас всё-таки лучшие в мире.
КСТАТИ
Заголовок в газете: Коронавирус и тайная комната
Опубликован в газете "Московский комсомолец" №28250 от 27 апреля 2020 Тэги: Дети , Коронавирус, Биотехнологии, Анализы, Договор Места: Россия
Заражение вирусом — обычное дело для большинства людей. С этими внеклеточными агентами мы сталкиваемся буквально ежедневно. Но что значит положительный анализ? И почему он может быть таким, когда никаких симптомов или ухудшения состояния не наблюдается? Разобраться в разных классах антител к вирусам поможет MedAboutMe.
Как определить заражение вирусом: симптомы и анализы
Инфекция начинается с острого периода: вирус активно размножается в клетках, а иммунная система вырабатывает защитные механизмы. В зависимости от вида микроорганизмов, после этого может наступить полное выздоровление, носительство или же болезнь перейдет в хроническую форму с последующими обострениями.
Чаще всего острая стадия характеризуется наличием симптомов. Например, грипп и другие острые респираторные вирусные инфекции (ОРВИ) проявляются высокой температурой, кашлем, общим ухудшением состояния. Ветряная оспа отличается выраженной сыпью, а паротит — воспалением заушных лимфоузлов. Однако в некоторых случаях, даже на начальном этапе, вирус в организме не дает о себе знать — болезнь протекает бессимптомно.
Диагностику осложняет и то, что схожие признаки могут быть у разных вирусов. Например, папилломавирусы могут вызывать образование бородавок и кондилом, но при этом быть разными по типу, а значит, и по опасности. Некоторые виды могут проходить без лечения, другие требуют контроля, поскольку являются онкогенными.
Именно поэтому окончательный диагноз можно поставить только после анализа на антитела к вирусу — иммуноферментного исследования. Диагностика крови выявит конкретный тип, а также поможет определить стадию болезни, интенсивность поражения вирусом и даже заразность человека. В некоторых случаях используется анализ ПЦР (полимеразная цепная реакция), который помогает выявить даже минимальное количество вируса в пробе.
Виды антител к вирусам
После заражения вирусом активизируется иммунная система: к каждому конкретному чужеродному объекту (антигену) вырабатываются иммуноглобулины (антитела), которые способны нейтрализовать его. Всего у человека выделяют пять классов таких антител — IgG, IgA, IgM, IgD, IgE. В иммунитете каждый из них играет свою роль. При анализе на вирусную инфекцию наиболее важными являются два показателя — IgG, IgM. Именно по ним определяется стадия и степень болезни, отслеживается процесс выздоровления.
IgM — первые антитела, которые вырабатываются организмом при заражении вирусом. Появляются они во время острой стадии болезни, а также в период обострений хронического заболевания. Для разных вирусов период обнаружения IgM в крови разнится: например, при ОРВИ их количество достигнет пика уже на первой неделе, а при вирусе иммунодефицита человека (ВИЧ) или вирусном гепатите — лишь спустя 4-5 недель после предполагаемого заражения.
IgG — антитела, которые присутствуют в крови на стадии длительной болезни, выздоровления или хронического течения в период ремиссии. И если IgM живут несколько месяцев, то IgG к некоторым вирусам способны оставаться на всю жизнь. Даже тогда, когда сама инфекция давно побеждена.
Именно соотношение показателей IgG и IgM дает возможность врачу оценить состояние человека. В частности, предположить, как долго инфекция находится в организме. Возможные комбинации говорят о следующем:
- Нет IgM и IgG. Организм не встречался с вирусом, нет иммунитета. Такая картина — не всегда повод успокоиться. Негативный анализ на некоторые виды вирусов ставит человека в группу риска по первичному заражению. Например, это актуально для тех женщин, которые планируют ребенка. В случае получения таких результатов на краснуху, паротит, ветрянку и прочие вирусы рекомендуется отложить беременность и пройти вакцинацию.
- Есть IgM, нет IgG. Первичное заражение, острая стадия заболевания.
- Нет IgM, есть IgG. Перенесенное заболевание, реже хроническая форма в стадии ремиссии. Приобретенный иммунитет.
- Есть IgM и IgG. Хроническое заболевание в период обострения или окончание болезни.
Что такое приобретенный иммунитет
Человеческий иммунитет делится на врожденный и приобретенный. Системы первого способны атаковать любой чужеродный микроорганизм, токсин и прочее. При этом эффективность такой защиты далеко не всегда высока. Приобретенный иммунитет, напротив, рассчитан на конкретные антигены — он способен противостоять лишь тем вирусам в организме, которые уже заражали человека.
За приобретенный иммунитет, в частности, отвечают и иммуноглобулины. В первую очередь, класса IgG, которые способны оставаться в крови человека на протяжении всей жизни. При первичном заражении иммунная система лишь производит эти антитела к вирусу. При следующих случаях заражения они быстро атакуют и нейтрализуют антиген, и заболевание просто не развивается.
Именно приобретенным иммунитетом объясняется понятие детских инфекционных болезней. Поскольку вирусы достаточно распространены, человек сталкивается с ними еще в первые годы жизни, переносит острую форму, и в дальнейшем получает надежную защиту в виде антител IgG.
И хотя большинство подобных заболеваний (краснуха, паротит, ветрянка) переносится легко, они все же могут давать осложнения на здоровье человека. Другие (полиомиелит) грозят опасными последствиями. Поэтому ко многим из них разумнее проводить вакцинацию. С помощью прививки запускается процесс производства антител к вирусу класса IgG, но при этом человек не переносит болезнь.
Вирус в организме: носительство инфекции и болезни

Некоторые вирусы в организме остаются пожизненно. Связано это с их возможностями защиты — одни проникают в нервную систему и там перестают быть доступными для иммунных клеток, а ВИЧ, например, атакует сами лимфоциты.
При этом наличие вируса не всегда говорит о самом заболевании. Иногда человек остается просто его носителем и на протяжении всей жизни не ощущает последствий вирусной инфекции. Примером таких антигенов могут быть герпесвирусы — простой герпес 1 и 2 типов, цитомегаловирус, вирус Эпштейна-Барр. Большинство населения планеты инфицировано этими внеклеточными агентами, однако болезни, связанные с ними, встречаются нечасто.
Существуют вирусы, живущие в организме человека на протяжении всей жизни, но при этом вызывающие достаточно серьезные заболевания. Классическим примером является ВИЧ, который без должной антиретровирусной терапии вызывает СПИД — смертельный синдром приобретенного иммунодефицита. Вирус гепатита В у взрослых людей редко переходит в хроническую стадию (всего в 5-10% случаев), однако при таком исходе также не поддается лечению. Гепатит В может вызывать рак печени и цирроз. А вирусы папилломы человека (ВПЧ) 16 и 18 типов способны провоцировать рак шейки матки. При этом сегодня от гепатита В и ВПЧ указанных типов существуют эффективные вакцины, которые помогают избежать заражения вирусом.
Читайте также:


