Анемия при токсическом гепатите
Токсическая анемия (Anaemia toxica) – анемия, вызванная гемолитическими факторами, и гематологически характеризуется нормохромной и нормоцитарной картиной крови.
Этиология. Причинами заболевания токсической анемией являются отравления животных гемолитическими ядами (ртуть, свинец, мышьяк, госсипол, сапонины, фенилгидразин, хлороформ, сероуглерод, яды насекомых и змей), ожоги, а также токсины бактериального, кишечного происхождения и гемоспоридиозы (пироплазмоз, бабезиеллез, тейлериоз и др.). Ядовитые вещества проникают в организм животного через кожу, слизистые оболочки, через легкие, желудочно – кишечный тракт или могут образовываться внутри самого организма больного животного.
В зависимости от реактивности организма и характера интоксикации различают острые и хронические формы анемии.
При попадании в организм животного кровяные яды вызывают раздражение тканевых и сосудистых рецепторов. От этих рецепторов в центральную нервную систему устремляются потоки необычных для организма животного импульсов, которые извращают характер эфферентных влияний на кровеносные органы и приводят к расстройствам их функций.
Прямое действие яда на циркулирующие в крови эритроциты хотя и сохраняется, но кора головного мозга рефлекторно и через нейрогуморальное звено изменяет (повышает или понижает) чувствительность эритроцитов к патогенному раздражителю.
В патогенезе гемолитической анемии имеет место усиленное разрушение эритроцитов в кровяном русле с реактивной гиперплазией кроветворных органов и повышенной гемолитической деятельностью ретикулоэндотелиальной ткани. На этой почве в организме больного животного возникает гемолитическая желтуха.
Патологоанатомические изменения у больных токсической анемией сопровождаются желтушностью слизистых оболочек и серозных покровов, нередко имеют место кровоизлияния в коже, слизистых оболочках и различных органах. Селезенка увеличена в объеме и полнокровная. В печени находим дегенеративные изменения. Масса красного костного мозга увеличена за счет желтого. В результате повышенного распада эритроцитов в эндотелии селезенки, костного мозга откладывается железосодержащий пигмент (гемосидероз). При интоксикации большими дозами замена желтого мозга отсутствует.
Клиническая картина. Для больных токсической анемией характерна депрессия, анемичность и желтушность видимых слизистых оболочек и кожных покровов, увеличение селезенки и ее чувствительность. Иногда на первый план у больного животного выступают симптомы свойственные анемии: сердцебиение, одышка, при незначительной физической нагрузке больное животное испытывает слабость. Если в процессе болезни происходит разрушение 1/60 всего количества эритроцитов, то у больного животного регистрируем признаки гемоглобинурии. В связи с усиленным гемолизом эритроцитов сыворотка крови приобретает насыщенно золотистый цвет. Происходит повышение количества билирубина, дающего непрямую диазореакцию, у лошадей количество билирубина повышается до 12,8 мг%, у крупного рогатого скота и свиней – до 1,6 мг%, в моче происходит увеличение содержания уробилина, из-за чего моча имеет красновато-бурый оттенок.
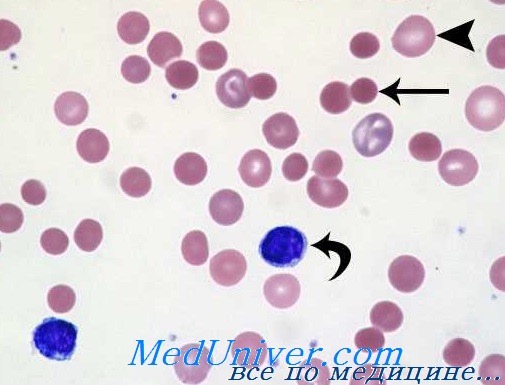
Наиболее характерным, ярким симптомом тяжелого отравления животного гемолитическими ядами является обилие в крови холестерина, липидов, а также сахара, вследствие чего у животного появляется временная глюкозурия. Выше указанные симптомы говорят о нарушении функции печени. Выявляемые в ходе клинического обследования, симптомы со стороны других внутренних органов, являются нехарактерными для этого заболевания. К 5-7дню болезни в картине крови отмечается резкое падение количества эритроцитов, притом более сильное, чем уменьшение содержания гемоглобина. Цветной показатель, который вначале болезни достигает 1,3-1,4 (гипохромная анемия), а затем (на 6-8-е сутки) постепенно возвращается к исходной величине. Происходит понижение резистентности эритроцитов – когда впервые дни начинают появляться тени эритроцитов, регистрируем анизоцитоз. Диаметр красных кровяных телец колеблется в пределах 3,3-10,2µ. Количество ретикулоцитов к 5-7-му дню болезни в 5-10 раз превышает исходные цифры (у свиней, рогатого скота). При исследовании крови, кроме ретикулоцитов, находят полихроматофилы, эритроциты с базофильной пунктацией, нормобласты. Количество тромбоцитов в крови падает. В первые дни болезни, у больного животного в 1мм³ крови насчитывают до 20тысяч лейкоцитов, а к 20-му дню количество лейкоцитов снижается до нормы. Лейкоцитарная формула дает нейтрофилию с выраженным сдвигом влево. В нейтрофилах отмечаем дегенеративные изменения ядра и протоплазмы. В зависимости от вида пораженного токсической анемией животного к 20-25-му дню (свиньи, собаки) морфологический состав крови приходит к норме.
При остром течении анемии в костномозговом пуктате отмечаем увеличение количества ядерных форм на 20-30%. Костномозговой индекс приобретает ясно выраженный эритробластический характер. В эритробластограмме происходит увеличение процента молодых эритробластических форм при одновременном уменьшении процента нормобластов. Количество ретикулоцитов (гранулофилоцитов) повышается по сравнению с нормой в несколько раз с преобладанием в эритрограмме форм, насыщенных субстанцией. Одновременно с регенеративными изменениями в костном мозге отчетливо выступают и признаки дегенеративного характера.
Течение. Учитывая, что причины токсической анемии действуют на организм больного животного обычно ограниченный промежуток времени, у организма сохраняется значительная способность к регенерации. Это проявляется также миелоидной метаплазией в селезенке и печени животного. Интенсивность регенерации крови напрямую зависит от резистентности организма, вида животного, его возраста, условий содержания, кормления и своевременно начатого лечения. В случае отравления животного малыми дозами гемолитических ядов, токсическая анемия у животного протекает легко; при поступлении в организм больших доз сильнодействующих веществ у животного может наступить смертельный исход.
Диагноз. Диагноз на токсическую анемию, как и при других болезнях животных, ставится комплексно с учетом анамнеза, клинической картины, изучения причинных факторов и условий развития заболевания, результатов гематологических данных и исследования размеров эритроцитов, костномозгового кроветворения и пигментного обмена. Характерным признаком токсической анемии является легкая желтушность видимых слизистых оболочек, повышенное количество непрямого билирубина в крови, увеличение содержания стеркобилина в фекалиях и уробилина в моче, гиперфункция селезенки наряду с признаками гемолиза (гемосидероз печени, селезенки, костного мозга и др.) и, наконец, картина изменений количественного и качественного состав красной крови.
Дифференциальный диагноз. Необходимо исключить инфекционные и гемоспоридиозные заболевания, сопровождающиеся изменением картины крови, особенно инфекционную анемию лошадей).
Лечение. Лечение больных токсической анемией животных начинают с создания для них хороших условий ухода, содержания, назначают диету, богатую белками и витаминами (А, В и С), а также организуют ежедневное пребывание больного на свежем воздухе. В том случае, если анемия вызвана действием ядов, ветспециалистам необходимо срочно их вывести из организма путем промывания желудочно-кишечного тракта, дачей слабительных и мочегонных. В случае острого отравления животного гемолитическими ядами проводят кровопускание, с последующим вливанием физиологического раствора вместе с плазмой или сывороткой. Отдельным больным животным можно провести переливание крови.
Для борьбы с возникшей интоксикацией организма показано внутривенное введение гипертонических растворов хлорида натрия, кальция и глюкозы. С целью стимуляции гемопоэза, при недостаточной регенерации крови, больным животным назначают камполон, антианемин (для крупного рогатого скота и лошадей 0,05 -0,08 мл, для свиней и овец 0,1-0,2 мл на 1кг живого веса), витогепат, витамин В12 (внутримышечно крупным животным 300-500мкг, мелким — 30-50 мкг 1 раз в 2 дня), а также препараты железа, мышьяка и аскорбиновой кислоты. Для профилактики закупорки почечных канальцев гемоглобиновым детритом больным животным вводят щелочи и большое количество жидкости.
Профилактика. Для предупреждения токсической анемии животных необходимо предохранять от соприкосновения с гематологическими ядами, а также проводить профилактические мероприятия против инфекционных и инвазионных заболеваний распространенных в данной местности.
Токсическая гемолитическая анемия (ТГА) относится к группе гемолитических анемий, обусловливаемых действием химических или медикаментозных агентов на эритроциты. С патологической точки зрения, равно как и в отношении клинических проявлений группа токсическая гемолитическая анемия не представляет собой обособленную нозологическую форму.
Тем не менее практические соображения побуждают нас рассмотреть, в отдельной статье, ряд гемолитических анемий по критерию их этиологии за счет клеточных токсических факторов.
Хотя токсическая гемолитическая анемия значительно реже иных видов гемолитических анемий (например АИГА) (Wintrobe и сотр.) в последнее время она приобретает все больший удельный вес в связи с увеличением профессиональных факторов отрицательного воздействия все растущего загрязнения среды и выпуска новых фармацевтических препаратов.
Ниже приведены этиологические факторы, способствующие развитию токсической гемолитической анемии.
Основные этиологические факторы, обусловливающие развитие токсической гемолитической анемии (ТГА):
1. Токсические для оболочки вещества:
Хлороформ, четыреххлористый углерод, бензол, толуол, тотрадецилсульфат, дигитонин, сапонин, катионное мыло, яд кобры.
2. Токсические вещества в отношении клеточных ферментов и/или гемоглобина:
Анилин, ацетанилид, нитриты, нитраты, хлораты, нитробензол, нитротолуол, фенацетин, антипирин, пирамидон, сульфонамиды, примахин, памахин, квинакрин, хинин, хинидин, нитрофурантоин, изониазид, синтетические заменители витамина К, фенилгидразин, пробенецид, хлорамфеникол, растительные вещества (Vicia faba), свинец.
В общих чертах воздействие токсических гемолитических (химических и медикаментозных) факторов на красные кроявные тельца осуществляется следующими тремя путями:
а) непосредственным действием на составные элементы клеточной оболочки;
б) взаимодействием с отдельными клеточными ферментативными механизмами и/или их чрезмерной нагрузкой;
в) иммунологическими механизмами.
Процесс расплавления крови, вызываемый токсическими веществами оболочки прямо пропорционален дозе и длительности воздействия. Субстрат, на который действует гемолитический фактор, был уточнен в нескольких случаях (Douste-Blazy). Так, хлороформ, четыреххлористый углерод, бензол, толуол действуют на полюсные группы жировых цепей; анионовые детергенты (тетрадецилсульфат) закрепляются на цефалине; растительные вещества (дигитонин, сапонин) и отдельные катионовые мыла вступают в комбинацию с холестерином; змеиный яд (кобры) преобразовывает лецитин в лизолецитин.
Отдельные вещества вызывают расплавление крови у лиц с врожденным недостатком Г-6-ФД (Wintrobe и сотр.), в том числе, примахин, памахин, хинакрин, хинин, сульфонамиды, сульфоны, нитрофурантоин, фуразолидон, ацетанилид, фенацетин, антипирин, пирамидон, пробенецид, синтетические заместители витамина К, фенилгидразин, изониазид, хлорамфеникол, хинидин, нафталин, тринитротолуол, метиленблау, растительные вещества (фасоль "Vicia faba"). Следует отметить, что некоторые медикаментозные препараты, вызывающие метгемоглобинизанию обусловливают расплавление крови и у лиц с недостатком Г-6-ФД.
Объяснение этого явления следует искать в том, что Г-6-ФД действует в качестве донора восстановленного НАДФ для цепи реакций, нацеленных на борьбу с излишним образованием внутриклеточных окисленных соединений.
Развивающаяся при сатурнизме анемия по комплексности и специфичности обусловливающего ее механизма занимает особое место. Свинец нарушает синтез гемоглобина на всех трех основных уровнях этого процесса — угнетает синтез гема, соединение железа с протопорфирином и синтез глобина. Влияя на синтез гема блокированием активности отдельных, богатых сульфгидрильными группами митохондриальных ферментов, таких как, дегидраза дельта-амино-левулиновой кислоты (ДДАЛК) и гемсинтетаза (Albahary) свинец обусловливает нарушение метаболизма порфиринов.
Угнетение активности дегидразы ДАЛК препятствует синтезу содержащегося в последней порфобилиногена (ПБГ). Избыток ДДАЛК выделяется с мочой. Угнетение активности гемсинтетазы препятствует включению железа в протопорфирин. В таких условиях в эритроцитах скопляется значительное количество свободного протопорфирина (500—600 мкг/100 мл) (Кондаксе и сотр.), в то время как в митохондриях — нейтрализованного железа. Отравление свинцом обусловливает также выделение с мочой значительного количества копропорфирина III (1—2 мг в сутки) (Кондаксе и сотр.), видимо в связи с неиспользованием этого предшественника. Влияние свинца на глобин отражается в нарушениях, подобных наблюдаемым при легкой форме талассемии — примерно у 15% больных повышается процент гемоглобина А2 и F (Albahary).
Отравление свинцом — болезнь не редкая. Ею заболевают наборщики, типографы, красильщики, шахтеры, потребители спиртных напитков, перегоняемых в самодельных установках и пр. К ведущим клиническим признакам относятся бледность, рези в желудке и неврологические проявления (полиневрит, нарушение поведения, энцефалопатия). Гематологические признаки определяет анемия, которая носит гипохромный и слегка микроцитный характер (Wintrobe и сотр.). Отмечается наличие точечно-базофильных эритроцитов. Показатель частоты последних не связан с интенсивностью воздействия токсического вещества. Число ретикулоцитов повышено, в частности при резко развившемся отравлении.
На мазках периферической крови обнаруживаются также нормобласты, эритроциты с тельцами Жолли или кольцами Кабо. В костном мозге наблюдается эритроидная гиперплазия. В отдельных случаях отмечено наличие мнегоядерных эритробластов (Moore) или кольцевых сидеробластов (Wintrobe). Продолжительность жизни эритроцитов несколько меньше (Albahary). Интенсивность и скорость обмена железа плазмы занижены. Наблюдается рост показателя выделения желчных пигментов. Отмеченные аспекты могут подсказать мысль о неэффективности эритропоеза (Wintrobe). По мнению отдельных авторов анемию, вызываемую отравлением свинцом можно отнести к группе сидеробластических анемий (Moore).
Уточнению диагноза способствуют обнаружение высокого показателя выделения АЛК и копропорфирина III с мочой (тест разборки) и нормальной концентрации свинца в крови и моче. При скрытом отравлении, когда наличие токсического вещества в крови и моче не выявимо постановке диагноза способствует исследование протопорфирина эритроцитов, при этом нормальный уровень исключает возможность отравления (Кондаксе и сотр.). Определение свинца в моче после введения стандартного количества ЭДТА—-еще один способ уточнения диагноза (Albahary).
После введения комплексонов (БАЛ, ЭДТА) отмечается быстрая нормализация нарушенного метаболизма порфиринов, однако продолжительность жизни эритроцитов восстанавливается лишь после замены неполноценных эритроцитов нормальными (Wintrobe). Показатель гемоглобина нормализуется спустя несколько недель после назначения лечения.
Изложенное приводит к следующему выводу большого практического значения: ряд химических веществ, оказывающих токсическое влияние на красную кровяную клетку обусловливают гемолитический эффект различными механизмами. Соединения бензола и толуола вызывают метгемоглобинемию и гемолиз, а иногда и аплазию, определяя развитие процесса относительной костномозговой недостаточности. В последнем случае анемия, хотя и представляется как результат гемолитического процесса, тем не менее не сопровождается численным ростом ретикулоцитоза. Ретикулоцитоз выявляется лишь после прекращения воздействия токсического вещества и восстановления костномозговой способности вырабатывать клетки, пропорционально интенсивности анемии.
Подобно этому некоторые медикаменты, в том числе сульфонамиды, хинидин, фенацетин и пр., обусловливают расплавление крови либо посредством ферментного механизма, либо путем иммунологической агрессии.
Выявление механизма, определяющего расплавление крови путем токсических веществ составляет решающий этап в процессе уточнения терапевтического подхода. Так, например, выявление телец Гейнца подсказывает мысль о возможной анемии под влиянием окисляющих метгемоглобинизирующих токсических веществ, или о наличии скрытого недостатжа Г-6-ФД и тем самым дает соответствующее направление исследованиям.

Токсическое воздействие на клетки печени, которое сопровождается воспалением клеток и их смертью, проявляется увеличением печени в размерах, болезненными ощущениями в правом подреберье и желтухой.
Острый токсический гепатит развивается при одноразовом попадании в организм большого количества токсических веществ. Симптомы данной формы заболевания проявляются в течение первых 2-5 суток после отравления. Хроническая форма развивается вследствие многоразового попадания ядов, но в маленьких количествах. В данном случае симптомы заболевания могут проявиться спустя годы.
Причины
Что это такое, и почему он развивается? Причинами токсического гепатита у взрослых может быть прием и вдыхание токсических веществ (органических растворителей и промышленных ядов), отравление грибами (чаще бледной поганкой, реже мухоморами, сморчками и строчками). К заболеванию приводит как однократное употребление алкоголя в больших дозах, так и употребление спиртных напитков в течение длительного промежутка времени.

При одномоментном приеме большой дозы одного из нижеперечисленных препаратов, значительно превышающей рекомендуемую врачом, наблюдается токсическое поражение печени и развивается острый токсический гепатит.
- сульфаниламиды (Бисептол);
- противовирусные препараты (Интерферон и т. д.);
- лекарства против туберкулеза (Фтивазид);
- жаропонижающие средства (Парацетамол, Аспирин);
- противосудорожные препараты (Фенобарбитал и др).
Генез (происхождение) болезни может быть обусловлено попаданием в организм следующих веществ:
- фосфором, который в изобилии содержится в удобрениях, применяемых для повышения урожайности садово-огородных культур.
- мышьяком, выделяемым на предприятиях металлургической промышленности.
- фенолами, содержащимися в дезинфицирующих средствах.
- пестицидами и инсектицидами, применяемыми в сфере сельского хозяйства при борьбе с сорняками и насекомыми.
- альдегидами, используемыми на предприятиях пищевой промышленности.
Яды и их токсины могут попасть в организм человека несколькими путями: через желудочно-кишечный тракт, через дыхательную систему, через кожу и через кровь. На печень они могут оказывать как прямое действие (при непосредственном влиянии на гепатоциты), так и опосредованное (когда происходит нарушение кровотока в сосудах печени, что приводит к их отмиранию и нарушению функций).
Согласно МКБ-10 по этиологии болезни токсический гепатит может быть непосредственным, холестатическим и иммунным. По течению заболевания принята классификация на хронические и острые вирусные поражения.
Симптомы токсического гепатита
В лёгких случаях токсического гепатита заболевание протекать почти без симптомов, обнаруживается лишь при групповом обследовании (например: употребление ядовитых грибов).
В более тяжелых случаях, гепатит может проявиться в виде следующих признаков:
- Боли в правом подреберье, возникают внезапно, через 2-5 дней после проникновения гепатотропного яда в организм, являются результатом растяжение капсулы увеличенной печенью (из-за острого воспалительного процесса в ней);
- Желтушная окраска слизистых оболочек и кожи;
- Насыщенная моча темного цвета;
- Обесцвеченный кал;
- Повышение температуры тела >38 С, общая слабость, отсутствие аппетита, тошнота, рвота (может быть с кровью), боли в суставах;
- Петехии (мелкие кожные кровоизлияния);
- Носовые кровотечения;
- Геморрагические явления;
- Кожные покровы могут менять свой цвет на шафранный или оранжевый. Размеры печени, в результате острой дистрофии, могут существенно уменьшаться.

Хронический токсический гепатит протекает более гладко, без острых проявлений. Возможны тупые боли в правом подреберье, умеренная желтуха, небольшая интоксикаций, субфебрильная температура, горечь во рту. Эти симптомы могут на время утихать (ремиссия), и опять проявляться (обостряться).
Диагностика
При диагностике токсического гепатита применяются лабораторный и инструментальный методы. Проводится биохимический анализ крови, при котором определяется уровень билирубина и таких ферментов, как АСТ и АЛТ, щелочная фосфатаза, гамма-глутамилтранспептидаза.
Лечение токсического гепатита
Лечение заболевания у взрослых, в первую очередь, подразумевает прекращение попадание вредного вещества в организм. Если по каким-либо причинам срочно отправиться в медицинское учреждение для получения полноценной помощи не представляется возможным, необходимо совершить ряд операций, препятствующих попаданию ядовитого вещества в кровь и, следовательно, в печень.
Если подозреваемый яд попал в пищеварительный тракт, необходимо избавиться от него с помощью ложно вызванной рвоты. Для начала нужно принять удобную для этого позу (положение полусидя с наклоном головы вперед). После чего следует раздражить корень языка путем надавливания на него пальцем (это используется не во всех случаях).

Пока все это делается, лучше всего вызывать скорую помощь или немедленно обратиться в медицинское учреждение. Если проявляются признаки острой формы токсического гепатита, то больной нуждается в срочной госпитализации. В больнице ему будет проведено под наблюдением врача следующее лечение:
- Промывание желудка от остатков яда. Для этого используют слегка теплую воду с расчетом того, что для взрослого человека необходимо 10 литров воды.
- Выведение ядов из организма (активированный уголь,капельницы с растворами электолитов), гемосорбция, плазмоферез (очищение крови от токсических веществ). Активированный уголь, всасывает на своей поверхности токсины, оставшиеся в желудке, предотвращая их попадание в кровь.
- Применение витаминов группы В и С.
- Для восстановления печени применяют специальные гепатопротекторы, например, Эссенциале или Гептрал.
- Желчегонные препараты (Холосас, Холензим). Вместе с желчь из печени выводится часть токсических веществ
- Если приступ заболевания был вызван отравлением грибами, то используются специальные антидоты, которые препятствуют токсическому поражению клеток.
Гепатопротекторы
Гепатопротекторы – это лекарственные препараты, специально разработанные для повышения уровня сопротивляемости печени различным негативным факторам. Это лечебные средства усиливают способность печени к обезвреживанию токсических веществ. Они являются важной частью лечения токсического поражения печени в следствие гепатита.
- Гептрал. Основное действующее вещество – адеметионин, который стимулирует рост клеток печени, участвует в синтезе серотонина и обезвреживании токсинов. Адеметионин вырабатывается печенью, но при её заболеваниях концентрация этого вещества в организме снижается. Гептрал восполняет дефицит адеметионина и стимулирует его естественный синтез.
- Эссенциале форте. Препарат нормализует обмен углеводов, белков и липидов в печени, усиливая ее обезвреживающие функции. Он способствует восстановлению печени после ее повреждения, предотвращает формирование в ней рубцовой ткани. В основе препарата – специальные жиры (так называемые эссенциальные фосфолипиды), которые получают из бобов сои.

Диета при токсическом гепатите
Что касается диеты в лечение на дому, то употребление алкоголя и курения категорически запрещено.
- Поэтому основными продуктами в рационе должны быть, свежие овощи и фрукты (различные салаты), бобовые (фасоль, горох).
- Употреблять только сливочные и растительные масла.
- Кушать мясо только легкоусвояемое (курица, кролик). Полностью отказаться от копчёностей, консервов.
- Делать разгрузочные дни, в один день из недели, кушать только овощи или фрукты.
Народные методы лечения токсического гепатита
Можно ли использовать лекарство на основе народных рецептов? Применение таких средств для лечения возможно только под контролем медицинского персонала. При заболевании хорошо помогают такие средства:
- сок квашеной капусты или грейпфрута;
- настой мяты или корней хрена;
- мякоть тыквы.
Клинические рекомендации по профилактике токсического гепатита
Профилактика токсического гепатита сводится к предотвращению контакта с токсическими веществами. Если гепатит токсический возник у человека, который работает на вредном производстве, то необходима смена работы, можно выйти на пенсию.
Токсический гепатит у детей
Зачастую токсические вещества проникают в организм ребёнка случайно. Это может быть следствием ошибки или же желания ребёнка пробовать все на вкус. Оказываясь в организме, яды оседают в печени, провоцируют сбой в жизнедеятельности печёночных структурных элементов, что приводит к их некрозу.
Вылечить токсический гепатит поможет комплекс медицинских мер, направленных на выведение токсинов из организма с последующим поддержанием работы печени у ребёнка. Такие меры включают в себя:
- соблюдение постельного режима;
- промывание желудка, если токсическое вещество попало в организм через пищеварительный тракт;
- приём абсорбирующих препаратов;
- приём витаминов;
- употребление гепатопротекторов для восстановления структурных частей печени;
- приём желчегонных препаратов для улучшения и ускорения процесса выведения токсинов из организма.

Прогноз
Все зависит от степени тяжести заболевания и от того, насколько быстро было назначено правильное лечение. При легкой стадии заболевания прогноз может быть благоприятным. Печень может полностью восстановиться, если своевременно диагностировать заболевание и начать лечение. Полное восстановление возможно при дальнейшем регулярном прохождении профилактических осмотров и проведении поддерживающей терапии.
Если же заболевание переходит в хроническую или тяжелую форму, возрастает риск осложнений. Повреждение гепатоцитов прогрессирует. Клетки постепенно отмирают и заменяются соединительной тканью.
Наиболее опасными осложнениями тяжелых гепатитов являются печеночная недостаточность, кома и цирроз печени. При этом прогноз может быть крайне неблагоприятным, вплоть до летального исхода. При появлении асцита следует ожидать скорой смерти.
Как правило, пациенты с асцитом умирают в течение нескольких дней и только 10% удается прожить с такой патологией месяц.
Сколько живут с токсическим гепатитом
При диагнозе токсический гепатит продолжительность и качество жизни во многом зависят от самого пациента. Нужно проводить полное и своевременное лечение, полностью соблюдать рекомендации врача, а также соблюдать диету и постельный режим. В таком случае человек достаточно быстро вылечится. Но в дальнейшем ему потребуются регулярные профилактические обследования и поддерживающая терапия. В таком случае можно жить десятки лет.
Если же игнорировать диагностику и лечение, болезнь может перейти в цирроз и асцит, что заканчивается летальным исходом. С такими осложнениями люди живут от нескольких месяцев до двух лет.

Дата публикации: 19.12.2016 2016-12-19
Статья просмотрена: 1569 раз
Вирусные гепатиты остаются серьезной медицинской и социальной проблемой. В Узбекистане эпидемиологическая ситуация по вирусные гепатиты и в прошлом, и в настоящем остается неблагополучной.
При хроническом гепатите обычно в патологический процесс вовлекаются многие органы и системы [6].
Изменения сердечно-сосудистой системы обычно выражены незначительно и выявляются нечасто. У ряда больных можно отметить приглушение тонов сердца, короткий систолический шум у верхушки, снижение артериального давления [2, 5]. В отдельных случаях определяется акцент II тона на легочной артерии.
При хроническом гепатите нередко возникают изменения кроветворной системы. Чаще всего отмечается умеренная анемия железодефицитного характера, связанная с нарушением гемопоэтической функции печени, угнетением функции костного мозга, недостатком железа, фолиевой кислоты и др [1, 2, 4, 6]. Нередки также тромбоцитопения и повышенная СОЭ. Эти изменения принято связывать с гиперспленизмом, но не исключается и аутоиммунный генез. При исследовании пунктатов костного мозга обнаруживают задержку созревания нейтрофилов и умеренную гиперплазию мегакариоцитарных элементов с понижением их тромбоцитообразующей функции. В редких случаях у больных хроническим гепатитом встречается апластическая анемия. Природа аплазии костного мозга окончательно не установлена [6]. Ведущее значение, по-видимому имеют аутоиммунные механизмы и непосредственное поражение костного мозга вирусами гепатитов В, С и дельта.
Изменения центральной нервной системы при хроническом гепатите характеризуются появлением у части больных таких симптомов, как головная боль, раздражительность, плаксивость, возбудимость, расстройство сна, снижение памяти, головокружение [2, 4, 5]. Электроэнцефалографические исследования обнаруживают изменения корковых процессов, наличие в коре головного мозга очагов торможения, снижение возбудимости и вовлечение в процесс подкорковых и стволовых структур. В редких случаях неврологические изменения бывают более выраженными и могут проявляться асимметрией тонуса, слабостью конвергенции, нистагмом. В других случаях изменения нервной системы больше указывают на поражение межуточных отделов головного мозга [3]. У таких детей в течение длительного времени может сохраняться повышенная температура тела, гинекомастия, извращение обмена веществ и, как следствие, возникает ожирение или, наоборот, похудание.
У больных хроническим гепатитом в фазе обострения может понижаться диурез, иногда развиваются альбуминурия, микрогематурия, цилиндрурия. Не исключается прямое действие вируса на канальцевый аппарат почек, нельзя исключить и поражение почек за счет токсических метаболитов, но вероятнее всего изменения со стороны почек возникают ввиду поражения клубочков и канальцевого аппарата почек иммунными вируссодержащими комплексами [6].
Высокие показатели заболеваемости вирусным гепатитом А (ВГА) и вирусным гепатитом В (ВГВ) на протяжении последних десятилетий отмечаются в республики. В этом отношении до сих пор актуальным вопросом является недостаточная изученность особенностей эпидемического процесса при ВГ, вариантов течения, клинических форм болезни у пациенты в регионах с высоким уровнем заболеваемости, к числу которых относится города Андижана.
Общеизвестно, что распространенность ВГ, клиника и исходы болезни зависят от комплекса факторов, касающихся как иммунного ответа, так и вида возбудителя. В ряду факторов, определяющих реактивность организма детей, их восприимчивость к возбудителям ВГ и оказывающих влияние на клиническое течение болезни, существенная роль принадлежит широко распространенным среди населения фоновым заболеваниям, в первую очередь железодефицитной анемии (ЖДА). Изучение роли железодефицитных состояний приобретает важное значение, в связи с высоким уровнем показателя анемизации населения, особенно в городе Андижана. Так, по данным общенациональной Программы медико-демографического исследования Узбекистана, в южном регионе среди пациенты показатель распространенности анемии была одной из высоких — 52,1 %, из них тяжелой степени — 17,6 %, выраженной степени — 12,8 % и умеренная анемия — 17,5 %.
При дефиците железа наряду с другими нарушениями, происходит резкое угнетение клеточного иммунитета, снижается сопротивляемость организма к различным биологическим агентам, следствием чего является повышение частоты и тяжести инфекционных заболеваний.
Цель:представить клиническую характеристику ВГ на фоне железодефицитной анемии для разработки практических рекомендаций по проведению лечебно-профилактических мероприятий с учетом фоновой патологии.
Материалы и методы исследования: Наши наблюдения проводились за 40 больными в возрасте от 14 до 55 лет, находившимися на лечении в отделениях терапии в клинике АГМИ.
Результаты исследования: на основании комплексного клинико-лабораторного обследования и результатов обнаружения специфических маркеров 24 больных был поставлен диагноз ВГА, 16 — ВГВ (острый ВГВ — 7, затяжное течение ВГВ — 4, хронический ВГВ — 5).
При оформлении диагноза ВГ использовалась классификация, предложенная В. Ф. Учайкиным с разделами: этиология ВГ, маркерные данные, тяжесть, критерии тяжести, течение.
Анемия классифицировалась как тяжелая, выраженная и умеренная на основании критериев, установленных ВОЗ в зависимости от концентрации гемоглобина в крови.
Тяжелая анемия соответствовала концентрации гемоглобина ниже 7 г/дл; выраженная — концентрация гемоглобина 7,0–9,9 г/дл; умеренная — концентрация гемоглобина 10,0–11,9 г/дл.
В ходе нашего исследования выявлена ЖДА у больных ВГА и ВГВ (соответственно у 60,0 % и 40,0 % больных). При этом, из 40пациенты с сопутствующей ЖДА, степень тяжести анемии на основании клинико-лабораторных данных оценивалась как умеренная у 21(52,5 %) больных, что составило, выраженная — у 9 (22,5 %) и тяжелая –– у 10 (25,0 %) больных. У всех наблюдавшихся больных определялись такие характерные симптомы анемии, как бледность кожных покровов, ушных раковин, слизистых оболочек, сухость или шершавость кожи, утомляемость, слабость и раздражительность, нарушения аппетита и др.
Наши наблюдения показали, что железодефицитная анемия отрицательно влияет на клиническое течение ВГ у больных. Так, у больных гепатитом А, имеющих сопутствующую анемию, наблюдалось преимущественно течение преджелтушного периода по смешанному типу.
Выводы:
- У больных ВГ в случаях нормального иммунного ответа, когда преморбидный фон не отягощен, заболевание протекает в типичной форме, острый период заканчивается в определенные сроки, применение дополнительных средств для иммунокоррекции не требуется. В случаях же, когда имеет место заведомо отягощенный преморбидный фон, после купирования остроты клинических проявлений, необходима дополнительно иммунокоррекция препаратами вышеописанными при ВГА. В случаях, когда имеет место атипичная форма ВГВ, а также затягивание процесса при типичной форме, длительное (более 1 месяца) персистирование HBeAg требуется интенсификация лечения введением короткоживущих препаратов-интерферонов.
- Таким образом, наличие такого фонового заболевания как анемия у больных ВГ требует его коррекции уже в ранние сроки ВГ, после купирования токсического синдрома, а также интенсификации лечения введением препаратов улучающих метаболические процессы в клетках крови: липоевая кислота, токоферола ацетат, ретинола ацетат, пантотенат кальция, пиридоксина гидрохлорид, тиамина хлорид.
- Руководство по инфекционным болезным у детей / В. Ф. Учайкин, — М.: ГЭОТАР-МЕД, — 2002, — 824 с.
- Пирогов К. Т. Внутренние болезни, М: ЭКСМО, 2005.
- Сиротко В. Л., Все о внутренних болезнях: учебной пособие для аспирантов, Мн: ВШ, 2008.
- Сайнов О. Л. Внутренние болезни, Мн: БГМУ, 2008. — 715 с.
- Павлов Э. А., Еременко М. А. Значение комплексного гематологического обследования для ранней диагностики дефицита железа и ЖДА // Гематол. и трансфуз. – 1991. – № 6.
- Сучков А. В., Митирев Ю. Г. Анемия // Клин. мед. – 1997. – № 7. – С. 71–75.
Читайте также:


