Адъюванты в вакцинах против гриппа
На сегодняшний день единственным надежным способом профилактики гриппа является вакцинация 1 . Она особенно необходима пожилым людям, детям, лицам, страдающим от хронических заболеваний и тем, кто работает в сфере обслуживания и по роду профессии контактирует с большим количеством людей, например, медицинские работники и педагоги.
Вакцинопрофилактика гриппа может проводиться различными вакцинами. В одних из них содержится живой, но ослабленный вирус (живые вакцины), другие иммунобиологические препараты содержат вирусные частицы, инактивированные ультрафиолетовыми лучами или химическими веществами (цельновирионные вакцины). На сегодняшний день самыми эффективными и безопасными являются субъединичные адъювантные вакцины. К ним относятся и иммунобиологические препараты отечественного производителя: Гриппол, Гриппол плюс и инновационная четырехвалентная вакцина Гриппол Квадривалент.

Виды противогриппозных вакцин
Первое поколение противогриппозных вакцин – живые вакцины, содержащие не инактивированный, а живой, только ослабленный вирус. Такие вакцины эффективны, но обладают рядом ограничений: они не рекомендованы детям до 3 лет, людям с иммуннодефицитами, беременным, лицам с хроническими заболеваниями, людям, по роду профессии контактирующим с больными, т.е. именно тем, кто является группами риска по гриппу.
Второе поколение иммунобиологических препаратов, сплит-вакцины, содержат расщепленный вирус – фрагменты оболочки и внутренних белков. Такие вакцины обладают хорошей иммуногенностью и, по сравнению с живыми вакцинами – более безопасны, однако, способны вызывать выраженные побочные реакции, особенно местные (зуд, боль, припухлость в месте введения).
Третьим поколением противогриппозных вакцин стали субъединичные вакцины, созданные на основе очищенных поверхностных антигенов вирусов гриппа – нейраминидазы и гемагглютинина. Для усиления иммунного ответа некоторые вакцины были дополнены адъювантами. Типичными представителями субъединичных адъювантных вакцин являются отечественные иммунобиологические препараты: Гриппол, Гриппол плюс и Гриппол Квадривалент. Рассмотрим эффективность субъединичных адъювантных вакцин на примере этих препаратов.
Гриппол плюс и Гриппол Квадривалент
Гриппол плюс – трехвалентная вакцина, содержащая антигены двух вирусов гриппа A и одного вируса гриппа В. Выпускается форме суспензии для внутримышечного и подкожного введения. Она существует на рынке уже более 10 лет и за это время ей были привиты более 135 миллионам человек.
Гриппол плюс используется для профилактики гриппа у детей с 6 месяцев жизни, а также у взрослых – без ограничений по возрасту. В первую очередь, вакцинация показана:
- детям;
- беременным женщинам;
- лицам, страдающим хроническими заболеваниями внутренних органов;
- людям старше 60 лет;
- тем, кто работает с людьми: медработникам, работникам общественного транспорта, образовательных учреждений, а также военным и милиции.
Гриппол Квадривалент – это первая в России субъединичная адъювантная вакцина с защитой от четырех вирусов гриппа: двух штаммов вирусов A (H1N1 и H3N2) и двух штаммов вирусов гриппа B (Виктория и Ямагата). Она особенно показана людям, имеющим высокий риск заражения гриппом. В настоящее время вакцина разрешена для иммунизации взрослых – от 18 до 60 лет, после завершения клинического исследования у детей вакцина сможет применяться для вакцинации детей с 6 лет.
Клинические испытания вакцин Гриппол проведены в соответствии с мировыми стандартами Good Clinical Practice 2,3 . Эффективность и безопасность использования Азоксимера бромида в качестве адъюванта была подтверждена отчетом независимой европейской компании 4 .
Вакцины изготовляются по мировым стандартам GMP. В них нет консервантов, токсичных веществ или антибактериальных средств, поэтому риск реакций гиперчувствительности стремится к нулю 2 .
Адъювант вакцин Гриппол
Вирусные антигены, входящие в состав обеих вакцин, связаны с высокомолекулярным полимером – Азоксимера бромидом. Это действующее вещество препарата Полиоксидоний, но в вакцине он содержится в концентрации в 24 раза меньшей, чем в лекарственном препарате Полиоксидоний. Благодаря низкой концентрации и с учетом местного введения вакцины он работает не как иммуномодулятор, и в комбинации с антигенами, стимулирует естественный иммунный ответ на антигены. Следовательно, Гриппол плюс может назначаться и беременным женщинам, и лицам с иммуносупрессией, и людям с онкопатологией и не влияет на системные иммунные механизмы.
Вакцины с содержанием адъювантов на основе алюминия, либо гидроокиси, либо фосфата, давно применяются как в России, так и в мире. Именно благодаря адъювантам удалось создать такое количество вакцин от актуальных инфекций - большинство вакцин в Национальных календаря прививок, не только российском, но и зарубежных.
Есть и гриппозные адъювантные вакцины, содержащие водно-эмульсионный адъювант MF59 на основе сквалена. Эта адъювантная вакцина была специально создана в Европе для пожилых людей, иммунитет которых уже не так хорошо отвечает на прививку.
Антигенная нагрузка вакцин Гриппол
Использование адъюванта в вакцине Гриппол® плюс позволяет в три раза снизить дозу вирусных антигенов: 5 мкг вместо 15 мкг, а значит сделать прививку более безопасной. Эта уникальная технология производства более 20 лет используется для производства вакцин Гриппол и Гриппол плюс, которые широко применяются при массовой иммунизации населения. Клинические исследования данных вакцин убедительно доказали, что такой дозировки антигенов в сочетании с адъювантом Полиоксидоний вполне достаточно для эффективного обеспечения высокого иммунного ответа 2,3,4 .
Состав и качество вакцин регламентирует Европейская или Национальная фармакопея. В Европейской фармакопее оговаривается 7 , что содержание антигенов должно составлять 15 мг, если результатами клинических исследований не обоснована иная дозировка. Теоретически, можно было бы довести содержание антигенов в вакцине до 15 мкг, но это не приведет к увеличению эффективности, при этом может привести к увеличению частоты местных реакций. Следовательно, вакцины Гриппол имеют повышенный профиль безопасности пациента за счет снижения антигенной нагрузки на организм, что было подтверждено результатами сравнительного исследования вакцины Гриппол плюс, и вакцин, содержащими антигенов по 15 мкг 8 .
Выводы
Таким образом, вакцины Гриппол имеют сопоставимую эффективность в сравнении с вакцинами, содержащими по 15 мкг на каждый штамм вируса гриппа, и соответствуют всем международным рекомендациям. За счет снижения антигенной нагрузки на организм, данные иммунобиологические препараты обладают наивысшим профилем безопасности, что было доказано клиническими исследованиями с большим числом участников, проведенными по всем мировым и российским стандартам качества.
Важно, что Полиоксидоний в составе вакцин Гриппол не работает как иммуномодулятор, а только как адъювант, не влияя на системные иммунные механизмы.
Литература
- World Health Organization. – 2005. – №33. – Р. 277-288.
- Войцеховская Е.М., Вакин В.С., Васильева А.А. и др. Результаты анализа иммуногенности новой гриппозной вакцины Гриппол® плюс Эпидемиология и вакцинопрофилактика. – 2009. – №1 (44). – С. 40-45.
- Харит С.М., Начарова Е.П., Черняева Т.В. Безопасность инактивированной полимер-субъединичной тривалентной гриппозной вакцины. Пострегистрационное наблюдение Вопросы современной педиатрии. – 2009. – №4. – С. 30-34.
- Р. Компьер. Безопасность и эффективность субъединичной вакцины против гриппа, содержащей Полиоксидоний®. Систематический обзор и метаанализ клинических исследований. Эпидемиология и Вакцинопрофилактика № 17 (4)/2018, стр. 25-30.
- Чебыкина А.В., Костинов М.П., Магаршак О.О. Оценка безопасности и эффективности вакцинации против гриппа Эпидемиология и вакцинопрофилактика. – 2010. – №4.
- Ерофеева М.К., Никоноров И.Ю., Максакова В.Л., Ельшина Г.А. и др. Оценка эффективности применения гриппозной вакцины Гриппол® плюс у детей школьного возраста в период эпидемии гриппа 2008-2009 г.г. Эпидемиология и вакцинопрофилактика. – 2010. – №3.
- Некрасов А.В., Пучкова Н.Г. Стратегии совершенствования и методы оценки гриппозных вакцин. Гриппол® плюс – современная защита от гриппа РМЖ. – 2008. – №22. – Т. 16.
- Сравнительная оценка реактогенности и иммуногенности коммерческих гриппозных инактивированных вакцин: полимер-субъединичной Гриппол плюс, субъединичной Инфлювак, сплит-вакцины Ваксигрип" С.М. Харит, Д.А. Лиознов, А.А. Рулёва /Эпидемиология и Вакцинопрофилактика № 2 (93)/2017.
- European Pharmacopoeia, 2006 (Ph. Eur 2006).
Нашли ошибку в тексте? Выделите ее и нажмите Ctrl + Enter.
Подготовка шприца перед вакцинацией против гриппа
— Среди существующих адъювантов можно найти очень разные примеры: от солей кальция и алюминия до органических веществ вроде парафинов, а адъювант Фрейнда состоит из эмульсии антигенов микробактерий в минеральном масле. Есть ли какие-либо общие химические признаки, по которым можно объединить адъюванты, или они обязательно все разные?
— Насколько распространены адъюванты и как давно они применяются в вакцинах?
Многие десятилетия это были соли алюминия. Они входят в вакцины против коклюша, дифтерии, столбняка, убитой полиомиелитной вакцины, против гепатита В и так далее.
После эмпирического открытия первых адъювантов произошел качественный скачок в развитии концепции стимулирования иммунного ответа организма. Он был связан с быстрым накоплением знаний о механизме взаимодействия иммунной системы с патогенами, более глубоким пониманием роли адъювантов в проведении эффективной вакцинопрофилактики. На сегодняшний день доказано, что включение адъювантов в состав вакцин является одной из самых передовых технологий, позволяющей снизить количество антигена и создать стойкий иммунитет к инфекционным заболеваниям. Это особенно важно для уязвимых групп населения, которые плохо реагируют на традиционные вакцины, — детей, пожилых людей и людей с ослабленным иммунитетом. Большинство современных инактивированных вакцин содержат адъюванты, например вакцины для профилактики гепатита B и ВПЧ, противогриппозные вакцины.
В настоящее время во всем мире продолжаются поиски новых адъювантов. Большое внимание адъювантам уделяют в онкологии, в создании вакцин против ВИЧ. У адъювантных технологий имеется потенциал для предотвращения инфекционных заболеваний глобального значения, когда успешная вакцинация на основе традиционных подходов невозможна.
— Расскажите, пожалуйста, вкратце об основных механизмах работы адъювантов — так, чтобы было понятно читателю без медицинского образования.
— Влияет ли введение адъюванта в вакцину на частоту появления местных аллергических реакций? С чем это связано: с неспецифичностью действия адъювантов в целом или с каким-то конкретным механизмом?
— Действительно ли польза от вакцинирования против гриппа (которое может достаточно надежно защитить от некоторых распространенных штаммов гриппа и в ряде случаев снижает вероятность заболеть ОРВИ) превосходит риск аллергической реакции?
И у нас нет учета, например, инфарктов и инсультов у привитых и непривитых против гриппа, а в мире такая статистика есть. В период подъема заболеваемости гриппом риск этих состояний у непривитых в четыре-пять раз выше, чем у привитых против гриппа.
— Но ведь даже в прогнозах ВОЗ год на год не приходится: в некоторые годы правильно предсказать штамм вируса, который будет циркулировать, получается очень плохо, и эффективность прививки даже в защите от гриппа (без учета других ОРВИ) падает до 10–30%.
— Как бы вы успокоили противников вакцинации и сомневающихся?
— Как часто адъюванты используются в антигриппозных вакцинах? Есть ли за рубежом примеры уже одобренных вакцин против гриппа, где количество действующего вещества уменьшено благодаря адъювантам?
— Адъюванты в гриппозных вакцинах в других странах стали применять во время пандемического гриппа, а сейчас это рассматривается как один из перспективных методов, в первую очередь, при создании вакцин против гриппа для людей со сниженным иммунитетом, людей старшего возраста. Например, недавно в Венгрии была зарегистрирована первая сезонная гриппозная вакцина со сниженным содержанием антигенов и адъювантом на основе алюминия. В ВОЗ говорят о том, что применение адъювантов в гриппозных вакцинах — одно из условий снижения количества применяемого антигена.
— Почему же тогда адъюванты не используются во всех вакцинах?
— Они применяются в большинстве неживых вакцин — анатоксинов, инактивированных, химических, рекомбинантных. Они нужны не во всех вакцинах: некоторые достаточно сильны и без них. Но в ряде случаев без адъювантов не обойтись. Сейчас ВОЗ активно поднимает вопрос о том, что нужно больше адъювантов и они должны быть хорошего качества, поскольку мир сталкивается с ростом вспышек инфекционных заболеваний. Эпидемический характер приобретают такие заболевания, как грипп, тяжелый острый респираторный синдром (SARS), ближневосточный респираторный синдром (MERS), лихорадка Эбола, Зика, чума, желтая лихорадка и другие быстро распространяющиеся болезни. В связи с этим как никогда актуальной становится задача разработки и создания новых перспективных вакцин, в том числе адъювантных.




Население планеты растет, а миграционные процессы становятся все более интенсивными. С развитием транспортного сообщения стремительно растет пассажиропоток, люди в считанные часы могут перелетать в другие страны и континенты. В результате возрастает риск возникновения крупных эпидемий - пандемий. Единственный надежный способ предотвращения или хотя бы смягчения этой угрозы - вакцинация населения. Поэтому в разных странах ученые работают над созданием более эффективных вакцин, защищающих от всевозможных инфекционных заболеваний.
Один из способов добиться того, чтобы вакцина, с одной стороны, надежно защищала, а с другой, минимизировала риски воздействия на иммунную систему человека - это использовать особые добавки, так называемые адъюванты. Это вещества, которые способны усиливать иммунный ответ организма на антиген, содержащийся в вакцине. Применение адъюванта дает возможность сократить количество основного действующего вещества в вакцине и тем самым уменьшить воздействие на иммунную систему человека при вакцинации.


"Если мы вводим при вакцинации меньше антигенов, являющихся чужеродными для организма белками, то снижаем вероятность побочных эффектов, - пояснил Алексей Матвеичев, руководитель Центра доклинических исследований компании, производящей вакцины. - Кроме того, использование адъювантов позволяет реализовать так называемую "антиген-сберегающую" стратегию. То есть мы можем производить больше вакцины из того же количества антигенов, быстрее развернуть производство и за короткий срок привить больше людей. Это особенно важно в условиях эпидемии".
В нашей стране вакцины против гриппа, содержащие адъювант азоксимера бромид, выпускаются уже более 20 лет. Эти вакцины содержат в три раза более низкую дозу антигенов вирусов по сравнению с безадъювантными, они эффективны и имеют высокий профиль безопасности, что было подтверждено несколькими клиническими исследованиями.
"Однако современные требования к доказательной базе вакцин ужесточаются, поэтому научно-исследовательская работа продолжается, и данные последних исследований мы представили на симпозиуме", - сообщил "РГ" Алексей Матвеичев.


Эксперт рассказал о сути проведенных исследований. "Мы изучили влияние адъюванта на дендритные клетки человека (одни из ключевых клеток, запускающих иммунный ответ на вакцинацию) и натуральные киллеры у мышей, - пояснил Алексей Матвеичев. - Также мы нашли новое подтверждение тому, как адъювант способствует развитию гуморального иммунного ответа (выработке антител) - именно запуск иммунного ответа и есть основная цель вакцинации. Мы также исследовали клеточный иммунный ответ, который особенно важен для нашей защиты, если заражение все же произошло, и вирус начал размножаться в клетках организма. Клеточный иммунный ответ, направленный на борьбу с зараженными вирусом клетками, обеспечивает их распознавание и уничтожение".
Мышей в эксперименте разделили на четыре группы. Каждой группе вводили определенный препарат: антигены вакцины без адъюванта, такие же антигены с адъювантом, вакцину со стандартной дозой антигена и - в группе сравнения - вакцинный растворитель без антигенной "начинки" в качестве плацебо. Ученые оценивали способность клеток вакцинированных мышей участвовать в гуморальном и клеточном иммунном ответе. В ходе работ было показано, что вакцина с адъювантом, содержащая меньше антигенов, вызывает такой же иммунный ответ, как и безадъювантная, в которой антигенов втрое больше. У вакцины, содержащей адъювант, обнаружилось еще одно интересное свойство: после ее применения возрастает активность натуральных клеток-киллеров, они начинают интенсивнее бороться с клетками, зараженными вирусом. "Это означает, что если человек все же был заражен вирусом гриппа, либо другими ОРВИ, хотя и был привит, выздоровление может наступить быстрее", - отметил эксперт.
В частных клиниках на выбор предлагали привиться французской Ваксигрип или отечественной Гриппол плюс. Перед прививкой в частной клинике осмотр врача обязателен и услуга вакцинации может стоить от 1 до 4 тысяч рублей, в зависимости от раскрученности клиники и страны производства вакцины.
Также в столице бесплатно делали прививку Гриппол плюс в мобильных пунктах у метро. В поликлиниках в основном прививали Совигриппом и Ультриксом. Кроме того, в этом году на рынке появилась еще одна отечественная вакцина Гриппол Квадривалент, куда входит не три, а четыре рекомендуемых ВОЗ штамма. Такая вакцина защищает от четырех штаммов вируса гриппа, которые ждут в этом сезоне.
Давайте разбираться, в чем же разница в этих вакцинах, почему многие доверяют больше импортным, чем родным, российским.
Пять сходных черт
1. Соблюдены все рекомендации ВОЗ по штаммам.
В начале года Всемирная организация здравоохранения собирает данные по мониторингу за инфекциями от лабораторий-партнеров, расположенных в разных регионах мира, в том числе и в России , ведь грипп не утихает круглый год. И в Южном полушарии он начинается раньше, чем в нашем Северном. По данным лабораторий, экспертная комиссия ВОЗ определяет наиболее вероятные штаммы вирусов гриппа, которые придут в гриппозный сезон. Исходя из этих данных, ВОЗ подготавливает перечень штаммов для производителей вакцин и предоставляет всем странам. Так что вопреки распространенным заблуждениям, прививки не бывают прошлогодними, каждый год их состав меняется. Это относится и к импортным, и к отечественным вакцинам.
2. Произведены по мировым стандартам GMP.
Очень важный общий пункт для всех вакцин. Стандарты GMP – это особая система норм и правил, которая используется при производстве лекарственных средств и препаратов. Это целостный подход, который контролирует выпуск препарата от входного контроля качества сырья и материалов до контроля качества готового продукта. Очень серьезная международная система требований, составленных с целью контроля качества, гарантирующая безопасность препарата.
3. Полные клинические исследования: безопасность и эффективность.
И самое главное – все вакцины на отечественном рынке, хоть платные, хоть бесплатные, прошли все необходимые клинические исследования. После доклинических исследований оценки и безопасности на животных проходят обязательные клинические исследования по контролю иммунологической эффективности и безопасности. Но и это не все: после выхода вакцины на рынок нужно пройти еще и пострегистрационные испытания на больших контингентах людей. Например, клинические испытания российской вакцины Гриппол плюс проведены в соответствии с мировыми и национальными стандартами. Только в эпидемиологических пострегистрационных исследованиях приняли участие более 24 тыс. детей и более 9,3 тыс. взрослых. Именно эти испытания окончательно подтвердили высокую эффективность и безопасность вакцины. На данный момент это самая крупная доказательная база среди всех отечественных и многих импортных вакцин.
4. Содержат только часть вируса.
Все вакцины против гриппа относятся к инактивированным, то есть в них используется не живой вирус, а лишь его отдельные фрагменты. Вот почему невозможно после прививки заболеть гриппом. Поэтому именно инактивированные вакцины рекомендуют людям с ослабленным иммунитетом, а прививку от гриппа можно делать уже спустя 1–2 недели после перенесенного заболевания.
5. Удобная индивидуальная одноразовая шприц-доза.
Все компании уже выпускают вакцины от гриппа в удобной форме, но для удешевления производства также по-прежнему используют обычные ампулы. И импортные, и отечественные вакцины в индивидуальных дозах – это, во-первых, удобно, во-вторых, более безопасно.

1. Наличие адъювантов.
Адъюванты, или иммуномодуляторы, используются в двух отечественных вакцинах: Гриппол плюс (полиоксидоний) и Совигрипп (совидон). Именно они часто становятся камнем преткновения, мол, зачем нужно в прививки добавлять иммуномодуляторы? Между тем полиоксидоний в составе вакцины Гриппол плюс действует не как иммуномодулятор, а как адъювант, стимулируя естественный иммунный ответ, развивающийся на введение гриппозных антигенов, что, по сути, повышает качество работы вакцины.
Кроме того, международная практика давно признала эффективность адъювантов.
Вот как обозначает EMEA (Европейская организация лекарственных средств) свое отношение к адъювантам в вакцинах, что дает их использование:
* Повышение иммуногенности антигенов
* Уменьшение количества антигенов
* Снижение частоты повторных иммунизаций
* Улучшение иммунного ответа у пожилых и людей с ослабленным иммунитетом
Так, адъюванты давно используются, например, в вакцинах АКДС, в более современных вакцинах от рака шейки матки, в импортных вакцинах для гриппа, специально рекомендованных пожилым людям, у которых иммунный ответ на вакцину с возрастом становится ниже. В американских вакцинах массово используются алюминиевые адъюванты. А ВОЗ призывает искать другие альтернативы адъювантам, которые помогают сделать массовую вакцинацию еще эффективнее и безопаснее.
Кстати, безопасность и эффективность адъюванта полиоксидоний в вакцинах (международное непатентованное название, присвоенное ВОЗ: азоксимера бромид) была подтверждена отчетом независимой европейской компании FluConsult.
2. Меньшее количество антигенов.
И в отечественные, и в зарубежные вакцины входят одни и те же штаммы вируса гриппа, но количество антигенов в вакцинах разное. В импортных Инфлювак и Ваксигрип, а также отечественном Ультриксе содержится по 15 мкг всех трех штаммов вируса. В двух других отечественных вакцинах антигенов меньше: в Гриппол плюс – по 5 мкг трех штаммов гриппа, в Совигриппе – по 5 мкг двух штаммов А и 11 мкг штамма В.
Что это значит для простого обывателя? Мы привыкли думать, что если доза меньше, то и помогает она хуже. Но это не так. Состав и качество вакцин регламентирует Европейская или Национальная фармакопея, и в обеих фармакопеях специально оговаривается, что содержание антигенов должно составлять 15 мкг, если результатами клинических исследований не обоснована иная дозировка. Дозировка же получает обоснование в ходе клинических испытаний, без которых ни одна вакцина не будет допущена на рынок. Получается, если работает меньшая доза, то зачем брать большую? Как поясняют разработчики вакцин и лекарственных средств, снижение количества активного вещества, выбор минимальной эффективной дозы – это главный принцип при разработке любого препарата. Ведь в первую очередь минимальная доза – это безопасность пациентов. И еще один большой плюс – за счет сниженного количества антигенов такие вакцины более безопасны для аллергиков, гораздо реже дают местную реакцию на прививку, чем вакцины с содержанием 15 мкг антигенов.
Так, чтобы получить доказательства этому тезису, проводились сравнительные пострегистрационные исследования вакцины Гриппол плюс, Инфлювак и Ваксигрип. Результаты исследований показали, что все три вакцины имеют схожую эффективность и безопасность. При этом местные реакции (боль после инъекции, зуд и припухлость) после вакцин Гриппол плюс и Инфлювак достоверно ниже, чем после вакцины Ваксигрип.
Получается, что отечественная вакцина, прошедшая многочисленные клинические испытания, ничуть не хуже импортных, а в некоторых случаях – даже безопаснее, чем зарубежные.
Для исследований в области вакцин
Иммунные реакции делятся на два типа: врожденная и адаптивная (рисунок 1). Клетки врожденной иммунной системы распознают и реагируют на патогенные микроорганизмы неспецифическим образом. В иммунном ответе участвуют многие типы клеток: дендритные клетки - DC, макрофаги, тучные клетки, эозинофилы, нейтрофилы, В- и Т-лимфоциты [1]. Антиген-представляющие клетки (АРС) поглощают вторгающиеся патогенные микроорганизмы, переваривают их и переносят в локальный лимфатический узел, где они представляют антигены наивным Т-клеткам и направляют дифференцировку Т-хелперов в различные эффекторные клетоки (CD8 + Т-клетки / Th1, CD4 + Т-клетки / Th2). Врожденная иммунная система обеспечивает немедленную защиту от инфекции и имеет важное значение для эффективной индукции адаптивного иммунитета [2, 3]. В отличие от этого адаптивный иммунитет включает антиген-специфический ответ, опосредуемый Т-клетками, В-клетками и клетками памяти. Т- и В-клетки экспрессируют уникальные рецепторы Т-клеток (TCR) и рецепторы В-клеток (BCR), соответственно, и распознают различные антигены. Когда Т и В-клетки активируются, они индуцируют развитие цитотоксических Т-киллеров (клеточный иммунитет) и производство антител дифференцированными плазматическими В-клетками (гуморальный иммунитет). Запуск иммунного ответа требует взаимодействия между клетками врожденной и адаптивной иммунной системы.
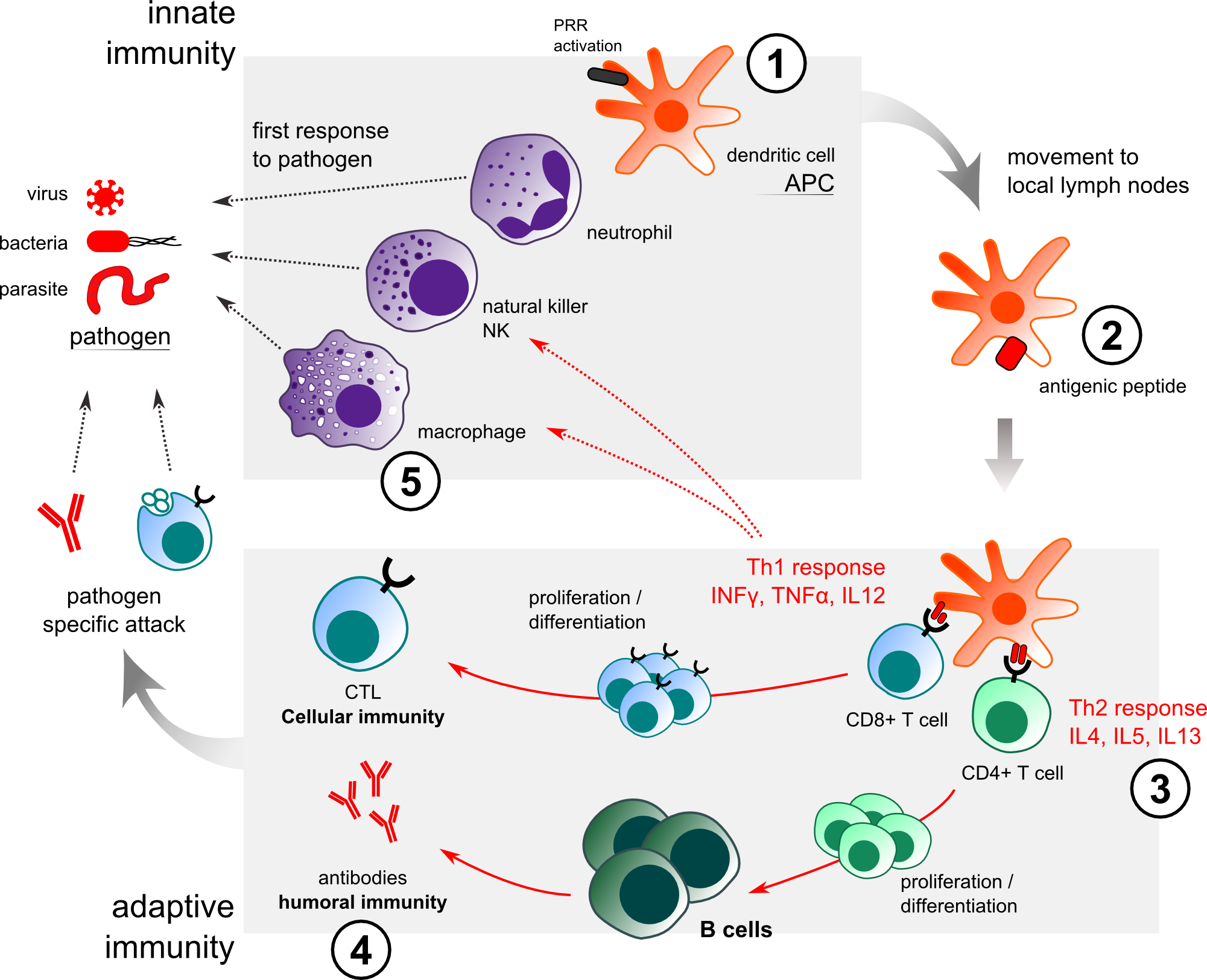
Рисунок 1. Врожденный и адаптивный иммунный ответ на действие патогена/адъюванта. VaxAlum / SqualVax / IFAVax: (1) привлечение APC к месту инъекции. (2) усиление захвата антигена. (3) усиление ответа Th2. (4) усиление гуморального иммунного ответа. (5) AlumVax: усиление образования NALP3/инфламмосом в макрофагах.
ROLE OF ADJUVANTS IN VACCINES & ANTIBODY PRODUCTION
Как правило, используются nри основных типа вакцины: I) живые ослабленные вакцины, II) инактивированные вакцины, которые представляют собой микроорганизмы, инактивированные химически или температурой и III) субъединичные вакцины, которые сделаны из компонентов патогена, таких как белки, пептиды или генетические материалы. Иммунизация или вакцинирование индуцируют специфический адаптивный иммунитет к патогену путем создания клеток памяти против конкретного патогена [2]. Любая вакцина состоит из специфической антигенной части патогена, который будет провоцировать ответ Т и В-лимфоцитов с производством клеток памяти. После введения антиген поглощается и презентируется АРС как комплекс пептид / белок МНС класса II или I, который связывается Т-клеточные рецепторы (TCR) Т-хелперов CD8+ (Th1) и CD4+ (Th2), соответственно. После индукции цитокинами АРС Т-хелперы дифференцируются в два основных подтипа: Th1 и Th2. Интерлейкины IL-2 и IL-12 способствуют дифференцировке Th1 и последующей секреции INF-гамма, TNF-альфа и высвобождению IgG2a, и пролиферации цитотоксических CD8+ Т-клеток. Это "клеточный ответ", который борется с внутриклеточными патогенами. IL-1b и IL-18 индуцируют дифференцировку Th2 приводят к секреции IL-4, -5, -6, -10 и -13 и пролиферации секретирующих антитела B-клеток: это "гуморальный ответ", который защищает организм от внеклеточных патогенов. Иммунный ответ, индуцируемый антигенной или генетической иммунизацией может, таким образом, отличаться по запуску одного из двух ответов: Th1 или Th2.
Успешное создание вакцин для некоторых патогенных микроорганизмов, вероятно, потребует расширенного иммуного ответа, включающего клеточный иммунитет Th1 или более надежный гуморальный ответ Th2.
Для получения антител предпочтительнее сильный ответ Th2 . Качество поствакцинального иммунный ответа или уровень выработки антител будут зависеть от нескольких факторов, в том числе способа, числа и времени введения вакцины, от природы антигена и качества презентации антигена. Весь этот процесс облегчается адъювантами. Действительно, адъюванты позволяют преодолеть слабо иммуногенные свойства большинства белков, пептидов и ДНК-вакцин (не имеющих природных иммунных триггеров) или индукцию неадекватного иммунного ответа. Таким образом, адъюванты могут быть использованы для (1) усиления иммунного ответа, (2) ориентирования иммунный ответ за счет модуляции баланса Th1 / Th2 и (3) снижения количества антигена и количества инъекций, необходимых для индукции защиты.
КАК РАБОТАЮТ АДЪЮВАНТЫ?
Адъюванты, как правило, делятся на две группы: средства доставки и иммуностимуляторы с некоторыми общими компонентами. Средства доставки - это, как правило, частицы (минеральные соли, например, гидроксид алюминия, эмульсии, липосомы). Они несут и "показывают" клеткам выбранные антигены в множестве копий, имитируя естественную презентацию микроорганизмами и используются для осаждения антигенов в месте введения, или увеличения его доставки в АРС (микро- и наночастицы) [4]. В противоположность этому, иммуностимуляторы (агонисты TLR, сапонины, цитокины . ) непосредственно узнают и активируют клетки иммунной системы и усиливают иммунный ответ на антигены (рисунок 2). В этой группе адъювантов вещетсва, нацеленные на рецепторы распознавания патогена (РРСС) врожденной иммунной системы получили значительное внимание в течение последнего десятилетия.
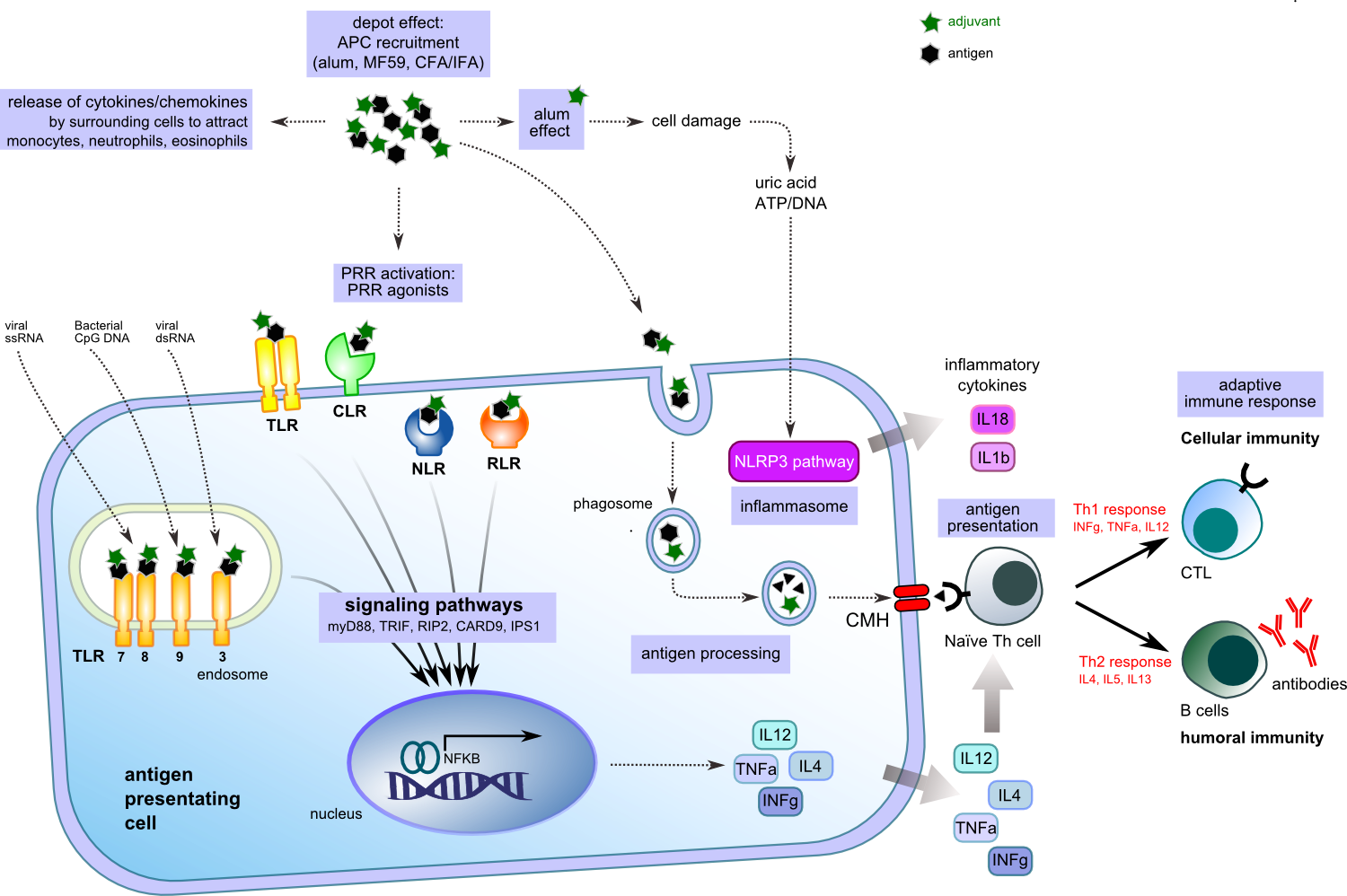
Рисунок 2. Активация APC адъювантом с антигеном.
Адъюванты Фройнда
Неполный адъювант Фройнда = сильный Th2 иммунный ответ + низкий ответ Th1
Полный адъювант Фройнда = сильный Th1 иммунный ответ
Неполный адъювант Фрейнда (IFA) IFAVax и полный адъювант Фрейнда (CFA) CFAVax являются водномасляной эмульсией, состоящей из смеси минерального масла и эмульгатора в соотношении 85% v/v масла и 15% v/v эмульгатора. В отличие от адъюванта Фрейнда (CFA), ИФА не содержит термически убитых микобактерий (Mycobacterum tuberculosis). IFA и CFA широко используются в экспериментальной иммунологии. IFA десятилетиями использовался в практической ветеринарной вакцинации. Важно отметить, что адъюванты Фрейнда не являются предварительно сформированными эмульсиями и, таким образом, они должны быть смешаны с равным объемом водного раствора антигенов, а затем эмульгированы перед использованием. Хотя механизмы действия масляный эмульсий до сих пор плохо изучены, некоторые доказательства указывают на частичное участие NOD2 в этом процессе. Кроме того, эти эмульсии склонны вызывать повреждение клеток при инъекции и, таким образом, эндогенные сигналы, выделяющиеся во время некротической смерти клеток, могут также способствовать их адъювантной активности. Иммунный ответ, направленный по CFA резко усиливается микобактериальным компонентом, который привлекает макрофаги и иммунные клетки в место инъекции. CFA индуцирует главным образом ответ Th1 и может вызвать гранулемы и интенсивную воспалительную реакцию в месте прививки. CFA следует использовать ответственно и с осторожностью, чтобы избежать или свести к минимуму неблагоприятные последствия чрезмерного воспаления. В отличие от CFA, индуцирующего главным образом Th1 ответ, IFA, лишенный микобактериальных компонентов, запускает Th2 ответ [11]. Для большинства приложений, CFA, как правило, необходим только для начальной иммунизации, в то время как IFA является больше подходит для последующих иммунизаций. Адъюванты IFAVax и CFAVax предназначены для обеспечения непрерывного высвобождения антигенов, необходимых для стимуляции сильного, длительного иммунного ответа.
Адъювант на основе алюминия (для иммунного ответа Th2)
Соединения алюминия являются наиболее распространенным адъювантом и используется в утвержденных профилактических вакцинах из-за его высокой безопасности и способности усиливать защитный гуморальный иммунный ответ (Th2). Он состоит из преципитатов фосфата алюминия и/или гидроксида алюминия, на которые антигены адсорбируются за счет гидрофобных и электростатических взаимодействий или попадания внутрь осадка. Гидроксид Alumax несет положительный заряд при физиологическом рН 7,4 и связывает кислые белки. Фосфат Alumax, с другой стороны, имеет отрицательный заряд и, следовательно, связывает основные белки. Ассоциация антигена с производными алюминия способствует высокой локальной концентрацией антигена и улучшает их поглощение APC. В ранних экспериментах было показано, что квасцы усиливает реакцию на антигены, увеличивая время доступности антигена. Кроме того, в настоящее время признается, что соединения алюминия, как и многие другие адъюванты, действует путем прямой активации клеток иммунной системы. У мышей, соединения алюминия индуцируют сильно поляризованный Th2 иммунный ответ, который характеризуется производством IL-4 и IL-5 и сильной индукцией производства антител - иммуноглобулинов IgE и IgG1 13. Следовательно, соединения алюминия очень эффективны против патогенных микроорганизмов, которые требуют Th2 гуморального иммунитета. Параллельно с этим, соединения алюминия способны активировать инфламмасому NLRP3 для получения зрелого IL-1, создавая благоприятные условия для иммунного ответа [14]. Тем не менее, данные вещества не могут индуцировать реакции Th1, связанные с индукцией ИНФ-гамма и цитотоксических Т-лимфоцитов, которые необходимы для защиты организма от внутриклеточных инфекций.
Различные соли алюминия содержатся в многочисленных лицензированных вакцинах (смотрите таблицу ниже) и их профили безопасности были проверены в течение длительного применения на людях [15].
Эмульсия сквалена (Сильный иммунный ответ – баланс ответов Th1/Th2)
SqualVax представляет собой эмульсию типа масло-в-воде из капель сквалена в непрерывной водной фазе. Капли сквалена стабилизированы путем добавления двух неионных поверхностно-активных веществ, которые широко используются в качестве эмульгаторов в пищевой, косметической и фармацевтической продукции [16]. Он полностью биоразлагаем, что является важным преимуществом по сравнению с альтернативными маслами, используемыми в качестве таких эмульсионных адъювантов, как адъювант Фрейнда, который содержит минеральное масло (парафиновое масло) и, таким образом, имеет длительный срок жизни в организмах.
Эмульсия сквалена вызывает местное раздражение и привлекает дендритные клетки и гранулоциты, стимулирует дифференцировку моноцитов в DC [17] и повышает поглощение антигена АРС [18]. Эмульсия действует в большей степени на макрофаги, находящихся в месте инъекции. Локальное увеличение высвобождения хемокинов также влияет на привлечение иммунных клеток из крови в месте прививки, создавая цикл амплификации. Данный состав усиливает дифференциацию моноцитов в направлении зрелого фенотипа и способствует миграции нагруженных антигеном клеток к лимфатическому узлу. По сравнению с солями алюминия, иммунный ответ от данного адъюванта получается сильнее (больше антител и более сильный Т-клеточный ответ) со смешанным и более сбалансированным клеточным фенотипом Th1 / Th2 [17]. Эмульсии сквалена присутствуют в лицензированных вакцинах против сезонного и пандемического гриппа. Они усиливают иммунный ответ в сложных популяциях, таких как пожилые люди, и могут способствовать иммунному ответу против конкретных вариантов вируса сезонного гриппа, не входящих в состав вакцины [19].
Состав SqualVax аналогичен MF59® (зарегистрированная торговая марка компании Novartis). MF59 используется только для целей сравнения. SqualVax ™ не производится, не аффилирован, не спонсируется и не поддерживается Novartis. Novartis не производил оценку и не давал одобрения настоящему документу.
БИБЛИОГРАФИЯ
1. van Kooyk Y., et al., Curr Opin Immunol, 2004. 16(4): p. 488-93.
2. Akira S., Philos Trans R Soc Lond B Biol Sci, 2011. 366(1579): p. 2748-55.
3. Iwasaki A. and R. Medzhitov, Science, 2010. 327(5963): p. 291-5.
4. Cox J.C. and A.R. Coulter, Vaccine, 1997. 15(3): p. 248-56.
5. Medzhitov R. and C. Janeway Jr., N Engl J Med, 2000. 343(5): p. 338-44.
6. Elinav E., et al., Immunity, 2011. 34(5): p. 665-79.
7. Kawai T. and S. Akira, Immunity, 2011. 34(5): p. 637-50.
8. Loo Y.M. and M. Gale Jr., Immunity, 2011. 34(5): p. 680-92.
9. Osorio F. and C. Reis e Sousa, Immunity, 2011. 34(5): p. 651-64.
10. Reed S.G et al., Nat Med, 2013. 19(12): p. 1597-608.
11. Lindblad E.B., et al., Infect Immun, 1997. 65(2): p. 623-9.
12. Marrack P., A.S. McKee, and M.W. Munks, Nat Rev Immunol, 2009. 9(4): p. 287-93.
13. Aimanianda V., et al., Trends Pharmacol Sci, 2009. 30(6): p. 287-95.
14. Li H.S. Nookala, and F. Re, J Immunol, 2007. 178(8): p. 5271-6.
15. Singh M., et al., Vaccine, 2006. 24(10): p. 1680-6.
16. O'Hagan D.T., Expert Rev Vaccines, 2007. 6(5): p. 699-710.
17. Seubert A., et al., J Immunol, 2008. 180(8): p. 5402-12.
18. Dupuis M., et al., Cell Immunol, 1998. 186(1): p. 18-27.
19. Podda A., Vaccine, 2001. 19(17-19): p. 2673-80.
Читайте также:


