Секвенирование днк при диагностики туберкулеза

В 2004 году по инициативе д.м.н., профессора Михаила Александровича Владимирского, заведующего сектором молекулярной диагностики туберкулёза НИИ Фтизиопульмонологии Первого МГМУ им. И.М.Сеченова, мы начали разработки в области ПЦР-диагностики туберкулёза.
Выделение ДНК: использование оригинальных реагентов и магнитных частиц обеспечивает получение максимального количества чистой ДНК и позволяет автоматизировать процесс выделения ДНК.
ПЦР в реальном времени: одновременная детекция нескольких различных участков генома комплекса микобактерий туберкулёза (МБТ) увеличивает информативность и достоверность анализа.
I этап – Пробоподготовка, инактивация
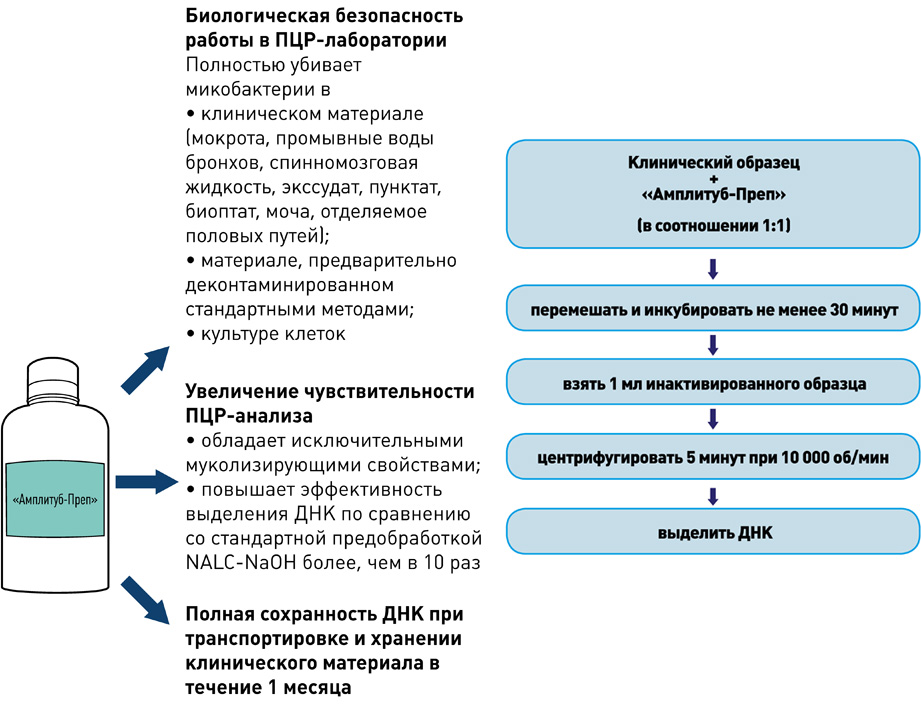
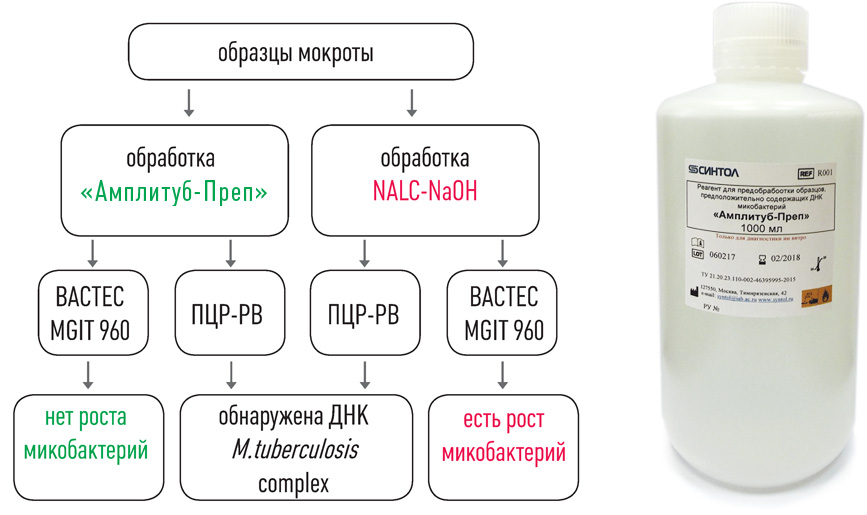
II этап – Выделение ДНК
набор реагентов для выделения ДНК (на магнитных частицах)
набор реагентов для выделения ДНК микобактерий из клинических образцов и культур клеток на автоматизированных станциях TECAN

- Снижение риска контаминации во время выделения ДНК практически до нуля.
- Значительное уменьшение трудоёмкости процесса выделения ДНК.
- Стандартизированное выделение ДНК из клинических образцов.
- Экономическая выгода: низкий расход пластика и реактивов.
набор реагентов для ускоренной пробоподготовки и выделения ДНК микобактерий из образцов мокроты
III этап – ПЦР в реальном времени
Обнаружение и количественное определение комплекса МБТ
Набор реагентов АМПЛИТУБ-РВ — это:
- высокая достоверность анализа благодаря одновременному обнаружению двух специфичных генов M.tuberculosis complex: IS6110 и regX3;
- оценка пригодности образца ДНК для определения антибиотикоустойчивости;
- высокая чувствительность (не более 100 КОЕ/мл мокроты или 1–10 копий фрагментов ДНК в реакции) и 100%‑ая специфичность, подтверждённые на панели QCMD (Quality Control for Molecular Diagnostics) Mtb EQA (UK).
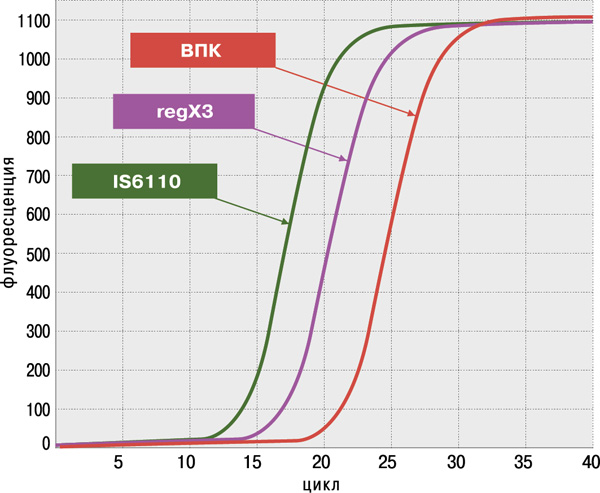
Определение антибиотикоустойчивости МБТ к препаратам I и II ряда
Наборы реагентов АМПЛИТУБ-МЛУ-РВ, АМПЛИТУБ-FQ-РВ — это:
- диагностика форм туберкулеза с лекарственной устойчивостью, в том числе множественной лекарственной устойчивостью (МЛУ) и широкой лекарственной устойчивостью (ШЛУ);
- быстрая детекция мутаций M.tuberculosis, ассоциирующихся с устойчивостью к антибиотикам первого и второго ряда (рифампицину, изониазиду, этамбутолу, фторхинолонам);
- достоверность результатов, ежегодно подтверждаемая при проведении Федеральной службой внешней оценки качества (ФСВОК) Росздравнадзора испытаний шифрованных тест-культур и образцов.
Наборы АМПЛИТУБ-МЛУ-РВ и АМПЛИТУБ-FQ-РВ основаны на использовании оригинальной мультиконкурентной аллель-специфичной методики ПЦР в реальном времени, позволяющей выявлять мутации в генах микобактерий туберкулеза, ответственных за устойчивость к конкретным антибиотикам.

Принцип мультиконкурентной аллель-специфичной методики ПЦР в реальном времени
- В формате одной пробирки используются 5’-флуоресцентно-меченые аллель-специфичные праймеры с общим комплементарным им 3’-меченым олигонуклеотидом-гасителем и контрольный флуоресцентный зонд, комплементарный участку ДНК без мутаций.
- При отсутствии мутаций в ДНК нарастание флуоресценции в ходе ПЦР-РВ наблюдается только по флуорофору зонда.
- При наличии мутаций в ДНК нарастание флуоресценции в ходе ПЦР-РВ наблюдается как по флуорофору зонда, так и по флуорофору 5’-флуоресцентно-меченого аллель-специфичного праймера. Данный метод позволяет определить не только точку мутации, но и процент устойчивого мутантного штамма МБТ на фоне дикого.
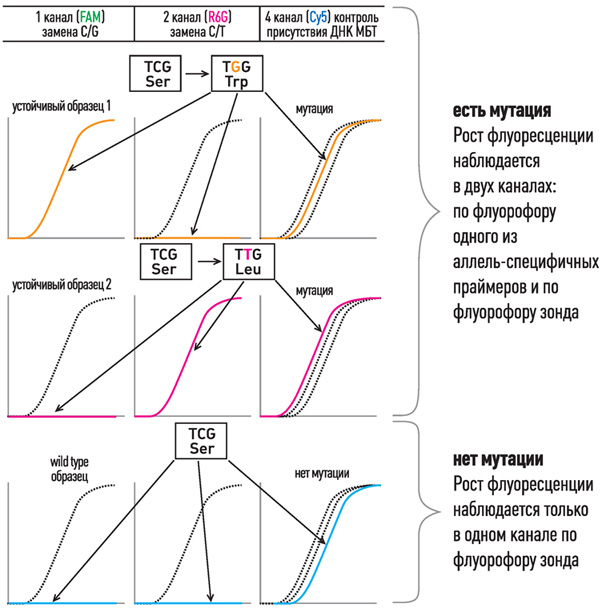
Интерпретация результатов выявления мутаций на примере
531 кодона rpoB гена M.tuberculosis
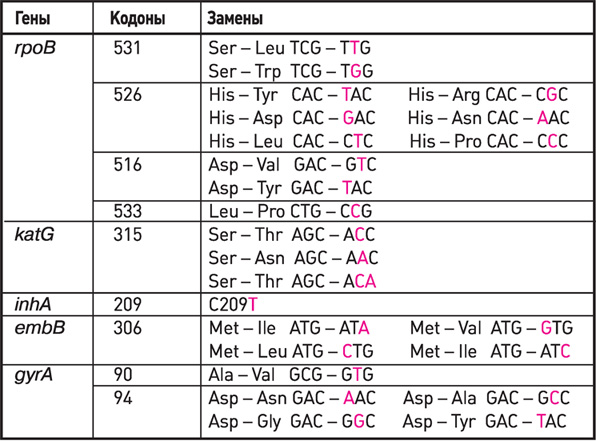
Гены, кодоны, замены, используемые в наборах реагентов
АМПЛИТУБ-МЛУ-РВ при определении антибиотикоустойчивости
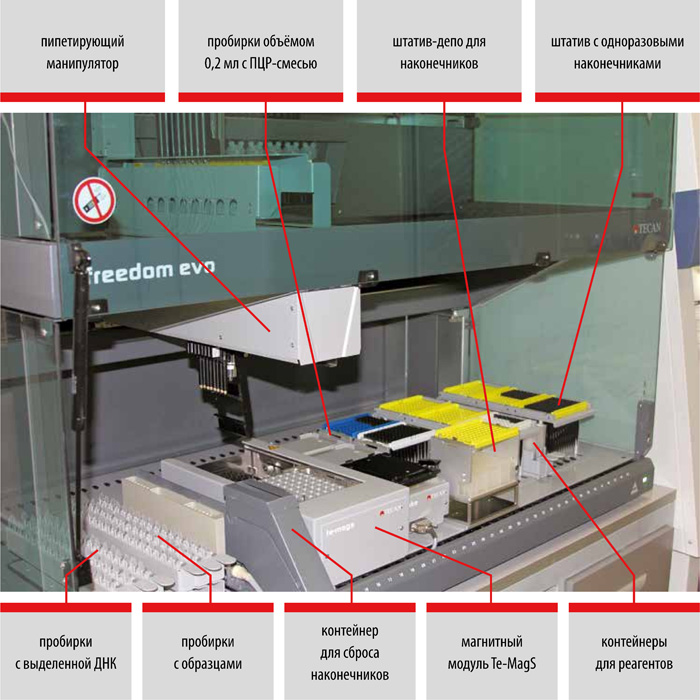
Использование автоматизированных станций Freedom EVO (TECAN, Швейцария) для молекулярно-генетической диагностики туберкулёза
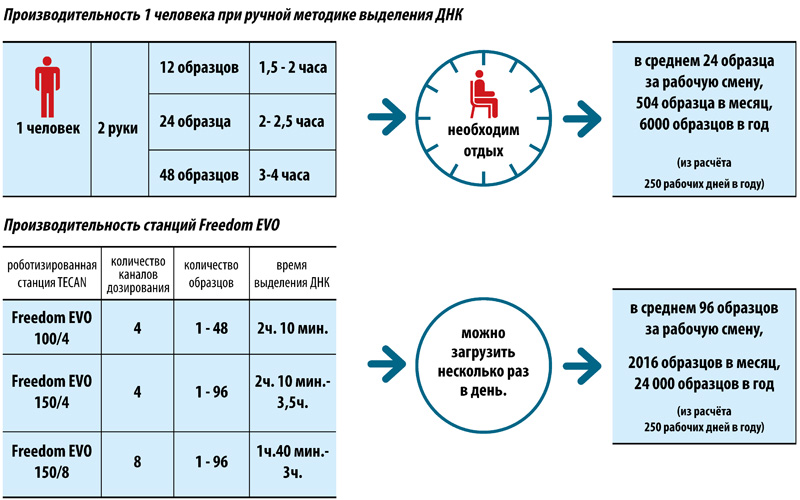

Трудозатраты — 1 час
Продолжительность выделения ДНК — не более 2 часов
Подготовка к амплификации и ПЦР-РВ — 1,5 часа
ИТОГО: результаты анализа будут готовы через 3,5 часа
Оператор затратит 1 час своего рабочего времени.
Полногеномное секвенирование (ПГС) позволяет определять видовую принадлежность микобактерий и устойчивость к антибиотикам. Годичное исследование, проведенное британскими учеными, показало, что эффективность ПГС сравнима с традиционными методами.
Колонии M. tuberculosis. Credit: Wikimedia Commons

Колонии M. tuberculosis. Credit: Wikimedia Commons
В 2015 году по данным ВОЗ было зарегистрировано 10,4 миллиона новых случаев туберкулеза, 1,4 миллиона смертей связаны непосредственно с этим заболеванием. Около 3% новых случаев и 20% ранее выявленных вызваны штаммами, резистентными к одному или нескольким противотуберкулезным препаратам.
При подозрении на мультирезистентность ВОЗ рекомендует линейный анализ образцов (line probe assays, LPA) — это ПЦР и затем гибридизация, позволяющая идентифицировать гены устойчивости.
Молекулярные тесты более точны, чем фенотипические, в том числе биохимические. Однако из-за межвидового сходства некоторых генов, например рибосомных, близкородственные виды бывает трудно распознать. Сейчас вполне реально использовать для рутинной идентификации видов микобактерий (помимо Mycobacterium tuberculosis, существует 176 микобактериальных видов), а также для тестирования на чувствительность к лекарствам полногеномное секвенирование (ПГС).
Группа британских ученых сравнила результаты ПГС и стандартных лабораторных методик по идентификации микобактерий, прогнозированию резистентности к антибиотикам первой линии M. tuberculosis, а также оценила затраченное на анализы время. Исследования проводились в Национальной референсной службе по микобактериям в течение года. с апреля 2015 года по март 2016-го.
Виды определяли генотипированием (тест GenoType CM, затем GenoType Mycobacterium MTBC или GenoType Mycobacterium AS, Hain Lifescience GmbH, Nehran, Germany), устойчивость к антибиотикам — также генотипированием (GenoType MTBDRplus ) либо фенотипически (Becton Dickinson MGIT 960 system).
Из 2039 изолятов, определенных до вида методами LPA, для 74 (3,6%) не удалось определить вид методом секвенирования или ПГС, таким образом, для сравнения остались 1965. Клинически значимые виды были идентифицированы методом LPA и полногеномным секвенированием в 1902 изолятах, причем в 1825 (96,0%) результаты совпали.
По резистентности к препаратам первой линии — изониазиду и рифампину — в общей сложности были получены 2215 результатов LPA в 728 изолятах комплекса M. tuberculosis (группа близкородственных видов микобактерий, способных вызвать туберкулез). Исключая 216 (10,0%) случаев, когда данных не хватило для ПГС, общая согласованность составила 99,3%, чувствительность — 97,6%, специфичность — 99,5%.
Всего было зарегистрировано 2982 фенотипических результата по резистентности для 777 изолятов комплекса M. tuberculosis. Из них 356 (11,9%) не имели параллельных результатов ПГС, а в 154 (5,2%) случаях результат был неопределенным из-за обнаружения новых, ранее не охарактеризованных мутаций. За исключением этих данных, общая согласованность составила 99,2%, чувствительность — 94,2%, а специфичность — 99,4%. Медианное время обработки для обычных лабораторных тестов по сравнению с ПГС было близким — 20 и 21 день соответственно.
Показано, таким образом, что полногеномное секвенирование с большой точностью определяет виды и восприимчивость к лекарственным средствам.
T. Phuong Quan et al. // Evaluation of Whole-Genome Sequencing for Mycobacterial Species Identification and Drug Susceptibility Testing in a Clinical Setting: a Large-Scale Prospective Assessment of Performance against Line Probe Assays and Phenotyping. // J. Clin. Microbiol. February 2018, 56:14 e01480-17; Accepted manuscript posted online 22 November 2017, DOI: 10.1128/JCM.01480-17
Еще о микобактериях и молекулярной диагностике в Journal of Clinical Microbiology (2018, февраль)
Туберкулез - хроническая инфекция с длительным периодом выделения возбудителя, многообразием клинических проявлений, поражением различных органов и систем - представляет непростую задачу для лабораторной диагностики. Молекулярно-биологические методы (ПЦР) используются для выявления, видовой дифференциации и определении лекарственной устойчивости микобактерий туберкулезного комплекса.
Ввиду биологических особенностей возбудителя и иммунного ответа человека диагностика туберкулеза не может ограничиваться каким-либо одним методом и должна проводиться комплексно.
Возбудители туберкулеза могут быть обнаружены в различных биоматериалах, природа которых определяет выбор наборов реагентов для экстракции ДНК. Ключевой принцип выбора биоматериала для диагностики туберкулеза методом ПЦР: необходимо выбирать биоматериал, соответствующий клинической форме туберкулезной инфекции.
Например, для диагностики туберкулеза мочеполовой системы нужно исследовать мочу или менструальную кровь, рекомендуется также исследовать биоптаты из подозрительного очага. Для диагностики туберкулеза легких используется мокрота, бронхо-альвеолярный лаваж.
Реагенты и оборудование для предобработки биоматериалов и экстракции ДНК
| Наборы реагентов для экстракции ДНК из мокроты, бронхо-альвеолярного лаважа, мочи, синовиальной жидкости и смывов с объектов окружающей среды | АмплиПрайм ДНК-сорб-В и АмплиПрайм РИБО-преп |
| Реагент для разжижения мокроты и синовиальной жидкости | Муколизин |
| Набор для экстракции ДНК, используемый при исследовании биоптатов (легкие, лимфатические узлы, почки, печень, мозг, селезенка) | ДНК-сорб-С |
| Оборудование для гомогенизации биоптатов | TissueLyser LT или TissueLyser II |
| Парафиновые блоки нарезают на микротоме или вырезают фрагмент ткани одноразовым скальпелем, а затем проводят экстракцию ДНК, например, с помощью набора реагентов QIAamp DNA FFPE Tissue Kit (50) | QIAamp DNA FFPE Tissue Kit (50) |
Наборы реагентов для ПЦР-диагностики туберкулеза
Применение молекулярно-биологических методов (в частности, выявление ДНК методом ПЦР) в диагностике туберкулеза регламентировано Приказом Минздрава РФ от 21.03.2003 № 109 "О совершенствовании противотуберкулезных мероприятий в Российской Федерации" (ред. от 29.10.2009).
Выявление микобактерий туберкулезного комплекса
Набор реагентов АмплиСенс® МТС-FL предназначен для обнаружения ДНК микобактерий туберкулеза – Mycobacterium tuberculosis complex (MTC), включающий в себя виды микобактерий разной степени вирулентности, вызывающих туберкулез у человека (M.tuberculosis, M.bovis, M.africanum, M.microti, M.canetti, М.pinipedii).
Микобактерии туберкулеза выявляются без видовой дифференциации; микобактерии, не относящиеся к MTC (например, M.avium и M.paratuberculosis) - не выявляются. Данный набор реагентов используется в топической диагностике туберкулеза и позволяет быстро (за несколько часов) с высокой чувствительностью и специфичностью (близким к 100%) определять наличие микобактерий туберкулеза в образце биоматериала.
Благодаря высокой скорости и информативности в диагностике туберкулеза, методы амплификации нуклеиновых кислот (в том числе ПЦР) в 2010 году были предложены CDC США для подтверждения диагноза туберкулеза наряду с культуральным методом.
Видовая дифференциация микобактерий туберкулеза методом ПЦР
Не менее важно дифференцирование до вида внутри группы MTC. Это связано с необходимостью определения источника заболевания, определения тактики противотуберкулезной терапии, а также для подтверждения случаев поствакцинальных осложнений.
С этой задачей позволяет справиться набор реагентов АмплиСенс® МТС-diff-FL, предназначенный для дифференцирования видов микобактерий туберкулеза внутри MTC: человеческого (M.tuberculosis), бычьего (M.bovis) и вакцинного штамма (M.bovis BCG) – в клиническом материале и культурах микроорганизмов.
Актуальность видовой дифференциации определяется, например, тем, что разные виды микобактерий отличаются профилем лекарственной устойчивости. Например, M.bovis и её вакцинный штамм M.bovis BCG отличаются природной резистентностью к одному из основных противотуберкулезных препаратов - пиразинамиду. Поэтому при туберкулезе, вызванной M.bovis, и БЦЖите пиразинамид не назначается.
Приказом Минздрава РФ от 21.03.2003 № 109 "О совершенствовании противотуберкулезных мероприятий в Российской Федерации" (ред. от 29.10.2009) регламентировано применение наборов реагентов, дифференцирующих M.bovis от ее вакцинного штамма M.bovis BCG, для диагностики БЦЖита.
Определение лекарственной устойчивости туберкулеза
Распространение штаммов туберкулеза с лекарственной устойчивостью, в том числе с множественной лекарственной устойчивостью (МЛУ, или MDR) составляет одну из серьезнейших проблем современного здравоохранения. Определение лекарственной устойчивости туберкулеза с помощью молекулярно-биологических методов всё шире применяется ввиду высокой скорости получения результатов (1-2 дня), что становится возможным благодаря использованию не только первичной культуры, но и непосредственно клинического материала.
Важно понимать, что наборы реагентов, основанные на разных молекулярно-биологических методах, характеризуются разными показателями диагностической чувствительности и специфичности.
| Наименование набора реагентов | АмплиСенс® MTC-Rif-Seq | АмплиСенс® MTC-PZA-Seq |
| Исследуемый ген | rpo B | pnc A |
| Препараты, к которым определяется устойчивость | рифампицин | пиразинамид |
| Кол-во выявляемых мутаций | более 200 | более 500 |
Наборы включают реагенты для амплификации фрагментов ДНК микобактерий туберкулеза, очистки продуктов амплификации (сорбентным методом), определения концентрации очищенного продукта амплификации и праймеры для секвенирования. Наборы для экстракции ДНК (АмплиПрайм РИБО-преп или ДНК-сорб-С ) и реагенты для проведения реакции секвенирования приобретаются отдельно.

Нормативные документы, публикации, информационные материалы >>
Аннотация научной статьи по биотехнологиям в медицине, автор научной работы — Капустин Д. В., Простякова А. И., Алексеев Я. И., Варламов Д. А., Зубов В. П.
Сравнили эффективность выделения ДНК Mycobacterium tuberculosis complex из лизированных образцов мокроты двумя способами с помощью спин-картриджей, содержащих сорбент на основе кремнезема, модифицированного фторопластом и полианилином , и с помощью автоматической системы выделения. Показано, что при одностадийном выделении с использованием сорбента существенно снижаются потери ДНК и обеспечивается большая чувствительность выявления ДНК M. tuberculosis complex по сравнению с системой, основанной на сорбции и десорбции нуклеиновых кислот в ходе выделения.
Похожие темы научных работ по биотехнологиям в медицине , автор научной работы — Капустин Д. В., Простякова А. И., Алексеев Я. И., Варламов Д. А., Зубов В. П.
Высокоэффективный метод одностадийного выделения ДНК для ПЦР-диагностики Mycobacterium tuberculosis
Д. В. Капустин1*, А. И. Простякова1, Я. И. Алексеев2,3, Д. А. Варламов2,3, В. П. Зубов1,
3Всероссийский научно-исследовательский институт сельскохозяйственной биотехнологии
РАСХ, 127550, Москва, ул. Тимирязевская, 42
Поступила в редакцию 09.10.2013
После доработки 14.03.2014
РЕФЕРАТ Сравнили эффективность выделения ДНК Mycobacterium tuberculosis complex из лизированных образцов мокроты двумя способами с помощью спин-картриджей, содержащих сорбент на основе кремнезема, модифицированного фторопластом и полианилином, и с помощью автоматической системы выделения. Показано, что при одностадийном выделении с использованием сорбента существенно снижаются потери ДНК и обеспечивается большая чувствительность выявления ДНК M. tuberculosis complex по сравнению с системой, основанной на сорбции и десорбции нуклеиновых кислот в ходе выделения.
КЛЮЧЕВЫЕ СЛОВА выделение ДНК, композиционные сорбенты, Mycobacterium tuberculosis complex, полианилин, ПЦР -диагностика, фторполимеры.
Очищенные препараты нуклеиновых кислот, выделенные из различных биологических источников, все шире применяются в биомедицинских исследованиях (например, при секвенировании, в качестве иммуномодулирующих агентов или противоопухолевых препаратов, при конструировании средств доставки лекарств и т.д.), особенно в биоанализе и медицинской диагностике, во многом благодаря успешному развитию ПЦР-технологии. Эффективность методов подготовки пробы зависит от разработки быстрых и воспроизводимых способов выделения ДНК, непосредственно пригодной для ПЦР-диагностики. Описаны различные методы выделения нуклеиновых кислот, доступны коммерческие наборы, которые соответствуют задаче выделения и используются как при решении исследовательских задач, так и в клинической практике. Впервые применять частицы кремнезема для сорбции ДНК в присутствии хаотропной соли предложили еще в 1979 г. [1], в 1990 г. этот метод был усовершенствован [2], и его различные варианты используются по сей день. Ши-
рокое распространение получили методы выделения нуклеиновых кислот с использованием магнитных частиц на основе кремнезема [3], волокон, модифицированных кремнеземными частицами [4], аффинных кремнеземных частиц [5] и т.д.
Очевидно, что более привлекательной и перспективной является одностадийная схема выделения. В этом случае выделяемый (и одновременно очищаемый) биополимер проходит через слой сорбента, не удерживаясь на его поверхности, в то время как мешающие ПЦР примеси эффективно удерживаются сорбентом. Несколько лет назад мы разработали одностадийную процедуру выделения ДНК, основанную на использовании уникальных сорбционных свойств некоторых полимеров, а именно фторполи-меров (ФП) [6] и полианилина (ПАНИ) [7, 8]. Покрытия из таких полимеров, например, сформированные на поверхности пористого кремнезема, не удерживают ДНК, но адсорбируют белки и ингибирующие ПЦР компоненты, присутствующие в типичных биологических образцах (бактериальные или растительные лизаты, мазки, плазма, кровь и т.д.).
В этой связи особый интерес представляют материалы, модифицированные нанослоями фторпо-лимера и ПАНИ одновременно. Ранее мы докладывали об успешном применении такого материала для одностадийного выделения преимущественно двухцепочечной ДНК вируса гепатита В человека и одноцепочечной ДНК вируса TTV (Transfusion transmitted virus, Torque teno virus - вирус, передающийся при переливании крови), пригодных для ПЦР-анализа, из образцов плазмы крови человека [11]. Однако до сих пор применимость таких сорбентов для экспресс-выделения ДНК патогенов человека невирусной природы из клинических образцов изучена недостаточно. В настоящей статье рассмотрено применение кремнеземного сорбента, модифицированного комбинацией нанослоев фторопласта ФП и ПАНИ,
Кремнезем Si-500 (100 г) вакуумировали в специальном реакторе в течение 30-40 мин, затем к носителю добавляли 500 мл 0.016% раствора ФП в ацетоне. Реактор, содержащий суспензию частиц кремнезема, инкубировали в ультразвуковой ванне при атмос-
ферном давлении в течение 15 мин. Затем растворитель удаляли на роторном испарителе при 40-45°C. В реактор вводили вторую порцию раствора полимера в ацетоне (500 мл) и повторяли манипуляции, следующие за введением первой порции раствора полимера. Полученный продукт сушили в вакууме до постоянного веса и использовали в качестве носителя при проведении окислительной полимеризации анилина как описано в [11].
Протокол выделения микобактериальной ДНК с помощью картриджей, содержащих ФП-ПАНИ-сорбент
Инактивация. В экспериментах использовали модельные и клинические образцы мокроты. Для инактивации модельных образцов к 500 мкл мокроты, содержащей 600 КОЕ МТК/мл (в частности, M. tuberculosis, M. bovis, M. bovis BCG и др.), добавляли 500 мкл инактивирующего реагента А. Все клинические образцы также предварительно инактивировали. Для этого к образцам мокроты, отобранным в 50-мл пробирки, добавляли инактивирующий реагент А до конечного объема 40 мл. Содержимое пробирки перемешивали, плавно переворачивая, до полной гомогенизации, а затем выдерживали в течение 30 мин. Пробирки центрифугировали (15 мин при 3500 об/мин). Супернатант сливали, осадок ре-суспендировали и переносили в пробирки объемом 1.5 мл.
Очистка ДНК. В пробирки с образцами вносили по 400 мкл разбавителя, перемешивали, плавно пи-петируя, содержимое наносили на картриджи с сорбентом, вставленные в пробирки-приемники. Центрифугировали в течение 1 мин при 4000 об/мин. Картриджи удаляли из приемников.
ских фрагментов ДНК гена IS6110, который присутствует во множестве копий в большинстве штаммов МТК, но при этом может отсутствовать в геноме M. tuberculosis. Одновременно метод позволяет определять количество специфического фрагмента ДНК regX, представленного в геноме МТК одной копией.
Условия проведения ПЦР с применением выделенных ДНК были идентичными.
результаты И ОБСУЖДЕНИЕ
Секвенирование экзома
Для чего проводят ДНК-тесты
Анализ ДНК используется для решения большого числа задач, которые связаны не только с идентификацией личности. Ниже приведены наиболее распространенные виды генетического тестирования, которые основываются на анализе ДНК.
- Скрининг новорожденных. В роддоме на 4-е сутки проводится первое в жизни генетическое тестирование. Тест на ДНК нужен для выявления генетических расстройств, которые могут проявиться на первых порах жизни и которые можно скорректировать при своевременном выявлении. Пяточную кровь малыша проверяют на 5 распространенных состояний: муковисцидоз, адреногенитальный синдром, гипотиреоз, фенилкетонурия, галактоземия.
- Диагностическое тестирование. Исследования этого рода позволяют идентифицировать болезнь со 100-процентной точностью. Тестирование ДНК проводится в том случае, когда выставлен предварительный диагноз на основании признаков и симптомов. Анализ ДНК лишь подтверждает генетическую природу заболевания.
- Предиктивные генетические тесты, или анализ предрасположенностей. Нередко врачи рекомендуют сдать тест ДНК здоровым людям с профилактической целью. Такие меры необходимы для поиска изменений в генетическом аппарате, которые повышают вероятность того или иного заболевания. Результаты говорят только о риске развития конкретного заболевания. Например, онкориски, склонность к тромбозам или избыточному накоплению железа (гемохроматоз) и т. д. Положительный результат на предрасположенность к заболеванию может служить основой для составления рекомендаций по профилактике состояний в будущем, что требует от пациента более внимательного отношения к своему здоровью. Это самый распространенный вид анализа ДНК в лаборатории ДНКОМ.
- Генетическое тестирование для людей, у которых уже есть семейная история наследственного заболевания или принадлежащих к определенным этническим группам. Особую значимость предиктивные генетические тесты имеют в группах людей с семейной историей заболевания. Люди, которые несут изменения в генах, связанные с болезнью, могут не проявлять признаков заболевания, однако способны передать генное изменение своим детям. ДНК-тесты рекомендованы всем людям, у которых один или несколько родственников ближайшей линии родства страдали состоянием, для которого четко доказана связь генетики.
- Прегравидарная подготовка, или планирование беременности. Прегравидарную подготовку могут пройти все пары, планирующие беременность. Порой такой тип анализа ДНК помогает выявить носительство мутаций, которые могут быть переданы будущему поколению. Родителям, которые оба являются носителями мутантных генов, необходимо проходить медико-генетическое консультирование на предмет здоровья будущих детей и выполнять преимплантационное тестирование.
- Преимплантационное тестирование. Это метод ПГД (преимплантационная генетическая диагностика). Используется для обнаружения генетических изменений эмбрионов, которые были созданы с использованием методов вспомогательных репродуктивных технологий.
- Пренатальное тестирование. Демонстрирует изменения в генах или хромосомах плода до рождения. Этот тип тестов ДНК выполняется во время беременности, если существует повышенный риск генетического или хромосомного расстройства. Анализ ДНК может выполняться по крови матери, что является более безопасным: другие требуют забора пуповинной крови, околоплодных вод или ткани плаценты. Результат пренатального тестирования помогает уменьшить волнение пары и позволяет принять решение о текущей беременности. Данный анализ на ДНК не способен идентифицировать все возможные наследственные нарушения и врожденные дефекты, только лишь наиболее часто встречающиеся.
- Судебно-медицинское тестирование. Анализ ДНК проводится для идентификации человека в юридических целях. Этот тип тестирования может идентифицировать жертв преступлений и катастроф, исключать или предполагать подозреваемого в совершении преступления, устанавливать биологические родство между людьми (например, отцовство, материнство и прочее).
В отдельной стороне стоит группа методов диагностики, где анализ ДНК применяется с целью идентификации возбудителей заболеваний. Это молекулярно-биологические методы, и в частности ПЦР-анализ. ДНК микроорганизмов отличаются друг от друга. Анализ позволяет определить присутствие генетического материала сразу нескольких возбудителей в образце. Такое исследование проводится с целью этиологической диагностики бактериальных или вирусных инфекций с широким спектром симптомов, в том числе неспецифических, при подозрении на определенное заболевание.
Существует несколько смежных с медициной областей, где анализ ДНК нашел свое применение.
Нутригеномический анализ. Благодаря нутригеномике удалось установить связь между питанием и генетическими особенностями организма. Целью исследования является создание подходящего рациона для оптимизации генетического профиля. Показанием к анализу служит коррекция веса, наличие неврологических заболеваний, аутизм и прочие состояния.
Исследование в области спортивной генетики. Физические способности человека заложены на уровне ДНК. На основании анализа можно выявить предрасположенность к определенным видам спорта и определить оптимальную нагрузку без вреда для здоровья. Анализ, в частности, позволяет родителям сделать выбор в пользу той или иной секции для ребенка.
Формирование генетического паспорта. Данный медицинский документ представляет собой полную базу данных генома. Проводится анализ с целью создания индивидуальной базы ДНК, которая отражает уникальные особенности организма, предрасположенности к заболеваниям и прочее. Генетический паспорт достаточно пройти один раз в жизни.
Как выполняют тест на ДНК
Процесс анализа ДНК начинается с выделения и очистки ДНК из биологического образца. ДНК может быть идентифицирована в нескольких типах образцов и извлечена с использованием ряда методов. Выбранный метод часто зависит от матрицы образца, количества ДНК и целей тестирования.
Общий алгоритм тестирования ДНК выглядит следующим образом.
Сбор генетического материала. В качестве образца для генетических тестов чаще всего используется образец крови. Пренатальные тесты ДНК, могут требовать забора более сложного биологического материала, который осуществляет врач. При проведении тестов по определению биологического родства используются клетки буккального эпителия, которые получают путем соскоба со слизистой оболочки щеки. Процедура довольно проста, безопасна и не занимает много времени. Материалом для анализа ДНК также могут служить образцы слюны, волос, ногтей, эякулята и т. д.
Выделение ДНК. Непосредственно в лаборатории регистратор вносит в базу данных информацию об образце и типе заказанного теста. После чего генетический материал отправляется в отдел лаборатории, где будет проводиться подготовка ДНК и анализ. После начинается сам процесс выделения ДНК. Процесс сопровождается обработкой реактивами, температурным и механическим воздействием, в ходе которых ДНК отделяется от примесей. Теперь ее можно непосредственного анализировать.
Анализ. На данном этапе образец помещают в генетический анализатор для выявления уникальных участков ДНК-маркеров. По ним врачи-генетики в дальнейшем могут сделать выводы.
Выдача результата. Специализированные данные анализа интерпретируются для удобства восприятия. Они могут быть представлены в виде графиков, диаграмм и таблиц. Оформленное печатью лаборатории и подписью генетика заключение может быть выдано на руки или получено в электронной форме.
Читайте также:


