Патогенез и патоморфология туберкулеза
Вторичный, реинфекционный, туберкулез развивается в организме взрослого человека, перенесшего ранее первичную инфекцию, которая не оградила от возможности повторного заболевания.
В настоящее время в возникновении вторичного туберкулеза большинство исследователей отдает предпочтение теории эндогенного заражения (из первичных очагов).
Для вторичного туберкулеза характерны:
При вторичном туберкулезе инфекция распространяется преимущественно интраканаликулярным или контактным путем, по бронхам, желудочно-кишечному тракту. Гематогенная генерализация не характерна, но возможна в терминальном периоде болезни.
Патоморфология. Выделено 8 форм (фаз) вторичного туберкулеза:
Острый очаговый туберкулез начинается со специфического воспаления внутридолькового бронха. В прилежащей легочной паренхиме развивается ацинозная или дольковая казеозная бронхопневмония. Вокруг очага воспаления формируется вал эпителиоидных, лимфоидных и гигантских клеток Пирогова-Лангханса. Такие очаги получили название очагов реинфекта Абрикосова. Они встречаются в количестве 1-2, располагаются в I и II сегментах правого, или реже левого легкого. В большинстве случаев процесс самостоятельно затихает, экссудативная тканевая реакция сменяется продуктивной тканевой реакцией, очаги казеозного некроза инкапсулируются и петрифицируются.
Фиброзно-очаговый туберкулез развивается после заживления очагов Абрикосова, на месте которых появляются крупные инкапсулированные и частично петрифицированные очаги, описанные немецкими учеными Л. Ашоффом и Х. Пулем (ашофф-пулевские очаги). Процесс остается односторонним, не выходит за пределы I и II сегментов. При этой форме сохраняется склонность к обострению туберкулеза.
Инфильтративный туберкулез является результатом прогрессирования острого очагового или обострения фиброзно-очагового туберкулеза. Его отличает явное преобладание перифокальных экссудативных изменений над казеозными. Очаги воспаления занимают дольку и даже сегмент и долю. Такой очаг называют очагом-инфильтратом Ассманна-Редекера (по имени ученых, впервые описавших его рентгенологическую картину). При благоприятном исходе перифокальное воспаление редуцируется, и процесс переходит в фиброзно-очаговую форму туберкулеза или туберкулему.
Туберкулема – округлый инкапсулированный очаг творожистого некроза диаметром более 1 см. Туберкулема расположена в I или II сегменте, чаще справа, достигает 5 см в диаметре. Может быть единичной или в виде конгломерата из нескольких очагов. При рентгенологическом обследовании её следует дифференцировать с опухолью (рак легкого или метастаз).
Казеозная пневмония чаще развивается в результате прогрессирования инфильтративного туберкулеза. Казеознопневмонические очаги занимают ацинус, дольку, сегмент или всю долю. Казеозная пневмония клинически протекает крайне тяжело, может завершать терминальный период любой формы туберкулеза. Часть легкого, вовлеченная в казеозную пневмонию, увеличена, уплотнена, на разрезе желто-серого цвета, с фибринозными наложениями на плевре.
Кавернозный туберкулез характеризуется образованием полости распада, а затем каверны на месте очага-инфильтрата или туберкулемы. Полость распада появляется при гнойном расплавлении казеозных масс, которые вместе с мокротой дренируются наружу через бронх. Это сопровождается выделением микобактерий в окружающую среду и создает условия для бронхогенного инфицирования легких. Обычно каверна локализуется в I или II сегменте, имеет овальную или округлую форму, диаметром 2-5 см. Стенка каверны изнутри покрыта казеозными массами, снаружи представлена уплотненной в результате воспаления легочной тканью.
Фиброзно-кавернозный туберкулез представляет собой хроническую форму кавернозного туберкулеза. Стенка каверны утолщена, уплотнена, с неровной поверхностью, имеет три слоя:
Каверна имеет неправильную форму, может быть многокамерной и занимать несколько сегментов, выходя за пределы одной доли. Вокруг каверны определяются очаги ателектаза, пневмосклероза, эмфиземы, бронхоэктазы. При обострении заболевания появляются участки инфильтрации и казеоза. Поскольку процесс распространяется сверху вниз, более старые изменения наблюдаются в верхних отделах, а свежие – в нижних легких.
Цирротический туберкулез рассматривается как следствие фиброзно-кавернозного туберкулеза, с массивным пневмосклерозом, рубцовыми изменениями, плевральными спайками, деформацией легких.
Патогенез.Туберкулез наиболее часто поражает легкие — основные входные ворота инфекции. Заражение (инфицирование) туберкулезом чаще всего происходит через дыхательные пути (аспирационный путь) при контакте с заразным больным, который при кашле выделяет во внешнюю среду капельки мокроты, содержащие МБТ. Причем только менее 10% этих частиц размером менее 5 мкм попадают в альвеолы и вызывают туберкулезное воспаление. Подавляющее большинство остальных более крупных частиц оседают на слизистой оболочке полости рта и верхних дыхательных путей и удаляются оттуда благодаря функции мукоциллиарного клиренса.
Инфицирование туберкулезом реже возникает при энтеральном попадании МБТ (при употреблении продуктов питания от больных туберкулезом животных).
Для инфицирования и развития заболевания туберкулезом основное значение имеют:
• массивность инфекции, доза и длительность поступления МБТ в организм человека;
• состояние естественной реактивности и факторов защиты организма в период воздействия инфекционного агента.
Механизмы защиты бронхолегочной системы действуют на уровне проводящих и респираторных отделов и осуществляются за счет конденсирования воздуха, механической очистки, фагоцитоза клетками неспецифической защиты и местного иммунитета.
Неповрежденная слизистая полости рта, носоглотки и верхних дыхательных путей — непроницаемый барьер для МБТ. Здесь осуществляется механическая очистка воздуха за счет фильтрации и осаждения инородных частиц, удаления их вследствие чихания и кашля. Наиболее значимая часть механической очистки — мукоцилиарный клиренсна уровне бронхов и бронхиол. Клиренс обеспечивается секретом, содержащим лизоцим, протеазы, сурфактант, иммуноглобулин A (IgA), который обволакивает (опсонизирует) МВТ и движением ресничек реснитчатого эпителия выводит их из организма.
Нарушение целостности слизистой полости рта и носоглотки, кариозные зубы, афтозные стоматиты, парадонтоз, синуситы, хронические тонзиллиты, а также периоды возрастной смены зубов у детей могут являться входными воротами для туберкулезной инфекции.
В трахее и крупных бронхах МВТ, как правило, не задерживаются и оседают в нижних дыхательных путях и альвеолах, где они фагоцитируются нейтрофилами и альвеолярными макрофагами. При этом фагоцитоз — единственный естественный механизм уничтожения МВТ в организме человека.
Локальные изменения в месте внедрения МВТ обусловлены прежде всего неспецифической реакцией нейтрофильных лейкоцитов, которые фагоцитируют, но не разрушают возбудитель (рис. 3.1).
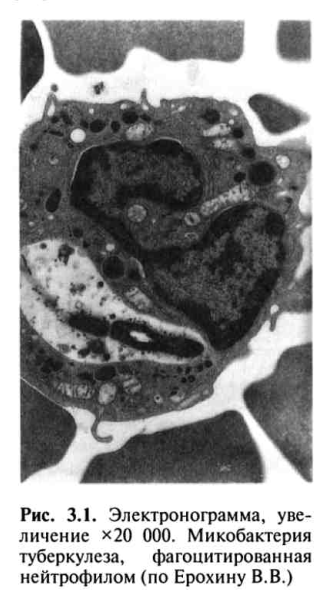
Под влиянием токсинов МВТ нейтрофилы разрушаются, вызывая воспалительную реакцию, которая сменяется более совершенной защитной реакцией с участием альвеолярных макрофагов, также осуществляющих неспецифический фагоцитоз возбудителя (рис. 3.2, см. цветную вклейку). От активности фагоцитоза во многом зависит эффективность всей системы противотуберкулезной защиты организма.
Однако при туберкулезе макрофаги самостоятельно уничтожить МВТ не могут. Необходимо активирующее воздействие на них сенсибилизированных Т-лимфоцитов, в частности субпопуляции Т-хелперов (CD4+ лимфоцитов).
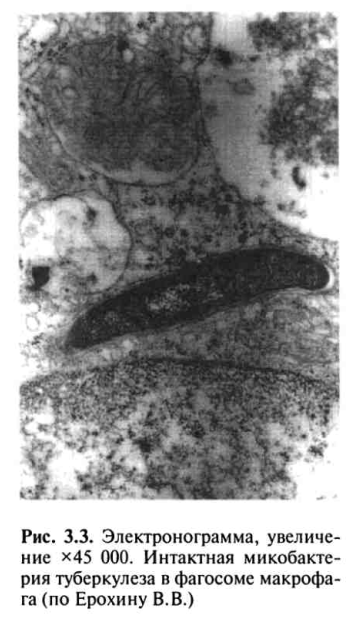
На слизистой альвеол МВТ опсонизируются иммуноглобулином М (IgM), и этот комплекс связывается с Fs-рецептором, расположенным на поверхности макрофага для распознавания чужеродных микроорганизмов. Затем МВТ погружаются (инвагинируют) в цитоплазму клетки с образованием фагосомы, которая сливается с лизосомой с образованием фагосомо-лизосомного комплекса.
Лизосомы представляют весьма сложный комплекс органелл, содержащих большое число протеолитических ферментов, способных разрушать самые различные макромолекулы. Оптимальные условия для функционирования этих ферментных систем обеспечиваются благодаря слабой кислотности среды внутри лизосом (pH около 5).
Однако МВТ, попадая в макрофаги, могут сохраняться в фагосомах и даже продолжать размножение. При этом не происходит слияния фагосомы с лизосомой и неспецифический фагоцитоз носит незавершенный характер.
Механизмы, способствующие незавершенному фагоцитозу, до конца не установлены, но имеются данные, что в процессе размножении МВТ могут продуцировать аммиак и корд-фактор (фактор вирулентности).
Аммиак, с одной стороны, способен ингибировать слияние фаго-сомы с лизосомой, а с другой — путем защелачивания содержимого лизосомы снижать его ферментативную активность. Корд-фактор разрушительно действует на энергетический метаболизм макрофагов, вызывая поражение митохондрий и нарушение синтеза АТФ, что ведет к клеточной дистрофии и гибели клеток и в то же время тормозит синтез лизосомальных ферментов, что предохраняет МВТ от разрушения и повышает внутриклеточную выживаемость возбудителя, защищая его от механизмов лизиса в макрофаге (рис. 3.3).
В случаях блокирования процесса переваривания МВТ происходят разрушение макрофагов и выход МВТ из поглотивших их клеток, которые в свою очередь вновь фагоцитируются другими макрофагами. Незавершенный фагоцитоз макрофагами МВТ играет двоякую роль, обеспечивая не только защиту от туберкулеза, но и создавая благоприятные условия для выживания МВТ.
Иммунопатогенез. В процессе фагоцитоза макрофаги синтезируют биологически активные вещества (цитокины) (см. рис. 3.2, см. цветную вклейку):
• фактор некроза опухоли альфа (TNF-α) — вызывает воспаление, тормозит размножение МВТ, усиливает миграцию и активирует новые макрофаги, поступающие из кровеносных сосудов;
• интерлейкин-1 (ИЛ-1) — привлекает и активирует Т-лимфоциты-хелперы (CD4+ лимфоциты), поступающие из кровеносных сосудов.
При этом основная роль в развитии противотуберкулезного иммунитета отводится субпопуляции Т-лимфоцитов-хелперов или CD4+ лимфоцитам.
Координация взаимодействия между макрофагами и CD4+ лимфоцитами рассматривается как центральное звено в формировании противотуберкулезного иммунитета. При этом макрофаги представляют собственно эффекторы, а CD4+ лимфоциты выполняют функцию индукторов ГЗТ.
Развитие первичного и вторичного Т-клеточного иммунного ответа при туберкулезе представлено на рис. 3.4, см. цветную вклейку.
Первичный Т-клеточный иммунный ответ развивается при первичном заражении. При этом поступающие из капилляров периферической крови CD4+ лимфоциты вступают в контакт с макрофагами и получают информацию о фагоцитированных МВТ.
CD4+ лимфоциты (Т-хелперы) активируются и синтезируют цитокины:
• интерлейкин-2 (ИЛ-2) специфически активирует новые макрофаги, поступившие из крови, в отношении МВТ;
• интерферон-гамма (IF-ϒ) усиливает специфический фагоцитоз макрофагами МВТ.
При первичном заражении инфекционный иммунитет развивается через 2-3 нед после первичного инфицирования, а достаточно выраженный иммунитет формируется через 6—8 нед.
Точные механизмы, с помощью которых уничтожаются МБТ, еще полностью не установлены. Тем не менее уже хорошо известны антимикобактериальные функции активированных макрофагов:
• качественное образование фагосомо-лизосомных комплексов;
• генерация реактивных продуктов кислорода (O2) при кислородном взрыве и образование перекиси водорода (Н3O3) в фагосомо-лизосомных комплексах под влиянием IF-ϒ;
• генерация реактивных продуктов азота (N) и образование оксида азота (NO) по L-аргинин-зависимому цитотоксическому пути в фагосомо-лизосомных комплексах под влиянием IF-ϒ и с помощью TNF-α.
Таким образом, фагоцитоз МБТ становится завершенным, а уничтожение МБТ активированными макрофагами возрастает в 100-1000 раз (рис. 3.5).
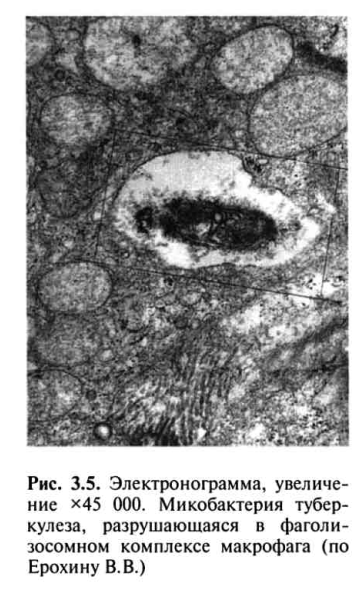
Вторичный Т-клеточный иммунный ответ развивается в иммунном организме при повторном заражении МБТ в течение 24-72 ч. Это связано с циркуляцией в крови специфически активированных CD4+ лимфоцитов памяти, которые тут же мигрируют в ткани органа, куда проникли МБТ, и с помощью цитокинов (ИЛ-2 и IF-ϒ) активируют антимикобактериальные функции макрофагов по уничтожению МБТ.
Морфологический эквивалент формирования защитных иммунных клеточных механизмов организма против туберкулезной инфекции — специфическая гранулема. В гранулеме имеются 3 вида морфологических элементов (рис. 3.6, см. цветную вклейку):
• центр гранулемы представлен казеозным некрозом ткани, который создает неблагоприятные условия для роста МБТ из-за снижения парциального давления кислорода (рО2);
• казеозный некроз окружен макрофагами и лимфоцитами;
• по периферии гранулемы располагаются нейтрофильные лейкоциты.
В некоторых туберкулезных гранулемах по периферии формируются эпителиоидные клетки и гигантские многоядерные клетки Пирогова-Лангханса — несколько слившихся малоактивных макрофагов, являющихся хранилищем МВТ, которые не в состоянии уничтожить своих внутриклеточных паразитов (рис. 3.7, см. цветную вклейку).
По мере формирования противотуберкулезного иммунитета происходит заживление гранулемы, которое начинается с обезвоживания и уплотнения казеозных масс с отложением солей кальция. По периферии гранулемы увеличивается количество фибробластов и фибрилл коллагена, образуется соединительнотканная капсула. В последующем в течение 5-10 лет гранулема полностью замещается соединительной тканью с солями кальция, формируется фиброзный или кальцинированный очаг (рис. 3.8, см. цветную вклейку).
Развитие специфического иммунитета и формирование фиброзных и кальцинированных очагов при первичном туберкулезе не в состоянии полностью уничтожить МВТ. Полное устранение возбудителя при туберкулезе не достигается даже при хорошо скоординированном взаимодействии макрофагов и CD4+ лимфоцитов, в результате чего организм остается инфицирован, хотя активный патологический процесс развивается далеко не во всех случаях. В фиброзных и кальцинированных очагах МВТ трансформируются в L-формы, которые поддерживают иммунитет. Однако любое нарушение иммунного баланса в последующие годы в сторону развития иммунодефицита создает условия для реактивации туберкулеза и развития клинически выраженных форм заболевания.
В развитии туберкулеза можно проследить 3 основных патогенетических варианта течения туберкулеза, когда клеточные реакции организма на внедрение МВТ носят четко разграниченные иммунологические, морфологические и клинические проявления (рис. 3.9).
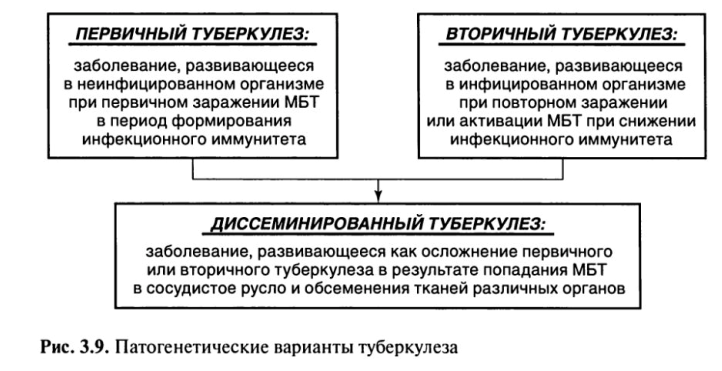
• Вариант течения туберкулеза, связанный с реакцией организма на первичное экзогенное заражение, определяется как первичный туберкулез.
• Вариант течения туберкулеза, связанный с реакцией организма на вторичное заражение (экзогенная суперинфекция) или реактивацию уже заживших постпервичных изменений (эндогенная инфекция), рассматривается как вторичный туберкулез.
• При обоих вариантах течения болезни возможно осложнение, связанное с проникновением МБТ в лимфатические и кровеносные сосуды и обсеменением тканей различных органов, определяемое как диссеминированный туберкулез.
При первичном туберкулезе(рис. 3.10) в зависимости от места входных ворот первичного внедрения МБТ воспалительный очаг (первичный очаг) может образоваться в полости рта, миндалинах, легких, кишечнике — первичный аффект.
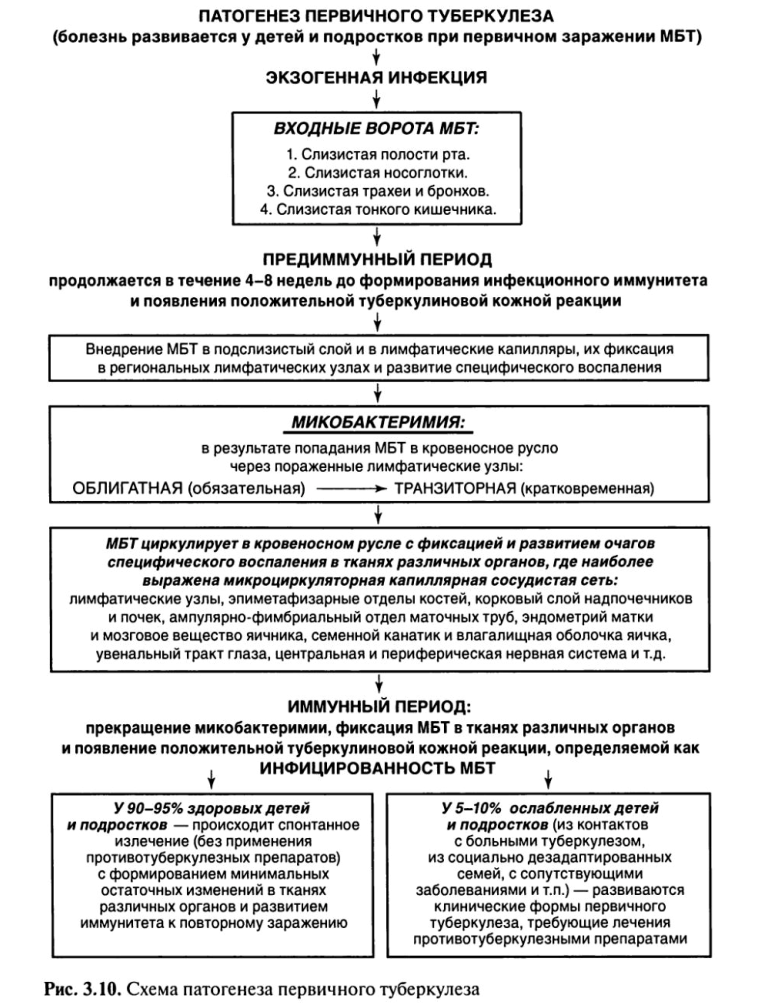
Некоторая часть МБТ остается на месте проникновения, другая с током лимфы и крови переносится к месту внедрения — в региональные лимфатические узлы. В зависимости от локализации входных ворот инфекции могут поражаться подчелюстные, шейные, над- и подключичные, подмышечные, внутригрудные и другие региональные лимфатические узлы.
Последующее размножение МБТ происходит как в легких, так и в лимфатических узлах, и организм реагирует образованием специфической гранулемы.
МБТ, продолжая размножаться, разносятся по организму с током крови и лимфы, возникает так называемая первичная, или облигатная (обязательная), микобактеримия. МБТ оседают и фиксируются в тканях различных органов, где наиболее выражена микроциркуляторная капиллярная сеть (капилляры лимфатических узлов, клубочков коркового слоя почек, эпиметафизарных отделов трубчатых костей, ампулярно-фимбриального отдела маточной трубы, увеального тракта глаз).
Таким образом, с момента первичного заражения туберкулезная инфекция носит генерализованный и системный характер, дающий в последующем возможность развития внелегочных форм туберкулеза.
Первичный туберкулез у 90—95% впервые инфицированных лиц протекает без клинических проявлений, и о наступившем заражении свидетельствует только переход отрицательной туберкулиновой реакции в положительную — вираж туберкулиновых проб. Он может также завершиться спонтанным излечением (без применения противотуберкулезных препаратов) с минимальными (малыми) фиброзными или кальцинированными остаточными специфическими изменениями в легких, внутригрудных лимфатических узлах и тканях других органов.
Только у 5—10% впервые инфицированных лиц развиваются клинические формы туберкулеза с выраженными клиническими проявлениями, что требует лечения противотуберкулезными препаратами. При излечении формируются выраженные остаточные изменения в легких (кальцинированные очаги Гона и Симона), лимфатических узлах (петрификаты или кальцинаты) и тканях других органов.
Отсутствие клинических проявлений первичной туберкулезной инфекции может быть объяснено высоким уровнем естественной резистентности организма человека к туберкулезу, а также приобретенным в результате вакцинации БЦЖ искусственным иммунитетом.
Первичное заражение МБТ, возникающее на фоне послевакцинного иммунитета у вакцинированного вакциной БЦЖ ребенка, происходит по типу вторичного Т-клеточного иммунного ответа и развивается в течение 24—72 ч. Это происходит за счет специфически активированных CD4+ лимфоцитов памяти, которые сразу мигрируют в зону внедрения МБТ и активируют антимикобактериальные функции макрофагов. При этом отсутствуют поражение региональных лимфатических узлов, микобактеримия и развитие очагов в тканях различных органов.
Длительность поствакцинного иммунитета определяется специфически активированными CD4+ лимфоцитами памяти, которые циркулируют в крови в течение 5—6 лет, активируя макрофаги при повторных случаях заражения МБТ. В связи с этим для поддержания поствакцинного иммунитета на достаточно высоком уровне необходимы повторные ревакцинации детей и подростков в возрасте 6—7 и 13-14 лет.
Необходимое условие для развития вторичного туберкулеза — снижение естественной резистентности и специфического иммунитета под влиянием неблагоприятных внешних и внутренних факторов. К таким факторам относят социально-экономическое неблагополучие, социальные стрессы и войны, неблагоприятную экологию, недостаточность питания, сопутствующие заболевания, в том числе алкоголизм, наркоманию, ВИЧ-инфекцию и др. При этом, как правило, у больных вторичным туберкулезом развиваются клинические проявления болезни и практически отсутствует тенденция к спонтанному излечению, что характерно для первичного туберкулеза (рис. 3.11).

Вторичный туберкулез развивается в результате экзогенной суперинфекции (новое заражение) и эндогенной реактивации при обострении остаточных посттуберкулезных изменений различных форм первичного туберкулеза.
Противотуберкулезное лечение может полностью привести к клиническому излечению, однако его отсутствие ведет к летальному исходу. При этом важное значение имеют состояние защитных механизмов макроорганизма, способность противостоять действию возбудителя, развитие полноценных репаративных процессов.
Необходимое условие для развития диссеминированного туберкулеза — выраженный иммунодефицит (рис. 3.12).
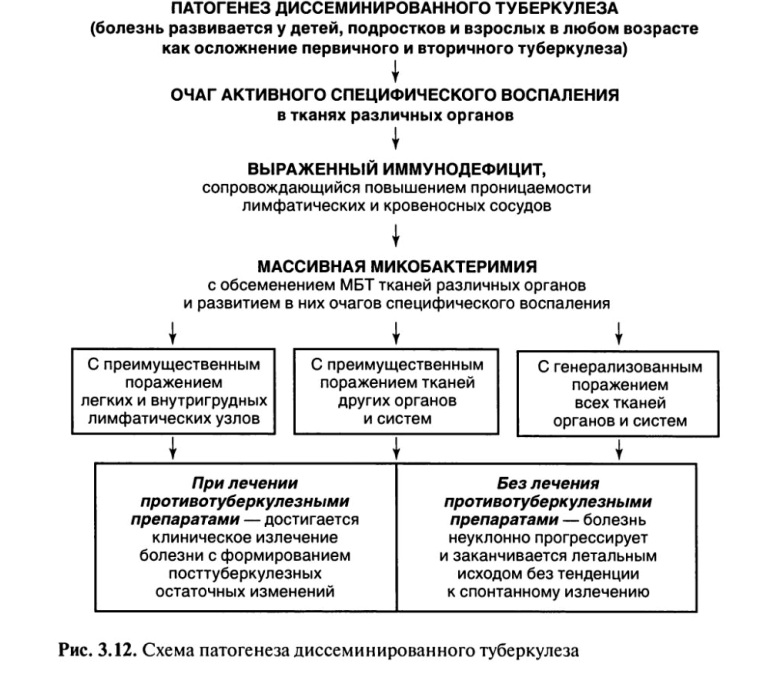
В этих случаях туберкулез развивается при осложненном течении первичного или вторичного туберкулеза, когда из очага специфического воспаления МВТ попадают в кровеносное русло и обсеменяют ткани различных органов с развитием в них очагов туберкулезного воспаления. Течение болезни сопровождается выраженными клиническими проявлениями и высокой вероятностью летального исхода.
| | | следующая лекция ==> | |
| Антигенная структура | | | Патоморфология туберкулеза |
Дата добавления: 2019-10-17 ; просмотров: 1283 ; ЗАКАЗАТЬ НАПИСАНИЕ РАБОТЫ
Характерные особенности патогенеза и патологической морфологии туберкулеза определяются древностью этой инфекции, хроническим течением и волнообразным проявлением клинико-анатомических форм.
На древность паразитарных отношений возбудителя туберкулеза с животным миром указывают не только археологические находки туберкулезных изменений в костных останках животных, но чрезвычайно широкий ареол восприимчивых животных (млекопитающие, птицы, хладнокровные им др.), наличие разных видов туберкулезного возбудителя приспособившихся к разным видам животных и разнообразие его морфологических форм (фильтрующаяся, зернистая, ветвистая, бактериальная и др.).
Наконец, об этом свидетельствует и типичная реакция организма животного на внедрение возбудителя в виде своеобразной гранулы (туберкула). Хроническое течение туберкулеза, длящегося у некоторых животных многие годы и десятилетия, во время которых изменяются внешние условия и внутреннее состояние организма, определяет значительную смену клинико - морфологических форм. В частности, способность возбудителя туберкулеза долгое время сохраняться в организме обуславливает появление скрытых (латентных) форм течения болезни, длительность аллергии и неспецифического иммунитета, что выражается волнообразным проявлением патологического процесса.
Самый характерный патоморфологический признак туберкулеза - очаговое воспаление - туберкул (бугорок), который дал название не только болезни - туберкулезу (бугорчатке), но и возбудителю - Mycobacterium tuberculosis.
В классической форме форм туберкул имеет типичное строение: в центре его располагается некротический очаг, нередко с отложением извести, а по его периферии - грануляционная ткань, состоящая из двух зон (поясов): зоны эпителиоидных и гигантских клеток и зоны лимфоидных клеток.
А) Гистогенез.
Туберкулезный возбудитель, попадая в организм через любые ворота инфекции, мигрирует по лимфатическим и кровеносным сосудам как посторонняя частица до тех пор, пока не задержится в том или ином капилляре. На основании электронно-микроскопических и гистохимических методов исследований в доочаговый период различают две стадии туберкулезного воспаления: интерстициальную, характеризующуюся изменениями в интерстиции и моноклеарную, выражающуюся скоплением моноцитов, лимфоидных элементов, размножением макрофагов.
Экзотоксины бактерий вызывают раздражение, а затем и повреждение ткани, эмиграцию нейтрофильных лейкоцитов, размножение макрофагов. На смену гибнущим нейтрофилам появляются лимфоидные клетки. Лизосомные ферменты фагоцитов усиливают альтернативную фазу воспаления, в частности, разрушаются капилляры в очаге воспаления, который становится бессосудистым. Из поврежденных сосудов выделяется плазма крови, она свертывается и в смеси с омертвевшими элементами местных тканей образует массу, макроскопически напоминающую творог, весьма характерную для туберкулезного поражения. В творожистой массе довольно быстро откладываются глыбки извести, а в последствии возможно значительное обызвествление очага некроза. При микроскопическом исследовании в относительно гомогенной некротической массе видны комковатые, сморщенные ядра и их обломки- следы кариопикноза и кариорексиса клеточных элементов. При специфической окраске методом серебрения можно выявить остатки стромы пораженного органа.
Макрофаги, сохраняющиеся по периферии некротического очага, превращаются в эпителиоидные клетки, получившие такое название за сходство с клетками эпителия. Это клетки с крупным пузырьковидным ядром и значительной массой цитоплазмы, лишенные межклеточного вещества. Среди них встречаются гигантские клетки Пирогова - Лангханса, типичные для инфекционных гранулем (сапных, бруцеллезных и др.), они в несколько раз крупнее эпителиоидных клеток с большим количеством ядер (до 20-30), расположенных подковообразно или кольцеобразно по периферии клетки. В цитоплазме таких клеток можно видеть глыбки извести и обломки туберкулезных клеток. Наружную зону туберкула представляют лимфоидные клетки - мелкие, с темным ядром и едва заметным слоем цитоплазмы.
Клеточные элементы туберкулезной гранулемы выполняют специальные функции защиты: эпителиоидные и гигантские клетки (активные фагоциты) не пропускают сквозь свой строй микробов, лимфоидно-клеточная зона выполняет антитоксические функции и продуцирует антитела.
Эти защитные свойства гранулемы настолько сильные, что за пределами ее нет признаков патологических изменений.
Впоследствии туберкулезный узелок нередко подвергается значительному обызвествлению. В грануляционной ткани образуются многоядерные клетки - кальциокласты, способствующие рассасыванию извести и некротических масс. Вокруг туберкула образуется соедительнотканная капсула и может наступать даже для организации некротического очага.
Как и всякий воспалительный очаг, характеризующийся тремя обязательными компонентами: альтерацией (дегенеративно-некратическими изменениями), экссудацией (выпотевание составных частей крови) и пролиферацией(размножением клеточных элементов), туберкулы могут варьировать в своей патоморфологической структуре.
Альтернативные туберкулезные поражения выражаются прогрессирующими некротическими изменениями (казеозом), причем грануляционная ткань не успевает формироваться. Эту форму туберкулезного изменения наблюдают у животных, не обладающих иммунитетом (обезьяны, морские свинки и др.), у новорожденных, истощенных и старых животных, при высокой вирулентности возбудителя.
Экссудативные туберкулезные поражения характеризуются также прогрессирующим некрозом и резко выраженными экссудативными изменениями в виде отека, гиперемии, лимфоидно-клеточной гиперплазии по периферии некротического участка. Их наблюдают как гиперэргические реакции при бурном развитии болезни.
Продуктивная форма туберкулезного поражения проявляется отсутствием или минимальными некротическими изменениями, разрастанием эпителиоидных и гигантских клеток. Ее регистрируют у высокорезистентных видов (лошадей, крыс), у животных, вакцинированных БЦЖ. Такие изменения в дальнейшем подвергаются фиброзному превращению и иногда бесследно исчезают.
Макроскопически туберкулезные поражения различают по величине и патоморфологической характеристике.
Очаговые поражения могут быть милиарными, субмилиарными и крупноочаговыми.
Милиарные очаги - круглые просовидные очажки размером около 1-2 мм с желтовато-серой казеозной массой и серовато-белой узкой грануляционной зоной. Очажки мелкого размера, иногда на пределе видимости, называют субмилиарными. Крупноочаговые поражения достигают размеров горошины (около 0,5-1 см). Они образуются при гематогенной и лимфогенной генерализации.
Клинико-морфологическая форма туберкулеза зависит от аллергического состояния организма. Различают первичную (нормэргическую) и вторичную (аллергическую) стадии туберкулеза.
Стадии туберкулеза. Первичный туберкулез включает первичный комплекс, который может быть полным неполным и сложным, и раннюю генерализацию - милиарную и крупноочаговую.
Вторичный туберкулез может быть в двух формах: поздняя генерализация и изолированное поражение органов.
Первичный туберкулез развивается в организме, не имевшим ранее контакта с туберкулезным возбудителем, т.е. это начальная форма развития болезни, не зависящая от способа заражения и ворот инфекции.
Клинико - анатомический первичный комплекс проявляется начальным поражением, выражающимся в классической форме сочетанием органа (первичный эффект) и регионарно ему лимфатического узла (полный первичный комплекс). Гораздо чаще выявляют поражение только лимфатических узлов без поражения органа, который им обслуживается (неполный первичный комплекс). Сложным называют наличие полного или неполного первичного комплекса в нескольких анатомических аппаратах, возникших более или менее одновременно, например в дыхательной и пищеварительной системы.
При массивной инфекции и высокой вирулентности возбудителя, слабой резистентности организма животного первичный комплекс образуется в воротах инфекции.
При незначительной массе инфекционного материала бактерии способны бесследному проникновению через ворота инфекции, мигрируют по лимфатическим и кровеносным сосудам и локализуются в лимфатических узлах и органах, наиболее благоприятствующих развитию бактерий (легких), или в месте наименьшего сопротивления, которым может быть любой орган в состоянии физического напряжения, перестройки (молочная железа, беременная матка) или повреждения различной этиологии.
Очаг первичного эффекта может быть маленьким (на пределе видимости); в легких процесс может охватывать одну или несколько смежных долек, в кишечнике - частично или полностью солитарный фолликул или пейерову бляшку, в печени - отдельные дольки.
В дальнейшем при благоприятном течении процесса поисходит обызвествление, инкапсуляция и организация первичных очагов.
В легких первичные очаги располагаются в наиболее вентилируемых частях органа, преимущественно под плеврой главных долей вблизи тупого края; в кишечнике - в подвздошной кишке, реже в других отделах тонкого кишечника.
Образование неполного первичного комплекса объясняют способностью прохождения бактерий через орган, послуживший воротами инфекции, и задержкой возбудителя в процессе лимфогенной миграции. Поэтому при убое животных положительно реагирующих на туберкулин, следует обращать особое внимание на лимфоузлы (подчелюстные, заглоточные, брыжеечные, надвымянных).
У долгоживущих животных и у человека первичные поражения имеют тенденцию к обратному развитию: подвергаются обызвествлению, инкапсуляции и организации, но возбудитель сохраняется долго, поддерживая аллергическое состояние и нестерильный иммунитет.
В неблагоприятных случаях болезни процесс прогрессирует: возможен экспансивный рост туберкулезных изменений, захватывающий новые смежные участки с первичным поражением , но нередко, при прорыве инфекции из первичного очага в кровеносные, лимфатические и естественные каналы органа, развивается генерализованный местный процесс или по всему организму с возникновением милиарных, субмилиарных поражений.
Генерализованный процесс при наличии цветущего первичного комплекса носит название ранней генерализации, но обычно приводит к летальному исходу. Она является естественным развитием первичного комплекса и потому входит в понятие первичного туберкулеза. Представляется ненаучным его обособление под названием пролонгированного (продолженного), а тем более послепервичного туберкулеза. Туберкулезу свойственно волнообразное течение со меной фаз затухания и обострения процесса, возможно даже заживление первичного очага. Однако бывают и вспышки туберкулеза вследствие эндогенной или экзогенной реинфекции.
Эндогенная реинфекция может быть вызвана вспышкой туберкулезного процесса в казавшемся зажившем туберкулезном очаге при падении резистентности и иммунитета вследствие общего и частичного голодания (белкового, минерального, витаминного и др.), физиологической перестройки (беременность), заболевания истощающими, эндокринными и острыми инфекционными заболеваниями. При этом наблюдают рассасывание известковых отложений из некротической массы, истончение грануляционной ткани, развитие перифокального отека, экспансивного разрастания очага, местной и общей метастазии.
Экзогенная реинфекция возникает при новом заражении туберкулезом, когда происходит срыв установившейся резистентности и иммунитета.
Характерная особенность реинфекции - отсутствие нового первичного комплекса. Генерализация развивается всеми возможными путями: гематогенными, лимфогенными, интраканикулярными с образованием милиарных, субмилиарных и крупноочаговых поражений во всех органах с заметными аллергическими особенностями (казеоз, перифокальный отек, недоразвитие грануляционной ткани).
Некоторые исследователи отрицают возможность реинфекции у сельскохозяйственных животных, считая, что они не доживают до этой стадии болезни, и любое проявление туберкулеза после образования первичного комплекса называют послепервичным туберкулезом.
Своеобразную форму вторичного туберкулеза представляет изолированное поражение отдельных органов при отсутствии генерализации. Эту форму связывают с прорывом первого местного органного иммунитета при относительно высокой резистентности организма в целом. Примерами этой формы может быть тяжелое изолированное поражение легких, кишечника, молочной железы, костей при отсутствии туберкулезных изменений в других органах.
Читайте также:


