Окраска по граму при туберкулезе
Консультант по гематологии,
цитохимии и микробиологии
Важное место в общем комплексе клинико-лабораторных исследований, применяемых для профилактики, диагностики и лечения гнойно-воспалительных заболеваний и осложнений у больных в лечебно-профилактических учреждениях занимают микробиологические исследования. Современная клиническая медицина предъявляет к микробиологическим (бактериологическим) исследованиям возрастающие требования по увеличению объема, повышению качества исследований, разработке и внедрению новых более совершенных методов. Это связано как с новыми научными достижениями в области эпидемиологии и бактериологии, так и с увеличением гнойно-воспалительных заболеваний, ростом госпитальных инфекций.
Материалом для изучения этиологии заболеваний дыхательных путей служат: отделяемое зева и носа; мокрота; содержимое бронхов, полученное при бронхоскопии или при отсасывании через трахеостому (у больных, находящихся на аппаратном дыхании); экссудаты; резецированные ткани и др. Материал собирают с соблюдением правил асептики в предварительно простерилизованные баночки или пробирки и доставляют в лабораторию. Хранение материала способствует размножению сапрофитирующей микрофлоры, развитию процессов гниения и брожения, что искажает результаты анализа. Интервал между взятием материала и его посевом не должен превышать 1-2 часа. Самым простым методом выявления микобактерий туберкулеза в выделениях больных является микроскопия мазка, приготовленного из мокроты. При бактериоскопии мазка, окрашенного по Цилю-Нильсену, микобактерии туберкулеза могут быть обнаружены при наличии не менее 100 000 - 1 000 000 бактериальных клеток в 1 мл патологического материала (мокроты). Такое большое количество микобактерий встречается у больных с далеко зашедшими прогрессирующими формами заболевания (диссеминированными и фиброзно-кавернозными). У значительно большего числа больных количество выделяемых ими микобактерий ниже предела метода бактериоскопии.
Чувствительность метода люминесцентной микроскопии значительно выше - от 10 000 до 100 000 микобактерий в 1 мл материала, кроме того, этот метод дает возможность за значительно более короткое время просмотреть необходимое количество препаратов. Эффективность бактериоскопии повышается также при передаче изображения на компьютер при помощи присоединенной к микроскопу видеокамеры.
Чтобы диагностировать туберкулез, необходимо сделать все возможное для выявления возбудителя заболевания. Микробиологически диагноз может быть подтвержден на основе результатов культурального исследования на комплекс M. tuberculosis (или, при возможности, путем идентификации специфических последовательностей нуклеиновых кислот) в пробах, взятых в месте локализации патологического процесса. Однако на практике в настоящее время многие лаборатории не располагают материально-технической базой для проведения культуральных исследований. К счастью, микроскопия окрашенных препаратов мокроты доступна практически везде, поэтому диагностика туберкулеза может проводиться на основе выявления кислотоустойчивых микобактерий. На территориях с высокой распространенностью туберкулеза выявление кислотоустойчивых микобактерий в окрашенных препаратах мокроты демонстрирует высокую специфичность, поэтому положительный результат микроскопии мокроты можно рассматривать как подтверждение диагноза. Кроме высокой специфичности к комплексу M. tuberculosis, выявление кислотоустойчивых микобактерий при микроскопии играет важную роль по трем причинам: это – наиболее быстрый метод диагностики туберкулеза; позволяет выявить больных с тяжелым развитием патологии, чреватым высоким риском летального исхода; дает возможность выявить больных, являющихся распространителями инфекции.
Оценка качества работы лабораторий микроскопии должна проводиться соответствующим государственными органом (как правило, представителями национальной программы борьбы с туберкулезом).
Неправильный диагноз, поставленный перед началом лечения, приводит к риску ненужного, неправильного или неудачного лечения. Более того, подобный подход чреват несвоевременной постановкой правильного диагноза и назначением соответствующего лечения. При надлежащем подходе и контроле в большинстве случаев у детей в возрасте пяти лет и старше могут быть получены образцы мокроты. У подростков (хотя они часто относятся к детской возрастной группе, по крайней мере, до 15 лет) получить пробы мокроты не составляет большого труда. Поэтому фактор возраста не может рассматриваться как препятствие для сбора проб мокроты у детей и подростков.
Исходя из имеющихся данных, можно прийти к заключению, что для диагностики туберкулеза необходимо взять не менее двух проб мокроты. В случаях, когда имеются соответствующие возможности, можно направлять для лабораторного исследования еще и третью пробу, но исследование более трех проб мокроты вряд ли целесообразно, поскольку не может в значительной мере повысить эффективность диагностики. Кроме того, исследование третьей пробы может оказаться полезным только для подтверждения диагноза, если одна или две предыдущие пробы дали положительный результат. Крайне желательно, чтобы результаты микроскопии мокроты направлялись лечащему врачу в течение одного рабочего дня с момента отправки проб. Не меньшее значение имеет также и время сбора проб. Результаты исследований показывают, что эффективность лабораторных анализов максимальна, если пробы мокроты получены утром, после пробуждения от ночного сна. Возможно, совершенно необязательно собирать только утренние пробы, но, про крайней мере, одна из них должна быть получена утром.
Как правило, внелегочные очаги туберкулезного процесса содержат гораздо меньшее количество M. tuberculosis, поэтому микроскопическое выявление кислотоустойчивых микобактерий в пробах из внелегочных очагов весьма затруднено, и в таких случаях результаты культуральных исследований приобретают большое значение. Учитывая низкую результативность микроскопии, при внелегочном туберкулезе культуральные и морфологические исследования приобретают особое значение, например, в диагностическом исследовании проб ткани лимфатических узлов, полученных при помощи игловой биопсии.
Лечение пациентов, у которых наблюдаются тяжелое или быстро развивающееся заболевания, ассоциированные с туберкулезом, необходимо начинать немедленно, даже до лабораторного подтверждения диагноза. Лечение следует начинать до получения результатов лабораторного исследования и лишь позднее внести необходимые поправки и изменения в схему лечения с учетом результатов микроскопии.
Хотя микроскопия мокроты является наиболее доступным бактериологическим тестом, там, где ресурсы позволяют и имеются условия для качественной лабораторной диагностики, в диагностический алгоритм необходимо включать культуральные исследования мокроты, в случаях отрицательных результатов микроскопии. Правильное проведение культуральных исследований связано с определенными трудностями и дополнительными затратами, но этот метод отличается более высокой чувствительностью и повышает вероятность раннего выявления больных туберкулезом.
Микроскопия мазков мокроты по Циль-Нильсену является важнейшим элементом диагностики туберкулеза. Исследование 3 мазков мокроты позволяет выявить более 60% случаев туберкулеза легких и 95% наиболее заразных случаев (исследование одного мазка мокроты выявляет 75% наиболее заразных случаев, исследование второго мазка мокроты добавляет еще 20%, а исследование третьего - еще 5%).
Микроскопия мазков мокроты по Циль-Нильсену позволяет быстро получить результаты, выявить основные источники инфекции, является менее дорогостоящей, чем посев мокроты и широко доступна для применения. Но она должна быть надежной и хорошо контролироваться. Вероятность обнаружения МБТ при бактериоскопии мазков мокроты прямо пропорциональна концентрации возбудителя в исследуемом материале. Например, когда в 1 мл мокроты содержится от 1000 до 10000 МБТ, то вероятность получения положительного результата составляет около 40-50%. При концентрации МБТ менее 1000 в 1 мл мокроты вероятность их обнаружения резко снижается – отрицательные результаты получаются примерно в 96% случаев.
Основным и наиболее часто изучаемым биоматериалом в пульмонологической практике является мокрота. Требования к забору и качеству мокроты следующие:
1) первую пробу мокроты желательно получить до начала курса антибиотикотерапии;
2) мокроту оптимально собирать утром, до приема пищи, после тщательного туалета полости рта (полоскание кипяченой водой);
3) больным нужно доступно объяснить, что требуется получить именно содержимое нижних отделов дыхательных путей, а не ротоглотки, и, по возможности, проконтролировать их действия;
4) забор материала проводить в стерильные интактные контейнеры;
5) продолжительность хранения мокроты в контейнерах не должна превышать 2 ч (в летнее время желательно не более 1 ч);
6) в условиях лаборатории качество мокроты оценивается после окрашивания мазка по Граму (при наличии в мазке менее 25 лейкоцитов и более 10 эпителиальных клеток, при просмотре не менее 8-10 полей зрения при малом увеличении, мокрота признается некачественной, дальнейшее ее исследование нецелесообразно, так как, скорее всего, материал получен из ротовой полости);
7) высокая диагностическая ценность исследования признается при выделении возбудителя в концентрации і106 КОЕ/мл.
Вообще, в диагностике заболеваний туберкулезом можно выделить несколько этапов:
· Преаналитический этап (предварительный диагноз, выбор материала и метода исследования, забор биомтериала и его транспортировка)
· Аналитический этап (непосредственно проведение анализа)
· Постаналитический этап (оценка результатов)
Часть этих этапов проводится вне лаборатории, поэтому очень важна согласованная и качественная работа всех специалистов, привлеченных в этот процесс. Важен правильный выбор исследуемого материала. Важным этапом диагностики являются процедуры взятия и доставки материала в лабораторию.При взятии всех видов исследуемого материала следует ориентироваться на стандартные системы для этой цели: тампоны, цитощетки, тубсеры, контейнеры и т.п. Эффективность аналитического этапа во многом определяется уровнем технического оснащения лабораторий. Постаналитический этап исследования включает две составляющие: проверку достоверности полученного результата и оценку этиологической значимости выделенных штаммов. В лаборатории должен осуществляться строгий внутренний контроль качества исследований, важной составляющей которого является проверка полученных результатов на достоверность. Оценка этиологической значимости выделенных микроорганизмов принципиальна для выбора адекватной терапии. Процедура приготовления мазков начинается с подготовки предметных стекол. Необходимо использовать только новые, отмытые и обезжиренные в спирте или смеси для обезжиривания предметных стекол (производство АБРИС+) стекла без царапин и сколов. При повторном использовании стекла могут быть недостаточно хорошо отмыты от предыдущего материала, что может привести к получению ложноположительных результатов. Не рекомендуется использовать саморезанные стекла, которые приводят к значительным аберрациям исследуемого изображения. Стекла должны соответствовать ГОСТу. Стекла, на которых при микроскопическом исследовании были обнаружены кислотоустойчивые микобактерии, сохраняются в лаборатории в течение 1 года, а затем подлежат обязательному уничтожению и не должны использоваться повторно. Новые предметные стекла кипятят 15 минут в 1% растворе питьевой соды (10 г двууглекислого натрия на 1 л воды), промывают в 1% растворе соляной кислоты (к 1 л воды добавляют 10 мл концентрированной соляной кислоты), а затем промывают в проточной воде и протирают насухо.
51. M. tuberculosis открыт:
б) А. Кальметтом, Ш. Гереном
Правильный ответ: в
52. Основной возбудитель туберкулеза человека:
а) Mycobacterium аvium
б) M. tuberculosis
в) M. intracellulare
Правильный ответ: б
53. Отличительная особенность микобактерий туберкулеза:
а) высокое содержание липидов в клеточной стенке
б) высокое содержание нуклеопротеидов
г) образование экзо- и эндотоксинов
д) проникают через неповрежденную кожу
Правильный ответ: а
54. Факторы патогенности возбудителей туберкулеза:
б) липиды, протеины
Правильный ответ: б
55. Особенности микобактерий туберкулеза, связанные с высоким содержанием липидов (верно все, к р о м е):
а) окраска по Граму
б) неокрашиваемость обычными методами
г) медленное размножение
д) выживание в макрофагах
Правильный ответ: а
56. Основной метод окраски микобактерий туберкулеза:
Правильный ответ: б
57. Микобактерии туберкулеза (верно все, к р о м е):
в) растут на специальных средах
г) требовательны к питательным средам
д) медленно размножаются
Правильный ответ: б
58. Источник инфекции при туберкулезе:
в) больные люди – бацилловыделители
г) пищевые продукты
д) предметы обихода больного
Правильный ответ: в
59. Пути заражения при туберкулезе (верно все, к р о м е):
Правильный ответ: а
60. Особенность иммунитета при туберкулезе:
б) передается трансплацентарно
Правильный ответ: в
61. Достоинства бактериоскопического метода при диагностике туберкулеза (верно все, к р о м е):
б) определение первичной лекарственной устойчивости возбудителя
г) низкая стоимость
д) эпидемиологическая значимость (положительный результат свидетельствует о массивном выделении и опасности больного для окружающих)
Правильный ответ: б
62. Методы микробиологической диагностики туберкулеза:
г) генодиагностика (ПЦР)
д) все вышеперечисленные
Правильный ответ: д
63. Исследуемый материал при подозрении на туберкулез легких:
а) носоглоточный смыв
в) пунктат лимфоузлов
г) спинномозговая жидкость
Правильный ответ: б
64. Результаты бактериологического исследования при диагностике туберкулеза выдают:
в) через 2 недели
д) через 3-4 месяца
Правильный ответ: д
65. Чувствительность микобактерий туберкулеза к антибактериальным препаратам определяют:
а) методом дисков
б) методом Циля – Нильсена
в) методом абсолютных концентраций
г) методом флотации
д) методом гомогенизации и осаждения
Правильный ответ: в
66. Первичная лекарственная устойчивость микобактерий туберкулеза:
а) природная устойчивость
б) не имеет эпидемиологического значения
в) выявляется у микобактерий, выделенных от больных, не принимавших противотуберкулезные препараты
г) выявляется у микобактерий, выделенных от больных, принимавших противотуберкулезные препараты
д) регистрируется редко
Правильный ответ: в
67. Приобретенная (вторичная) лекарственная устойчивость микобактерий туберкулеза:
а) природная устойчивость
б) не имеет клинического значения
в) выявляется у микобактерий, выделенных от больных, не принимавших противотуберкулезных препаратов
г) выявляется у микобактерий, выделенных от больных, принимавших противотуберкулезных препаратов
д) регистрируется редко
Правильный ответ: г
68. Кожно-аллергическая проба Манту положительна у:
б) больных туберкулезом
в) контактных, вакцинированных
д) беременных, рожениц
Правильный ответ: б
69. Специфическая профилактика туберкулеза включает:
а) улучшение социальных условий
в) вакцинацию БЦЖ
г) назначение противотуберкулезных препаратов
Правильный ответ: в
70. Вакцина БЦЖ создана:
б) А. Кальметом, Ш. Гереном
Правильный ответ: б
а) инактивированная корпускулярная
г) живая аттенуированная
Правильный ответ: г
72. Рост заболеваемости туберкулезом связан с (верно все, к р о м е):
а) новыми видами возбудителей
б) интенсивной миграцией населения
в) ухудшением социально-экономических условий
г) лекарственной устойчивостью возбудителя
д) большим числом больных с эпидемически опасными формами заболевания
Правильный ответ: а
73. Туберкулин – это:
в) белковая фракция микобактерий
г) липидная фракция микобактерий
Правильный ответ: в
74. Система мероприятий по снижению заболеваемости туберкулезом включает (верно все, к р о м е):
а) улучшение социально-экономических условий
б) широкое использование противотуберкулезных препаратов
в) вакцинацию БЦЖ
г) диспансеризацию больных
д) совершенствование методов микробиологической диагностики
Правильный ответ: б
Не нашли то, что искали? Воспользуйтесь поиском:

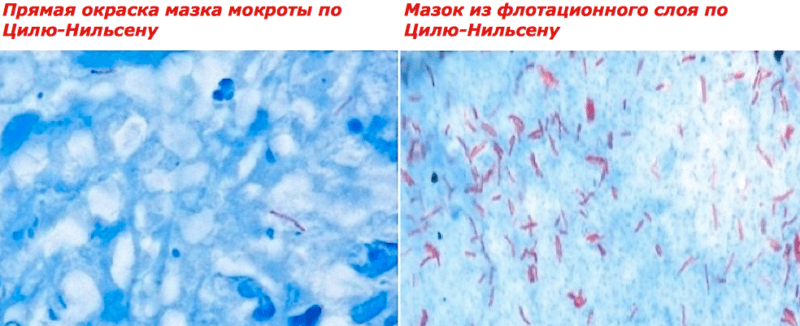
Окраска по Цилю-Нильсену – это один из методов, используемый для обнаружения при исследовании анализов больного различных заболеваний. В случае изучения мокроты пациента на предмет наличия возбудителей, к примеру, туберкулеза широко используется данный метод. В этой статье пойдет речь о нюансах его проведения, а также о некоторых аналогичных методах.
Область применения метода
Этот метод окрашивания используется в тех случаях, когда необходимо выявить в образце кислотоустойчивые микроорганизмы, к которым относятся возбудители туберкулеза, проказы и микробактериозов. Такие бактерии характеризуются, прежде всего, медленной скоростью роста, общими морфологическими особенностями, а также устойчивостью к кислотам и некоторым другим химическим веществам. Из-за последнего свойства такие бактерии плохо поддаются окраске обычными разведенными красителями. Для окрашивания таких бактерий на препарат наносится и в дальнейшем поджигается фуксин Циля, причем полученная окраска не исчезает под воздействием спирта и кислот.

Необходимые реактивы и оборудование
Для проведения окраски образца по методу Циля-Нильсена необходимы следующие реактивы:
- Метиленовый синий с 10%-ным содержанием спирта;
- Раствор солянокислого спирта;
- Фуксин Циля, состоящий из фенола, фуксина и этилового спирта в количестве 50 г, 10 г и 10 г соответственно.
Также потребуется следующие инструменты:
- Газовая горелка;
- Часы для слежения за временем;
- Вода;
- 96%-ный этиловый спирт;
- Перчатки.

Ход процедуры
Окрашивание по методу Циля-Нильсена состоит из следующих этапов:
- На мазок, находящийся на предметном стекле, накладывается фильтровальная бумага, на которую затем наносится небольшое количество фуксина Циля.
- Затем предметное стекло нагревается до появления характерного пара. После появления пара стеклу нужно дать остыть. Затем нужно повторить эту процедуру еще 2 раза, а затем дать подогретому мазку остыть.
- После этого нужно смыть фуксин с приборного стекла, предварительно убрав бумагу, с помощью дистиллированной воды.
- Затем стекло помещается в раствор соляной или серной кислоты до полного обесцвечивания.
- Наконец, на обесцвеченный препарат наносится раствор метиленового синего. Стекло промывается дистиллированной водой и высушивается для дальнейшего исследования образца под микроскопом.
Липиды, которые содержатся в клеточной стенке кислотоустойчивых бактерий, хорошо удерживают цвет основного красителя. В некислотоустойчивых бактериях стабильно удерживается цвет как основного красителя, так и дополнительного.
Показания к применению метода
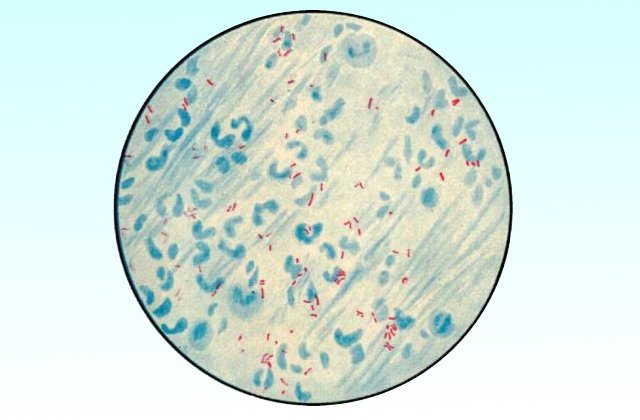
При подозрениях на туберкулез исследуется мокрота больного. Длительный кашель с обильными выделениями является показанием для проведения подобного исследования. Визуально наличие возбудителей туберкулеза в организме может выдать мокрота характерной жидкой, пенистой консистенции и признаками гноя, а также мокрота, смешанная с кровью. Обнаружение возбудителей туберкулеза – рисовидных телец, известных также как линзы Коха, облегчается при использовании методов окраски образца. Таких как вышеописанный метод Циля-Нильсена или метод Грама, суть которого будет описана ниже.
Метод Грама
Окраска препарата по методу Грама проводится следующим образом:
- Сперва препарат обрабатывается раствором Люголя на протяжении минуты;
- Затем препарат обесцвечивается с использованием спирта;
- Наконец, препарат промывается с использованием воды и дополнительно окрашивается фуксином.
Классификацию бактерий на грамположительные и на грамотрицательные можно наглядно увидеть при проведении подобной окраски. Первый тип бактерий окрашивается в темно-фиолетовый цвет, тогда как второй тип – в красный цвет. Исходя из такой классификации, можно судить о химическом составе клеточной стенки бактерии и о других ее характерных свойствах.
Заключение
Анализ мокроты пациента является жизненно необходимым для своевременного выявления заболеваний, затрагивающих дыхательные пути, в том числе и туберкулеза. Окрашивание по методу Циля-Нильсена помогает выявить микроорганизмы и возбудители подобных болезней. В том числе и в случаях, когда речь идет об атипичных бактериях. Тем самым позволяет производить более точную и качественную диагностику подобных болезней.
Если вы сталкивались с подобными заболеваниями, знакомы с техниками исследования анализов больного на предмет наличия в них возбудителей инфекции или же у вас есть вопрос по теме, вы можете оставить свой комментарий.
При исследовании мазков по Цилю-Нельсону следует избегать:
- 1. приготовления толстых мазков мокроты;
- 2. фиксации плохо высушенных мазков;
- 3. недостаточной фиксации;
- 4. обжигания препарата при длительной фиксации.
Эта методика должна выполнятся в условиях клинических лабораторий, начиная с уровня поликлиники, входит в поликлинический и клинический минимум обследования пациента, страдающего кашлем с мокротой (трехкратное микроскопическое исследование мокроты на микобактерии туберкулеза). Бактериоскопия мокроты должна проводится и больным хроническими заболеваниями органов дыхания и мочевыводящих путей, а также работникам неблагоприятных по туберкулезу животноводческих хозяйств. При обнаружении в мазке в одном поле зрения пяти и более микобактерии вероятность получения положительного результата посева материала на питательные среды значительно возрастает. Метод микроскопического исследования кислотоустойчивых мазков с окраской по Цилю-Нильсону позволяет быстро получить результаты, но обладает низкой чувствительностью и специфичностью. Частота выявлений микобактерии у больных туберкулезом при микроскопии мокроты составляет по данным разных авторов от 48 до 78%. При этом сравнение данных микроскопических исследований с данными культуральных исследований показывает, что доля ложноположительных результатов составляет до 6%.
Приготовление растворов для метода по Цилю-Нильсону:
Раствор 1. Насыщенный спиртовый раствор фуксина (3%) - растереть в ступке 0,3 г основного фуксина с 2-3 каплями глицерина, добавить по каплям 10 мл 96 ? этилового спирта. Добиться полного растворения фуксина.
Раствор 2. Рабочий раствор фенола (5% водный раствор) - расплавить 5 г кристаллического фенола на водяной бане или в термостате (температура плавления фенола 41 ? С).
Осторожно! При попадании фенола на кожу вызывает ожоги. Растворить расплавленный фенол в 100 мл воды.
Рабочий раствор 3. Рабочий раствор карболового фуксина - в 90 мл полученного раствора фенола (раствор №2) добавить 10 мл насыщенного раствора фуксина (раствор №1).
Раствор 4. Обесцвечивающий раствор серной кислоты (25%) - к 75 мл дистиллированной воды осторожно долить 25 мл концентрированной серной кислоты, постепенно наслаивая ее по стенкам сосуда, смешать. Содержимое нагреется.
Или: обесцвечивающий раствор соляной кислоты (3%) - к 97 мл 96% этилового спирта осторожно добавить 3 мл концентрированной соляной кислоты.
Всегда медленно добавляйте кислоту в спирт, а не наоборот! Смесь может нагреться.
Раствор 5. 0,3% раствор метиленового синего - растворить 0,3 г хлорида метиленового синего в 100 мл дистиллированной воды.
Переходные материалы и реактивы
Предметные стекла; 25х75 мм; 1,1-1,3 мм толщиной (на 1 год).
Восковые карандаши или алмазные ручки или несмываемые водой фломастеры.
Фильтровальная бумага, фильтры диаметром 15 см №1.
Салфетки для линз.
Шариковая ручка черная или синяя.
Шариковая ручка красная.
Петля бактериологическая, нихромовая, 1 мм диаметром.
Фуксин основной, х.4.
Спирт этиловый 96%, х.4 (для приготовления спиртового фуксина).
Фенол кристаллический, х.4.
Метиленовый синий, х.4.
Реактивы для обесцвечивания:
- - серная кислота, 96% х.4, или
- - солянокислый спирт 3%
- - соляная кислота, концентрированная, х.4
- - спирт этиловый, 96%, х.4
Спирт этиловый технический.
Учет результатов микроскопического исследования
Количество КУМ являет очень важным информационным показателем, так как оно характеризует степень эпидемиологической опасности больного и тяжесть заболевания. Поэтому микроскопическое исследования должно быть не только качественным, но и количественным. При использовании объектива 90х или 100х окуляра 7х10 (общее увеличение равно 630х 1000х) используется следующая градация результатов световой иммерсионной микроскопии.
Градация результатов микроскопического исследования
Микобактериозы – группа инфекционных заболеваний человека и животных, включая все виды птиц, вызываемая бактериями рода Mycobacterium.
Большинство видов микобактерий
птиц вызывают хроническую (зачастую без проявления внешней симптоматики в течение длительного периода времени) полиорганную инфекцию с поражением печени, селезенки, легких, кишечника, суставной и костной ткани.
Также процесс может протекать локально, с поражением отдельных участков кожи и прилежащих тканей (чаще в области головы либо конечностей).
Некоторые виды возбудителя являются зооантропонозными, т.е.заразны для животных и человека. К ним относятся в том числе Mycobacterium tuberculosis, M.bovis и M.avium, вызывающие у людей туберкулёз. Передача возбудителя может происходить от птицы человеку и наоборот – в равной степени и люди, болеющие туберкулёзом, несут опасность заражения для домашних птиц, проживающих с ними.
Помимо трех вышеобозначенных видов, есть и другие микобактерии (M.fortuitum, M. scrofulaceum, M. intracellulare и др.), встречающиеся у птиц и потенциально опасные для людей. Чаще они не вызывают системных поражений (тубёркулеза), однако могут провоцировать очаговые хронические дерматиты с образованием абсцессов; главным образом, к группе риска по подобным атипичным микобактериозам относятся дети младшего возраста, пожилые люди, ВИЧ-положительные, онко-больные, а также люди, проходящие химиотерапию или иммуносупрессивную терапию.
Проблема постановки диагноза на микобактериоз и лабораторной диагностики данного заболевания у птиц стоит весьма остро, и на то есть несколько причин:
1. неравномерное выделение возбудителя из организма больного животного – не каждая проба помета может нести в себе микобактерии или содержать достаточное их количество для диагностики. Отсюда вытекает две сопутствующие проблемы:
1.1 необходимость проведения серий анализов – окраска по Цилю-Нильсену, ПЦР, посевы на питательные среды– для постановки окончательного диагноза;
1.2 зачастую требуется концентрация микобактерий в материале (методом флотации) перед проведением анализа, что в разы повышает эффективность обнаружения возбудителя при любом методе диагностики (окраске, ПЦР, посевах).
2. необходимость концентрации материала приводит к последующей сложности: соответствующее оснащение лабораторий для безопасной работы с концентрированным зооантропонозным возбудителем в материале для проведения анализов. Именно за счёт повышенного риска для сотрудников при работе с концентрированными пробами единицы лабораторий (как правило, это государственные лаборатории на базе НИИ) ведут данную деятельность.
[немаловажно: риск заражения владельца прямо пропорционален длительности его проживания с зараженной птицей, т.к.птица-бактериовыделитель способствует поддержанию высокой, нарастающей концентрации микобактерий в помещении, особенно при отсутствии регулярной уборки со специфическими дез.средствами, т.к.микобактерии являются кислото-, спирто-, щёлоче-устойчивыми микроорганизмами, длительно сохраняющимися в окружающей среде]
Для диагностики микобактериозов у содержащихся в неволе птиц в России доступны следующие методы:
Окраска по методу Циля-Нильсена:
Материал: помет, мокрота, мазки со слизистых оболочек и из очагов поражения кожи, синовиальная и перитонеальная жидкость, мазки-отпечатки органов при посмертной диагностике.
Принцип метода основан на обнаружении микобактерий при микроскопии материала – в готовом мазке они окрашены в красный цвет красителем фуксином Циля, т.к.являются кислотоустойчивыми, большинство же других микроорганизмов обесцвечивается (на этапе промывания мазка серной кислотой после фуксина) и затем окрашивается в синий (на этапе завершающей окраски метиленовой синью).
| Преимущества: | Недостатки: | ||||||||||||
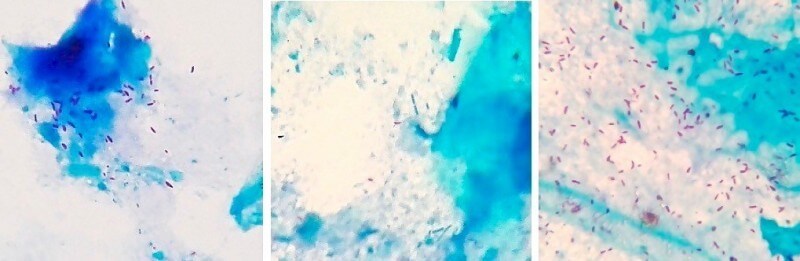
|
Окрашенные по методу Циля-Нильсена помёт жако – слева (более 40 микобактерий в поле зрения микроскопа), помёт сизого голубя – по центру (единичные микобактерии в поле зрения), помёт кореллы – справа (более 100 микобактерий в поле зрения). Фото автора. При последующей сдаче помёта от данных пациентов на ПЦР-диагностику только от жако с первого же раза была получена положительная ПЦР и подтвержден возбудитель M.bovis. Две другие птицы прореагировали ложно-отрицательно. Корелла прореагировала положительно при повторной ПЦР по помёту. Голубь прореагировал ложно-отрицательно при повторной ПЦР по помёту, но диагноз был подтвержден по ПЦР крови. ПЦР (полимеразная цепная реакция):Материал: кровь, помет, мокрота, мазки со слизистых оболочек и из очагов поражения кожи, синовиальная и перитонеальная жидкость, кусочки органов при посмертной диагностике.
Посевы на питательные среды:Материал: помет, мокрота, мазки со слизистых оболочек и из очагов поражения кожи, синовиальная и перитонеальная жидкость, кусочки органов при посмертной диагностике. Метод основан на культивировании (высевании) бактерий из материала на специальных питательных средах (наиболее часто используемой является среда Левенштейна-Йенсена), с целью обнаружения роста возбудителя и дальнейшего получения чистой культуры микобактерий для проведения последующей типизации.
|