Методы дифференциации микобактерий туберкулеза
Одним из самых опасных и распространённых во всём мире инфекционных заболеваний не только человека, но и животных является туберкулёз. Возбудителем туберкулёза более чем в 90% случаев выступает mycobacterium tuberculosis (микобактерия туберкулёза).
Что такое микобактерия туберкулёза
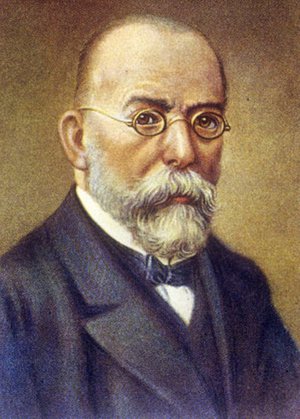
На протяжении долгих столетий человечество страдало и умирало от туберкулёза, называемого ранее чахоткой. Медикам из многих стран мира никак не удавалось обнаружить и выделить коварного возбудителя туберкулёза, даже с появлением микроскопа. И только в 1882 году доктор Генрих Герман Роберт Кох из Германии сумел в результате многочисленных лабораторных опытов, проводимых на протяжении 17 лет, обнаружить продолговатую бактерию и позднее идентифицировать её. Эта бактерия также получила в медицине название по имени своего первооткрывателя: микобактерию туберкулёза называют палочкой Коха. В 1905 году Роберт Кох получил за своё открытие Нобелевскую премию.
Именно Роберт Кох предложил алгоритм для идентификации вызывающих туберкулёз бацилл, получивший также его имя (триада Коха) и применяемый до сих пор. Суть алгоритма состоит в следующем:
- Из тканей больного пациента извлекаются бактерии.
- Из них выращивается чистая культура – колонии бактерий.
- Далее, для получения клинической картины болезни, происходит заражение здорового организма (лабораторные мыши).
По своей форме микобактерия туберкулёза представляет собой продолговатую прямую или изогнутую палочку со слегка закруглёнными концами, размер бактерии обычно составляет 1 – 10 мкм в длину и 0,2 – 0,6 мкм в ширину.
Клетка МБТ состоит из:
- микрокапсулы, защищающей микобактерию от внешних воздействий и связанной с клеточной стенкой;
- клеточной стенки, которая обеспечивает клетке стабильность её формы и размера;
- гомогенной цитоплазмы и цитоплазматической мембраны;
- ядерной субстанции (собственно набор хромосом и плазмиды).
Размножение микобактерий происходит путём простого деления на две клетки. Цикл деления клетки составляет от 14 до 24 часов. Реже встречаются случаи размножения МБТ почкованием или ветвлением. На скорость размножения влияют многие факторы окружающей среды.
За свою тысячелетнюю историю бактерии приобрели различные механизмы защиты и приспособления к неблагоприятным для них внешним условиям.
Оптимальная для роста МБТ температура – 37 – 38°С. Размножаются они при температурном режиме от 29°С до 42°С. Однако, туберкулёзные палочки в состоянии сохранить свою жизнеспособность в условиях как очень низких, так и довольно высоких температур (н.п., при температуре в 80°С палочка является жизнеспособной ещё на протяжении 5 минут, при кипячении гибнет через 15 минут).
Наиболее комфортно бактерии чувствуют себя в сырых и тёмных условиях, на ярком солнце и при высокой температуре окружающей среды они прекращают интенсивное размножение и гибнут через полтора-два часа. Ультрафиолетовые лучи в состоянии уничтожить микобактерии за 2 – 3 минуты.
На протяжении многих месяцев МТБ в состоянии выжить, находясь вне живого организма. В водной среде они сохраняются около 150 дней, в пыли на улицах – до 10 дней, на книжных страницах до 3 месяцев. В высушенной форме микобактерии могут выживать в периоде до 3-х лет, а в замороженном состоянии их жизнеспособность может достигать и 30 лет.
В неблагоприятных для бактерии условиях, при лечении туберкулёза с помощью химиотерапии или при мощном иммунитете, палочка Коха быстро вырабатывает устойчивость к препаратам, может принять L -форму, способна сохраняться в таком состоянии целые десятилетия и вызывать противотуберкулёзный иммунитет. У пациентов, длительное время принимавших противотуберкулёзные препараты, бактерии могут принимать мелкие фильтрующиеся формы.
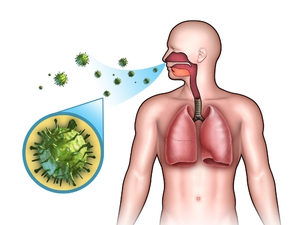
Основной путь передачи mycobacterium tuberculosis – воздушно-капельный. Этим путём передаётся до 95% из всех случаев заболевания туберкулёзом. Заражение происходит при кашле, чихании и даже во время разговора с инфицированным активной формой туберкулёза больным. Достаточно редко (в пределах 3 – 5 % от общего числа заболеваний) встречается передача МТБ через инфицированные продукты питания или от заражённых животных. Наиболее часто подвержен этому заболеванию крупный рогатый скот и свиньи. Гораздо реже им страдают собаки и кошки.
Практически любой орган или ткань человеческого организма, включая костные ткани, может быть подвержен заболеванию туберкулёзом. Более 90% всех случаев заболевания поражает органы дыхания. Наиболее часто из других внелегочных форм происходит поражение микобактериями мочеполовой системы, суставов, печени и почек.
Лабораторная диагностика и методы исследования материала на содержание микобактерий

При подозрении на туберкулёз органов дыхания материалом для лабораторного исследования является мокрота. При этом лучшие результаты даёт анализ мокроты, собранной на протяжении от 12 часов до суток. При локализации заболевания в других органах в качестве материала для анализа могут выступать разнообразные виды жидкостной среды человеческого организма: жидкость из брюшной полости или из полости суставов, спинномозговая жидкость, промывные воды бронхов кровь и гнойные выделения из ран.
При подозрении на туберкулёз внелегочных форм в качестве материала для лабораторного анализа также используют кусочки тканей органов, взятые при биопсии, пункциях и соскобах.
Если речь идёт о возможном заражении половой или мочевыделительной системы, на анализ берут мочу, собранную после ночного сна утром, как правило, это средняя порция мочи. У женщин для обследования на туберкулёз женских половых органов используют менструальную кровь, которую собирают с помощью колпачка Кафки.
В исследовании материала современная медицина применяет следующие методы:
- бактериологические;
- микроскопические;
- аллергологические;
- биологические;
- молекулярно – генетические и серологические методы (применяются достаточно редко).
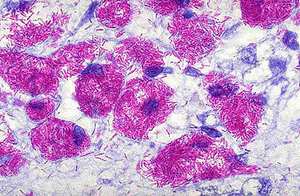
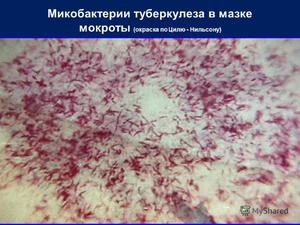
Этот метод является наиболее распространённым и заключается в исследовании мазков, выделенных из собранного материала (мокроты, мочи, спинномозговой жидкости и др.). Суть заключается в окрашивании материала по методу Циля-Нильсена или флуорохромом (как правило, аурамин-родомином или другим), и в дальнейшей обработке спиртом и промывании водой. После чего материал исследуется под люминесцентным микроскопом. Mycobacterium tuberculosis , обработанные флуорохромами, излучают золотистый цвет на тёмно-зелёном фоне. Обработанные по методу Циля - Нильсена туберкулёзные палочки имеют рубиново-красный цвет.
Для обнаружения L -форм используется в большинстве случаев фазово-контрастная микроскопия.
Необходимо просмотреть не менее 100 полей зрения для вынесения положительного ответа при обнаружении mycobacterium tuberculosis , при этом следует указать число бактерий в каждом поле. Однако следует отметить, что наличие отрицательного результата при микроскопии не даёт гарантии полностью исключить диагноз туберкулёза.
Микроскопический метод анализа имеет определённые недостатки, к которым в первую очередь относится низкая чувствительность: mycobacterium tuberculosis обнаруживается только при присутствии не менее 50 – 100 тысяч микробов на 1 мл исследуемого материала. Этот метод не позволяет отличить mycobacterium tuberculosis от других видов mycobacterium , он также не в состоянии определить чувствительность микобактерий к определённым химиотерапевтическим препаратам.
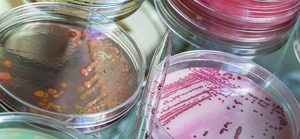
Этот метод представляет собой посев штаммов бактерий на специальные питательные среды и в состоянии определить наличие туберкулёзных палочек при концентрации 200 – 300 микробов на 1 мл. Посев помещается в термостат и на протяжении трёх месяцев при температуре 37 °С еженедельно наблюдается рост микобактерий.
Главный недостаток этого метода состоит в том, что получение конечных результатов требует определённых затрат времени (от 3 до 12 недель). На искусственных средах рост микобактерий наступает через 3 – 6 недель. У пациентов, проходящих курс химиотерапии, выделенные штаммы вырастают на ещё более поздних сроках (от 50 до 80 дней). На сегодня современной медициной испытаны и ускоренные методы выращивания культур mycobacterium tuberculosis по методу Прайса (на препаратах – мазках) и по методу посева на кровяной среде.
С помощью бактериологического метода можно определить не только вирулентность культуры, но и её чувствительность к различным медицинским препаратам.
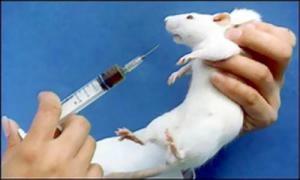
Этот метод относится, пожалуй, к самым рациональным методам исследования. Он позволяет определять микобактерии туберкулёза при малых количествах их содержания в материале (до 10 бактерий на 1 мл).
При этом методе материал вводиться морским свинкам подкожно или в брюшную полость. Если в материале присутствуют вирулентные mycobacterium tuberculosis , то обычно через 10 – 12 дней на месте инъекции образуется уплотнение, которое переходит в незаживающую язву. На протяжении 2 – 4 месяцев развивается генерализованный туберкулёз и свинки погибают.
Ускоренный биологический метод заключается во введении материала в региональный лимфоузел морской свинки. Увеличенный узел вырезается на 8 – 10 день и исследуется на присутствие микобактерий туберкулёза в препаратах-отпечатках.
В связи, с распространением в последние годы изменённых и устойчивых микобактерий чувствительность этого метода заметно снизилась. На сегодняшний день метод применяется в крупных специализированных лабораториях и требует строгого соблюдения режима проведения.
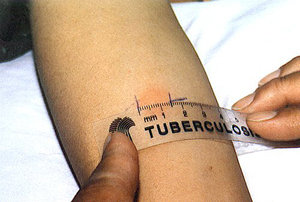
К этому методу относятся широко применяемые кожные туберкулиновые пробы. Проба Манту предусматривает введение туберкулина в предплечье, даёт положительные, отрицательные и резко положительные реакции. У детей и взрослых вводится различная концентрация вещества.
При помощи пробы Манту определяется круг лиц для проведения ревакцинации. Положительная проба Манту не является обязательным признаком наличия заболевания.
Профилактика

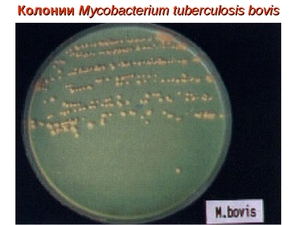
Основной профилактикой распространения микобактерий и предотвращение заболевания туберкулёзом является вакцина БЦЖ (Бацилла Кальметта-Герена). Вакцину изготовляют из штамма ослабленной живой mycobacterium bovis (бычий вид туберкулёзной палочки). При отсутствии противопоказаний вакцинацию проводят новорождённым в роддоме на 5 – 7 день жизни. Ревакцинация проводится в возрасте 7, 12, 17 и 22 лет при отрицательном результате пробы Манту и при отсутствии противопоказаний.
Взрослым с целью выявления туберкулёза на ранних стадиях не реже 1 раза в год необходимо проходить флюорографию лёгких в поликлинике. При резких изменениях реакции Манту за год или в случаях контакта с инфицированным больным фтизиатр может предложить проведение курса профилактической химиотерапии.
Туберкулез
Туберкулез - хроническая инфекция с длительным периодом выделения возбудителя, многообразием клинических проявлений, поражением различных органов и систем - представляет непростую задачу для лабораторной диагностики. Молекулярно-биологические методы (ПЦР) используются для выявления, видовой дифференциации и определении лекарственной устойчивости микобактерий туберкулезного комплекса.
Ввиду биологических особенностей возбудителя и иммунного ответа человека диагностика туберкулеза не может ограничиваться каким-либо одним методом и должна проводиться комплексно.
Выбор, предобработка биоматериалов.
Возбудители туберкулеза могут быть обнаружены в различных биоматериалах, природа которых определяет выбор наборов реагентов для экстракции ДНК. Ключевой принцип выбора биоматериала для диагностики туберкулеза методом ПЦР: необходимо выбирать биоматериал, соответствующий клинической форме туберкулезной инфекции.
Например, для диагностики туберкулеза мочеполовой системы нужно исследовать мочу или менструальную кровь, рекомендуется также исследовать биоптаты из подозрительного очага. Для диагностики туберкулеза легких используется мокрота, бронхо-альвеолярный лаваж.
Выявление микобактерий туберкулезного комплекса
Набор реагентов АмплиСенс® МТС-FL предназначен для обнаружения ДНК микобактерий туберкулеза – Mycobacterium tuberculosis complex (MTC), включающий в себя виды микобактерий разной степени вирулентности, вызывающих туберкулез у человека (M.tuberculosis, M.bovis, M.africanum, M.microti, M.canetti, М.pinipedii). Данный набор реагентов используется в топической диагностике туберкулеза и позволяет быстро (за несколько часов) с высокой чувствительностью и специфичностью (близким к 100%) определять наличие микобактерий туберкулеза в образце биоматериала. Благодаря высокой скорости и информативности в диагностике туберкулеза, методы амплификации нуклеиновых кислот (в том числе ПЦР) в 2010 году были предложены CDC США для подтверждения диагноза туберкулеза наряду с культуральным методом.
Видовая дифференциация микобактерий туберкулеза методом ПЦР
Не менее важно дифференцирование до вида внутри группы MTC. Это связано с необходимостью определения источника заболевания, определения тактики противотуберкулезной терапии, а также для подтверждения случаев поствакцинальных осложнений. С этой задачей позволяет справиться набор реагентов АмплиСенс® МТС-diff-FL, предназначенный для дифференцирования видов микобактерий туберкулеза внутри MTC: человеческого (M.tuberculosis), бычьего (M.bovis) и вакцинного штамма (M.bovis BCG) – в клиническом материале и культурах микроорганизмов.
Актуальность видовой дифференциации определяется, например, тем, что разные виды микобактерий отличаются профилем лекарственной устойчивости. Например, M.bovis и её вакцинный штамм M.bovis BCG отличаются природной резистентностью к одному из основных противотуберкулезных препаратов - пиразинамиду. Поэтому при туберкулезе, вызванной M.bovis, и БЦЖите пиразинамид не назначается.
Приказом Минздрава РФ от 21.03.2003 № 109 "О совершенствовании противотуберкулезных мероприятий в Российской Федерации" (ред. от 29.10.2009) регламентировано применение наборов реагентов, дифференцирующих M.bovis от ее вакцинного штамма M.bovis BCG, для диагностики БЦЖита.
Взятие, транспортирование и хранение исследуемого материала.
- Бронхо-альвеолярный лаваж (БАЛ) или промывные воды бронхов (ПВБ), ликвор собирают в одноразовые плотно завинчивающиеся емкости из полипропилена (во избежание адгезии клеток на внутренней поверхности емкости) объемом не менее 5 мл.
- Мокроту, мочу (среднюю порцию) собирают в одноразовые градуированные завинчивающиеся емкости с широким горлом объемом не менее 50 мл.
- Кровь, плевральную жидкость собирают в пробирки типа Vacuetteâ с раствором или напылением ЭДТА. Закрытую пробирку с материалом несколько раз переворачивают, чтобы перемешать консервант. Для анализа используют цельную кровь, собранную у пациента утром натощак.
- Менструальную кровь собирают с помощью колпачка Кафка, собранную кровь переносят в сухую одноразовую пробирку.
- Синовиальную жидкость собирают в сухую одноразовую пробирку.
- Секрет предстательной железы получают одним из двух способов: а) После окончания массажа предстательной железы ее секрет собирают в одноразовую стерильную пробирку объемом 1,5 мл; б) При невозможности получить секрет – сразу после массажа собирают первую порцию мочи (в которой содержится секрет предстательной железы).
- Тканевой (биопсийный и операционный) материал помещают в пробирки типа Vacuetteâ с напылением раствора ЭДТА или в одноразовую пробирку, содержащую 0,2 мл стерильного физиологического раствора.
- Культуры микроорганизмов, выросшие на селективных для микобактерий туберкулеза питательных средах.
- Смывы с объектов окружающей среды берут зондами с тампонами, смоченными стерильным физиологическим раствором. Площадь смыва с плоской поверхности составляет 5-10 см2. Рабочую часть зонда с тампоном помещают в пробирку объёмом 1,5 мл с 0,5 мл стерильного физиологического раствора, верхнюю часть зонда отламывают и удаляют.
Хранение материала (в случае отсроченного выполнения анализа, резервирования материала для возможной перестановки, а также хранения архивных образцов) возможно по следующей схеме: предполагаемое хранение в течение 3 суток (кроме мочи) – допускается температура от 2 до 8 °С; хранение не более 1 года - допускается температура не выше минус 16 °С; архивирование образцов на срок более 1 года – температура не должна превышать минус 68 °С. Мочу хранить при температуре от 2 до 8 °С не более 6 ч, в дальнейшем – замораживать. Кровь не замораживают! Допускается двукратное замораживание-оттаивание остального клинического материала.
Транспортирование материала осуществляют в термоконтейнере с хладагентом не более 3 суток
В соответствии с современными программами ВОЗ, основой выявления туберкулёза за рубежом считают проведение микроскопии мазков мокроты, полученной от кашляющих больных, обратившихся к врачам общей практики; мазки окрашивают по Цилю-Нильсену. Эта методика входит в отечественный поликлинический и клинический минимум обследования пациента, выделяющего мокроту. В 1995 г. Минздравмедпром России в приказе № 8 "О развитии и совершенствовании деятельности лабораторной клинической микробиологии (бактериологии) лечебно-профилактических учреждений" подтвердил эту обязанность клинико-диагностических лабораторий. Обязательное бактериологическое исследование мокроты на М. tuberculosis должно быть организовано для нетранспортабельных больных, больных хроническими заболеваниями органов дыхания и мочевыводящей системы, а также для работников неблагополучных по туберкулёзу животноводческих хозяйств. Этот старейший метод полностью сохраняет свое значение вследствие доступности для практических клинико-диагностических лабораторий, низкой стоимости и быстроты выполнения.
При бактериоскопии мазка, окрашенного по Цилю-Нильсену, микобактерии туберкулеза могут быть обнаружены при наличии не менее 100 000 - 1 000 000 бактериальных клеток в 1 мл патологического материала (мокроты). Такое большое количество микобактерий встречается у больных с далеко зашедшими прогрессирующими формами заболевания (диссеминированными и фиброзно-кавернозными). У значительно большего числа больных количество выделяемых ими микобактерий ниже предела метода бактериоскопии, что и является большим минусом этого метода. Только при идеальном выполнении всех требуемых условий, указанных в Приказе № 109 МЗ РФ,-исследование не менее трех проб диагностического материала, правильный сбор мокроты, наличие современного бинокулярного микроскопа и высококачественных реактивов, просмотр до 300 полей зрения - возможно повышение чувствительности до 10000 микробных клеток.
Микобактерии туберкулёза имеют вид тонких, слегка изогнутых палочек различной длины с утолщениями на концах или посередине, располагаются группами и поодиночке (рисунок 1,а) Окрашенные по Цилю-Нильсену мазки микроскопируют с иммерсионной системой не менее 10 мин.
Люминесцентная микроскопия
Метод основан на проникновении в микробную клетку карболового производного флюоресцентного красителя (аурамина, родамина). При окраске флюоресцентным красителем аурамином-родамином микобактерии можно видеть при неиммерсионном 100-кратном увеличении. Более точен результат при окраске по Цилю-Нильсену карболфуксином и иммерсионной микроскопии при 1000-кратном увеличении. Именно окраска мазка по Цилю-Нильсену рекомендована при применении технологий DOTS. Микобактерии в этом случае выглядят светящимися желтыми палочками (рисунок 1, б). Метод имеет неоспоримые преимущества, так как позволяет при меньшем увеличении микроскопа просмотреть фактически весь мазок, так же этот метод экономически более эффективен, так как уменьшается время, затрачиваемое на просмотр мазков.
К недостаткам метода ЛМ следует отнести значительно более высокую стоимость люминесцентного микроскопа, при процедуре окрашивания- соблюдение и коррекция pH мазка, а также освобождение микобактерий в диагностическом материале (особенно в мокроте) от окружающей их слизи, которая препятствует проникновению флуоресцентного красителя в микробную клетку. Поэтому нецелесообразно использование ЛМ для нативной мокроты, но применять этот метод рекомендуется при исследовании мазков, приготовленных после центрифугирования из осадка материала, обработанного для культурального исследования и нейтрализованного после деконтаминации. Поэтому метод ЛМ следует применять в бактериологических лабораториях, где культуральное и микроскопическое исследование может быть произведено из одной и той же порции диагностического материала.
При гистологическом или цитологическом исследовании иногда можно обнаружить характерные для туберкулёза клетки, являющиеся результатом защитной реакции организма на внедрение туберкулёзной палочки. Наличие в цитограмме гигантских клеток Лангханса с несомненностью решает диагноз туберкулёза. Эти клетки имеют очень большие размеры (80 - 90 мкм и более в диаметре). Цитоплазма окрашена в серо-голубой цвет. По её периферии расположено в ряд большое количество ядер (до 20), расположенных в форме кольца (рисунок 1, в).
Другим признаком туберкулёза является присутствие в препарате так называемых эпителиоидных клеток, из которых и развиваются клетки Лангханса. Это происходит при увеличении количества ядер без разделения цитоплазмы, которая только увеличивается в размерах (рисунок 1, г).
Микроскопия позволяет быстро получить результат, но обладает низкой чувствительностью и специфичностью, невозможностью дифференциации кислотоустойчивых микобактерий.
Рисунок 1
Микобактерии туберкулеза
а - метод окраски по Цилю-Нельсену
б - метод люминисцентной микроскопии
в - клетки Лангхаса
г - эпителиоидные клетки
Наиболее распространенным методом выявления микобактерий туберкулеза в нашей стране является культуральный метод. Это "золотой стандарт" бактериологической диагностики туберкулеза, так как чувствительность метода существенно выше микроскопического и дает возможность получить чистую культуру микобактерий для её последующей идентификации и исследования лекарственной устойчивости. Этот метод дает положительные результаты при наличии в исследуемом материале от 20 до 100 жизнеспособных микробных клеток в 1 мл. Однако он трудоемок и длителен в связи с тем, что микобактерии туберкулеза растут очень медленно и их обнаружение может быть зарегистрировано только через 3 недели культивирования.
Исторически сложилось, что питательные среды на яичной основе (Левенштейна-Йенсена, Финна-2, Огавы, Аникина, "Новая", Попеску) получили наибольшее распространение среди плотных питательных сред, применяемых для выделения МБТ. Посев материала на среду Левенштайна-Йенсена проводят в бактериологической лаборатории. Рост первых колоний на классических средах отмечают через 4 - 8 недель. Однако появившиеся в последние годы агаровые среды Миддлбрука (7Н10, 7Н11) позволяют быстрее обнаружить рост микобактерий (от двух до четырех недель) и обеспечивают лучшие возможности для изучения морфологии колоний, чем на яичных средах. Недостатком агаризованных питательных сред является необходимость инкубации посевного материала в термостате с углекислым газом, поэтому агаризованные среды в России практически не применяются.
Следует отметить, что в связи с высокой избирательностью различных штаммов микобактерий и потребностью в полноценных белках до сих пор нет универсальной питательной среды, способной заменить все остальные. В Приказе № 109МЗ РФ для посева диагностического материала на МБТ рекомендуется использовать по одной пробирке международной питательной среды Левенштейна-Йенсена и Финна-2. Однако практика показывает, что кроме указанных сред целесообразно использовать и какую-либо из дополнительных, а посев на три пробирки питательной среды также повышает эффективность культуральной диагностики.
Для полноценной культуральной диагностики туберкулеза необходимо иметь соответствующие помещения и оборудование. Особенно важно наличие центрифуги и антиаэрозольной защитой и способностью обеспечить ускорение 3000g. А также шкафов биологической безопасности для предотвращения внутрилабораторного инфицирования.
Основным недостатком культуральной диагностики туберкулеза является длительность исследования - от трех недель до трех месяцев. Поэтому остаются актуальными дальнейшие исследования по разработке методов ускорения роста микобактерий.
Культуральная диагностика туберкулеза переживает в настоящее время принципиальные изменения, связанные с внедрением в практику полностью автоматизированных систем культивирования МБТ. Главное отличие этих методов - применение жидких питательных сред для культивирования с последующей радиометрической (BACTEC 460), колорометрической (Mb-Bact, Вас- tALERT) и люминесцентной детекцией роста (BACTEC MGIT 960). Рост МБТ на жидкой питательной среде в этих системах удается обнаружить уже через 1 - 2 недели в зависимости от их исходного количества в диагностическом материале. Частота выявления микобактерий так же несколько выше, чем на плотных питательных средах. Автоматизированные системы BACTEC с использованием соответствующих флаконов, содержащих различные противотуберкулезные препараты, позволяют сократить время исследования лекарственной устойчивости микобактерий до 10 - 14 суток.
Из перечисленных автоматизированных систем наиболее эффективна в настоящее время система BACTEC MGIT 960BD. Флаконы MGIT с жидкой питательной средой 7Н9 содержат в придонной части под силиконом флуоресцентный индикатор, "погашенный" высокими концентрациями кислорода. При наличии роста микобактерий в процессе поглощения кислорода индикатор начинает светиться, регистрация флуоресценции в сисиеме BACTEC MGIT производится автоматически. Использование флаконов MGIT возможно и "вручную", тогда регистрацию свечения производят с помощью трансиллюминатора на флаконах MGIT составляет 11 суток.
Основным недостатком BACTEC MGIT, как и других систем BACTEC, является высокая стоимость оборудования (до 100000 долларов США) и флаконов с питательной средой - посев одной пробы диагностического материала стоит до 400 рублей.
Так называемые дефектные по клеточной стенке L-формы микобактерий и других инфекционных патогенов являются результатом изменчивости и основным видом персистирования, то есть переживания в неблагоприятных условиях. Посев на L-формы особенно эффективен при внелегочном туберкулезе, поскольку вегетация МБТ в очагах ВЛТ при повышенном ацидозе и анаэробиозе приводит к снижению их жизнеспособности и ферментативной активности.
Диагноз не может быть поставлен только на основании выявления L-форм микобактерий, но их обнаружение, особенно при верификации методом ПЦР, является весомым аргументом в пользу туберкулезной природы заболевания. В очагах внелегочного туберкулеза наблюдается ранняя L-трансформация микобактерий, поэтому их обнаружение позволяет поставить диагноз на начальных стадиях заболевания.

Микобактерии туберкулеза (mycobacterium tuberculosis) – это крайне опасные микроорганизмы, которые могут провоцировать заболеваемость как у человека, так и у животных. Данные патогенные микроорганизмы отличаются высокой степенью вирулентности, т.е. способны быстро адаптироваться к неблагоприятным внешним факторам.
Они способны за короткий период приобрести резистентность к использующимся для их подавления антибиотикам. Данный эффект сильно усложняет лечение этой бактериальной инфекции.
Какие бактерии вызывают туберкулез
Классификация группы Mycobacterium включает 74 разновидности микробов. Все они являются одноклеточными микроорганизмами. Многие виды микобактерий являются безопасными для человека. Данные типы обитают в почве и водной среде, но не вызывают заболеваемость людей и домашних животных.
Однако есть и опасные формы микобактерий туберкулеза. Наиболее патогенной считается вид mycobacterium tuberculosis. Другое название этого микроорганизма – палочка Коха. Это бактерии, вызывающие туберкулез у людей и животных.
Примерно 95% случаев заражения микобактериозом вызваны этим микробом.
Еще одной часто встречающейся разновидностью микобактерий выступает mycobacterium bovis. Этот микроорганизм чаще поражает крупный рогатый скот. Данная бактерия туберкулеза называется бычьей. У людей, страдающих туберкулезом, болезнь выявляется в 3-6% случаев. Данные бактерии провоцируют кишечную форму заболевания.
К распространенным разновидностям микобактерии относятся птичий и африканский типы. Они не вызывают заболеваемости у людей, но могут под действием различных неблагоприятных факторов контактировать с человеческим штаммом. Это повышает риск появления высоко патогенных атипичных микобактерий, имеющих устойчивость к препаратам.
Строение
Физиология микобактерий туберкулеза обусловлена крайне простым строением. Эти организмы представляют собой прямые или изогнутые палочки. Их длина достигает примерно 1-10 мкм. Их ширина не превышает 0,2-0,6 мкм. Оболочка микроорганизма представлена микрокапсулой. Она состоит из фибриллярных структур и мукополисахаридов. В ней также содержатся факторы вирулентности, отвечающие за изменчивость микобактерий туберкулеза.
Внутри оболочки располагается клеточная стенка. Данный элемент обеспечивает стабильность размера и формы клетки. Кроме того, от данного элемента зависят факторы патогенности и токсичность. Внутри оболочки присутствует цитоплазма. Она отвечает за процесс размножения микобактерий, который протекает путем деления. Внутри микроорганизма присутствует ядерная субстанция. ДНК микобактерии, представленная набором плазмидов и хромосом, содержится ядре.
Свойства
Бактерии возбудители туберкулеза относятся к грамположительным микроорганизмам. Они являются устойчивыми к кислотной среде. Это свойство микобактерии туберкулеза обусловлено присутствием в клеточной стенке воска. Они могут быть как свободноживущими в окружающей среде, так и вести паразитический образ жизни.
Эти организмы отличаются полиморфизмом. Если бактерия попадает в неблагоприятную среду, она переходит в L-форму. В этом виде организм неактивен, но может пережить влияние различных факторов. При изменении характеристик среды на более благоприятные патогенная микрофлора активизируется. Эти микробы не способны продуцировать споры.
Возбудитель туберкулеза является облигатным аэробом. Активизации деления способствуют следующие условия:
- температура 37-38°C;
- повышенное содержание кислорода:
- уровень рН -7,0-7,2.
- наличие белков и глицерина;
- присутствие железа, магния и других минеральных веществ.
Стимулятором их роста является лецитин. Размножение микроорганизмов происходит путем деления. Культивирование микобактерий туберкулеза проводится на яичных, картофельно-желчных и синтетических средах. Палочка при выращивании в искусственных условиях может образовывать R- и S-колонии.
В каком виде будет формироваться колония, зависит от корд-фактора микроорганизма.
Он обуславливает степень вирулентности. R-колонии отличаются шероховатостью и повышенной изменчивостью. S-колонии гладкие и обладают низкой изменчивостью. На жидкой питательной среде всего за 5-7 недель микроорганизмы формируют толстую морщинистую пленку. При проведении экспресс-диагностики применяют метод культивирования на стеклах с использованием жидкой питательной среды. Он позволяет получить результат всего за 2-3 суток.
Туберкулезная бактерия вырабатывает ряд ферментов, в т.ч. эстеразу, аминотрансферазу, трегалозу. Дыхание микроорганизма происходит за счет оксидоредуктазы. Вирулентность микроорганизма связана со способностью выработки пероксидазы и каталазы.
Жизненный цикл микобактерий протекает с продукцией большого количества никотиновой кислоты. Это вещество накапливается в жидкой питательной среде. Из-за этого при добавлении к ней раствора хлорамина Б и цианида калия происходит изменение цвета среды на ярко-желтый.
Для окраски препаратов с возбудителем туберкулеза не применяют анилиновые красители. В данном случае используется метод Циля-Нильсена, предполагающий сернокислое протравливание. При таком подходе в препаратах выявляются ярко-красные палочки, устойчивые к кислотной среде. Они могут располагаться одиночно или скоплениями по 2-3 клеток.
В какой среде выживает
Наличие в микроорганизме липидов обеспечивает ему высокую устойчивость к влиянию различных неблагоприятных факторов. Во внешней среде микобактерии выживают в почве, речной воде, канализационных стоках и других средах. В условиях падения температуры и влияния других неблагоприятных факторов происходит замедление воспроизведения микобактерий и их переход в L-форму. В мокроте и биологических жидкостях микроорганизм может сохраняться на протяжении длительного времени. МБТ устойчивы к дезинфицирующим средствам в стандартных концентрациях.
Сколько живет
Продолжительность жизни микобактерий зависит от характеристики питательной среды и внешних факторов. Жизненный цикл этих бактерий может протекать как внутри организма хозяина, так и в окружающей среде. При отсутствии доступа прямых солнечных лучей, высокой влажности и комнатной температуре в квартире этот микроорганизм проживет на поверхности предметов на протяжении нескольких месяцев.
При рассеянном свете они сохраняются около 1,5 месяцев.
В уличной грязи микобактерии нередко живут до 4 месяцев. В условиях речной воды микобактерии сохраняют жизнедеятельность до 7 месяцев. В сточной воде возбудители заболевания туберкулез могут жить около 1,5 лет. В почве они сохраняются до 2 лет. Под прямыми солнечными лучами бактерии сохраняются около 90 минут.
Как передается у людей
Наиболее часто источником распространения микобактерий являются инфицированные люди. В организме больного патогенная микрофлора стремительно размножается. Выделяются контактный и воздушно-капельный пути распространения микобактерий. Наиболее часто от больного человека инфекция распространяется воздушно-капельным путем. Патогенная микрофлора выделяется при чихании, кашле и при разговоре. В этом случае в воздух попадает большое количество капелек, в которых присутствуют активные микобактерии.
Инфицирование контактным путем часто происходит при совместном использовании средств личной гигиены, а также зараженных предметов интерьера, одежды, продуктов, воды и т.д. Вдыхание капелек, содержащих бактерии, и контакт с зараженными предметами не всегда приводит к инфицированию. В большинстве случаев заражение происходит на фоне длительного контакта с источником инфекции или при наличии сниженного иммунитета.
Исследование на наличие
Использующиеся методы диагностики позволяют выявить наличие туберкулеза до появления выраженных признаков заболевания. Для определения наличия заболевания назначаются:
- общий и биохимический анализы крови;
- исследование микробиологии мокроты;
- проба Манту;
- проба Пирке;
- бронхоскопия;
- бактериологический посев;
- биопсия;
- КТ;
- МРТ.
В процессе диагностики нередко используются новые методы выявления микобактерий туберкулеза. Точные данные позволяют иммунологические и серологические исследования крови и мокроты. Часто применяется при диагностике ПЦР, квантифероновый тест и ИФА. Для выявления внелегочной формы патологии часто назначается РПГА. Нередко оцениваются суммарные показатели, полученные при проведении исследований.
Данный метод обнаружения микроорганизмов, вызывающих туберкулез, предполагает исследование под микроскопом мазков мокроты, ликвора и других жидкостей. Материал окрашивается по методу Циля-Нильсена и дальнейшее обрабатывается спиртом и промывается водой.
В обработанном таким способом препарате микобактерии светятся красным цветом.
Данный эффект хорошо виден при рассмотрении препарата люминесцентным микроскопом. Недостатком этого метода диагностики является то, что действует он только при высокой концентрации бактерий в препарате. Если активность микобактерий невелика, положительная реакция не проявляется при проведении окрашивания.
Для выявления микобактерий и их штаммов диагностика дополняется путем проведения бактериологического посева. Данный метод предполагает занесение бактерий в питательную среду. В дальнейшем емкость перемещается в термостат, где выдерживается при температуре 37°C на протяжении 3-12 недель. Каждый день оценивается активность патогенной микрофлоры. При посеве на кровяной среде удается вырастить культуру быстрее. Это исследование позволяет выявить чувствительность микроорганизмов к антибиотикам и степень вирулентности.
Определение микобактерий биологическим методом позволяет быстро получить результат, даже если содержание в материале патогенных микроорганизмов невелико. Этот способ предполагает введение зараженного материала, полученного от человека, в брюшную полость морской свинки. Всего за 10-12 дней в месте укола формируется уплотнение. В дальнейшем развивается генерализованная форма туберкулеза. Вызываемая введением зараженного препарата реакция губительна для животного.
Примером этого метода выявления туберкулеза является проба Манту. Это исследование предполагает введение туберкулина в кожу предплечья. При отрицательной реакции след от укола исчезает за 72 часа. При положительной пробе появляется пятно, достигающее 1,5-2 см в диаметре. Данное исследование не всегда показательно. Если у человека сильно ослаблен иммунитет, при туберкулезе проба может давать отрицательный результат.
Что убивает
Если иммунная система у человека сильна, она вырабатывает специфические антитела к микобактериям. Они способны уничтожать патогенную микрофлору. Для формирования иммунитета детям делается прививка БЦЖ. Некоторые родители, не имея понятия о важности вакцинации от туберкулеза, отказываются от нее. Палочка Коха быстро погибает под действием:
- ультрафиолета;
- прямых солнечных лучей;
- длительного кипячения.
Поспособствовать гибели бактерий может длительный контакт с хлорсодержащими дезинфицирующими препаратами.
Причины лекарственной устойчивости микобактерий
У патогенной микрофлоры, вызывающей развитие туберкулеза, устойчивость во многом обусловлена генетически заложенной изменчивостью. Высокая вирулентность данного микроорганизма способствует его быстрой адаптации к влиянию возникших неблагоприятных факторов. Это приводит к тому, что каждое последующее поколение бактерий имеет заложенные механизмы нейтрализации влияния внешних неблагоприятных факторов. Кроме того, причины множественной лекарственной устойчивости (МЛУ) микобактерий кроются в нерациональном использовании антибиотиков.
Читайте также:


