Лаборатория молекулярной диагностики туберкулеза сеченова
*Импакт фактор за 2018 г. по данным РИНЦ
Журнал входит в Перечень рецензируемых научных изданий ВАК.
Читайте в новом номере
ЦНИИ туберкулеза РАМН, Москва
В настоящее время лабораторная диагностика занимает ведущее место в выявлении многих инфекционных заболеваний. Подтверждение диагноза туберкулеза основывается на результатах микробиологических анализов при выделении из биологического материала возбудителя – микобактерий туберкулеза. Современная микробиологическая диагностика туберкулеза состоит из нескольких основных групп анализов, направленных на выявление возбудителя, определение лекарственной чувствительности и типирование микобактерий.
Обнаружение возбудителя начинается с наиболее простых и быстрых бактериоскопических методов с использованием светового микроскопа с окраской по Циль–Нильсену и люминесцентного с окраской флюорохромами. Преимущество бактериоскопии – в быстроте получения результата. Однако возможности ее ограничены из–за низкой чувствительности. Этот метод является наиболее экономичным и рекомендован ВОЗ в качестве основного для выявления заразных больных (табл. 1).
При антибактериальной терапии обнаружение микобактерий туберкулеза имеет прогностическое значение. Поэтому бактериовыделение оценивается количественно. Золотым стандартом выявления микобактерий признаны культуральные исследования. Для посева патологического материала используют яичные среды: Левенштейна–Йенсена, среду Финна II, Мордовского и др. Количество микобактерий (или колоний в пробирке при культуральном методе исследования) в процессе химиотерапии является ориентировочным показателем ее эффективности или косвенным свидетельством развития устойчивости микобактерий к противотуберкулезным препаратам.
Для повышения процента выделения микобактерий посевы патологического материала проводят на несколько сред, в том числе и на жидкие в автоматизированных системах учета роста типа BACTEC, что позволяет удовлетворить все культуральные потребности возбудителя. Посевы инкубируют до двух с половиной месяцев. При отсутствии роста к этому времени посев считается отрицательным. Наиболее чувствительным способом обнаружения микобактерий туберкулеза считается метод биологической пробы – заражение диагностическим материалом высокочувствительных к туберкулезу морских свинок.
Развитие молекулярной биологии позволило значительно повысить эффективность обнаружения микобактерий. Базовым методом молекулярно–генетических исследований является полимеразная цепная реакция (ПЦР), направленная на выявление ДНК микобактерий в диагностическом материале. ПЦР дает экспоненциальное увеличение специфического участка ДНК возбудителя: 20 циклов ПЦР приводят к увеличению исходной ДНК в 1 миллион раз, что позволяет визуализировать результаты методом электрофореза в агарозном геле.
Роль молекулярной диагностики в клинической практике повышается, поскольку увеличивается число больных со скудным бактериовыделением. Однако при постановке диагноза результаты ПЦР являются дополнительными и должны сопоставляться с данными клинического обследования, рентгенографии, микроскопии мазка, посева и даже ответа на специфическое лечение.
Интереснейшая область исследования, которая открывается благодаря ПЦР–диагностике, – изучение латентной инфекции M. tuberculosis. По современной концепции туберкулезной инфекции, из 100 человек, контактирующих с M. tuberculosis, 90 могут быть инфицированы, но только у 10 развивается активная болезнь. У остальных 90% инфекция будет оставаться латентной из–за противотуберкулезного иммунитета. Положительные ответы ПЦР при отрицательных результатах посевов патологического материала отмечаются у 55% лиц, подвергавшихся бытовым контактам с M. tuberculosis, и у 80% лиц, у которых туберкулез протекал без рентгенографических проявлений. Проведение ПЦР–исследований у пациентов из групп риска выявляло больных с отрицательными результатами микроскопии и посевов, но с субклинической инфекцией M. tuberculosis [11]. Подобные результаты были получены и в наших исследованиях [6].
Определение лекарственной устойчивости микобактерий
Для определения лекарственной устойчивости микобактерий используется несколько групп методов (табл. 2). По приказу № 558 МЗ РФ от 1978 г. в бактериологических лабораториях России используется метод абсолютных концентраций. В лаборатории ЦНИИТ РАМН внедрен ускоренный метод по тестированию нитратредуктазной активности микобактерий с помощью реактива Грисса.
В крупных противотуберкулезных центрах используются методы определения лекарственной устойчивости в жидких средах с автоматизированной радиометрической и флюоресцентной системой учета роста микобактерий типа ВАСТЕК, позволяющие сокращать срок анализа до 14 дней.
В последнее время разрабатываются новые методы оценки лекарственной устойчивости на уровне генотипа [10]. Работа по изучению молекулярных механизмов резистентности показала наличие у микобактерий генов, связанных с устойчивостью к различным препаратам: к изониазиду – гены katG, inhA, kasA, к рифампицину – rpoB, к стрептомицину – rpsL и 16SрРНК, к этамбутолу – emb1, к фторхинолонам – gyrA и т.д. [7].
Широкомасштабные исследования по изучению спектра мутаций в геноме устойчивых микобактерий показали, что наиболее распространенными были мутации в 531, 526 и 516 кодонах rpoB гена, устойчивость к изониазиду характеризовалась мутациями в 315 кодоне katG гена. В целом спектр мутаций не отличался от выявленных исследователями в разных регионах мира [2].
Доступность данных по молекулярной основе лекарственной устойчивости к противотуберкулезным препаратам дала возможность разработки новых, основанных на ПЦР, методов, представленных в табл. 2. Наши работы, проведенные совместно с Институтом физико–химической медицины МЗ РФ и Институтом молекулярной биологии РАН, продемонстрировали перспективность использования молекулярно–генетических методов для быстрого определения лекарственной устойчивости [1, 3, 4].
Наибольшие надежды по совершенствованию методов для определения лекарственной устойчивости микобактерий связаны с развитием микрочиповой технологии, позволяющей определять устойчивость одновременно к нескольким противотуберкулезным препаратам микобактерий непосредственно из диагностического материала в течение 2 дней [9].
Комплекс методов имеется и для типирования микобактерий, когда используются традиционные культуральные и биохимические методы, биологические, а также молекулярно–генетические (табл. 3). На основе молекулярно–генетического типирования микобактерий интенсивно развивается область молекулярно–эпидемиологических исследований, в которой по генотипу микобактерии выявляются очаги и прослеживаются пути распространения туберкулезной инфекции [5, 8].
#Pt6982.gif В заключение необходимо подчеркнуть, что в настоящее время имеется научный потенциал для совершенствования бактериологических исследований, а благодаря успехам молекулярной биологии существует возможность значительного сокращения сроков выявления микобактерий, определения лекарственной устойчивости и контроля за эффективностью химиотерапии.
1. Альтшуллер М.Л. и др. Применение аллель–специфической амплификации и SSCP для выявления устойчивости к рифампицину клинических изолятов Mycobacterium tuberculosis. // БЭБиМ, 1999; 128(11): 555–8.
2. Генерозов Э.В. и др. Молекулярная характеристика полирезистентных клинических штаммов Mycobacterium tuberculosis из России. // Молекулярная генетика, микробиология и вирусология, 2000; 1: 11–7.
3. Генерозов Э.В.и др. Детекция и характеристика мутаций в rроВ гене резистентных к рифампицину клинических штаммов Mycobacterium tuberculosis. // Проблемы туберкулеза, 1999; 2: 39–42.
4. В.М. Михайлович и др. Использование методов гибридизации и ПЦР на специализированном ТБ–микрочипе для обнаружения рифампицин–резистентных штаммов Mycobacterium tuberculosis // БЭБ и М, 2001, 1: 112–7.
5. Черноусова Л.Н.и др. Молекулярная эпидемиология туберкулеза в тюрьмах. // Актуальные проблемы пенитенциарной медицины. Мат–лы международной научно–практич. конференции, Минск, 2001: 48–50.
6. Черноусова Л.Н., Ларионова Е.Е., Севастьянова Э.В., Голышевская В.И. Роль ПЦР–анализа в комплексных бактериологических анализах во фтизиатрии. // Проблемы туберкулеза, 2001; 3: 58–60.

В 2004 году по инициативе д.м.н., профессора Михаила Александровича Владимирского, заведующего сектором молекулярной диагностики туберкулёза НИИ Фтизиопульмонологии Первого МГМУ им. И.М.Сеченова, мы начали разработки в области ПЦР-диагностики туберкулёза.
Выделение ДНК: использование оригинальных реагентов и магнитных частиц обеспечивает получение максимального количества чистой ДНК и позволяет автоматизировать процесс выделения ДНК.
ПЦР в реальном времени: одновременная детекция нескольких различных участков генома комплекса микобактерий туберкулёза (МБТ) увеличивает информативность и достоверность анализа.
I этап – Пробоподготовка, инактивация
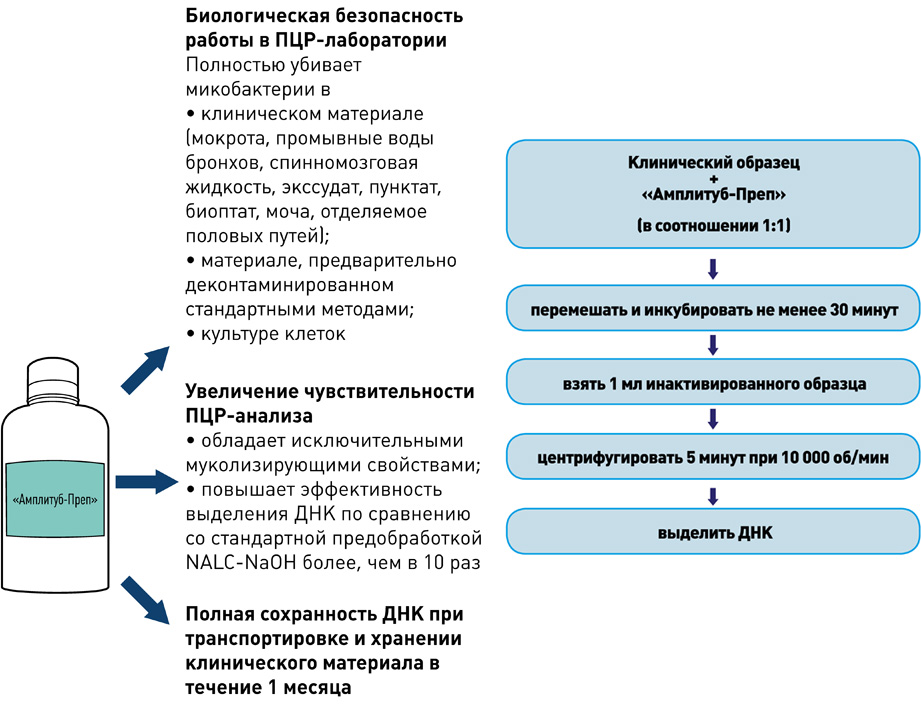
II этап – Выделение ДНК
набор реагентов для выделения ДНК (на магнитных частицах)
набор реагентов для выделения ДНК микобактерий из клинических образцов и культур клеток на автоматизированных станциях TECAN

- Снижение риска контаминации во время выделения ДНК практически до нуля.
- Значительное уменьшение трудоёмкости процесса выделения ДНК.
- Стандартизированное выделение ДНК из клинических образцов.
- Экономическая выгода: низкий расход пластика и реактивов.
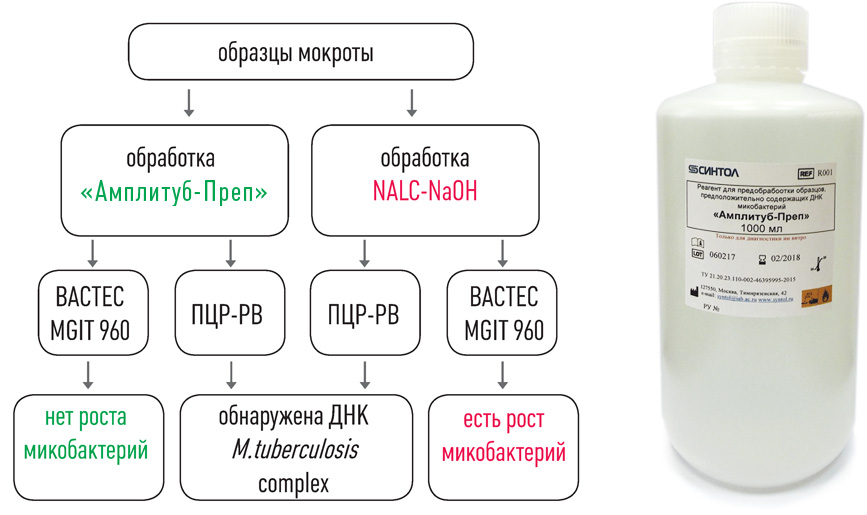
набор реагентов для ускоренной пробоподготовки и выделения ДНК микобактерий из образцов мокроты
III этап – ПЦР в реальном времени
Обнаружение и количественное определение комплекса МБТ
Набор реагентов АМПЛИТУБ-РВ — это:
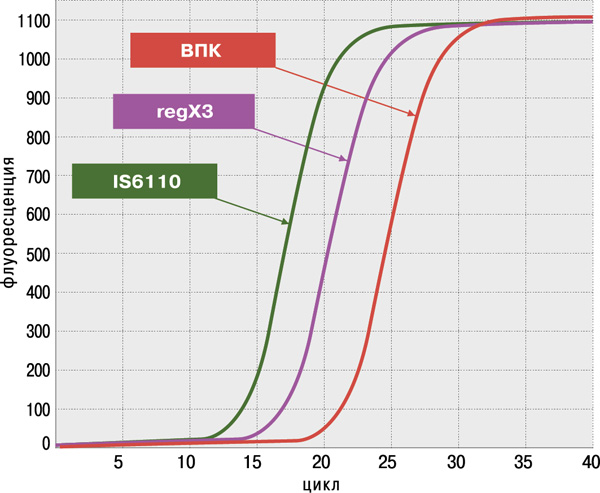
- высокая достоверность анализа благодаря одновременному обнаружению двух специфичных генов M.tuberculosis complex: IS6110 и regX3;
- оценка пригодности образца ДНК для определения антибиотикоустойчивости;
- высокая чувствительность (не более 100 КОЕ/мл мокроты или 1–10 копий фрагментов ДНК в реакции) и 100%‑ая специфичность, подтверждённые на панели QCMD (Quality Control for Molecular Diagnostics) Mtb EQA (UK).
Определение антибиотикоустойчивости МБТ к препаратам I и II ряда
Наборы реагентов АМПЛИТУБ-МЛУ-РВ, АМПЛИТУБ-FQ-РВ — это:
- диагностика форм туберкулеза с лекарственной устойчивостью, в том числе множественной лекарственной устойчивостью (МЛУ) и широкой лекарственной устойчивостью (ШЛУ);
- быстрая детекция мутаций M.tuberculosis, ассоциирующихся с устойчивостью к антибиотикам первого и второго ряда (рифампицину, изониазиду, этамбутолу, фторхинолонам);
- достоверность результатов, ежегодно подтверждаемая при проведении Федеральной службой внешней оценки качества (ФСВОК) Росздравнадзора испытаний шифрованных тест-культур и образцов.
Наборы АМПЛИТУБ-МЛУ-РВ и АМПЛИТУБ-FQ-РВ основаны на использовании оригинальной мультиконкурентной аллель-специфичной методики ПЦР в реальном времени, позволяющей выявлять мутации в генах микобактерий туберкулеза, ответственных за устойчивость к конкретным антибиотикам.

Принцип мультиконкурентной аллель-специфичной методики ПЦР в реальном времени
- В формате одной пробирки используются 5’-флуоресцентно-меченые аллель-специфичные праймеры с общим комплементарным им 3’-меченым олигонуклеотидом-гасителем и контрольный флуоресцентный зонд, комплементарный участку ДНК без мутаций.
- При отсутствии мутаций в ДНК нарастание флуоресценции в ходе ПЦР-РВ наблюдается только по флуорофору зонда.
- При наличии мутаций в ДНК нарастание флуоресценции в ходе ПЦР-РВ наблюдается как по флуорофору зонда, так и по флуорофору 5’-флуоресцентно-меченого аллель-специфичного праймера. Данный метод позволяет определить не только точку мутации, но и процент устойчивого мутантного штамма МБТ на фоне дикого.
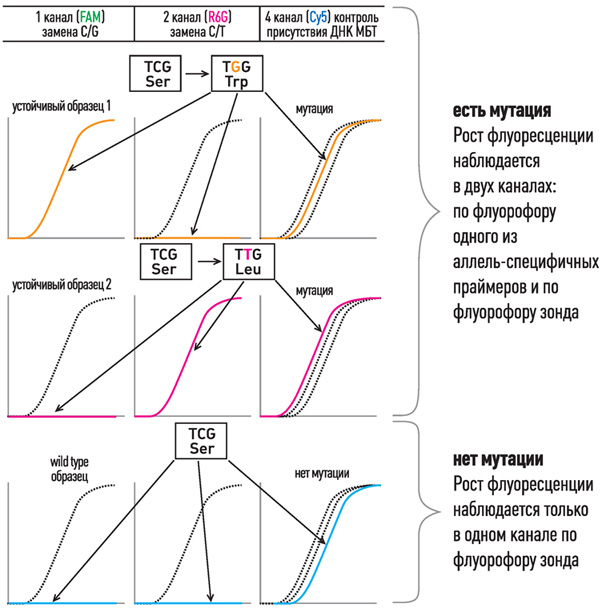
Интерпретация результатов выявления мутаций на примере
531 кодона rpoB гена M.tuberculosis
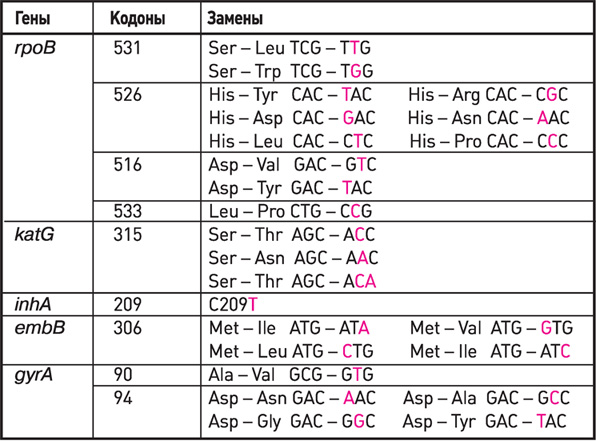
Гены, кодоны, замены, используемые в наборах реагентов
АМПЛИТУБ-МЛУ-РВ при определении антибиотикоустойчивости
Использование автоматизированных станций Freedom EVO (TECAN, Швейцария) для молекулярно-генетической диагностики туберкулёза
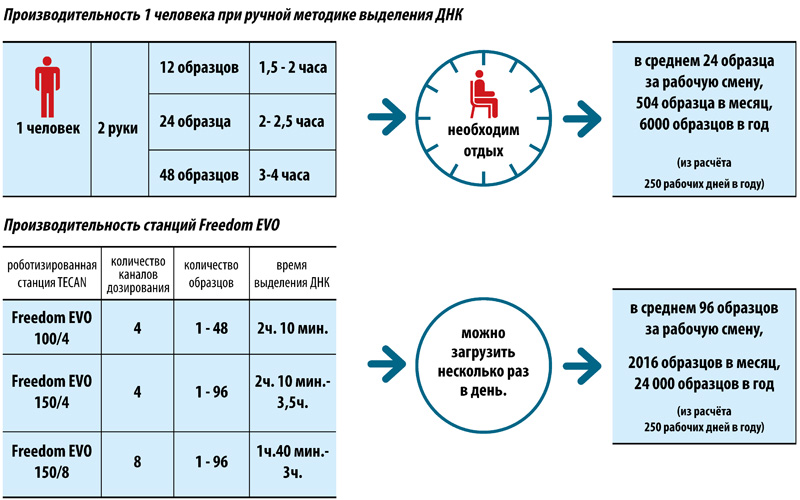

Трудозатраты — 1 час
Продолжительность выделения ДНК — не более 2 часов
Подготовка к амплификации и ПЦР-РВ — 1,5 часа
ИТОГО: результаты анализа будут готовы через 3,5 часа
Оператор затратит 1 час своего рабочего времени.
Государственное бюджетное учреждение здравоохранения
Клинический
противотуберкулёзный диспансер
министерства здравоохранения Краснодарского края
Краснодар, ул. Айвазовского, 95

Горячая линия по оказанию помощи детям
8-918-382-91-00
Горячая линия по оказанию помощи взрослому населению
8-952-81-81-418
Горячая линия по стационарной помощи
8-952-81-81-311
- Главная --> -->
- Сведения о мед.организации --> -->
- Структура --> -->
- Лаборатории --> -->
- Бактериологическая лаборатория
Бактериологическая лаборатория
Волкова Влада Викторовна
врач высшей категории
г. Краснодар, ул. Айвазовского, 95
Как добраться?
- Посевы патологического материала на микобактерии туберкулеза;
- Определение лекарственной устойчивости выделенных культур к четырем противотуберкулезным препаратам первого ряда и семи препаратам резервного ряда;
- Типирование микобактерий, относящихся к микобактериям туберкулезного комплекса методом ПЦР-диагностики;
- Бактериоскопическое исследование диагностического материала на микобактерии туберкулеза.
- Посевы патологического материала на неспецифическую микрофлору с выделением чистой культуры и определением лекарственной чувствительности к антибактериальным препаратам;
- Санитарно-бактериологические исследования;
- Исследование патологического материала на микобактерии туберкулеза методом ПЦР-диагностики;
- Посев на микобактерии туберкулеза и определение лекарственной устойчивости с использованием автоматизированной системы BACTEC MGIT 960.
- Исследование на автоматизированной системе с использованием жидких сред
Резкое ухудшение эпидситуации по туберкулезу во многом обусловлено увеличением числа больных остропрогрессирующими распространенными формами туберкулеза с массивным выделением лекарственно-устойчивых форм возбудителя заболевания. Одной из основных задач диагностики туберкулеза является сокращение сроков выявления микобактерий туберкулеза и определения лекарственной чувствительности для своевременной госпитализации больного, назначения адекватного лечения и корректного применения антибактериальных препаратов.
Действие системы основано на регистрации флюоресценции, возникающей при поглощении растущими микобактериями кислорода из пробирок. Положительный рост микобактерий может наблюдаться уже на 4-10 сутки максимальный протокол исследования 42 дня, для сравнения, при классической методике исследования видимый рост микобактерий появляется через 3 недели, а отрицательный результат выдается через 12 недель-90 дней. Исследуется любой диагностический материал кроме крови и мочи. В среднем полное обследование одного бактериовыделителя с определением чувствительности к противотуберкулезным препаратам первого ряда выполняется за 2-4 недели. Данная методика поглощает все недостатки классического метода посева на плотные питательные среды и позволяет в кратчайшие сроки провести дифференциальную диагностику туберкулеза от неспецифической патологии, правильно выбрать тактику ведения больного.
- Исследования с помощью молекулярно-генетических методов
Благодаря повышенному вниманию к проблеме туберкулеза достигнуты значительные успехи в молекулярно-биологических исследованиях микобактерий туберкулеза. Метод ПЦР является наиболее эффективным методом среди методов молекулярной диагностики. Использование этого метода позволяет с высокой степенью специфичности выявить микобактерии в течение короткого срока при наличии 10 клеток в 1 мл. материала и следовательно по своей чувствительности значительно превосходит бактериоскопические и даже культуральные методы. Метод обеспечивает диагностику при сниженной жизнеспособности микобактерий. Некоторые данные свидетельствуют о высокой эффективности ПЦР-анализа для диагностики туберкулеза мочевой системы и туберкулеза мужских половых органов. Быстрота проведения анализа(1-2 дня) чрезвычайно ценна для клинической практики.
Сочетание ПЦР анализа с культивированием диагностического материала с использованием автоматизированной системы BACTEC MGIT 960 позволит оценивать эффективность лечения, особенно у больных с ограниченными формами туберкулеза.
КВАНТИФЕРОНОВЫЙ ТЕСТ (QuantiFERON®-ТВ Gold) – современный лабораторный тест для выявления туберкулезной инфекции, альтернатива классическому кожному тесту с туберкулином. В настоящий момент в различных странах разработано и выпущено большое число национальных рекомендаций по применению данного теста.
Квантифероновый тест основан на определении INF-γ (гамма-интерферона), высвобождаемого сенсибилизированными Т-клетками, стимулированными in vitro специфическими протеинами (ESAT-6, CFP-10, TB7.7 (p4)) микобактерий туберкулеза, входящих в комплекс Mycobacterium tuberculosis complex (M. tuberculosis, M. bovis, M. canettii, M. caprae, M. pinnipedii, M. mungi, M. microti, M. africanum и др.). Эти протеины отсутствуют в вакцинных штаммах M. bovis BCG и в большинстве нетуберкулезных микобактерий, за исключением M. kansasii, M. szulagai, M. marinum.
В исследуемой крови пациента (из пробирки с ТВ-антигеном) определяется содержание INFγ, результат анализируется в совокупности с данными, полученными из 2-х других пробирок (выполняющих роль контрольных).
Примерно 1/3 часть населения мира инфицирована МБТ, и только у 5-10% инфицированных лиц развивается заболевание. При наличии неблагоприятных факторов латентная туберкулезаня инфекция (ЛТИ – состояние, когда микобактерии туберкулеза (МБТ) присутствуют в организме человека, но при этом отсутствуют клинические и рентгенологические признаки туберкулеза) может перейти в активную форму с развитием внелегочного туберкулеза (например, туберкулез почек).
К группе высокого риска инфицирования МБТ относятся лица, имевшие контакт с больным туберкулезом, или имеющие высокую вероятность контакта (работники противотуберкулезных диспансеров, приютов, исправительных учреждений и др.), а также лица с сопутствующими заболеваниями (ВИЧ-инфекцией, сахарным диабетом и др.).
Используемые для диагностики ЛТИ кожные тесты – проба Манту и Диаскинтест®, имеют ряд противопоказаний и ограничений к применению.
Противопоказания к проведению пробы Манту и Диаскинтеста:
- Индивидуальная непереносимость туберкулина;
- Острые и хронические инфекционные заболевания и соматические заболевания в период обострения;
- Кожные заболевания и аллергические состояния в период обострения;
- Период карантина в детских коллективах.
У пациентов с индивидуальной гиперчувствительностью к туберкулину может наблюдаться ложноположительная реакция.
Сравнение тестов для диагностики туберкулезной инфекции
| Параметр | Проба Манту | Диаскинтест® | Квантифероновый тест |
|---|---|---|---|
| Метод исследования | Кожный тест | Кожный тест | Исследование крови |
| Побочные реакции | Возможны | Возможны | Нет |
| Противопоказания | Есть | Есть | Нет |
| Специфичность | Низкая | Высокая | Высокая |
| Ложноположительные результаты после вакцинации БЦЖ | Да | Нет | Нет |
| Зависимость от сроков проведения профилактических прививок | Да (не ранее чем через месяц) | Да (не ранее чем через месяц) | Нет |
| Интерпретация результатов | Субъективна | Субъективна | Объективна |
Преимущества КВАНТИФЕРОНОВОГО ТЕСТА:
- отсутствие противопоказаний и ограничений по времени проведения;
- отсутствие ложноположительных результатов в случае вакцинации БЦЖ;
- безопасность процедуры и отсутствие побочных реакций;
- интерпретация результатов этого теста менее субъективна, чем интерпретация результатов кожных туберкулиновых тестов;
- высокая специфичность (99,1%) и высокая чувствительность (89,0%).
Показания к назначению КВАНТИФЕРОНОВОГО ТЕСТА:
- Выявление ЛТИ в группах высокого риска: работники специализированных противотуберкулезных и других учреждений, где есть высокий риск контакта с возбудителем или больным туберкулезом, пациенты с сопутствующими заболеваниями и др.;
- Наличие известных контактов с больным туберкулезом (бактериовыделителем);
- Наличие положительной реакции пробы Манту для исключения поствакцинальной реакции;
- Наличие противопоказаний к проведению кожных туберкулиновых проб (пробы Манту и Диаскинтеста®);
- Дифференциальная диагностика инфекций, вызванных МБТ;
- Обследование иммигрантов.
Пример результата исследования и интерпретация:
| Параметр | Результат | Критерии оценки результатов |
|---|---|---|
| Содержание гамма-интерферона в контрольной пробирке (NIL) | 0,05 | До 8,00 |
| Содержание гамма-интерферона в пробирке с ТВ-антигеном (ТВ Ag) | 0,09 | Менее 0,35 (или свыше 0,35, но до 25% контрольного значения NIL) |
| Содержание гамма-интерферона в пробирке с митогеном (Mitogen) | 9,56 | От 0,50 |
| Квантифероновый тест (диагностика туберкулеза) | Отрицательный | Отрицательный |
Интерпретация результата исследования
| Положительный результат | Сомнительный результат | Отрицательный результат |
|---|---|---|
|
|
Продолжая использовать наш сайт, вы даете согласие на обработку файлов cookie, пользовательских данных (сведения о местоположении; тип и версия ОС; тип и версия Браузера; тип устройства и разрешение его экрана; источник откуда пришел на сайт пользователь; с какого сайта или по какой рекламе; язык ОС и Браузера; какие страницы открывает и на какие кнопки нажимает пользователь; ip-адрес) в целях функционирования сайта, проведения ретаргетинга и проведения статистических исследований и обзоров. Если вы не хотите, чтобы ваши данные обрабатывались, покиньте сайт. Copyright ФБУН Центральный НИИ Эпидемиологии Роспотребнадзора, 1998 - 2020
! Продолжая использовать наш сайт, вы даете согласие на обработку файлов cookie, пользовательских данных (сведения о местоположении; тип и версия ОС; тип и версия Браузера; тип устройства и разрешение его экрана; источник откуда пришел на сайт пользователь; с какого сайта или по какой рекламе; язык ОС и Браузера; какие страницы открывает и на какие кнопки нажимает пользователь; ip-адрес) в целях функционирования сайта, проведения ретаргетинга и проведения статистических исследований и обзоров. Если вы не хотите, чтобы ваши данные обрабатывались, покиньте сайт.
Университетская клиническая больница фтизиопульмонологии является структурным подразделением Клинического центра ГБОУ ВПО Первого МГМУ им. И.М. Сеченова. Клиника оказывает медицинскую помощь с 1918 года больным туберкулезом гражданам РФ, стран Ближнего и Дальнего Зарубежья. На бюджетной основе проводится лечение пациентов с туберкулезом легких и внелегочными локализациями при наличии направления из региональных Управлений Здравоохранения. Все остальные граждане могут получить специализированную медицинскую помощь на платной основе, оформив Договор на предоставление платных медицинских услуг в консультативном отделении клиники. В настоящее время общий штат коек УКБ фтизиопульмонолгии составляет 386, в том числе для лечения легочных форм туберкулеза – 200, для больных туберкулёзным менингитом - 10, для больных туберкулезом, сочетанным с ВИЧ-инфекцией -15. Для хирургического лечения больных туберкулёзом развернуто 50 коек и 6 реанимационных. Для лечения больных туберкулёзом детей в возрасте от 3 до 18 лет функционирует 60 койко-мест. Основные направления лечебной и диагностической работы включают: В УКБ ФП работают высококвалифицированные специалисты в области фтизиатрии, пульмонологии, педиатрии, торакальной хирургии, лабораторной диагностики, лучевой диагностики. Сотрудники больницы являются членами Российского общества фтизиатров, профильных рабочих групп Минздрава России, экспертами Всемирной организации здравоохранения по вопросам борьбы с туберкулезом, членами Рабочей Группы Высокого Уровня по туберкулезу, Европейского респираторного общества, Международного союза борьбы с туберкулезом и болезнями легких. В клинике функционирует бактериологическая лаборатория, оснащенная самым современным лабораторным оборудованием, включающим молекулярно-генетические методы и автоматизированные системы бульонного культивирования для выявления микобактерий и определения их лекарственной чувствительности, что позволяет сократить сроки диагностики в два раза, повысить процент высеваемости микобактерий и существенно ускорить определение лекарственной устойчивости по сравнению с применявшимися ранее, а значит подобрать эффективный курс противотуберкулезной терапии. В УКБ фтизиопульмонологии проводится исследование иммунного статуса методом проточной цитофлюориметрии, иммуноферментного анализа. На базе УКБ фтизиопульмонологии работает лечебно-диагностическое отделение, которое обеспечивает обследование в амбулаторных условиях с целью диагностики, определения стадии процесса и выбора лечебной тактики для больных со сложным течением заболевания, направленных из других лечебно-профилактических учреждений. Лечебно-диагностическое отделение проводит очные, заочные консультации больных туберкулезом и лиц с подозрением на туберкулез. В консультационном отделении можно провести диагностику туберкулезной инфекции с помощью ДИАСКИН-ТЕСТА, реакции Манту с 2 ТЕ, пробы Коха. Лучевая диагностика включает в себя традиционную рентгенографию, цифровую малодозовую рентгенографию высокого разрешения для выявления и диагностики туберкулеза органов дыхания. Для уточнения выявленной патологии используется спиральная компьютерная томография, а также ультразвуковая диагностика экссудативных плевритов и краевых образований легких, патологии щитовидной железы, сердца, сосудов, лимфатических узлов, органов брюшной полости, мочеполовой системы и молочных желез. Высокотехнологичная медицинская помощь (ВМП) При появлении талона-направления на оказание ВМП в подсистеме мониторинга реализации государственного задания по оказанию ВМП за счет средств федерального бюджета пациенту определяется дата госпитализации. Приемная главного врача - (495) 681-51- 23 Отделение терапии туберкулеза легких № 2 - заведующий отделением, к.м.н. Сенчихин Павел Владимирович - (495) 684-57-30 Отделение терапии туберкулеза легких № 3 - заведующий отделением, к.м.н. Береснева Раиса Егоровна - (495) 681-39- 21 Отделение терапии туберкулеза легких № 4 - заведующий отделением, к.м.н. Дадашева Белла Бексултановна - (495) 681-45- 35 Туберкулезное детско-подростковое отделение – и.о. заведующий отделением, к.м.н. Казаков Алексей Владимирович - (495) 681-92- 36 Туберкулезное легочно-хирургическое отделение – заведующий отделением, к.м.н. Бижанов Ануар Бахтыбаевич - (495) 688-27- 78 Лечебно-диагностическое отделение - заведующий отделением, к.м.н. Щербакова Галина Владимировна, тел.: 8(495) 681-45-38 Эндоскопическое отделение - заведующий отделением, к.м.н. Глотов Алексей Александрович - (495) 681-45- 35 Рентгенодиагностическое отделение - заведующий отделением, д.м.н. Ратобыльский Геннадий Викторович (495) 681-10-01 Клинико - диагностическая лаборатория - заведующая лабораторией Грачева Марина Петровна - (495) 681-08- 72 Читайте также:
 Пожалуйста, не занимайтесь самолечением!При симпотмах заболевания - обратитесь к врачу. Пожалуйста, не занимайтесь самолечением!При симпотмах заболевания - обратитесь к врачу.
|



