Кислотоустойчивые бактерии при туберкулезе
Консультант по гематологии,
цитохимии и микробиологии
Важное место в общем комплексе клинико-лабораторных исследований, применяемых для профилактики, диагностики и лечения гнойно-воспалительных заболеваний и осложнений у больных в лечебно-профилактических учреждениях занимают микробиологические исследования. Современная клиническая медицина предъявляет к микробиологическим (бактериологическим) исследованиям возрастающие требования по увеличению объема, повышению качества исследований, разработке и внедрению новых более совершенных методов. Это связано как с новыми научными достижениями в области эпидемиологии и бактериологии, так и с увеличением гнойно-воспалительных заболеваний, ростом госпитальных инфекций.
Материалом для изучения этиологии заболеваний дыхательных путей служат: отделяемое зева и носа; мокрота; содержимое бронхов, полученное при бронхоскопии или при отсасывании через трахеостому (у больных, находящихся на аппаратном дыхании); экссудаты; резецированные ткани и др. Материал собирают с соблюдением правил асептики в предварительно простерилизованные баночки или пробирки и доставляют в лабораторию. Хранение материала способствует размножению сапрофитирующей микрофлоры, развитию процессов гниения и брожения, что искажает результаты анализа. Интервал между взятием материала и его посевом не должен превышать 1-2 часа. Самым простым методом выявления микобактерий туберкулеза в выделениях больных является микроскопия мазка, приготовленного из мокроты. При бактериоскопии мазка, окрашенного по Цилю-Нильсену, микобактерии туберкулеза могут быть обнаружены при наличии не менее 100 000 - 1 000 000 бактериальных клеток в 1 мл патологического материала (мокроты). Такое большое количество микобактерий встречается у больных с далеко зашедшими прогрессирующими формами заболевания (диссеминированными и фиброзно-кавернозными). У значительно большего числа больных количество выделяемых ими микобактерий ниже предела метода бактериоскопии.
Чувствительность метода люминесцентной микроскопии значительно выше - от 10 000 до 100 000 микобактерий в 1 мл материала, кроме того, этот метод дает возможность за значительно более короткое время просмотреть необходимое количество препаратов. Эффективность бактериоскопии повышается также при передаче изображения на компьютер при помощи присоединенной к микроскопу видеокамеры.
Чтобы диагностировать туберкулез, необходимо сделать все возможное для выявления возбудителя заболевания. Микробиологически диагноз может быть подтвержден на основе результатов культурального исследования на комплекс M. tuberculosis (или, при возможности, путем идентификации специфических последовательностей нуклеиновых кислот) в пробах, взятых в месте локализации патологического процесса. Однако на практике в настоящее время многие лаборатории не располагают материально-технической базой для проведения культуральных исследований. К счастью, микроскопия окрашенных препаратов мокроты доступна практически везде, поэтому диагностика туберкулеза может проводиться на основе выявления кислотоустойчивых микобактерий. На территориях с высокой распространенностью туберкулеза выявление кислотоустойчивых микобактерий в окрашенных препаратах мокроты демонстрирует высокую специфичность, поэтому положительный результат микроскопии мокроты можно рассматривать как подтверждение диагноза. Кроме высокой специфичности к комплексу M. tuberculosis, выявление кислотоустойчивых микобактерий при микроскопии играет важную роль по трем причинам: это – наиболее быстрый метод диагностики туберкулеза; позволяет выявить больных с тяжелым развитием патологии, чреватым высоким риском летального исхода; дает возможность выявить больных, являющихся распространителями инфекции.
Оценка качества работы лабораторий микроскопии должна проводиться соответствующим государственными органом (как правило, представителями национальной программы борьбы с туберкулезом).
Неправильный диагноз, поставленный перед началом лечения, приводит к риску ненужного, неправильного или неудачного лечения. Более того, подобный подход чреват несвоевременной постановкой правильного диагноза и назначением соответствующего лечения. При надлежащем подходе и контроле в большинстве случаев у детей в возрасте пяти лет и старше могут быть получены образцы мокроты. У подростков (хотя они часто относятся к детской возрастной группе, по крайней мере, до 15 лет) получить пробы мокроты не составляет большого труда. Поэтому фактор возраста не может рассматриваться как препятствие для сбора проб мокроты у детей и подростков.
Исходя из имеющихся данных, можно прийти к заключению, что для диагностики туберкулеза необходимо взять не менее двух проб мокроты. В случаях, когда имеются соответствующие возможности, можно направлять для лабораторного исследования еще и третью пробу, но исследование более трех проб мокроты вряд ли целесообразно, поскольку не может в значительной мере повысить эффективность диагностики. Кроме того, исследование третьей пробы может оказаться полезным только для подтверждения диагноза, если одна или две предыдущие пробы дали положительный результат. Крайне желательно, чтобы результаты микроскопии мокроты направлялись лечащему врачу в течение одного рабочего дня с момента отправки проб. Не меньшее значение имеет также и время сбора проб. Результаты исследований показывают, что эффективность лабораторных анализов максимальна, если пробы мокроты получены утром, после пробуждения от ночного сна. Возможно, совершенно необязательно собирать только утренние пробы, но, про крайней мере, одна из них должна быть получена утром.
Как правило, внелегочные очаги туберкулезного процесса содержат гораздо меньшее количество M. tuberculosis, поэтому микроскопическое выявление кислотоустойчивых микобактерий в пробах из внелегочных очагов весьма затруднено, и в таких случаях результаты культуральных исследований приобретают большое значение. Учитывая низкую результативность микроскопии, при внелегочном туберкулезе культуральные и морфологические исследования приобретают особое значение, например, в диагностическом исследовании проб ткани лимфатических узлов, полученных при помощи игловой биопсии.
Лечение пациентов, у которых наблюдаются тяжелое или быстро развивающееся заболевания, ассоциированные с туберкулезом, необходимо начинать немедленно, даже до лабораторного подтверждения диагноза. Лечение следует начинать до получения результатов лабораторного исследования и лишь позднее внести необходимые поправки и изменения в схему лечения с учетом результатов микроскопии.
Хотя микроскопия мокроты является наиболее доступным бактериологическим тестом, там, где ресурсы позволяют и имеются условия для качественной лабораторной диагностики, в диагностический алгоритм необходимо включать культуральные исследования мокроты, в случаях отрицательных результатов микроскопии. Правильное проведение культуральных исследований связано с определенными трудностями и дополнительными затратами, но этот метод отличается более высокой чувствительностью и повышает вероятность раннего выявления больных туберкулезом.
Микроскопия мазков мокроты по Циль-Нильсену является важнейшим элементом диагностики туберкулеза. Исследование 3 мазков мокроты позволяет выявить более 60% случаев туберкулеза легких и 95% наиболее заразных случаев (исследование одного мазка мокроты выявляет 75% наиболее заразных случаев, исследование второго мазка мокроты добавляет еще 20%, а исследование третьего - еще 5%).
Микроскопия мазков мокроты по Циль-Нильсену позволяет быстро получить результаты, выявить основные источники инфекции, является менее дорогостоящей, чем посев мокроты и широко доступна для применения. Но она должна быть надежной и хорошо контролироваться. Вероятность обнаружения МБТ при бактериоскопии мазков мокроты прямо пропорциональна концентрации возбудителя в исследуемом материале. Например, когда в 1 мл мокроты содержится от 1000 до 10000 МБТ, то вероятность получения положительного результата составляет около 40-50%. При концентрации МБТ менее 1000 в 1 мл мокроты вероятность их обнаружения резко снижается – отрицательные результаты получаются примерно в 96% случаев.
Основным и наиболее часто изучаемым биоматериалом в пульмонологической практике является мокрота. Требования к забору и качеству мокроты следующие:
1) первую пробу мокроты желательно получить до начала курса антибиотикотерапии;
2) мокроту оптимально собирать утром, до приема пищи, после тщательного туалета полости рта (полоскание кипяченой водой);
3) больным нужно доступно объяснить, что требуется получить именно содержимое нижних отделов дыхательных путей, а не ротоглотки, и, по возможности, проконтролировать их действия;
4) забор материала проводить в стерильные интактные контейнеры;
5) продолжительность хранения мокроты в контейнерах не должна превышать 2 ч (в летнее время желательно не более 1 ч);
6) в условиях лаборатории качество мокроты оценивается после окрашивания мазка по Граму (при наличии в мазке менее 25 лейкоцитов и более 10 эпителиальных клеток, при просмотре не менее 8-10 полей зрения при малом увеличении, мокрота признается некачественной, дальнейшее ее исследование нецелесообразно, так как, скорее всего, материал получен из ротовой полости);
7) высокая диагностическая ценность исследования признается при выделении возбудителя в концентрации і106 КОЕ/мл.
Вообще, в диагностике заболеваний туберкулезом можно выделить несколько этапов:
· Преаналитический этап (предварительный диагноз, выбор материала и метода исследования, забор биомтериала и его транспортировка)
· Аналитический этап (непосредственно проведение анализа)
· Постаналитический этап (оценка результатов)
Часть этих этапов проводится вне лаборатории, поэтому очень важна согласованная и качественная работа всех специалистов, привлеченных в этот процесс. Важен правильный выбор исследуемого материала. Важным этапом диагностики являются процедуры взятия и доставки материала в лабораторию.При взятии всех видов исследуемого материала следует ориентироваться на стандартные системы для этой цели: тампоны, цитощетки, тубсеры, контейнеры и т.п. Эффективность аналитического этапа во многом определяется уровнем технического оснащения лабораторий. Постаналитический этап исследования включает две составляющие: проверку достоверности полученного результата и оценку этиологической значимости выделенных штаммов. В лаборатории должен осуществляться строгий внутренний контроль качества исследований, важной составляющей которого является проверка полученных результатов на достоверность. Оценка этиологической значимости выделенных микроорганизмов принципиальна для выбора адекватной терапии. Процедура приготовления мазков начинается с подготовки предметных стекол. Необходимо использовать только новые, отмытые и обезжиренные в спирте или смеси для обезжиривания предметных стекол (производство АБРИС+) стекла без царапин и сколов. При повторном использовании стекла могут быть недостаточно хорошо отмыты от предыдущего материала, что может привести к получению ложноположительных результатов. Не рекомендуется использовать саморезанные стекла, которые приводят к значительным аберрациям исследуемого изображения. Стекла должны соответствовать ГОСТу. Стекла, на которых при микроскопическом исследовании были обнаружены кислотоустойчивые микобактерии, сохраняются в лаборатории в течение 1 года, а затем подлежат обязательному уничтожению и не должны использоваться повторно. Новые предметные стекла кипятят 15 минут в 1% растворе питьевой соды (10 г двууглекислого натрия на 1 л воды), промывают в 1% растворе соляной кислоты (к 1 л воды добавляют 10 мл концентрированной соляной кислоты), а затем промывают в проточной воде и протирают насухо.
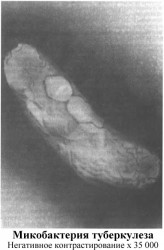
Возбудитель туберкулеза — Mycobacterium tuberculosis — открыт Р. Кохом в 1882 г. Род микобактерий относится к семейству лучистых грибов Actinomycetaceae, широко распространенных в природе, и лишь некоторые из них, в том числе микобактерии туберкулеза и лепры, являются патогенными для человека.
Возбудителя туберкулеза человека принято называть бациллой Коха (БК) или микобактерией туберкулеза (МТ).
Патогенными для человека являются также другие типы микобактерий: бычий тип (М. bovis) и некоторые атипичные кислотоустойчивые микобактерии.
В состав микобактерий входят следующие компоненты: белки (протеины), которые принято называть туберкулопро-теинами, полисахариды и липиды, состоящие из эфирных кислот, воска и фосфатидов. Все указанные фракции и создают патогенные свойства этих микробов, но и в отдельности каждый компонент несет определенные функции в развитии заболевания или придает характерные свойства возбудителю. Так, протеины обусловливают в основном аллергическое действие, полисахариды играют роль стимуляторов в образовании антител, а липиды придают микробу кислотоустойчивость и свойство медленно воспринимать окрашивание анилиновыми красителями. Именно поэтому для окраски этих микробов применяют карболовую кислоту в качестве протравы, а мазок при этом подогревают на спиртовке. Липиды оказывают также токсическое и аллергизирующее действие на организм.
Микроб имеет форму палочки длиной 1,5—5 мкм (10-6 м по международной системе СИ).
Микобактерии отличаются значительным разнообразием форм (полиморфизмом): они могут принимать нитевидные, зернистые, фильтрующиеся и L-формы. L-формы — это такие варианты микроорганизмов, которые утратили частично или полностью клеточную стенку. Такие формы микробов появляются чаще под воздействием антибиотиков. В этой форме микробы могут в организме человека не только выживать, но и размножаться. Они способны вызывать у экспериментальных животных морфологические изменения и реакции иммунитета, присущие туберкулезной инфекции. Важное свойство L-форм — их способность к возвращению (реверсии) в исходный штамм. Такими же свойствами обладают и вакцинные штаммы БЦЖ. В организме вакцинированного они могут длительно существовать как в бактериальной форме, так и в виде L-форм, сохраняя все основные свойства вакцинного штамма БЦЖ.
Микобактерии обладают вирулентностью, изменяющейся под влиянием условий культивирования; экзотоксинов у них не обнаружено. Вместе с тем содержащиеся в клетках туберкулопротеиды (туберкулин) и липиды обладают токсическими свойствами. Размножение микобактерии происходит медленно — период их деления составляет около 20 ч, в то время как, например, для сальмонелл или кишечной палочки — всего 30 мин.
Микобактерии весьма устойчивы во внешней среде. В высохшей мокроте в темноте они могут выживать до нескольких лет, на предметах домашней обстановки — несколько месяцев, в сыром молоке — до 2 нед. Прямой солнечный свет убивает микобактерии в течение нескольких минут, а рассеянный — через несколько дней. Пастеризация молока в течение 30 мин при температуре 85 °С является достаточной. Губительны для возбудителя 0,5 % активированные растворы хлорамина, 5 % раствор формалина и другие дезинфицирующие средства. Характерным свойством микобактерий является их устойчивость к кислотам, щелочам и спиртам, однако эти свойства у измененных микобактерий могут утрачиваться.
Под влиянием химиопрепаратов у микобактерий может развиться лекарственная устойчивость, т. е. способность сохранять жизнеспособность и размножаться при наличии такой концентрации препарата, которая гибельна для обычных, не обладающих такой устойчивостью микроорганизмов. Такие микобактерии, выделенные от впервые заболевших туберкулезом и ранее не лечившихся противотуберкулезными антибиотиками, называются первично-устойчивыми. Их находят в среднем у 5—10% больных. Устойчивость к лекарствам, которую приобретают микробы в процессе лечения, называется вторичной. Как правило, этот тип устойчивости развивается у больных с деструктивными формами после длительного и неэффективного лечения, у нарушающих режим химио-терапии. Чаще устойчивость развивается к одному препарату и реже к двум-трем. Больные, выделяющие лекарственно-устойчивые МТ, также заразны для окружающих.
Устойчивость микробов к определенному препарату имеет наследственную (генетическую) природу. Появление лекарственноустойчивых микробов в организме происходит следующим образом. Небольшая часть популяции микробов (в первую очередь, их генетически измененных вариантов — мутантов) может обладать свойством устойчивости. Лечебный препарат при введении в организм убивает чувствительные к нему микробы, в то время как устойчивые мутанты микробов выживают и размножаются. Постепенно устойчивые к лекарству микробы замещают чувствительные, пока вся популяция не будет состоять только из лекарственноустойчивых микробов. Тем не менее с размножением в организме лекарственноустойчивых микробов можно успешно бороться путем одновременного назначения 3 препаратов и регулярностью лечения. Поэтому схемы лечения предусматривают комбинации нескольких лекарств с учетом результатов исследования лекарственной устойчивости выделенных микроорганизмов.
Атипичные (нетуберкулезные) кислотоустойчивые мико-бактерии. За последние 10—15 лет установлена этиологическая роль некоторых атипичных кислотоустойчивых мико-бактерий в возникновении заболеваний, иногда клинически не отличимых от различных форм туберкулеза легких. Они выявляются у 1—2 % больных легочным туберкулезом. Более часто их находят при поражении лимфатических узлов, кожи и подкожного жирового слоя.
Атипичные бактерии — не варианты микобактерий туберкулеза, а самостоятельные виды. Патогенная роль для человека установлена для М. avium, М. kansasii, М. battey, М. fortuitum, М. xenopi, М. ulcerance и др. Заболевания, вызываемые атипичными микобактериями, получили наименование микобактериозов.
При росте на питательных средах колонии атипичных микобактерий отличаются от колоний истинных туберкулезных палочек яркой пигментацией, быстротой роста и морфологией.
Общепринятым является вариант классификации атипичных микобактерий, предложенный Раньоном в 1959 г., по которому различают 4 основные группы: фотохромогенные (образующие желтый пигмент), скотохромогенные (образующие оранжевый пигмент), нехромогенные (непигментные) и быстрорастущие.
В большинстве случаев заболевания, вызванные атипичными микобактериями, имеют большее или меньшее сходство с туберкулезом. Только заболевания, вызванные М. ulcerance, М. marinum, имеют ярко выраженную клинику, отличную от туберкулеза. Указанные микобактерии вызывают поражение кожи и подкожного жирового слоя и ближе стоят в этом отношении к возбудителю лепры (М. leprae). Эти заболевания распространены преимущественно в тропических странах. Иногда заболевания, вызванные М. ulcerance, носят эндемический характер, как, например, в Уганде в районе Бурули, расположенном на берегу Нила (отсюда и название болезни — язва Бурули). В небольшом районе в течение 3 лет (1967—1969) мы наблюдали около 400 случаев этого заболевания, с поражением около 6 % населения. Наибольшее число случаев приходилось на сухой сезон года.
Эпидемиология микобактериозов изучена еще недостаточно. Наиболее существенное отличие эпидемиологии микобактериозов от классической туберкулезной инфекции состоит в том, что больные микобактериозами люди практически не заразны для окружающих, а источниками инфекции являются преимущественно животные и птицы. Передача инфекции происходит, очевидно, различными путями: через воду, при вдыхании инфицированной пыли, при контакте с зараженными животными и птицами, через поврежденные кожные покровы.
Читайте также:
|