Экспресс диагностика микобактерий туберкулеза
Самым простым методом выявления микобактерий туберкулеза в выделениях больных является микроскопия мазка, приготовленного из патологического материала (в большинстве случаев - мокроты). При бактериоскопии мазка, окрашенного по Цилю-Нильсену, микобактерии туберкулеза могут быть обнаружены при наличии не менее 100 000 - 1 000 000 бактериальных клеток в 1 мл патологического материала (мокроты). Такое большое количество микобактерий встречается у больных с далеко зашедшими прогрессирующими формами заболевания (диссеминированными и фиброзно-кавернозными). У значительно большего числа больных количество выделяемых ими микобактерий ниже предела метода бактериоскопии.
Использование метода флотации повышает выявляемость микобактерий на 10%, но в связи с отмеченными выше недостатками этого метода, он не может быть рекомендован для широкого применения в клинико-диагностических лабораториях.
Чувствительность метода флуоресцентной микроскопии значительно выше - от 10 000 до 100 000 микобактерий в 1 мл материала, кроме того, этот метод дает возможность за значительно более короткое время просмотреть необходимое количество препаратов. Обогащение материала для микроскопии путем обработки иммуномагнитным сорбентом, обеспечивающим концентрацию возбудителя в осадке гомогенизированной мокроты, позволяет значительно повысить эффективность метода, особенно при незначительном количестве микобактерий туберкулеза в материале. Эффективность бактериоскопии повышается также при передаче изображения на компьютер при помощи присоединенной к микроскопу видеокамеры.
Культуральный метод выявления микобактерий туберкулеза дает положительные результаты при наличии в исследуемом материале от 20 до 100 жизнеспособных микробных клеток в 1 мл. Однако он трудоемок и длителен в связи с тем, что микобактерии туберкулеза растут очень медленно и их колонии можно наблюдать только через 2-2,5 месяца.
Чаще всего применяется посев на твердую яично-картофельную среду Левенштайна-Йенсена, реже на среды Фин-2 и В.А. Аникина.
Диагностические возможности культурального метода ограничиваются длительным периодом роста микобактерий, а также тем, что при активном туберкулезе легких этим методом возбудитель выделяется только в 52 - 65% случаев. При внелегочном туберкулезе процент выявлений культуральным методом еще ниже. Так, например, при туберкулезном менингите рост микобактерий на питательных средах наблюдается только в 3% случаев. При нефротуберкулезе частота выявления варьирует от 26,7% до 73% случаев.
Российским НИИ фтизиопульмонологии Министерства здравоохранения рекомендуется комплексная методика исследования мочи на наличие микобактерий туберкулеза. Из одной и той же порции одновременно выполняется люминесцентная микроскопия осадка, окрашенного ауромином, и посев не менее чем на две питательные среды. Микобактерии, потерявшие кислотоустойчивость, но сохранившие жизнеспособность, выявляются посевом, а потерявшие жизнеспособность, но сохранившие кислотоустойчивость - бактериоскопией.
К сожалению, широкое внедрение этой методики сдерживается, как уже было отмечено выше, высокой стоимостью лабораторного оборудования для люминесцентной микроскопии. Также существует ряд факторов, ограничивающих широкое применение культурального метода, в частности, необходимость использования дорогостоящих питательных сред.
Значительные трудности представляет обнаружение микобактерий у лиц со скудным их выделением. Это притом, что среди впервые выявленных больных у одной трети бактериовыделение бывает однократным.
За рубежом широкое распространение получила радиометрическая система Bactec, дающая возможность быстрого обнаружения микобактерий туберкулеза в жидкой питательной среде. Микобактерии культивируются в жидкой среде Bactec, где в качестве источника углерода используется меченая С14 пальмитиновая кислота. При положительных данных бактериоскопического исследования рост микобактерий обнаруживается радиометрически на 7-10 день, а при отрицательных - на 14-21 день. К недостаткам этого метода, ограничивающим возможность его широкого применения, относятся: высокая стоимость исследований, необходимость применения радиоактивных изотопов, специального радиометрического оборудования, сложность работы с изотопной технологией, необходимость дополнительного посева на плотные питательные среды при возникновении проблем с идентификацией возбудителя.
В настоящее время для культуральной диагностики туберкулеза также используется автоматизированная система MB/BacT фирмы Organon Teknika. В результате использования этой системы среднее время детекции роста микобактерий составляет 18,7 дня против 33,2 на стандартной плотной среде Левенштайна-Йенсена. К сожалению, высокая стоимость оборудования делает повсеместное внедрение этого метода в практику лабораторной диагностики туберкулеза маловероятным.
Иммуноферментный анализ (ИФА) получил широкое распространение в диагностике различных инфекционных заболеваний в связи с высокой чувствительностью и специфичностью, высокой производительностью, простотой проведения анализа и регистрации результатов, возможностью микроколичества диагностического материала и автоматизации процесса. ИФА используется для определения в биологических жидкостях, как антигенов, так и антител к этим антигенам.
Полимеразная цепная реакция (ПЦР), основанная на обнаружении участка ДНК, характерного только для данного возбудителя, может служить одним из методов экспресс-диагностики туберкулеза. Высокая чувствительность ПЦР позволяет обнаружить в исследуемом материале единичные клетки или даже фрагменты ДНК возбудителя в течение 4-5 часов. Благодаря отсутствию перекрестных реакций с ДНК бактерий - возбудителей других легочных инфекций (L.pneuphila, M.pneumoniae, K.pneumoniae, Y.pestis, Y.pseudotuberculosis, S.aureus, E.coli, F.tularensis), а также с ДНК человека, ПЦР обладает высокой специфичностью (100%). Чувствительность ПЦР при тестировании образцов патологического материала полученного от больных с различными формами туберкулеза легких составляет: мокроты - 63,5-80,0%, мочи - 50,0-78,8%, плевральной жидкости - 45,8-54,5% и крови - 17,2-42,8%. Моча достаточно часто служит прекрасным материалом для выявления специфической ДНК у больных с распространенным туберкулезом легких, без сопутствующего специфического процесса в почках и мочевыделительной системе. ПЦР дает возможность дифференциальной диагностики при ограниченных формах туберкулеза (очаговых инфильтратах, туберкулемах, туберкулезе внутригрудных лимфатических узлов), а также при диссеминированной форме туберкулеза, при которых дифференциальная диагностика с использованием только традиционных микробиологических методов весьма затруднена в связи с редким обнаружением возбудителя в мокроте. Обобщая результаты бактериоскопии, посева на плотные питательные среды и исследования методом ПЦР материала, полученного от больных ограниченными формами туберкулеза можно сделать вывод о том, что последняя обладает значительно более высокой чувствительностью по сравнению с традиционными методами. В частности при сравнительном исследовании одного и того же материала бактериоскопией было получено 11,2% положительных результатов, методом посева на питательные среды - 19,3%, и методом ПЦР - 51,6% таких результатов.
Практически полное совпадение результатов сравнительного исследования патологического материала микробиологическими методами и методом ПЦР отмечается только при хронических деструктивных формах туберкулеза легких: кавернозной и фиброзно-кавернозной. Такое совпадение результатов обусловлено наличием у пациентов постоянного массивного бактериовыделения, характерного для таких форм туберкулеза. ПЦР достаточно информативна при необходимости подтверждения диагноза туберкулеза у детей и подростков при отрицательных результатах традиционных микробиологических методов исследования.
Использование ПЦР в диагностике туберкулеза рекомендовано Минздравом РФ (приказ от 21.02.2000 №64 "Об утверждении номенклатуры клинических лабораторных исследований", п. 9.4.5. приложения).
Использование ПЦР раскрывает возможности проведения, параллельно с традиционным бактериологическим способом определения лекарственной резистентности, экспресс-диагностики резистентности микобактерий туберкулеза к лекарственным препаратам методом выявления точечных мутаций в генах. В настоящее время известны следующие гены микобактерии туберкулеза, мутации в которых вызывают резистентность к лекарственным препаратам: rpoB - к рифампицину, katG, inhA, oxyR, ahpC, kasA - к изониазиду, rpsL - к стрептомицину, gyrA - к фторхинолонам, pncA - к пиразинамиду, embCAB - к этамбутолу. При этом, в большинстве случаев, исследованные клинические изоляты, устойчивые к рифампицину, оказались резистентными и к другим противотуберкулезным препаратам. Таким образом, устойчивость к рифампицину является маркером полирезистентности.
Кроме того, последние результаты изучения спектра MDR-штаммов микобактерии туберкулеза у впервые выявленных больных можно позволяют сделать вывод о снижении показателя удельного веса штаммов, устойчивых к стрептомицину и этамбутолу, и о наличии тенденции к увеличению частоты выделения штаммов, устойчивых к изониазиду и рифампицину.
Разработанный в Институте молекулярной биологии метод определения лекарственной резистентности микобактерии туберкулеза к рифампицину на микрочипах позволяет обнаружить 30 мутантных вариантов ДНК микобактерии туберкулеза.
Использование данного метода позволило выявить резистентность к рифампицину у 64,8% больных в течение 3-х дней до начала лечения. Режим химиотерапии данной когорты больных изначально состоял из комбинации препаратов резервного ряда (канамицин, офлоксацин, этионамид, циклосерин) и пиразинамида. Спустя 3 три месяца методом абсолютных концентраций выявлена лекарственная резистентность, по крайней мере, к изониазиду и рифампицину у 34 из 35 (97,2%) пациентов данной группы.
Применение молекулярно-генетических методов в эпидемиологии позволяет провести генотипирование клинических изолятов микобактерий, выделенных от больных на определенной территории.
В частности, в Томской области молекулярно-генетическими исследованиями, проведенными Нью-Йоркским институтом общественного здравоохранения, совместно с Центральным научно-исследовательским институтом туберкулеза РАМН, установлено, что 45% всех выделенных культур микобактерий туберкулеза представлено всего двумя штаммами, один из которых является эндемичным для Томской области. Данным методом было выявлено уникальное семейство микобактерии туберкулеза KY, ранее не встречавшееся в базе данных Нью-Йоркского института, а также преобладание микобактерий W- (20 штаммов) и Al- (8 штаммов) семейств. Молекулярное типирование показало, что более 60% штаммов, выделенных от больных из учреждений УИС Ивановской области, принадлежало к W-семейству, а около 12% культур было представлено смесью штаммов микобактерий туберкулеза двух генотипов.
Выявление путей распространения возбудителей туберкулеза, основанное на методах молекулярной эпидемиологии, способствует принятию эффективных мер по предотвращению дальнейшего распространения туберкулеза в УИС и дальнейшему снижению заболеваемости.

В 2004 году по инициативе д.м.н., профессора Михаила Александровича Владимирского, заведующего сектором молекулярной диагностики туберкулёза НИИ Фтизиопульмонологии Первого МГМУ им. И.М.Сеченова, мы начали разработки в области ПЦР-диагностики туберкулёза.
Выделение ДНК: использование оригинальных реагентов и магнитных частиц обеспечивает получение максимального количества чистой ДНК и позволяет автоматизировать процесс выделения ДНК.
ПЦР в реальном времени: одновременная детекция нескольких различных участков генома комплекса микобактерий туберкулёза (МБТ) увеличивает информативность и достоверность анализа.
I этап – Пробоподготовка, инактивация
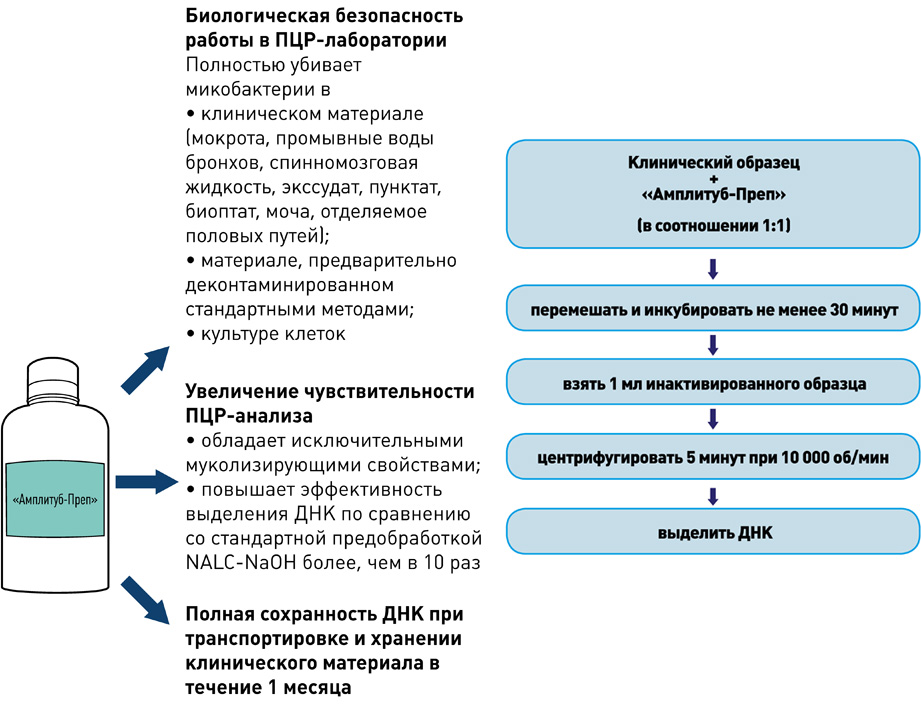
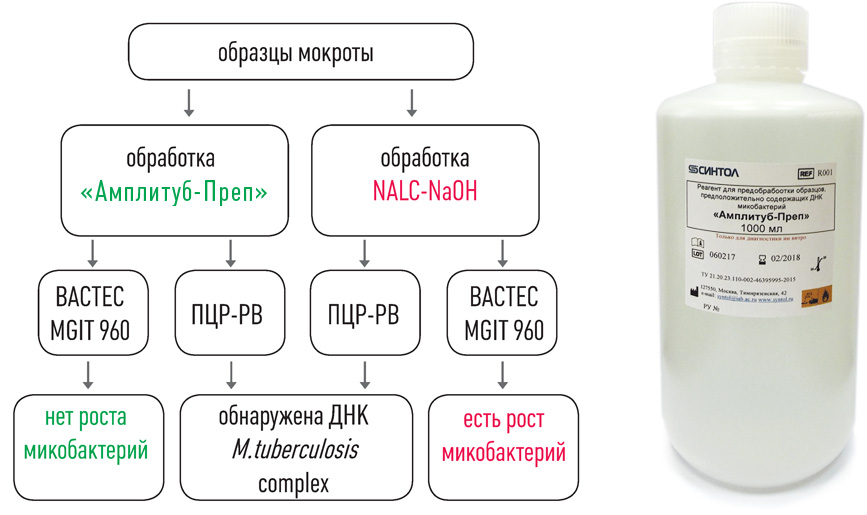
II этап – Выделение ДНК
набор реагентов для выделения ДНК (на магнитных частицах)
набор реагентов для выделения ДНК микобактерий из клинических образцов и культур клеток на автоматизированных станциях TECAN

- Снижение риска контаминации во время выделения ДНК практически до нуля.
- Значительное уменьшение трудоёмкости процесса выделения ДНК.
- Стандартизированное выделение ДНК из клинических образцов.
- Экономическая выгода: низкий расход пластика и реактивов.
набор реагентов для ускоренной пробоподготовки и выделения ДНК микобактерий из образцов мокроты
III этап – ПЦР в реальном времени
Обнаружение и количественное определение комплекса МБТ
Набор реагентов АМПЛИТУБ-РВ — это:
- высокая достоверность анализа благодаря одновременному обнаружению двух специфичных генов M.tuberculosis complex: IS6110 и regX3;
- оценка пригодности образца ДНК для определения антибиотикоустойчивости;
- высокая чувствительность (не более 100 КОЕ/мл мокроты или 1–10 копий фрагментов ДНК в реакции) и 100%‑ая специфичность, подтверждённые на панели QCMD (Quality Control for Molecular Diagnostics) Mtb EQA (UK).
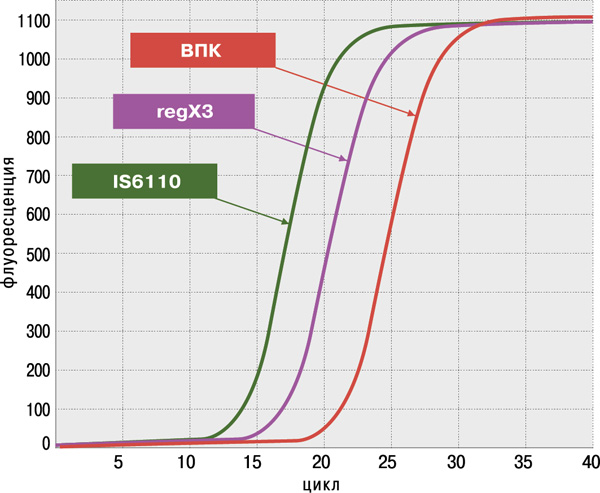
Определение антибиотикоустойчивости МБТ к препаратам I и II ряда
Наборы реагентов АМПЛИТУБ-МЛУ-РВ, АМПЛИТУБ-FQ-РВ — это:
- диагностика форм туберкулеза с лекарственной устойчивостью, в том числе множественной лекарственной устойчивостью (МЛУ) и широкой лекарственной устойчивостью (ШЛУ);
- быстрая детекция мутаций M.tuberculosis, ассоциирующихся с устойчивостью к антибиотикам первого и второго ряда (рифампицину, изониазиду, этамбутолу, фторхинолонам);
- достоверность результатов, ежегодно подтверждаемая при проведении Федеральной службой внешней оценки качества (ФСВОК) Росздравнадзора испытаний шифрованных тест-культур и образцов.
Наборы АМПЛИТУБ-МЛУ-РВ и АМПЛИТУБ-FQ-РВ основаны на использовании оригинальной мультиконкурентной аллель-специфичной методики ПЦР в реальном времени, позволяющей выявлять мутации в генах микобактерий туберкулеза, ответственных за устойчивость к конкретным антибиотикам.

Принцип мультиконкурентной аллель-специфичной методики ПЦР в реальном времени
- В формате одной пробирки используются 5’-флуоресцентно-меченые аллель-специфичные праймеры с общим комплементарным им 3’-меченым олигонуклеотидом-гасителем и контрольный флуоресцентный зонд, комплементарный участку ДНК без мутаций.
- При отсутствии мутаций в ДНК нарастание флуоресценции в ходе ПЦР-РВ наблюдается только по флуорофору зонда.
- При наличии мутаций в ДНК нарастание флуоресценции в ходе ПЦР-РВ наблюдается как по флуорофору зонда, так и по флуорофору 5’-флуоресцентно-меченого аллель-специфичного праймера. Данный метод позволяет определить не только точку мутации, но и процент устойчивого мутантного штамма МБТ на фоне дикого.
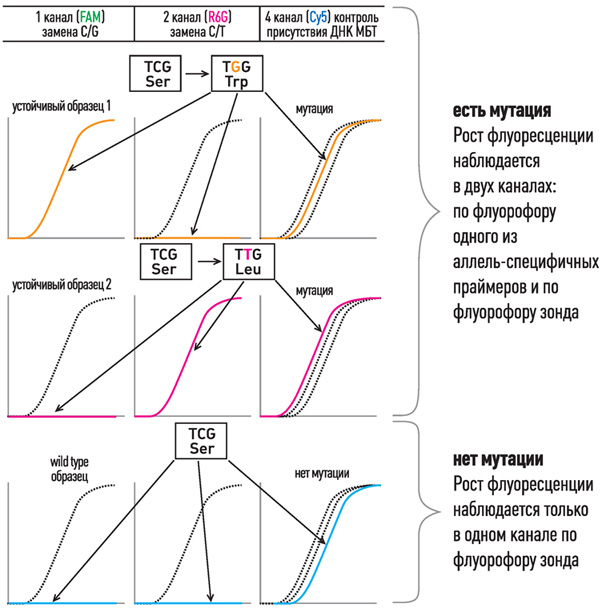
Интерпретация результатов выявления мутаций на примере
531 кодона rpoB гена M.tuberculosis
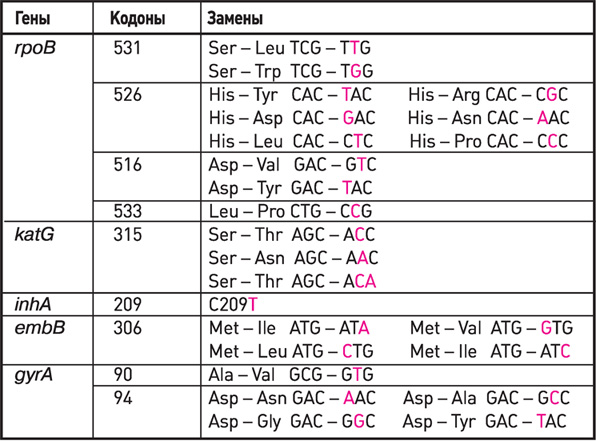
Гены, кодоны, замены, используемые в наборах реагентов
АМПЛИТУБ-МЛУ-РВ при определении антибиотикоустойчивости
Использование автоматизированных станций Freedom EVO (TECAN, Швейцария) для молекулярно-генетической диагностики туберкулёза
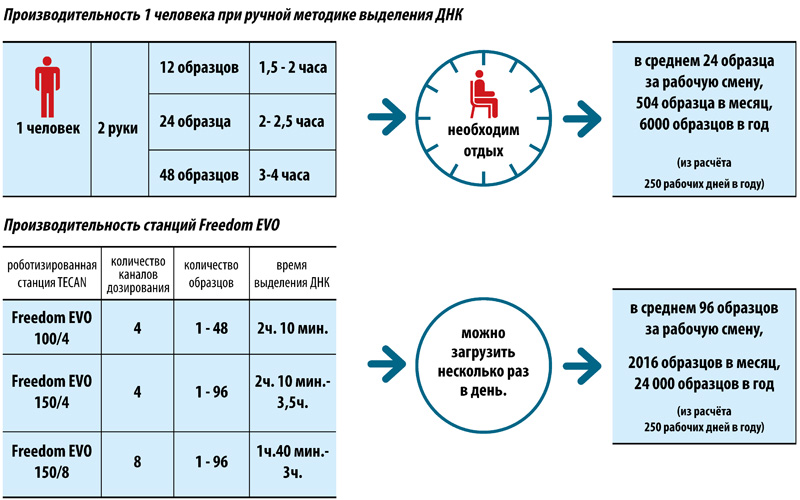

Трудозатраты — 1 час
Продолжительность выделения ДНК — не более 2 часов
Подготовка к амплификации и ПЦР-РВ — 1,5 часа
ИТОГО: результаты анализа будут готовы через 3,5 часа
Оператор затратит 1 час своего рабочего времени.
Лабораторная диагностика. Для диагностики туберкулеза применяют все методы: бактериоскопический, бактериологический, серологический, биологический, аллергические пробы, ПЦР. При бактериоскопическом исследовании исходного материала (мокрота, моча, гной, спинномозговая жидкость, испражнения) необходимо учитывать, что содержание в нем микобактерий может быть незначительным, выделение их эпизодическим и в нем могут быть измененные варианты возбудителя, в том числе L-формы. Поэтому для повышения вероятности обнаружения микобактерий туберкулеза используют методы концентрирования их с помощью центрифугирования или флотации, а также фазово-контрастной (для обнаружения L-форм) и люминесцентной микроскопии (в качестве флуорохромов используют аурамин, аурамин-родамин, акридиновый оранжевый и др.).
Биологический метод — заражение морских свинок — является одним из наиболее чувствительных. Считается, что заражающая доза возбудителя для них составляет несколько клеток. Морские свинки могут быть использованы и для обнаружения L-форм туберкулезных бактерий, но в этом случае необходимо сделать несколько последовательных заражений, так как L-формы обладают меньшей вирулентностью и вызывают у свинок доброкачественную форму туберкулеза, которая в случае реверсии L-форм в исходное состояние может перейти в генерализованный процесс.
Из числа серологических реакций для диагностики туберкулеза предложены РСК, РПГА, реакции преципитации, методы иммуноферментного анализа (в том числе точечного), радиоиммунный метод, иммуноблотинг, реакция агрегат-гемаг- глютинации (для обнаружения ЦИК) и др. Использование различных антигенов позволяет обнаруживать наличие определенных антител. Для совершенствования серологических методов диагностики туберкулеза важное значение имеет получение моноклональных антител к различным антигенам микобактерий. Это позволит выявить те специфические эпитопы туберкулезных бактерий и соответственно те антитела к ним, обнаружение которых имеет наибольшее диагностическое значение, а также позволит создать коммерческие тест-системы для иммунодиагностики туберкулеза.
Среди всех методов микробиологической диагностики туберкулеза решающим все же остается бактериологический. Он необходим не только для постановки диагноза болезни, но и для контроля эффективности химиотерапии, своевременной оценки чувствительности микобактерий к антибиотикам и химиопрепаратам, диагноза рецидивов туберкулеза, степени очищения больного организма от возбудителя и выявления его измененных вариантов, особенно L-форм. Исследуемый материал перед посевом необходимо обрабатывать слабым раствором серной кислоты (6— 12 %) для устранения сопутствующей микрофлоры. Выделение чистых культур микобактерий ведут с учетом скорости их роста, пигментообразования и синтеза ниа- цина. Дифференциацию между отдельными видами микобактерий осуществляют на основании их биологических свойств, как указано выше. Вопрос о вирулентности микобактерий решается с помощью биологических проб и на основании обнаружения корд-фактора. Для этой цели предложены цитохимические реакции. Они основаны на том, что вирулентные микобактерии (содержащие корд-фактор) прочно связывают красители — нейтральный красный или нильский голубой — и при добавлении щелочи сохраняют цвет краски, а раствор и невирулентные микобактерии изменяют свою окраску.
Для более быстрого выделения возбудителя туберкулеза предложен метод микрокультур. Суть его состоит в том, что на предметное стекло наносят исследуемый материал, обрабатывают его серной кислотой, отмывают, стекло помещают в цит- ратную лизированную кровь и инкубируют при температуре 37 "С. Уже через 3— 4 сут. рост микобактерий на стекле проявляется в виде микроколоний, которые к 7—10-му дню достигают максимального развития, а микобактерии хорошо выявляются при микроскопии. При этом вирулентные микобактерии образуют змеевидные колонии, а невирулентные растут в виде аморфных скоплений.
Для обнаружения L-форм используют культуральный, биологический и иммунофлуоресцентный методы. В связи с широким распространением лекарствен- ноустойчивых штаммов микобактерий возникла необходимость усилить контроль за этим процессом. С этой целью, а также для более точной идентификации и дифференциации микобактерий используют молекулярно-генетические методы, в частности, метод типирования штаммов, основанный на выявлении различий в структуре генома микобактерий — геномная дактилоскопия. Метод заключается в обнаружении в геноме микобактерии ряда повторяющихся нуклеотидных последовательностей и анализе полиморфизма длин фрагментов рестрикции. В качестве зонда (праймера) обычно используют IS6110 (англ. insertion sequence — вставочная последовательность). В хромосоме микобактерии, как правило, имеется несколько копий элемента IS6110, которые отличаются высокой стабильностью своего местоположения, что позволяет точно идентифицировать различные штаммы.
Биологический способ обнаружения L-форм заключается в серии последовательных пассажей на морских свинках.
Для иммунофлуоресцентного метода используют диагностические сыворотки, содержащие меченные флуорохромом антитела к антигенам L-форм.
9. Бактериологическая диагностика туберкулеза. Схема дифференцирования микобактерий в ходе их выделения. Специфическая профилактика туберкулёза. Вакцина БЦЖ, состав, способы применения. Химиотерапия туберкулеза.
Среди всех методов микробиологической диагностики туберкулеза решающим все же остается бактериологический. Он необходим не только для постановки диагноза болезни, но и для контроля эффективности химиотерапии, своевременной оценки чувствительности микобактерий к антибиотикам и химиопрепаратам, диагноза рецидивов туберкулеза, степени очищения больного организма от возбудителя и выявления его измененных вариантов, особенно L-форм. Исследуемый материал перед посевом необходимо обрабатывать слабым раствором серной кислоты (6— 12 %) для устранения сопутствующей микрофлоры. Выделение чистых культур микобактерий ведут с учетом скорости их роста, пигментообразования и синтеза ниа- цина. Дифференциацию между отдельными видами микобактерий осуществляют на основании их биологических свойств, как указано выше. Вопрос о вирулентности микобактерий решается с помощью биологических проб и на основании обнаружения корд-фактора. Для этой цели предложены цитохимические реакции. Они основаны на том, что вирулентные микобактерии (содержащие корд-фактор) прочно связывают красители — нейтральный красный или нильский голубой — и при добавлении щелочи сохраняют цвет краски, а раствор и невирулентные микобактерии изменяют свою окраску.
По патогенным свойствам род Mycobacterium подразделяют на две группы:
1) патогенные и условно-патогенные (потенциально патогенные)
2) сапрофита. Для их ускоренной предварительной дифференциации учитывают прежде всего три признака: а) скорость и условия роста; б) способность к пигментообразованию; в) способность синтезировать никотиновую кислоту (ниацин).
По скорости роста род Mycobacterium подразделяют на три группы:
1) Быстрорастущие — крупные видимые колонии появляются ранее 7-го дня инкубации (18 видов).
2) Медленнорастущие — крупные видимые колонии появляются после 7-ми и более дней инкубации (20 видов).
3) Микобактерии, которые требуют специальных условий для роста или не растут на искусственных питательных средах. К этой группе относятся два вида: М. leprae и М. lepraemurium.
По способности к пигментообразованию микобактерии также делят на 3 группы:
1) Фотохромогенные — образуют пигмент лимонно-желтого цвета при росте на свету.
2) Скотохромогенные — образуют пигмент оранжево-желтого цвета при инкубировании в темноте.
3) Нефотохромогенные — пигмента не образуют (независимо от наличия света), иногда культуры имеют светло-желтоватую окраску.
К патогенным и потенциально патогенным относится 24 вида.
Профилактика. Помимо проведения широких социально-экономических мероприятий, направленных на улучшение жизни населения, раннего и своевременного выявления больных туберкулезом и оказания им эффективной лечебной помощи, большое значение имеет плановая массовая вакцинация против туберкулеза. Она осуществляется вакциной БЦЖ, полученной А. Кальметтом и Ш. Гереном из ослабленного многолетними пересевами штамма М. bovis. Вакцинации подлежат все новорожденные дети на 5—7-й день жизни. Вакцину, содержащую 0,05 мг сухих живых бактерий в объеме ОД мл, вводят внутрикожно. Ревакцинацию проводят в возрасте 7—12—17—22 и 27—30 лет только лицам, отрицательно реагирующим на внутри- кожную пробу Манту (5 ТЕ/0,1 мл).
Лечение. Консервативное лечение туберкулеза проводят с помощью антибиотиков и химиопрепаратов. Препараты I ряда (более ранние) включают производные парааминосалициловой кислоты (ПАСК), гидразида изоникотиновой кислоты (ГИНК) — изотиазид (тубазид), фтивазид и др. и препараты группы стрептомицина. Препараты II ряда — циклосерин, канамицин, флоримицин, рифампицин и другие антибиотики. У микобактерий к химиопрепаратам, в особенности I ряда, часто наблюдается устойчивость, поэтому лечение должно сопровождаться контролем степени чувствительности их к применяемым препаратам.
10. Возбудитель лепры. Морфологические и культуральные особенности. Лабораторная диагностика. Аллергические пробы и их диагностическое значение. Химиотерапия лепры.
Лепра — высококонтагиозное и одновременно низкопатогенное хроническое заболевание, при котором субклиническая инфекция — обычное явление, в то время как клинические проявления отмечаются только у небольшого числа инфицированных лиц. Характеризуется длительным течением, специфическим поражением кожи, слизистых оболочек, периферических нервов и различных внутренних органов. Возбудитель — Mycobacterium leprae — был открыт в 1874 г. А. Хансеном. До сих пор никому не удавалось получить рост возбудителя проказы на искусственных питательных средах. Палочка лепры является строгим внутриклеточным паразитом тканевых макрофагов (гистиоцитов), моно- нуклеарных фагоцитов и других клеток. Ее удается культивировать только в организме мышей, крыс и особенно при внутривенном заражении большими дозами (до 10 8 клеток) броненосцев (армадиллов), у которых она вызывает специфический генерализованный процесс и накапливается в огромном количестве в пораженных тканях (лимфатические узлы, печень, селезенка). В связи с этим морфологические свойства возбудителя лепры описаны по его картине в лепрозных тканях.
М. leprae — прямая или слегка изогнутая палочка с закругленными концами, диаметром 0,3—0,5 мкм и длиной 1,0—8,0 мкм. Спор, капсул не образует, жгутиков не имеет, грамположительна. По химическому составу сходна с М. tuberculosis, обладает спирто- и кислотоустойчивостью, поэтому ее окрашивают по методу Циля—
Нильсена. М. leprae обладает большим полиморфизмом: в лепромах (лепрозных бугорках) встречаются зернистые, кокковидные, булавовидные, нитевидные, ветвящиеся и другие необычные формы. В пораженных клетках они образуют шаровидные плотные скопления, в которых микобактерии располагаются параллельно друг другу, напоминая расположение сигар в пачке.
Главные особенности болезни во многом определяются следующими свойствами возбудителя:
1) Очень медленное размножение в организме является причиной продолжительного инкубационного периода (в среднем 3—7 лет, иногда до 15—20 и более лет) и хронического течения болезни у людей и подопытных животных.
2) М. leprae регулярно вовлекает в процесс нервную ткань и приводит к инвалидности, а это имеет большое экономическое значение для эндемичных регионов.
3) Оптимальная температура для размножения возбудителя менее 37 °С. Следовательно, наиболее поражаемы охлаждаемые ткани человека и подопытных животных (у броненосцев температура тела 30—35 °С).
4) М. leprae способны вызывать иммунологическую толерантность у людей с лепроматозной формой болезни, и такие больные являются главным источником заражения людей лепрой.
Определяющим фактором формирования типа болезни и исхода первичного заражения служит степень напряженности естественного иммунитета против лепры, которая выявляется с помощью лепроминовой пробы. Положительная реакция на лепромин свидетельствует о наличии достаточно высокого естественного иммунитета к М. leprae. Нарушение клеточного иммунитета при лепроматозном типе болезни проявляется прежде всего в том, что фагоцитоз имеет незавершенный характер: микобактерии лепры не только не разрушаются макрофагами, но именно в них они активно размножаются. Кроме того, лимфоциты у таких больных не подвергаются бласттрансформации и не подавляют миграции макрофагов (у больных туберкуло- идным типом эти реакции положительны). Иммунитет к лепре зависит от многих факторов, и при его снижении возможно обострение процесса и отягощение течения болезни.
Лабораторная диагностика. Из всех микробиологических методов диагностики используется главным образом бактериоскопический. Материалом для исследования являются слизь или соскобы со слизистой оболочки носа, скарификаты из пораженного участка кожи, кусочки пораженного органа или ткани, из которых готовят гистологические срезы. Мазки и срезы окрашивают по Цилю—Нильсену. Для дифференциации №. leprae от М. tuberculosis используют биологическую пробу на белых мышах, для которых М. leprae не патогенна.
Лечение. Больные лепрой, в зависимости от ее типа, подвергаются лечению или в специальных противолепрозных учреждениях (лепрозориях), или в амбулаториях по месту жительства. В лепрозории госпитализируют первично выявленных больных, у которых имеются распространенные кожные высыпания, возбудитель обнаруживается бактериоскопически; а также больных, находящихся на постоянном учете, в случае обострения или рецидива болезни. Амбулаторно можно лечить больных с ограниченными кожными проявлениями, у которых при бактериоскопии возбудитель не обнаруживается.
Лечение должно носить комплексный характер с одновременным использованием 2—3 различных антилепрозных химиопрепаратов, а также общеукрепляющих и стимулирующих иммунную систему средств. Наиболее активными химиопрепара- тами являются: производные сульфонового ряда — диафенилсульфон, солюсуль- фон, диуцифон и др.; рифампицин, лампрен, этионамид и др. Курс химиотерапии должен быть не менее 6 мес., при необходимости проводят несколько курсов, чередуя препараты.
Не нашли то, что искали? Воспользуйтесь поиском:
Читайте также:


