Бронхообструктивный синдром при туберкулезе

Туберкулёз остается главной глобальной проблемой здравоохранения, касающейся 8,8 миллиона человек каждый год, являясь важной причиной заболеваемости и смертности во всём мире [9].
В России ежегодно выявляется около 100 тысяч человек, впервые заболевших активной формой туберкулёза, ещё столько же страдают хроническими формами туберкулёза. Несмотря на стабилизацию и некоторое снижение основных показателей распространения туберкулёза, ежегодно отмечается увеличение количества больных, выделяющих микобактерии туберкулёза (МБТ), устойчивые к противотуберкулёзным препаратам. Такая ситуация обусловлена рядом политических и экономических преобразований, прошедших в России в девяностых годах [22]. Основные причины, вызвавшие ухудшение эпидемиологической обстановки по туберкулёзу в нашей стране: низкий социально-экономический уровень жизни большинства слоёв населения, большой объём миграционных процессов, рост численности социально-дезадаптированных групп населения [15]. Также сохраняется большой резервуар инфекции в учреждениях пенитенциарной системы. Все эти факты сыграли определенную роль в увеличении напряженности эпидемической ситуации по туберкулёзу [18, 24].
Известно, что специфический процесс чаще развивается на фоне других патологических состояний, которые также могут способствовать развитию туберкулёза [28]. Наряду с высокими показателями заболеваемости туберкулёзом, в последние годы увеличивается число больных с сопутствующими неспецифическими заболеваниями органов дыхания.
По данным ряда исследований, распространенность ХОБЛ в мире у людей старше 40 лет составляет 10,1 % (11,8 % у мужчин и 8,5 % у женщин) [42]. ХОБЛ рассматривается как заболевание, которое можно предотвратить и лечить, характеризующееся персистирующим ограничением скорости воздушного потока, которое обычно прогрессирует и связано с повышенным хроническим воспалительным ответом лёгких на действие патогенных частиц или газов; у ряда пациентов обострения и сопутствующие заболевания могут влиять на общую тяжесть ХОБЛ [11]. Ведущим фактором риска при возникновении ХОБЛ является табакокурение, социально-экономический статус, профессия, загрязнения окружающей среды, бронхолёгочная патология. Но по общепризнанному мнению главным этиологическим фактором в развитии ХОБЛ является в 70-80 % случаев курение. В патогенезе ХОБЛ большое значение имеет угнетение клеточного и гуморального иммунитета, что приводит к нарушениям мукоцилиарного клиренса, а в дальнейшем - к нарушению дренажной функции бронхиального дерева. Это приводит к ещё большему снижению местной иммунологической защиты с высоким риском развития обострения и присоединением инфицирования с развитием бронхолёгочного воспаления [7, 16, 45, 47]. Частое развитие обострений у больных ХОБЛ приводит к быстрому прогрессированию заболевания и к декомпенсации сопутствующих хронических заболеваний [2, 29, 43, 45].
В последнее время ХОБЛ рассматривается как заболевание, для которого характерны системные проявления: сердечно-сосудистые заболевания, остеопороз, поражение желудочно-кишечного тракта [4, 10, 21]. Установлено, что у больных с дисфункцией ЖКТ обострение ХОБЛ протекает с более выраженными нарушениями бронхиальной проходимости, высокой активностью воспалительного процесса [5]. Наличие хронической венозной недостаточности также является фактором, усугубляющим течение и прогрессирование ХОБЛ [17].
Наличие других заболеваний бронхо-легочной системы может способствовать возникновению и прогрессированию ХОБЛ [48, 50]. Отмечено увеличение распространенности неспецифических заболеваний легких среди больных туберкулёзом [12, 44].
При развитии инфекции на фоне имеющихся заболеваний и, наоборот, при развитии сочетанной патологии на фоне туберкулёза отмечается взаимное утяжеление их течения: с одной стороны, возникают хронические распространенные формы туберкулёза, с другой, наблюдается более тяжелое течение сопутствующих заболеваний. В сочетании с туберкулёзом органов дыхания, ХОБЛ поддерживает патологический процесс, замедляя репарацию, осложняя течение туберкулёза, и приводит к неблагоприятному исходу развития [19, 25, 26, 36]. Туберкулёзный процесс у таких больных ХОБЛ характеризуется более тяжелыми формами с большей частотой образования полостей распада, бактериовыделением в мокроте, наличием осложнений, замедленной динамикой [39].
Бронхообструктивный синдром встречается при всех формах туберкулёза легких. Существует 3 формы его сочетания с туберкулёзом органов дыхания [8]:
1) паратуберкулёзный - предшествующий туберкулёзу легких ХОБЛ, диагностируемый в 21 % случаев; 2) метатуберкулёзный, развивающийся при длительном хроническом течении туберкулёза органов дыхания в 76 % случаев; 3) посттуберкулёзный, возникающий после перенесенного туберкулёза на фоне остаточных посттуберкулёзных изменений.
При очаговом туберкулёзе бронхиальная обструкция встречается в 52,7 %, инфильтративном - в 56,6 %, фиброзно-кавернозном - в 76,9 %, при диссеминированном - в 88,2 % [35]. Установлено, что при инфильтративном туберкулёзе в сочетании с бронхообструктивным синдромом бактериовыделение продолжается на 1,5-2 месяца больше, чем у больных без сопутствующей бронхиальной обструкции [34].
По данным А.А. Баранчуковой, Е.Ю. Пушкаревой [3] ХОБЛ метатуберкулёзного происхождения в структуре хронических обструктивных болезней органов дыхания у обследованных больных туберкулёзом составил 74,3 % и в структуре хронических неспецифических заболеваний легких метатуберкулёзного происхождения - 51 %. У больных с посттуберкулёзными изменениями при исследовании толерантности к физической нагрузке выявлено снижение ФВД в 58 % и наличие бронхообструктивных нарушений у 44 % больных [32].
Вопросы лечения ХОБЛ в сочетании с туберкулёзом легких остаются актуальными, современные высокоэффективные бронхорасширяющие препараты, как тиотропиум, у больных туберкулёзом практически не используются [24, 25].
Проблема лечения туберкулёза является одной из самых значимых проблем, что, по мнению большинства специалистов, связано с лекарственной устойчивостью МБТ. Это существенно снижает эффективность химиотерапии и в свою очередь ведёт к накоплению контингентов больных лекарственно-устойчивым туберкулёзом лёгких и создаёт условия для формирования нового резервуара инфекции [14, 20].
Цель фармакотерапии ХОБЛ - уменьшение выраженности симптомов, снижение частоты и тяжести обострений, улучшение состояния здоровья и переносимости физической нагрузки (GOLD, 2011). Характер терапии зависит от фазы процесса, к базисной терапии как в фазе ремиссии, так и в фазе обострения относится применение ингаляционных препаратов с эффектом бронходилятации, предпочтительнее использовать длительно действующие лекарственные формы β2-агонистов и антихолинэргических препаратов. Определение степени тяжести ХОБЛ, частоты обострений, выраженности симптомов заболевания является определяющим для выбора оптимального лечения и приводит к уменьшению частоты и длительности обострений в год и оказывает положительное влияние на качество жизни [2, 3, 27].
При лёгкой степени тяжести ХОБЛ в фазе ремиссии ингаляционные антихолинэргические препараты - ипратропиум бромид или β2-агонисты (сальтутамол, фенотерол) назначаются по потребности при появлении у больного одного из легочных симптомов [1, 41]. При среднетяжёлом, тяжёлом и крайне тяжёлом течении ХОБЛ необходимо лечение бронхолитиками пролонгированного действия, назначение ингаляционных глюкокортикостероидов. Применение β2-агонистов, антихолинэргических препаратов, метилксантинов и их комбинаций зависит от доступности препарата и эффективности проводимого лечения [11, 13, 28].
Таким образом, сочетание туберкулёза легких и ХОБЛ является взаимоусугубляющим и требует своевременной диагностики, профилактики и длительного лечения обоих заболеваний. Это возможно только в условиях преемственности в работе учреждений противотуберкулёзной службы и общей лечебной сети.
Рецензенты:

Бронхообструктивный синдром и его коррекция у больных туберкулезом легких
Центральный НИИ туберкулеза РАМН, Москва
Бронхообструктивный синдром (БОС) – универсальный патологический синдром, характерный для большинства заболеваний респираторной системы, в том числе и для туберкулеза легких (ТЛ).
Наличие БОС усугубляет течение основного заболевания [1, 2]. БОС встречается при всех формах ТЛ, частота его выявления зависит от длительности течения специфического процесса [3, 4] и выраженности остаточных изменений в легких [5].
При очаговом туберкулезе бронхиальная обструкция встречается в 52,7%, инфильтративном – 56,6%, фиброзно-кавернозном – 76,9% [6–8], диссеминированном – 88,2%.
Распространенность БОС среди лиц с посттуберкулезными изменениями в легких отмечается в 2–3 раза чаще, чем среди остального населения, составляя от 59,5 до 83,9% [6, 9, 10] и являясь одной из основных причин временной потери трудоспособности, инвалидизации, и преждевременной гибели этих больных [6, 10, 11].
Различают 3 формы сочетания БОС с ТЛ [12]:
- Паратуберкулезный (предшествующий ТЛ) как проявление хронического обструктивного бронхита (ХОБ) или хронической обструктивной болезни легких (ХОБЛ).
- Метатуберкулезный БОС, возникающий при длительно текущем активном ТЛ.
- Посттуберкулезный БОС, развивающийся после излечения активного туберкулеза на фоне остаточных посттуберкулезных изменений в легких [13, 14].
Бронхиальная обструкция, которая предшествует ТЛ, чаще всего является проявлением ХОБ или ХОБЛ и диагностируется в 21% случаев [8]. В последние 15–20 лет отмечен значительный рост заболеваемости ХОБЛ, которая наносит значительный экономический ущерб обществу как в связи с частой временной утратой трудоспособности, так и с инвалидностью [15–17].
Метатуберкулезный БОС возникает при длительном течении туберкулеза в 75,8% случаев [6, 15, 18]. При этом на степень выраженности бронхиальной обструкции оказывает влияние распространенность специфического процесса в легких.
У больных с ограниченными процессами выраженные и резко выраженные нарушения бронхиальной проходимости выявлены в 40,1% случаев, а при распространенных изменениях – в 83,3% случаев [14, 18].
Также развитию бронхиальной обструкции при наличии ТЛ способствует хирургическое лечение заболевания, когда в результате оперативного вмешательства нарушается архитектоника структурных элементов легочной ткани, происходит деформация бронхов.
Такими формами являются кавернозный, фиброзно-кавернозный, цирротический, диссеминированный ТЛ [14, 18, 19].
Отличительной чертой возникновения бронхиальной обструкции при туберкулезе является сочетание “неспецифических” этиологических факторов: курение, хроническое раздражение, связанное с бытовым или производственным запылением и действием ирритантов со специфическим компонентом (интоксикация, раздражение дренирующих бронхов).
У больных с посттуберкулезными изменениями в легких бронхиальная обструкция выявляется в 23,8% случаев [7, 20]. Этиологические факторы развития БОС у этого контингента больных разнообразны.
Нередко заболевание возникает на фоне остаточных изменений перенесенного ТЛ [10]. Частота возникновения бронхообструкции возрастает в 2–3 раза по сравнению с остальным населением [3, 6, 10, 21]. При этом установлено, что чем значительнее остаточные посттуберкулезные изменения в легких, тем выше частота развития БОС [6].
Наряду с общеизвестными этиологическими факторами, ведущими к формированию ХОБЛ, у больных ТЛ есть еще дополнительные патогенетические компоненты развития бронхиальной обструкции.
Доказано положение о том, что БОС у больных ТЛ связан с туберкулиновой аллергией, в развитии которой существенную роль играет гистамин [14, 19].
Кроме того, бронхиальная гиперреактивность рассматривается как параспецифическая реакция слизистой оболочки дыхательных путей, обусловленная рефлекторным влиянием туберкулезной интоксикации, активацией биологически активных веществ [6, 18, 22, 23].
В ходе многочисленных исследований установлено, что выраженность патологических изменений в нижних дыхательных путях нарастает соответственно интенсивности экссудативной фазы туберкулезного процесса и угасает по мере ее затихания [6, 8].
При распространенном туберкулезном процессе наблюдаются дистрофические изменения слизистой оболочки бронхов с присутствием элементов неспецифического воспаления, которые в процессе заживления специфического процесса приводят к перестройке стенки бронха и формированию изменений, приводящих в 50% случаев к развитию бронхоэктазов [6].
При впервые выявленном ТЛ БОС наблюдается от 57,4 до 63,8%, при продолжительности заболевания свыше 4 лет – в 80% случаев [1, 3, 4]. Из признаков бронхиальной обструкции наиболее часто наблюдается повышение бронхиального сопротивления на выдохе и снижение удельной бронхиальной проходимости (39,5%), повышение бронхиального сопротивления на вдохе (29,2%). В 24,1% случаев отмечается увеличение общего бронхиального сопротивления [24].
Наличие бронхиальной обструкции при ТЛ способствует регионарному ухудшению газообмена, развитию гипоксемии и гиперкапнии, нарушению бронхиальной проходимости, развитию дыхательной недостаточности, формированию хронического легочного сердца, что в свою очередь является причиной высокой инвалидизации и смертности больных хроническими формами туберкулеза [5, 12, 24].
Течение туберкулеза у больных с бронхиальной обструкцией имеет свои особенности. Установлено, что у таких пациентов наблюдается более выраженная симптоматика с большей частотой осложнений и образованием полостей распада с бацилловыделением, более частым (в 3,4 раза) волнообразным течением и побочными реакциями на химиопрепараты (в 1,6 раза) [14, 25, 26].
В ряде исследований [4, 26, 27] установлено, что все инфильтративные процессы, возникающие в сочетании с бронхообструктивным синдромом имеют фазу распада с бактериовыделением, сроки прекращения которого на 1,5–2 мес больше, чем у больных без сопутствующей бронхообструкции.
Частота развития дыхательной недостаточности зависит от формы туберкулезного процесса и диагностируется от 25% при инфильтративном туберкулезе до 75% при фиброзно-кавернозном туберкулезе [5].
Противотуберкулезная химиотерапия ТЛ, сочетающегося с БОС, продолжается более 12 мес, предполагает худший исход заболевания и наибольшую вероятность формирования остаточных изменений [28–31].
Таким образом, ТЛ является заболеванием, предрасполагающим к развитию бронхиальной обструкции.
Основными факторами, способствующими его возникновению, являются развитие мета- и посттуберкулезного пневмосклероза с нарушением архитектоники легочной ткани, деформацией бронхов, образованием бронхоэктазов, воспалительные изменения слизистой оболочки бронхов с нарушением системы “местной” защиты [6, 23].
По этой причине функциональное состояние легких у больных туберкулезом органов дыхания является предметом постоянного внимания клиницистов в течение нескольких десятилетий [24, 27].
Функционально обратимый характер обструктивных нарушений при ТЛ по результатам проб с бронхолитическими препаратами, по данным разных авторов, встречается с частотой 44–88% [32]. Поэтому для снижения частоты необратимых нарушений функции внешнего дыхания наряду с противотуберкулезной химиотерапией используются патогенетические средства компенсации БОС [10, 33, 34].
Эффективная комплексная противотуберкулезная терапия является основой лечебной программы и в 43,3% случаев самостоятельно приводит к улучшению бронхиальной обструкции [1, 5, 24], однако применение целенаправленной терапии БОС у больных ТБ общепринято.
Множество работ посвящено лечению БОС при ТЛ. Применение аэрозолей эуфиллина, атропина, трипсина, а также лечебной физической культуры, массаж, УФ-облучение крови приводят к положительной динамике проходимости бронхов, особенно при наличии обструкции смешанного характера [35, 36].
Однако влияние каждого из этих методов лечения на течение БОС при отдельных формах ТЛ легких не изучено. Исследования, посвященные применению однократного введения туберкулина в сочетании с антибактериальной терапией в лечении больных ХОБ с остаточными посттуберкулезными изменениями в легких, показали, что туберкулинотерапия оказывает положительное влияние на клиническое течение ХОБ: на 20% увеличивает число больных, достигающих полной ремиссии, уменьшает периоды обострений (на 2 нед) и увеличивает продолжительность ремиссий в 3 раза.
Однократное использование туберкулина способствует улучшению реологических свойств мокроты – на 17% снижается ее вязкость и адгезивность. Основой клинического эффекта туберкулина являются изменения в клеточной фармакокинетике антибиотиков, способствующие повышению их концентрации в альвеолярных макрофагах [20].
Включение в комплекс лечения больных хроническим бронхитом курсов климатотерапии на Южном берегу Крыма приводит к уменьшению частоты обострений в 1,7 раза, улучшению показателей временной нетрудоспособности. Повторные курсы климатотерапии на Южном берегу Крыма препятствуют формированию ХОБ у больных туберкулезом, позволяют уменьшить выраженность обструкции, снизить частоту обострений заболевания и количество дней нетрудоспособности [3, 10, 11].
Санаторное лечение в туберкулезных санаториях в сочетании с химиопрофилактикой изониазидом и лечением неспецифического процесса в легких позволило снизить частоту рецидивов туберкулеза в 9,2 раза [21].
В последние годы в лечении ХОБ у больных ТЛ успешно применяются экстракорпоральные методы: плазмаферез и экстракорпоральное ультрафиолетовое облучение крови, которые позволяют уменьшить выраженность бронхиальной обструкции, снизить суточную потребность в применении b2-агонистов, увеличивают объем форсированного выдоха за 1-ю секунду (ОФВ1) [14, 25, 26, 37, 39].
При этом установлено, что наибольший эффект при использовании плазмафереза наблюдается у больных при ограниченных процессах (очаговом, инфильтративном), а меньший – при хронических формах ТЛ (кавернозный, фиброзно-кавернозный, диссеминированный) [38].
Использование экстакорпорального ультрафиолетового облучения крови у больных ТЛ в сочетании с ХОБ ведет к уменьшению выраженности клинической симптоматики (уменьшению выраженности одышки, интенсивности сухих хрипов в легких) увеличивает ОФВ1 на 23% от должных величин и жизненную емкость легких (ЖЕЛ) на 12,6%, способствует нормализации показателей периферической крови (уменьшение лейкоцитоза, снижение СОЭ и увеличение числа лимфоцитов).
Сочетание ЭУФОК с антибактериальной терапией позволило существенно уменьшить бактериовыделение (на 39,8%) и подавить рост микрофлоры мокроты в 10 раз [25, 35].
Приведенные материалы свидетельствуют о многообразии подходов к компенсации БОС у больных ТЛ. Некоторые из них вызывают недоумение (ингаляции протеолитических ферментов), другие (ингаляции атропина и эуфиллина) носят исторический характер.
Последнее десятилетие отмечено большой интенсивностью работ по проблеме самого распространенного хронического заболевания респираторной системы – ХОБЛ, и созданием международных и национальных рекомендаций по лечению ХОБЛ. Использование этих рекомендаций систематизировало и упорядочило методики лечения, что привело к значительным успехам в лечении ХОБЛ.
Конечно, ставить знак равенства между ХОБЛ и БОС у больных ТЛ нельзя, но провести аналогии можно. Нами [40] адаптированы и модифицированы рекомендации по лечению ХОБЛ для больных ТБ, протекающих с БОС. При выборе объема бронхорасширяющей терапии в самом начале ее применения необходимо учитывать выраженность бронхиальной обструкции.
Общепринятым критерием выраженности бронхиальной обструкции является ОФВ1: степень 1 – ОФВ1>70%, степень 2 – ОФВ1=69–50%, степень 3 – ОФВ1 Рубрика: Туберкулез и сопутствующая патология
Бронхообструктивные проявления все чаще сопровождают такие серьезные болезни, как бронхиальная астма и хроническая обструктивная болезнь легких (ХОБЛ). У взрослых более распространен второй вариант. Бронхиальная обструкция у детей вызвана чаще астмой.
СБО (синдром бронхиальной обструкции) – нарушение вентиляции легочной ткани, которое проявляется острой недостаточностью функции дыхания.
Что такое обструкция бронхов и чем она вызвана, вы сможете узнать в данной статье. Также рассмотрим подходы к диагностике и лечению бронхообструктивного синдрома.
Причинные факторы
Основными этиологическими состояниями БОС являются заболевания дыхательной системы, сопровождающиеся отеком слизистой бронхов и спазмом их мускулатуры. К ним относятся:
Основной причиной появления описываемого синдрома специалисты-пульмонологи считают курение. Оно вызывает бронхит курильщика, который сопровождается хроническим воспалением. К этому фону со временем присоединяется бронхоспастический компонент. Он знаменует начало бронхообструкции. Затем при отсутствии адекватного лечения стенка бронха подвергается необратимому ремоделированию. В результате развивается ХОБЛ.
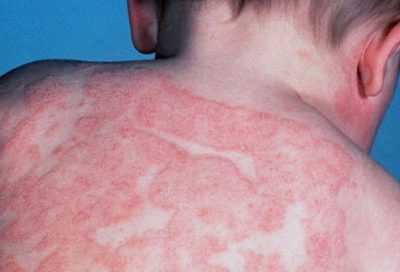
Атопический дерматит рассматривается как один из начальных этапов формирования атопии. Так называемый атопический марш создает угрозу развития бронхиальной астмы, которая проявляется обструктивным синдромом.
Следующая возможная причина – инфицирование паразитами. Продукты жизнедеятельности и метаболизма паразитирующих организмов являются мощными антигенами и аллергенами. Они могут так же, как и аллергическая настроенность к пищевым продуктам, бытовым аллергенам, вызвать обструкционный синдром в рамках бронхиальной астмы.
Разновидности синдрома
Существует несколько патогенетических вариантов бронхообструкции. Они отличаются только главным механизмом, который вызывает спазм мускулатуры бронхов.
Инфекционно-воспалительная форма. Обструкции бронхиального дерева вызывается различными пневмониями, туберкулезом. Бронхитический тип также может появляться на фоне обострения хронической обструктивной болезни легких. Доминирующим патогенетическим механизмом считается отек слизистой бронхиальной стенки и скопление мокроты со слизью, которые создают препятствие, непроходимость мелких бронхов.- Аллергическая форма бронхоспазма. Вызвана выраженным отеком слизистой. Генез этой разновидности обструкции связан с повышением проницаемости стенки бронхов. Спазм мускулатуры поддерживает этот патогенетический фактор. Аллергическая форма бронхообструктивного синдрома появляется в рамках сывороточной болезни или отека Квинке с реализацией гиперчувствительности немедленного типа.
Аутоиммунная форма. Обструкция бронхов развивается у половины пациентов с аутоиммунными патологиями. Механизмы бронхиальной обструкции реализуются при следующих заболеваниях:
криоглобулинемический васкулит.- синдром Чарга-Стросса.
- гранулематоз Вегенера.
- узелковый полиартериит.
- гигантоклеточный артериит.
- эозинофильный полиангиит.
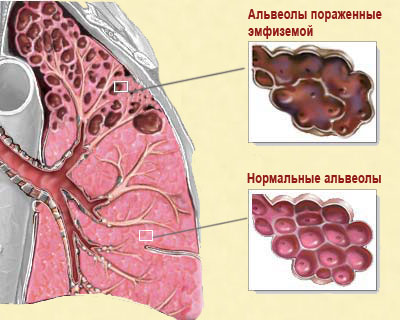
Эмфизема легких. Может вызвать развитие обструкции бронхиального дерева. При этом легочная ткань теряет свою эластичность. Затем некоторые бронхи спадаются, формируя дыхательную ловушку: воздух может проникнуть в альвеолы, а обратно не возвращается через спавшийся бронх. Такой вариант синдрома носит название эмфизематозный.
Клинические проявления
Жалобы пациента зависят от степени выраженности бронхиальной непроходимости. Бронхоспазму может предшествовать так называемый продром. Он проявляется ощущением заложенности грудной клетки. При бронхиальной астме или другом аллергическом заболевании триггерной ситуацией может быть контакт с аллергеном.

Внезапно возникает одышка. Она носит экспираторный характер. Это означает, что взрослый или ребенок испытывает трудности при выдохе. Даже сильное форсирование не приводит к облегчению. Пропедевтика внутренних болезней называет это состояние приступом удушья.
При бронхиальной астме этот синдром наиболее ярко протекает. Кожа становится несколько синюшной из-за гипоксии. Учащается ритм дыхания и сердцебиения. Одышка достигает такой степени, что частота респираторных движений превышает 20 в минуту.
Возникают хрипы, которые слышны даже на расстоянии. Сам пациент опирается руками на кровать для того, чтобы облегчить выдох, активируя деятельность вспомогательной дыхательной мускулатуры. Ребенок часто раздувает ноздри. Это несколько увеличивает объем вдыхаемого и выдыхаемого воздуха. Бронхообструктивный синдром у детей протекает тяжелее, чем у взрослых пациентов.
При физикальном обследовании отмечается перкуторное укорочение звука над всеми легочными полями. В тяжелых ситуациях западают надключичные ямки. Это свидетельствует о тяжелой дыхательной недостаточности. Аускультативная картина довольно типичная. Слышны свистящие сухие хрипы повсюду. На их фоне могут быть и влажные хрипы. Фаза выдоха заметно удлинена. Вдох обычный, протекает быстро.
В отличие от сердечной астмы по причине левожелудочковой недостаточности при бронхиальной астме горизонтальное положение пациента не усугубляет его состояние. Не приносит ему облегчения применение диуретиков (разгрузка малого круга кровообращения), а также использование сердечных гликозидов.
Кашель может беспокоить перед развитием приступа удушья. При ХОБЛ или астме обострение может вызывать острая респираторная инфекция вирусной или бактериальной этиологии. Поэтому кашель предшествует бронхообструкции. На фоне удушья кашель сухой, непродуктивный. Мокрота выделяется очень тяжело и имеет так стекловидный характер.
Диагностика и лечение
При синдроме бронхообструкции следует вести прицельный поиск причины. Первоочередно важно провести рентгенологическое исследование для исключения пневмонии. Затем определяют сатурацию крови. Это нужно для того, чтобы выявить степень дыхательной недостаточности. При тяжелом нарушении функции дыхания целесообразно лечение в условиях реанимационного отделения с кислородотерапией.
Клинический анализ крови важен для дифференциальной диагностики. Повышение уровня лейкоцитов, нейтрофилов объясняет инфекционный генез синдрома при пневмонии или тяжелом обструктивном бронхите. Эозинофилия свидетельствует о бронхиальной астме в большей степени или о других аллергических заболеваниях. Спирография позволяет отличить бронхообструкцию от рестриктивных нарушений. Исследуются объемные и форсированные показатели. В том числе, пробы с бронхолитиками.
На этапе скорой помощи важно уменьшить выраженность бронхоспазма.
Широко используется в практике фельдшера или врача бригады СМП Эуфиллин. Он вводится внутривенно. Перед инъекцией стоит выяснить, нет ли на этот препарат непереносимости.
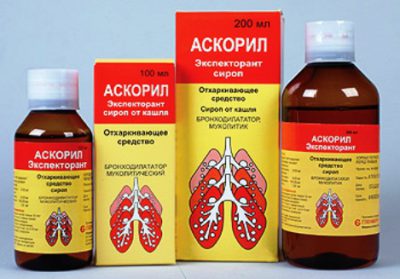
С этой же целью на любом из этапов терапии используются Б-адреномиметики, которые обладают коротким действием. Лечение бронхообструктивного синдрома у детей может включать комбинированный препарат Аскорил. Он вызывает меньше побочных эффектов, а также реализуется аптеками в свободном доступе без рецептов.
Для постоянного лечения – базисной терапии – существуют комбинированные препараты, которые используются ингаляционно. В своем составе они содержат гормональные препараты и бронхолитики длительного действия. Это Пульмикорт, Сибри и другие лекарственные средства. Дозу подбирает и титрует доктор.
Что такое бронхообструктивный синдром?
Бронхообструктивный синдром (сокр. БОС, или также называемый синдромом бронхиальной обструкции) — симптомокомплекс поражения дыхательных путей, обусловленный органическим или функциональным нарушением бронхиальной проходимости. В его основе лежит сужение или окклюзия на каком-либо участке бронхиального дерева, которая может быть следствием разнообразных патологических состояний.
Причины бронхообструктивного синдрома
Причины развития БОС многообразны. Основными из них являются:
- спазм гладкомышечных волокон в стенке бронха;
- механическая закупорка его просвета инородными телами, а также гноем или кровью;
- повышенная секреция вязкой слизи и ее скопление в просвете бронха;
- трахеобронхиальная дискинезия;
- воспалительный процесс в нижних дыхательных путях;
- отек стенки бронхов (при аллергических реакциях, токсических воздействиях);
- наличие рубцовых изменений и фиброза по ходу бронхиального дерева;
- эндобронхиальные опухоли или сдавление бронха извне;
- утрата легкими эластичными и коллапс мелких бронхов на выдохе.
Механизмы развития
Длительное нарушение бронхиальной проходимости под воздействием провоцирующих факторов (табачного дыма, пыли, аллергенов, частых ОРВИ) приводит сначала к утолщению стенки бронха за счет отека, гиперплазии слизистых желез и гипертрофии гладкой мускулатуры. Затем развивается перестройка бронхиального дерева на всем протяжении с расстройствами вегетативной иннервации и формируется мукоцилиарная недостаточность.
При этом обструкция дыхательных путей может быть обратимой или необратимой:
- Первый вариант наблюдается при бронхоспазме и отеке с гиперсекрецией.
- Второй чаще обусловлен хронической обструкцией со скоплением вязкой мокроты в мелких бронхах или эмфиземой.
Эпидемиология
Синдром бронхиальной обструкции достаточно часто встречается у детей, особенно у детей первых трех лет жизни. На возникновение и развитие его оказывают влияние различные факторы и, прежде всего, респираторная вирусная инфекция.
Частота развития бронхиальной обструкции развившейся на фоне острых респираторных заболеваний у детей раннего возраста составляет, по данным разных авторов, от 5% до 50%. У детей с отягощенным семейным анамнезом по аллергии БОС, как правило, развивается чаще, в 30-50% случаев. Такая же тенденция имеется и у детей, которые часто, более 6 раз в году, болеют респираторными инфекциями.
Классификация
Условно все заболевания, протекающие с синдромом бронхиальной обструкции, можно разделить на 2 большие группы:
- болезни, при которых бронхиальная обструкция обязательна и является их неотъемлемой частью (ХОЗЛ, бронхиальная астма, эмфизема легких);
- болезни, при которых синдром бронхиальной обструкции может отсутствовать или быть выражен в той или иной мере (острый бронхит, пневмония, саркоидоз легких, туберкулез легких, пневмокониозы, паразитарные поражения и опухоли легких).
В зависимости от причины и механизма развития синдром бронхиальной обструкции можно разделить на следующие варианты:
- Инфекционно-воспалительный (бронхиты, пневмония, туберкулез, микозы).
- Аутоиммунный (поражение бронхо-легочной системы при диффузных заболеваниях соединительной ткани, паразитарных инвазиях).
- Аллергический (лекарственная аллергия, поллинозы, бронхиальная астма).
- Дискинетический (стенозы, дискинезии трахеобронхиального дерева).
- Обтурационный (инородные тела в дыхательных путях, опухолевый процесс, муковисцидоз).
- Гемодинамический (тромбоэмболия легочной артерии, первичная гипертензия в малом круге кровообращения, застойная сердечная недостаточность).
- Токсический (прием лекарств, вдыхание токсических веществ, отравление веществами холинергического действия).
- Неврогенный (вегетативная дистония, истерия, гипервентиляционный синдром).
- Ирритативный (термические или химические ожоги, интубация трахеи).
- Эндокринно-гуморальный (диэнцефальный синдром, гипопаратиреоз).
Симптомы бронхообструктивого синдрома

Несмотря на множество причин бронхиальной обструкции проявления данного синдрома однотипны, к ним относятся:
В легких при этом выслушивается ослабленное везикулярное дыхание с удлиненным выдохом и сухими свистящими рассеянными хрипами. При перкуссии определяется звук с коробочным оттенком, опущение нижних границ легких и ограничение подвижности их нижних краев.
Диагностика
Наличие БОС у больного подтверждается комплексом жалоб, истории заболевания, объективных признаков и данных дополнительных методов исследования. Таким пациентам назначаются:
- общий анализ крови;
- исследование мокроты;
- рентгенография органов грудной клетки;
- спирография с проведением бронходилатационных проб (в пользу бронхообструкции свидетельствует снижение объема форсированного выдоха за первую секунду менее 80 % от должного и снижение его от отношения к жизненной емкости легких менее 70 %);
- компьютерная томография и бронхоскопия (по показаниям).
Дифференциальная диагностика синдрома проводится с воспалительными заболеваниями верхних дыхательных путей, стенозом гортани или трахеи, опухолями этой же локализации.
По результатам спирографии в течении бронхообструктивного синдрома выделяют 3 степени тяжести:
- Легкая (воздух проходит по суженному бронху с развитием гиповентиляции, при этом ОФВ1 составляет более 70 % от должного).
- Среднетяжелая (характеризуется клапанным механизмом обструкции, ОФВ1 колеблется от 50 до 69 %).
- Тяжелая (полное закрытие просвета бронха, ОФВ1 менее 49 %).
Особенности течения синдрома при различных патологических состояниях
- При бронхиальной астме обструкция дыхательных путей является обратимой, ее симптомы быстро развиваются и также быстро исчезают под действием бронхолитиков. В этом случае приступу удушья, возникающему под действием аллергенов, предшествуют чихание, першение в горле или сухой кашель. У таких больных обычно имеется отягощенный аллергологический анамнез.
- При ХОЗЛ бронхиальная обструкция характеризуется определенной стойкостью и необратимостью, она возрастает из года в год и утяжеляется в период присоединения респираторной инфекции. При обследовании таких пациентов выявляют признаки эмфиземы.
- Если на фоне бронхообструктивного синдрома возникают частые пневмонии в одних и тех же сегментах легких и по утрам отделяется большое количество гнойной мокроты, то следует предполагать развитие бронхоэктазов.
- Клинической картиной бронхиальной обструкции могут сопровождаться воспалительные заболевания легких. При этом на первый план выступают лихорадка с интоксикацией и болью в грудной клетке и выявляются типичные объективные данные (локальное притупление перкуторного звука, фокус влажных хрипов).
- Рак легкого, при сужении просвета бронха на 2/3 и более, так же протекает с обструкцией дыхательных путей. Однако в ряде случаев ему предшествует период длительного субфебрилитета, кровохарканье и мучительный кашель. При обследовании выявляется укорочение перкуторного звука над пораженным сегментом и ослабление везикулярного дыхание в этой зоне.
- Развитию бронхообструкции способствует сдавление увеличенными лимфоузлами трахеи и бронхов при опухолях средостения. Последние распознаются по нарастающему компрессионному синдрому верхней полой вены и рентгенологическим признакам.
- Нейрогенный бронхообструктивный синдром развивается при неврастении, истерии у молодых людей (чаще женского пола) в ответ на психотравмирующие воздействия. Такое состояние никогда не сопровождается цианозом и участием в акте дыхания вспомогательной мускулатуры. Характерной особенностью этой патологии является отсутствие каких-либо органических изменений.
Остро развивающийся и повторяющийся синдром бронхообструкции возникает при механическом нарушении проходимости респираторного тракта (инородные тела или наличие крупной опухоли). При этом выявляется:
- инспираторная одышка,
- стридорозное дыхание,
- цианоз.
При аспирации инородных тел небольшого размера, которые раздражают определенный отдел бронхиального дерева, возникает приступообразный кашель.
Лечение бронхообструктивого синдрома
Лечение бронхообструктивного синдрома проводится с учетом заболевания, которое его вызвало. При этом используются различные специфичные и неспецифичные методы. Для каждой нозологической формы набор этих методов строго индивидуален. Однако принципы бронхорасширяющей терапии для всех видов данного синдрома едины. Обычно лечение БОС включает:
- устранение причин болезни и возможных факторов риска;
- противовоспалительную терапию;
- прием бронходилятаторов (В2-агонистов, антихолинергических препаратов, метилксантинов);
- антибактериальную терапию;
- хирургическое вмешательство (по показаниям).
Заключение
Правильная диагностика с уточнением причины патологических изменений важна для определения тактики ведения таких больных и назначения адекватного лечения. Именно от этого зависит прогноз при бронхообструктивном синдроме.
Читайте также:


