Научные медицинские статьи токсоплазмоз
Токсоплазмоз — широко распространенная зоонозная паразитарная инфекция, характеризующаяся полиморфизмом клинических проявлений и значительной вариабельностью течения процесса: от здорового, бессимптомного носительства до тяжелых, летальных форм болезни.
.jpg)
Токсоплазмоз — широко распространенная зоонозная паразитарная инфекция, характеризующаяся полиморфизмом клинических проявлений и значительной вариабельностью течения процесса: от здорового, бессимптомного носительства до тяжелых, летальных форм болезни.
Этиология. Возбудитель токсоплазмоза Toxoplasma gondii относится к царству Protozoa, классу Coccidia, отряду Eucoccidiorida, типу Apicomplexa. T. gondii — условно патогенный внутриклеточный паразит, поражающий в организме промежуточных хозяев, в том числе человека, любые ядерные клетки гистеофагоцитарной системы.
Эпидемиология. Пораженность или инфицированность токсоплазмами населения Российской Федерации в среднем составляет около 20,0%. Показатели пораженности выше в регионах с теплым климатом; среди лиц ряда профессиональных групп: рабочие мясокомбинатов и звероводческих ферм, животноводы, ветеринарные работники и др. Инфицированность женщин, как правило, в 2–3 раза выше, чем у мужчин.
Заболеваемость токсоплазмозом во много раз ниже показателей инфицированности, однако трудности диагностики, несмотря на обязательную регистрацию, не позволяют судить об истинном уровне инфекции.
Восприимчивость к токсоплазмозу — практически поголовная. Распространение инфекции — повсеместное в виде носительства и спорадических заболеваний. Основной источник инфекции — дикие и домашние кошки.
Основной фактор передачи токсоплазм — сырое или недостаточно термически обработанное мясо, мясные продукты с находящимися в нем цистами токсоплазм. К дополнительным факторам передачи инфекции относятся плохо вымытая зелень, овощи, фрукты (с земли), грязные руки с находящимися на них ооцистами возбудителя.
Основные пути передачи:
- пищевой — связанный с употреблением в пищу термически плохо обработанного мяса, содержащего цисты паразита;
- контактный — ассоциированный с больными кошками, выделяющими токсоплазмы с фекалиями;
- трансплацентарный — при котором становится возможным проникновение токсоплазм в плод, с последующим развитием врожденного токсоплазмоза у новорожденного;
- парентеральный — при котором не исключается передача инфекции реципиенту при переливании крови, пересадке органов и тканей.
Беременная с токсоплазмозом не представляет эпидемиологической опасности ни для окружающих, ни для медицинского персонала, что делает возможным лечение этих пациентов как в амбулаторных условиях, так и в любом соматическом стационаре.
Патогенез. Вышедшие из цист или ооцист возбудители внедряются в эпителиальные клетки тонкого кишечника, где они размножаются, образую первичный аффект и проникая затем в региональные лимфатические узлы, а из них с током лимфы — в кровь. Диссеминация возбудителя приводит к поражению самых различных органов и тканей.
При беременности, в условиях сниженного иммунитета, наряду с первичным заражением токсоплазмами, опасным является и реактивация паразита (при инфицировании до беременности), что в значительной степени определяет течение и исход беременности.
При выходе токсоплазм из цист происходит диссеминация возбудителей. Их концентрация в тканях ассоциирована со способностью токсоплазм проникать трансплацентарно, что приводит к развитию внутриутробной патологии на любом сроке беременности.
Заражение плода наблюдается у беременных как с первичным инфицированием токсоплазмами, так и реактивацией возбудителя во время беременности у серопозитивных женщин. Поражение плода может возникать на любом сроке гестации, но особую опасность представляет его инфицирование в первом и втором триместрах. При заражении в третьем триместре беременности преобладают бессимптомные формы течения заболевания, а поздние клинические признаки проявляются через месяцы и годы.
Заражение на ранних сроках эмбриогенеза заканчивается спонтанным выкидышем, мертворождением, вызывает тяжелые нарушения развития — анэнцефалию, анофтальмию, гидроцефалию, гепатоспленомегалию и др. (табл.).
Формирование иммунитета приводит к исчезновению возбудителя из крови, прекращается его размножение в клетках. Образуются истинные тканевые цисты, которые могут длительно, десятилетиями, в интактном состоянии сохраняться в организме (носительство токсоплазм).
Клиника. Приобретенный токсоплазмоз по характеру течения делится на острый и хронический. Кроме того, в зависимости от длительности болезни и выраженности клинических симптомов возможно подострое, а также инаппарантное (субклиническое) течение инфекции, которое характеризуется определенной динамикой либо высоким уровнем специфических антител в крови, при отсутствии клинических проявлений болезни. Таким образом, наиболее удобной для практического здравоохранения, с нашей точки зрения, является следующая классификация приобретенного токсоплазмоза: острый, подострый, хронический, инаппарантный и носительство.
Клинические проявления токсоплазмоза у беременных не имеют каких-либо существенных отличий от уже известной клинической картины заболевания.
Лабораторная диагностика. Для лабораторной диагностики токсоплазмоза чаще всего применяют серологические методы: реакцию непрямой иммунофлюоресценции (РНИФ) и иммуноферментный анализ (ИФА). Диагноз подтверждается достоверно нарастающей динамикой показателей этих тестов, их высоким уровнем либо наличием антител класса IgM. Существенное значение в диагностике токсоплазмоза, особенно в дифференциации острого и хронического процессов, имеет определение классов иммуноглобулинов, в частности антител класса IgM. Надежно диагностировать токсоплазменную инфекцию можно лишь при сравнении результатов серологических реакций в динамике. Антитела всех классов существенно повышаются к концу второй — началу третьей недели от момента инфицирования и достигают диагностического уровня. Диагноз токсоплазмоза при наличии соответствующей клиники может быть поставлен при положительной серологической конверсии, когда второй анализ сыворотки становится положительным.
Диагностика токсоплазмоза у беременных женщин включает в себя весь комплекс необходимых клинических, параклинических и специальных (иммунобиологических) исследований, которые применяются для диагностики токсоплазмоза вообще.
Обязательным условием обследования беременной на токсоплазмоз должна быть консультация врача-инфекциониста для подтверждения либо исключения текущего инфекционного манифестного или бессимптомного (инаппарантного) токсоплазменного процесса.
Учитывая исключительную важность результатов иммунологического обследования в диагностике токсоплазмоза у беременных, необходимо правильно интерпретировать полученные данные.
Вариант 3: клинические проявления инфекции отсутствуют; серологические реакции положительные в низких, средних, иногда высоких титрах (РНИФ 1:640, ИФА IgG ≥ 200 Ед/мл; ИФА IgM — положительно). При исследовании парных сывороток (через 3–4 недели) регистрируется достоверное нарастание уровня специфических антител класса IgM.
Заключение: инаппарантный токсоплазмоз — реальная угроза инфицирования плода.
Вариант 4: имеются клинические проявления токсоплазмоза; серологические реакции положительные в низких и средних (иногда высоких) титрах: РНИФ 1:1280, ИФА IgG ≥ 200 Eд/мл; ИФА IgM — положительно, при исследовании парных сывороток в динамике регистрируется достоверное нарастание уровня специфических антител; выявляются специфические антитела класса IgM-класса. Заключение: острый токсоплазмоз.
Рекомендации: экстренная превентивная этиотропная терапия (не ранее чем со II триместра беременности); в I триместр — рассмотреть вопрос о прерывании беременности; проводят кордо- и амниоцентез на 22–23 неделях беременности; новорожденный обследуется на токсоплазмоз, и при подтверждении диагноза проводится этиотропная терапия (диспансерное наблюдение 5 лет).
Вариант 5: имеются клинические проявления инфекции; серологические реакции положительные в высоких или средних показателях; при исследовании парных сывороток в динамике регистрируется снижение уровня специфических антител (РНИФ ≤ 1:1280, ИФА IgG — 200 Eд/мл; ИФА IgM — положительно). Заключение: подострый токсоплазмоз. Рекомендации: этиотропная терапия (не ранее чем со II триместра); в I триместр — ставится вопрос о прерывании беременности; новорожденный обследуется на токсоплазмоз и при подтверждении диагноза проводится этиотропная терапия (диспансерное наблюдение 5 лет).
Вариант 6: имеются клинические проявления токсоплазмоза; серологические реакции положительны в низких или средних показателях (РНИФ 1:640, ИФА IgG — 200 Eд/мл; ИФА IgM — отрицательно); при исследовании парных сывороток (через 3–4 недели) динамики уровня антител нет; антитела класса IgM отсутствуют. Заключение: хронический приобретенный токсоплазмоз. Рекомендации: этиотропная терапия не проводится; при необходимости специфическая терапия вне беременности; прерывание беременности не показано.
Лечение. Показанием к назначению этиотропной терапии у беременных женщин являются острый, подострый и инаппарантный токсоплазмоз. Лечение хронического токсоплазмоза следует проводить строго по клиническим показаниям либо до, либо после беременности. При отсутствии жалоб и клинических показаний не нуждаются в лечении женщины, переболевшие токсоплазмозом до беременности. Эти женщины расцениваются как практически здоровые лица, не требующие специального медицинского наблюдения. Лечение беременных женщин следует проводить не ранее 12–16 недель беременности (со II триместра беременности).
Назначаются препараты группы пириметамина (Фансидар, Ровамицин).
Фансидар содержит сульфадоксин 500 мг и пириметамин 25 мг. Этиотропная терапия состоит из 2–3 циклов. Назначается 1 таблетка 1 раз в 3 дня № 8 таблеток на цикл. Учитывая возможность угнетения кроветворения под действием этиотропных препаратов, рекомендуется назначение фолиевой кислоты (в средних терапевтических дозах), а также проведение общих анализов крови и мочи. При непереносимости препаратов группы пириметаминов назначают Ровамицин, 1 таблетка которого содержит спиромицина 3 млн МЕ. Назначают по 3 млн МЕ 3 раза в день с семидневным перерывом. Хорошая переносимость Ровамицина больными, отсутствие лекарственного взаимодействия, высокая эффективность позволяют назначать его для лечения токсоплазмоза у беременных. При непереносимости пириметаминов возможна замена на антибиотики, например, эритромицин.
Противопоказаниями для назначения Фансидара и его аналогов, а также сульфаниламидных препаратов и антибиотиков являются: нарушения эритропоэза с анемией, заболевания почек с нарушением их функций, заболевания печени, декомпенсация сердечной деятельности.
В зависимости от сроков беременности целесообразно проведение не менее двух полных курсов этиотропной терапии с перерывами между ними 1–1,5 месяца.
Как показала практика, у пациенток с инаппарантным течением острого токсоплазмоза хороший эффект дает комплексное применение Фансидара с иммуномодуляторами (Галовит, Полиоксидоний). Уже после первого цикла лечения наблюдается значительное снижение IgM.
Профилактика врожденного токсоплазмоза. Профилактика врожденного токсоплазмоза должна строиться с учетом того факта, что только первичное заражение женщины во время беременности может привести к инфицированию плода. Оптимально профилактика врожденного токсоплазмоза должна включать в себя обследование женщин детородного возраста на токсоплазмоз до или, в крайнем случае, во время беременности. Неиммунные беременные женщины должны быть обязательно взяты на диспансерное наблюдение и обследоваться на токсоплазмоз 1 раз в триместр.
Литература
- О выявлении и профилактике токсоплазмоза в Москве. Методические рекомендации (№ 25). М., 2007.
- Лысенко А. Я. Клиническая паразитология. Женева, 2002.
- Hill D., Dubey J. P. Toxoplasma gondii: transmission, diagnosis and prevention // Clin. Microbiol. Infect. 2002. № 10.
- Desmonts G., Couvreur J. Toxoplasmosis in pregnancy and its transmission to the fetus // Bull. N. Y. Acad. Med. 1974. № 2.
Ф. К. Дзуцева*
Г. Ю. Никитина**
Ю. В. Борисенко*
Л. П. Иванова***, кандидат медицинских наук, доцент
С. Х. Зембатова***
*Городской центр по токсоплазмозу, **ГКБ им. С. П. Боткина, ***РМАПО, Москва

Дата публикации: 19.05.2015 2015-05-19
Статья просмотрена: 15344 раза
В данной статье представлены обзорные данные о клинических проявлениях, методах диагностики и лечении токсоплазмозной инфекции у новорожденных. Своевременная диагностика и лечение данной инфекции, предотвращает летальный исход.
Ключевые слова: токсоплазмозная инфекция, интранатальное инфицирование беременной женщины и плода, полиорганные поражения плода, методы диагностики, антибиотики.
Токсоплазмоз у детей — врожденное (заражение в утробе матери) или приобретенное паразитарное заболевание.
Актуальность проблемы токсоплазмоза обусловлена практически повсеместным распространением возбудителя в природе, высокой частотой инфицированности токсоплазмами, возможностью длительной персистенции токсоплазм в различных органах и тканях, а также простыми путями передачи инфекции и ролью этой инфекции в перинатальной патологии.
Латентные формы токсоплазмозной инфекции, как и при многих других инфекциях, количественно преобладают над клинически выраженными. Заболевания токсоплазмозом различной степени тяжести развиваются при массивном заражении или при низком уровне иммунологической защиты организма.
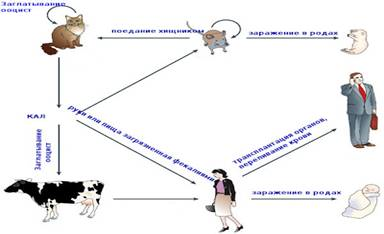
ЭТИОЛОГИЯ: Возбудитель — Toxoplasma gondii, облигатный внутриклеточный паразит, относится к типу Protozoa, классу Sporozoa и имеет сложный цикл развития. Окончательным (дефинитивным) хозяином токсоплазмы является домашняя кошка, а также дикие представители семейства кошачьих. При заражении кошки алиментарным путем паразиты проникают в эпителиальные клетки кишечника, где после нескольких бесполых генераций формируются макро- и микрогаметы. Половой процесс завершается образованием ооцист, которые выводятся с фекалиями кошки во внешнюю среду. Ооцисты токсоплазм высоко устойчивы к различным неблагоприятным воздействиям и сохраняют свою эффективность в почве при достаточной влажности до 2-х лет. Промежуточные хозяева — многие виды теплокровных животных, млекопитающие, птицы, а также человек. [12,15,24].
ОСНОВНЫЕ ИСТОЧНИКИ: Источником инфекции для людей могут быть домашние животные. Крупный и мелкий рогатый скот, свиньи, кролики, инфицированы токсоплазмами в 5 –15 % и человек может заразиться при употреблении недостаточно термически обработанного мяса. Проведенные в США исследования по изучению инфицированности кошек — основного хозяина паразита — показали, что 30 % кошек инфицированы токсоплазмами, но только 1 % выделяют ооцисты, которые при попадании в почву до 2 лет могут сохранять инфекционные свойства.
ПУТИ ЗАРАЖЕНИЯ: 1. Основной путь — пероральный. Он осуществляется в основном цистами или ооцистами. Заражение цистами может произойти при употреблении полусырого мяса или сырого мясного фарша, а заражение ооцистами — через грязные руки при контакте с кошками, при употреблении немытых или плохо вымытых овощей, ягод, загрязненных почвой. 2. Контаминационный путь — заражение через слизистые и поврежденную кожу — возможен у детей и взрослых при тесном контакте с больными животными, а также у взрослых, имеющих профессиональный контакт с животными (например, работники мясокомбинатов). 3. Возможна трансплантационная передача токсоплазмоза — при пересадке органов от донора с токсоплазмозной инфекцией. 4. Конгенитальный путь заражения — внутриутробное заражение плода от матери через плаценту — имеет важное значение в акушерской и педиатрической практике. Источником инфекции для плода в данном случае является мать. Доказано заражение плода только от женщин со свежей (первичной) инфекцией, приобретенной во время данной беременности, когда имеется паразитемия, и возбудитель с кровью может попасть в плаценту. В ней формируется первичный очаг инфекции, откуда токсоплазмы гематогенным путем попадают к плоду. У женщин, заразившихся токсоплазмозом до беременности (старая, хроническая или латентная инфекция), передача возбудителя в плод не доказана, развившийся иммунитет матери защищает плод от заражения. Не все женщины, заразившиеся во время беременности, имеют симптомы острого заболевания токсоплазмозом, а только одна из десяти. Обычно это лимфаденит. У остальных первичная инфекция протекает асимптомно. Но передача возбудителя плоду может происходить как от больных с лимфаденитом, так и от женщин с первичной асимптомной инфекцией. Установлено также, что не все женщины, заразившиеся во время беременности, передают инфекцию плоду, это происходит примерно у половины из них; у остальных успевает развиться иммунитет, защищающий плод. [5,13,24].
ЭПИДЕМИОЛОГИЯ: Инфицированность токсоплазмами в разных странах колеблется от 0 до 90 %. В Западной Европе и Северной Америке инфицированность здорового населения составляет 25–50 %, в то время как в Африке и Центральной и Южной Америке — до 90 %. Сравнительно низкая инфицированность в Азии — Афганистане, Вьетнаме, Индонезии. В средней полосе России инфицированность составляет 15–25 %, в Москве инфицированность составляет 25 %. Для региональной инфицированности играют роль климатические условия, хозяйственный профиль района, особенности национальной кухни, санитарное состояние и уровень культуры. Заболеваемость токсоплазмозом изучена недостаточно. Обязательная регистрация введена лишь в некоторых странах (ФРГ, Чешская и Словацкая республики). Имеются данные о частоте врожденного токсоплазмоза. Так, во Франции, Австрии, ФРГ на 1000 новорожденных приходится 1–8 детей с врожденным токсоплазмозом. [6,11].
ПАТОМОРФОЛОГИЯ ТОКСОПЛАЗМОЗА: При врожденном токсоплазмозе обнаруживают деструктивные изменения и кальцификаты в головном и спинном мозге, пигментный хориоретинит. Некротические очаги в коре, базальных ганглиях, мозжечке, перивентрикулярных областях, спинном мозге образуются в результате тромбоваскулита. В очагах некроза и вокруг них обнаруживаются токсоилазмы в виде псевдоцист. В дальнейшем в некротических очагах откладывается известь. Кальцификации могут подвергаться и сами паразиты. Крупные петрификаты можно обнаружить на рентгенограмме, а мелкие — только при гистологическом исследовании. Часто наблюдается обызвествление сосудистой стенки. Степень патологических изменений в мозге широко колеблется от небольших очагов деструкции до глубокого недоразвития мозга с явлениями гидроцефалии. При хориоретините в области желтого пятна обнаруживают овальной формы, беловато-желтого цвета диск, который образуется на месте воспалительно-некротического очага в результате разрастания соединительной ткани и атрофии сосудов сетчатки. В некоторых случаях очаги некроза находят в печени, почках, легких, миокарде. При инфицировании плода в период органогенеза токсоплазма вызывает настолько тяжелые изменения, что беременность заканчивается самопроизвольным выкидышем или рождением ребенка с пороками развития, не совместимыми с жизнью. Такие дети обычно погибают в ближайшее время после рождения. При более позднем заражении плода острый период токсоплазмоза может закончиться внутриутробно. В этом случае ребенок рождается с выраженными рубцовыми изменениями мозга, глаз, внутренних органов. Иногда ребенок рождается в период генерализации внутриутробной инфекции с текущими воспалительно-дегенеративными изменениями нервной системы, глаз и внутренних органов. При заражении плода в конце беременности ребенок рождается здоровым, а первичная генерализация и острый период токсоплазмоза наступают уже после рождения. [5,11,15,24].
Клиника врожденного токсоплазмоза:
Новорожденные дети и первых месяцев жизни (от 0 до 3 мес.)

Токсоплазмоз является одной из частых причин гибели больных ВИЧ-инфекцией. Токсоплазмоз – заболевание, вызываемое Toxoplasma gondii, чаще всего возникающее у ВИЧ-инфицированных пациентов на фоне СПИДа. К факторам риска развития токсоплазмоза у больных ВИЧ-инфекцией относится количество CD4-лимфоцитов менее 100 клеток/мкл. Хотя токсоплазмы могут поражать все органы и ткани, но, как правило, у ВИЧ-инфицированных пациентов регистрируют церебральную форму заболевания. Церебральный токсоплазмоз в странах Европы и Северной Америки регистрируют все реже – с внедрением АРВТ в Европе заболеваемость им сократилась в 4 раза, однако он по-прежнему остается самым важным оппортунистическим поражением ЦНС у больных с ВИЧ-инфекцией. Распространенность токсоплазмоза в Центральной Европе достигает 90 %, что связано прежде всего с традицией жителей некоторых стран (Франция, Германия) употреблять в пищу сырые и полусырые мясные блюда [1, 2, 4].
Токсоплазмоз характеризуется выраженным полиморфизмом клинических проявлений при отсутствии патогномоничных симптомов. Это объясняется тем, что у токсоплазм нет какой-либо тканевой специфичности, а также наличием в патогенезе заболевания стадии гематогенной диссеминации возбудителя. Основная роль в развитии токсоплазмоза у лиц с иммуносупрессией отводится нарушениям продукции цитокинов. Показано, что при развитии токсоплазмоза на фоне ВИЧ-инфекции резко снижается как концентрация сывороточного гамма-интерферона, так и его способность активировать макрофаги. Нормальная реакция организма на инфекцию T. gondii опосредуется в основном клеточной иммунной системой. Дефект клеточной иммунной системы у больных с ВИЧ-инфекцией приводит к снижению сопротивления по отношению к внутриклеточным токсоплазмам, в результате происходит реактивация латентной инфекции и генерализация процесса: тахизоиты поступают в кровь, а затем разносятся во внутренние органы и ткани [2, 5].
Внемозговые локализации токсоплазмоза (например, хориоретинит, интерстициальная пневмония, миокардит и поражение органов пищеварительной системы) у больных СПИДом регистрируют в 1,5–2 % случаев. Диссеминация (по меньшей мере две локализации) происходит в 11,5 % случаев [4].
Максимальное количество очагов внемозговых локализаций обнаруживают при исследовании зрительного аппарата глаза (примерно в 50 % случаев). При токсоплазмозе поражения глаз встречаются в виде переднего и заднего увеита, экссудативного и пролиферативного ретинита, диссеминированного хориоретинита. Наиболее часто наблюдается центральный хориоретинит, который начинается с клинической картины острого серозного ретинита. На заднем полюсе обнаруживаются различной величины ограниченные очаги. В сетчатке или под ней видны кровоизлияния. Поражения глаз в виде хориоретинита, увеита наиболее часты, но атрофия зрительного нерва может быть иногда единственным клиническим проявлением токсоплазмоза. Диагностика токсоплазмозного поражения органа зрения должна быть основана на тщательном изучении анамнеза, офтальмологического статуса и серологических реакций. Выявление этих хориоретинитов и увеитов возможно лишь при консультации офтальмолога, и при обычном клиническом обследовании врачом-инфекционистом они нередко остаются нераспознанными [3–5, 9].
При токсоплазмозе весьма часто отмечаются также изменения со стороны органов дыхания, в частности очаговая пневмония, хронический бронхит, плеврит токсоплазмозной этиологии. Наиболее частой формой поражения легких являются интерстициальные пневмонии [5].
Со стороны сердечно-сосудистой системы, помимо расширения границ сердца, глухости тонов, гипотонии и тахикардии, отмечается экстрасистолия. При токсоплазмозе имеются существенные электрокардиографические сдвиги, выражающиеся в уменьшении вольтажа зубцов, различных нарушениях ритма (экстрасистолия, неполная предсердно-желудочковая блокада, блокада ножек пучка Гиса, синусовая тахикардия и брадикардия), увеличение систолического показателя, изменения зубца T и комплекса QRS и др. Эти изменения говорят о выраженных нарушениях миокарда преимущественно диффузного характера. При ЭКГ почти у всех больных выявляются очаговые или диффузные изменения миокарда. Перикард и эндокард не поражаются [2, 5].
Со стороны органов пищеварения отмечаются снижение аппетита, больные жалуются на сухость во рту, тошноту, тупые боли в подложечной области, вздутие живота, задержку стула, нередко наблюдается похудание. При исследовании желудочного сока выявляются снижение секреции и уменьшение кислотности [7].
Токсоплазмоз ЦНС занимает 2–3 место среди оппортунистических инфекций у больных СПИДом. Попадание токсоплазм в организм человека приводит к формированию объемных образований в ЦНС (в 50–60 % случаев) и развитию первичных эпилептических припадков (в 28 % случаев). Симптомы токсоплазмоза развиваются приблизительно у 18–20 % больных на поздних стадиях ВИЧ-инфекции. Появление симптомов токсоплазмозного энцефалита отмечается у 6–12 % больных в стадии СПИДа. Если у таких больных развивается энцефалит, то на долю токсоплазмоза приходится от 25 до 80 % всех случаев. При этом отмечают лихорадку, головные боли, возникновение в 90 % случаев разнообразной очаговой неврологической симптоматики (гемипарез, афазия, психические и некоторые другие нарушения). Иногда токсоплазмоз протекает без формирования объемных образований в головном мозге (по типу герпетического энцефалита или менингоэнцефалита). Токсоплазмозный энцефалит нередко сочетается с хориоретинитом [2, 4, 6].
Диагностировать токсоплазмоз крайне сложно. Диагноз ставят на основании клинической картины, данных магнитно-резонансной томографии или компьютерной томографии, а также при наличии антител к токсоплазме в сыворотке крови. Вместе с тем обнаружение положительных серологических реакций без учета динамики титра антител и клинической симптоматики не всегда дает возможность говорить о болезни из-за широкого распространения носительства. Полагают, что развитие токсоплазмоза – реактивация латентной инфекции, поскольку при наличии в сыворотке крови антител к токсоплазме вероятность возникновения токсоплазмоза увеличивается в 10 раз. Однако примерно у 5 % ВИЧ-инфицированных пациентов на момент постановки диагноза токсоплазмоза антитела к T. gondii отсутствуют. В форме цист токсоплазмы сохраняются до 10–15 лет, преимущественно в тканях головного мозга и органах зрения, а также во внутренних органах [2, 4, 8].
В большинстве случаев развитие токсоплазмозного энцефалита не сопровождается появлением противотоксоплазменных антител в сыворотке крови. Некоторое диагностическое значение имеет появление антител в ликворе при отсутствии их в сыворотке. Ликвор при спинномозговой пункции может быть интактным. В цереброспинальной жидкости отмечается плеоцитоз, повышенное содержание белка и нормальное содержание глюкозы. После ее центрифугирования в мазке можно обнаружить трофозоиты токсоплазм [2, 4, 10].
При выполнении МРТ или КТ с контрастированием обнаруживают множественные очаги с кольцевидным усилением и перифокальным отеком, реже – единичный очаг. Биопсию головного мозга выполняют при невозможности правильно установить диагноз, в биоптатах мозга выявляются трофозоиты токсоплазм. В диагностике церебрального токсоплазмоза используется ПЦР для определения ДНК T. gondii в спинномозговой жидкости [2, 4, 6].
Диагностическое значение имеет пробное назначение пириметамина в сочетании с сульфаниламидным препаратом. Если в течение 7–10 дней наступает заметное улучшение, то это говорит о токсоплазмозной природе энцефалита у больного СПИДом [8].
Таким образом, при комплексном применении нескольких лабораторных методов повышается надежность диагностики токсоплазмоза у ВИЧ-инфицированных больных.
Заключение
Токсоплазмоз у ВИЧ-инфицированных больных характеризуется множественными органными поражениями: нервной системы, органов зрения, миокарда и т.д. Среди них ведущее место отводится церебральному токсоплазмозу. Церебральный токсоплазмоз диагностируют на стадии СПИДа, при этом чаще отмечается снижение CD4-лимфоцитов менее 100 в 1 мкл. Оппортунистические инфекции при ВИЧ/СПИД требуют применения широкого спектра диагностических методов, а именно иммунологических, серологических, инструментальных (МРТ, КТ). С учетом многообразия клинических проявлений токсоплазмоза у ВИЧ-инфицированных больных по показаниям необходимы консультации нескольких специалистов, в частности инфекциониста, невропатолога, офтальмолога и др.
Рецензенты:
Тебенова К.С., д.м.н., профессор КарГУ им. Е.А. Букетова, г. Караганда;
Бейбитхан Д., д.м.н., профессор КарГУ им. Е.А. Букетова, г. Караганда.

Токсоплазмоз – паразитарное заболевание, характеризующееся преимущественным латентным или хроническим течением, поражением нервной системы, органов ретикулоэндотениальной системы, мышц, миокарда и глаза.
Этиология
Возбудитель Toxoplasma gondii относится к простейшим. Существует в трех основных формах: трофозоиты, цисты и ооцисты. Трофозоиты размножаются внутриклеточно во всех клетках млекопитающих и обнаруживаются в острой стадии инфекции. На трофозоиты активно воздействуют различные химиопрепараты (хлоридин, сульфаниламиды, макролиды). Цисты очень устойчивы к различным воздействиям в организме хозяина и потому сохраняются десятки лет. Большая часть их локализуется в скелетных мышцах, миокарде, ЦНС. Ооцисты формируются в слизистой оболочке некоторых представителей семейства кошачьих и выделяются с фекалиями. При благоприятных условиях сохраняются во внешней среде до 1 года и более. Именно они играют основную роль в передачи инфекции.
Эпидемиология
Токсоплазмоз относится к зоонозам с природной очаговостью. Окончательным хозяином являются домашние кошки и представители семейства кошачьих (рысь, пума, оцелот, ягуар). Больной человек не выделяет возбудителя во внешнюю среду и никакой опасности не представляет! Пути передачи: пероральный, трансплацентарный. Реальность и мифы, или как можно заразиться и как – нельзя.
С возрастом увеличивается частота инфицирования при употреблении недостаточно термически обработанных продуктов, контаминированных токсоплазмами, в результате расширения питания, в процессе самостоятельного приготовления пищи, а также формирования поведенческих особенностей. Заражение ооцистами возможно, например, если лежа на траве, на даче, пожевать петрушку, вырванную прямо с грядки. Если по ночам по огородам бегают кошки, обрадованные свободой и возможностью проявить охотничий инстинкт, то на петрушке могут оказаться (помимо массы микроорганизмов) и созревшие ооцисты токсоплазм. Женщины достаточно часто инфицируются при опробовании мясного фарша (в среднем, 25% проб мяса животного происхождения содержат брадизоиты токсоплазм).
Нельзя заразиться токсоплазмами воздушно-капельным путем, при контакте с птицами (если не есть их мясо), наличии в доме даже значительного количества тараканов, блох, крыс и т.д. (их не едят, а они не выделяют возбудителя даже при укусах). Заболевание не передается трансмиссивное.
Токсоплазмоз НЕ ПЕРЕДАЕТСЯ ПОЛОВЫМ ПУТЕМ.
Несмотря на то, что токсоплазм обнаруживали в свое время во всех биологических жидкостях человека, включая семенную жидкость и вагинальный секрет, количество возбудителя настолько мало, что не может вызвать заражения. До сегодняшнего дня нет убедительных доказательств, что какой-либо человек заразился именно от своего полового партнера.
Токсоплазмами нельзя заразиться при использовании общего постельного белья, одежды, предметов личной гигиены, то есть, контактно-бытовым путем. Маловероятно заражение от пожилой кошки.
Клиника
Инкубационный период около 2 недель. Первичное инфицирование приводит в 95-99% случаев к выработке специфических антител и формированию нестерильного иммунитета, без каких – либо проявлений заболевания. Такое состояние называется первично – латентным токсоплазмозом и выявляется лишь при серологическом обследовании. В зависимости от базового иммунитета возможно развитие первично-хронического (1-5%) или острого токсоплазмоза.
Острый токсоплазмоз: бурное начало по типу менингита, менингоэнцефалита, энцефалита, с развитием неврита зрительных нервов, парезов, гемиплегий, через 4-5 недель миокардита. В ряде случаев может быть сыпь на 4-7 день ( обильная, макулезная, от розового до темно-красного цвета). Одновременно на фоне доминирующей картины нейроинфекции,выявляются другие признаки токсоплазмоза(полилимфоденит, гепатолиенаьный сидром, артралгии и миалгии).
Первично-хронический токсоплазмоз характеризуется выраженным полиморфизмом клинических проявлений при отсутствии патогномотичных симптомов. Заболевание начинается постепенно, наиболее отмечаются признаки интоксикации, поражения ЦНС, сердечно-сосудистой системы, лимфоаденопатия, увеличение печении селезенки, поражение опорно-двигательного аппарата и желудочно-кишечного тракта. Постоянный субфебрилитет длится годами и носит волнообразный характер. Периферические лимфоузлы увеличены до 1-3 см в диаметре, нередко чувствительные при пальпации, примерно у половины больных в процесс вовлечены мезентеральные узлы. Поражение вегетативной нервной и периферической нервной системы проявляется акроцианозом, мраморностью кожи, гипергидрозом, плекситами. Выраженный астено-вегетативный синдром. При длительном течении может развиться вторичная гормональная недостаточность с формированием привычного невынашивания беременности.
Методы исследований
В норме токсоплазмы можно обнаружить у 30% клинически здоровых людей (особенно, если искать там, где надо). По этой же причине (учитывая многолетнюю персистенцию возбудителя) обнаружение Ig G к токсоплазмам в любых концентрациях является всего лишь дополнительной констатацией факта инфицирования, но не болезни. Подавляющее большинство исследователей признают, что ни один отдельно взятый метод исследования не в состоянии полностью решить проблему диагностики токсоплазмоза. Все лабораторные методики могут быть разделены на две группы. К первой относят способы прямого определения наличия токсоплазм в органах и биологических жидкостях. Вторая группа представлена серологическими тестами, направленными на выявление специфических антител к возбудителю в биологических жидкостях макроорганизма.
Конечно, самый лучший способ – обнаружить саму токсоплазму, выделить ее каким-то образом и рассмотреть под микроскопом. Для этого применяются паразитологические методы. Эти методы исторически наиболее старые и основаны на представлениях о патогенезе острого токсоплазмоза, где существует стадия гематогенной диссеминации возбудителя, который присутствует в органах и тканях в форме тахизоитов. В это время можно выделить возбудителя в чистом виде (на культуре клеток или при заражении восприимчивых животных), увидеть при прямой микроскопии окрашенного препарата нативного материала, либо обнаружить его генетический материал (полимеразная цепная реакция). Материалом для исследования могут служить любые биологические жидкости (кровь, слюна, спинномозговая жидкость и т.д.), пробы органов и тканей (полученные при биопсии, например, лимфатического узла).
Однако паразитологические методы имеют ряд недостатков, существенно снижающих их ценность и, соответственно, ограничивающих применение на практике. Во-первых, в биологических жидкостях в течение более-менее продолжительного срока токсоплазмы могут находиться только при септических формах заболевания. При остром латентном или манифестном токсоплазмозе это время ограничивается 2-3 неделями, после чего возбудитель фиксируется в органах и тканях. При латентном и манифестном хроническом токсоплазмозе паразиты (в целом виде) не попадают в биологические жидкости и, следовательно, вообще не обнаруживаются в них.
Во-вторых, если мы выявили возбудителя в тканях, еще не факт, что все проблемы со здоровьем связаны именно с токсоплазмами, поскольку инфицировано ими до 30% населения. Несколько большее значение имеет выявление трофозоитов, располагающихся внеклеточно, что указывает на имеющееся активное размножение возбудителя. Выделение токсоплазм в чистом виде – трудоемкий процесс, требующий соблюдения целого ряда условий. Во-первых, в исследуемом образце должен присутствовать живой возбудитель, во-вторых, необходимо поддержание клеточной культуры, либо наличие достаточного количества восприимчивых лабораторных животных. Однако главным фактором ограничивающим эффективность этих методов является кратковременность пребывания токсоплазм в наиболее доступных для исследования биологических жидкостях.
В последние годы достаточно широкое распространение получил метод полимеразной цепной реакции (ПЦР), суть которого состоит в обнаружении в исследуемом субстрате генетического материала (ДНК, РНК) инфекционных агентов. Его преимуществами являются высокая чувствительность и специфичность. Однако широкому внедрению в практику препятствуют не только высокие требования к соблюдению технологии постановки и учета реакций. Оказалось, что исследование одиночного образца крови через 2-23 недели после заражения положительно только у 35% пациентов, а при исследовании в первые 5 недель – в 53 % случаев доказанного заражения (Guy E.C., Joynson D.H., 1995). Следовательно, отрицательный результат ПЦР не исключает инфекции. Даже у лиц с ВИЧ-инфекцией, когда наблюдается вторичная генерализация токсоплазмоза, ПЦР оказалась положительной лишь в 70 % проб крови (Angel S.O. et al., 1997, S. Romand et al., 2001). Более того, даже в условиях референсных лабораторий в 26,6% случаев наблюдаются ложно-положительные результаты ПЦР (Pelloux H. et al., 1998). Положительный результат ПЦР всего лишь констатирует зараженность индивидуума. Таким образом, метод ПЦР, наряду с положительными чертами (обнаруживается минимальное количество искомого агента), имеет и недостатки, ограничивающие его применение.
В целом, методы прямого выявления возбудителя находят свое применение в следующих ситуациях.
1. Врожденный токсоплазмоз в возрасте до 1 года.
2. Токсоплазмоз у больных с выраженным иммунодефицитом (СПИД).
3. Поражение глаза токсоплазмами (материал для исследования – стекловидное тело).
Наиболее распространенными являются серологические методы исследования, направленные на выявление антител к токсоплазмам в биологических жидкостях макроорганизма. В зависимости от давности заражения и характера иммунного ответа в ходе инфекционного процесса могут обнаруживаться различные количества антител различных классов. Определенная закономерность динамики антител обнаружена только при остром токсоплазмозе. Специфические антитела иммуноглобулины класса M начинают выявляться доступными методами со второй недели после заражения, достигают максимума, в среднем, к концу первого месяца, затем снижаются и в 70% случаев исчезают в течение 3 месяцев. Иммуноглобулины класса G начинают определяться с 1-2 недели и достигают пика через 1-2 месяца. Позже их концентрация снижается и, в дальнейшем, носит волнообразный характер, не имеющий самостоятельного значения. Эти иммуноглобулины сохраняются десятилетиями как проявление феномена персистенции возбудителя. Важным является доказанный факт отсутствия повторного появления Ig M при обострении хронического токсоплазмоза (исключением являются случаи реактивации латентного токсоплазмоза у больных ВИЧ-инфекцией). Особенности динамики специфических иммуноглобулинов различных классов позволяют сделать важные практические выводы. Во-первых, необходимо стремиться к проведению исследования в максимально раннем сроке от начала заболевания. Во-вторых, следует определять одновременно специфические антитела, как минимум, классов M и G. В-третьих, только количественное (или, по крайней мере – полуколичественное) определение антител позволяет оценивать их динамику во времени.
Практические выводы из сказанного выше состоят в следующем:
1. Обнаружение антител к токсоплазмам отражает, главным образом, только факт заражения (при отсутствии иммуноглобулинов класса M – как минимум, за три месяца до исследования).
2. Количество антител класса G не отражает "остроты" заболевания и не может служить основанием для назначения лечения.
3. Никакая терапия не в силах полностью избавить человека от антител, поэтому их концентрация не может служить критерием эффективности терапии (возбудитель в организме сохраняется пожизненно).
4. Если мы хотим установить связь внезапно развившегося заболевания с токсоплазмозом, исследования на антитела должны проводиться как можно раньше, потому что через 3-6 месяцев исчезнут антитела класса M, а антитела класса G определяются у каждого третьего человека (в том числе, и у тех, кто понятия не имеет о токсоплазмозе).
5. С точки зрения качества обследования предпочтительным является исследование методом иммуноферментного анализа (ИФА) с использованием коммерческих тест-систем. Качественное исследование стоит более 1 МРОТ (за один класс иммуноглобулинов), а дешевые услуги менее надежны.
Для исследования на антитела могут использоваться не только сыворотка крови, но и спинномозговая жидкость, содержимое стекловидного тела, околоплодные воды.
Токсоплазмин как средство диагностики
В 1948 году J. Frenkel предложил для диагностики токсоплазмоза использовать оценку реакции на внутрикожное введение токсоплазмина (комплекс структур клеточной стенки токсоплазм, в основном, SAG1). Принцип реакции и ее учет аналогичны туберкулиновой пробе. Доказано, что проба высоко специфична, она не бывает положительной при других заболеваниях. В зарубежных странах этот метод не используется из-за сложности стандартизации препарата .В Центре диагностики и лечения токсоплазмоза Российской Военно-медицинской академии это исследование проводится с 1959 года. За прошедшие годы оно выполнено примерно у 19 тысяч пациентов. Ни в одном случае мы не наблюдали каких-либо побочных реакций на введение препарата. Суть метода состоит в развитии местной воспалительной реакции после внутрикожного введения набора антигенов токсоплазм у тех людей, у которых в организме есть клон специфических лимфоцитов (то есть, у инфицированных). В настоящее время проба (в нескольких модификациях) используется
1. Для окончательного решения вопроса о наличии заражения (отрицательные результаты пробы и отсутствие антител надежно исключают токсоплазмоз).
2. Для определения показаний к проведению иммунокоррекции больным манифестной формой токсоплазмоза.
3. Для определения "стартовой дозы" при проведении иммунокоррекции.
Рассмотрим те ситуации, когда целесообразно обследовать пациента на наличие токсоплазмоза и те методы, которыми следует пользоваться.
1. Беременность – в максимально раннем сроке определить специфические антитела классов M и G количественным методом.
2. Длительное (более 3 недель) повышение температуры до субфебрильных цифр не установленного происхождения – сначала следует исключить другие возможные причины (очаги хронической инфекции, туберкулез, онкологическая патология, колагенозы, тиреотоксикоз и т.д.), затем провести лечение выявленной патологии и только потом, при отсутствии эффекта – определить антитела и направить пациента к специалистам.
3. Увеличение периферических лимфатических узлов (шейных, затылочных, подмышечных, локтевых), если оно не может быть объяснено другими причинами.
4. Медленно прогрессирующая нейроинфекция в сочетании с лимфаденитом, увеличением печени, селезенки, присоединением поражения органа зрения и/или миокардита с третьей недели заболевания – антитела в крови и ликворе, прямая микроскопия ликвора, ПЦР (ликвор и кровь).
5. Невынашивание беременности, бесплодие – антитела, затем внутрикожная проба.
6. Подозрение на врожденный токсоплазмоз (плод – антитела, ПЦР, прямая микроскопия околоплодной жидкости, дети до 1 года – антитела, ПЦР в сыворотке крови, спинномозговой жидкости).
7. Поражение глаза (хориоретинит) в сочетании с субфебрилитетом, увеличением лимфатических узлов, печени, селезенки, болями в мышцах, суставах – исключить туберкулез, определить антитела к токсоплазмам.
До сих пор актуальным является мнение, высказанное в 50-е годы O. Thalhammer, что диагноз токсоплазмоза легче отвергнуть, чем подтвердить.Поэтому, в первую очередь следует обратить внимание на критерии, которые позволяют отвергнуть токсоплазменную этиологию заболевания. К ним относятся комплекс признаков, включающий1. Отрицательные серологические реакции (отсутствие специфических антител к T. gondii классов Ig M и Ig G в ИФА) и внутрикожная проба (ВКП) с нативным токсоплазмином (гиперемия в месте введения менее 10 мм при учете через 24 и 48 часов) при отсутствии выраженного иммунодефицита. Одновременное сочетание этих условий позволяет надежно исключить хронический токсоплазмоз.
2. Отрицательные серологические реакции и ВКП, выполненные с интервалом 2-3 недели, даже при наличии некоторых клинически синдромосходных признаков делают диагноз токсоплазмоза крайне маловероятным. Следует подчеркнуть, что проведение ВКП не влияет на количество специфических антител.
Обнаружение специфических Ig G к T. gondii без клинических проявлений токсоплазмоза не может служить основанием для постановки диагноза манифестных форм болезни и назначения антипротозойной терапии. Критерии, позволяющие подтвердить диагноз, разработаны в Центре диагностики и лечения токсоплазмоза клиники инфекционных болезней Военно-медицинской академии. Они представлены несколькими группами.
1. Критерии 1, 2, 3 группы А.
2. Обнаружение при КТ или ЯМР абсцессов головного мозга при неэффективности стандартной терапии в течение 2 недель и положительном эффекте тест-терапии антипротозойными препаратами.
3. Острое начало и бурное прогрессирование болезни (менингит, менингоэнцефалит, абсцессы мозга, пневмония, гепатит, макуло-папулезная, пятнистая экзантема, тифоподобное течение заболевания).
Критерии являются достаточными только при наличии клинической картины тяжелого инфекционного заболевания, протекающего по типу нейроинфекции, сепсиса в сочетании с полилимфаденитом, гепатолиенальным синдромом. Критерии 2 и/или 3 достаточны при отсутствии критерия 1. Дополнительные критерии – присоединение миокардита, поражения органа зрения на 2-3-ей неделе болезни.
Читайте также:


